24: Valves urétrales postérieures et obstruction infravésicale
Ce chapitre prendra environ 31 minutes de lecture.
Introduction
Les valves de l’urètre postérieur (VUP) demeurent la cause congénitale la plus fréquente d’obstruction de la voie d’évacuation vésicale chez les nouveau-nés de sexe masculin. Elles constituent la principale cause d’insuffisance rénale terminale (IRT) chez les garçons.1 De nos jours, la grande majorité des cas sont suspectés en anténatal et adressés à des centres spécialisés après la naissance. De plus, le seuil pour entreprendre des investigations chez un garçon présentant une infection urinaire est bas et, par conséquent, le diagnostic en temps opportun est généralement la règle. L’éventail des dysfonctions rénales et les résultats fonctionnels ultérieurs varient largement chez les enfants présentant cette affection. Les VUP et leurs conséquences, notamment la dysplasie rénale, la dilatation des voies excrétrices supérieures, le reflux vésico-urétéral, l’infection urinaire et la dysfonction vésicale, représentent 25–30% des transplantations rénales pédiatriques au Royaume-Uni (UK Transplant Registry).
Ce chapitre a pour objectif de fournir un aperçu actualisé des valves de l’urètre postérieur et de la manière dont elles sont prises en charge dans notre centre.
Embryologie
Il existe deux théories distinctes pour expliquer l’origine des PUVs. La première théorie postule une insertion anormale du canal mésonéphrique dans le sinus urogénital, empêchant la migration normale de ces canaux et leur fusion antérieure. L’autre théorie suggère que les valvules représentent une membrane urogénitale persistante.2 La classification initiale des PUV a été réalisée par Hugh Hampton Young en 1919, qui a décrit des types I à III sur la base d’études de dissection post-mortem. Des études ultérieures ont suggéré un aspect plus uniforme de la membrane urétrale postérieure obstructive et l’évaluation prospective d’urètres non instrumentés par Dewan et al. a retrouvé des aspects similaires dans tous les cas étudiés.3 Leur évaluation endoscopique a montré que la membrane s’insérait en arrière, juste en aval du verumontanum. La membrane s’étendait vers l’avant et obliquement au-delà du sphincter externe, avec un orifice de taille variable situé en son sein, au niveau du verumontanum, et ils ont décrit l’affection comme une membrane obstructive congénitale de l’urètre postérieur (COPUM).
Incidence et aspects génétiques
L’incidence des PUV couramment rapportée est de 1 sur 5 000 naissances vivantes, dont 50 % évoluent vers une IRT dans les 10 ans.4 Elle a montré une certaine variation, avec une incidence de 1:7800 en Australie et de 1 sur 3 800 au Royaume-Uni et en Irlande.5,6 La compréhension des bases génétiques, ou de facteurs environnementaux ou maternels potentiels pour cette anomalie, continue d’évoluer. Chiraramonte et al ont proposé un rôle spécifique du bras court du chromosome 11.7 Des anomalies associées seront présentes chez environ 40 % de ces garçons, touchant principalement le système cardiovasculaire, le système gastro-intestinal et d’autres affections urologiques telles que l’hypospadias, le micro/ macro-phallus et les valves urétrales antérieures.8,9,10 Il a été fait état de cas d’absence de méat auditif externe et d’agénésie surrénalienne bilatérale chez des garçons atteints de PUV.
Diagnostic prénatal
Le nombre de cas de VUP diagnostiquées en période prénatale a augmenté avec l’utilisation et la sensibilité accrues du dépistage prénatal des anomalies. Au Royaume-Uni, au moins deux échographies sont réalisées chez les femmes enceintes. La première est une échographie de datation réalisée vers 10–12 semaines de gestation. La seconde est une échographie morphologique plus détaillée vers 20 semaines de gestation. Environ la moitié à deux tiers des garçons présentant des VUP seront suspectés prénatalement. Les constatations prénatales à l’échographie dans les cas suspects peuvent inclure une vessie à paroi épaissie, le signe en ‘trou de serrure’ avec une vessie dilatée et un urètre postérieur, une urétéro-hydronéphrose unilatérale ou bilatérale, des reins hyperéchogènes et un oligoamnios. Le diagnostic différentiel inclut le syndrome de Prune-Belly, l’atrésie urétrale, un reflux vésico-urétéral bilatéral et, plus rarement, le trouble d’hypopéristaltisme intestinal avec mégavessie et microcôlon. Le récent audit national BAPS CASS a identifié 35 % des VUP prénatalement et environ 40 % au cours de la première année de vie.6 Cet audit a également montré une relation statistiquement significative entre le moment du diagnostic et un risque accru d’altération de la fonction rénale.
Intervention prénatale
Les interventions anténatales pour les valves urétrales postérieures comprennent l’aspiration vésicale, la mise en place d’un shunt vésico-amniotique et l’ablation endoscopique fœtale des valves. La justification est que la décompression précoce des voies urinaires fœtales permettra d’améliorer la survie tout en préservant la fonction rénale, de réduire l’atteinte respiratoire et les anomalies des membres observées en association avec un oligoamnios sévère. Cependant, un volume de liquide amniotique normal ne garantit pas une bonne fonction rénale postnatale. Une étude du North American Fetal Therapy Network a évalué le devenir de 32 grossesses consécutives avec LUTO et un volume de liquide amniotique normal à mi-gestation.11 La survie périnatale était de 97 %. Une suppléance rénale a été nécessaire en cas de survenue d’oligoamnios et/ou d’anamnios, de kystes corticaux rénaux, de PUV, de prématurité et de séjour prolongé en unité de soins intensifs néonatals, selon l’analyse univariée. Selon l’analyse multivariée, le seul facteur prédictif de recours à la RRT était l’accouchement prématuré.
Historiquement, l’algorithme introduit par Johnson en 1994 a été utilisé pour sélectionner les fœtus pour une intervention prénatale.12 Les critères incluent un caryotype masculin normal en l’absence d’autres anomalies fœtales qui affecteraient défavorablement le pronostic, et un oligoamnios/anhydramnios maternel ou une diminution des volumes de liquide amniotique. pourraient bénéficier d’une intervention. Ces dernières années, Ruano et al ont proposé un modèle de sélection des patients basé sur 4 stades d’obstruction. L’intervention fœtale n’est pas recommandée pour le stade III-IV.13
Tableau 1 Système de stadification de Ruano
| Échographie fœtale | Biochimie fœtale 18-30 semaines | Traitements possibles | |
|---|---|---|---|
| Stade 1 | AFI normal Absence de kystes rénaux ou de dysplasie | Favorable après prélèvements séquentiels | Surveillance échographique hebdomadaire |
| Stade 2 | Oligoamnios Hydronéphrose bilatérale sévère Absence de kystes ou de dysplasie | Favorable après un maximum de 3 prélèvements séquentiels | Cystoscopie ou dérivation vésico-amniotique |
| Stade 3 | Anamnios ou oligoamnios Reins hyperéchogènes Kystes rénaux et/ou dysplasie | Défavorable après prélèvements séquentiels | VAS avec amnio-infusion possible |
| Stade 4 | Anamnios et anurie après surveillance du taux de remplissage vésical. Dysplasie rénale et reins hyperéchogènes | Biochimie défavorable et anurie documentée après surveillance de la reprise du remplissage | Amnio-infusion |
Biochimie favorable : sodium <100 mEq/L, chlorure <90 mEq/L, osmolalité <200 mOsm/L, et β-2-microglobuline <6 mg/L.
Une revue systématique et méta-analyse récentes de 10 articles sur l’intervention anténatale pour LUTO, incluant 355 fœtus, a établi que la survie globale était plus élevée dans le groupe VAS que dans le groupe conservateur.14 Un peu plus de la moitié (57 %) ont survécu dans le groupe VAS par rapport au groupe témoin. Cinq études ont montré que la fonction rénale postnatale était meilleure dans le groupe VAS que dans le groupe conservateur. Deux études impliquant 45 fœtus ayant subi une cystoscopie fœtale ont démontré que la survie périnatale était plus élevée dans le groupe cystoscopie que dans le groupe de prise en charge conservatrice. Une fonction rénale normale a été notée chez 13/34 fœtus dans le groupe cystoscopie contre 12/61 dans le groupe de prise en charge conservatrice à 6 mois de suivi.
Plus récemment, on a tenté de répondre à la question du bénéfice d’une intervention prénatale sous forme de dérivation vésico-amniotique en cas d’obstruction suspectée de la voie d’évacuation vésicale. L’essai PLUTO a été conçu comme un essai multicentrique paneuropéen.15 L’inclusion dans cet essai reposait sur le principe d’incertitude. En cas de doute quant au bénéfice de l’intervention, les patients étaient randomisés pour une dérivation vésico-amniotique ou une absence de traitement. Les critères de jugement comprenaient la mortalité postnatale, la fonction rénale évaluée par la créatinine sérique à l’âge d’un an et toute morbidité associée ou complication de la procédure. L’essai a duré 5 ans mais n’a pas pu recruter le nombre requis de patients et est désormais clos. Malheureusement, en raison du faible nombre de patients recrutés, il n’a pas permis de déterminer si l’intervention prénatale apporte un bénéfice significatif dans le traitement d’une obstruction suspectée de la voie d’évacuation vésicale.
Prise en charge néonatale
Pour les nouveau-nés chez lesquels des VUP sont suspectées en prénatal, sans inquiétude concernant le volume de liquide amniotique, l’accouchement peut avoir lieu en dehors des centres spécialisés en urologie pédiatrique. La priorité est de drainer la vessie à l’aide d’un cathéter urétral sans ballonnet de calibre 6/8 Fr. Une prophylaxie antibiotique doit être instaurée, par exemple triméthoprime 2 mg/kg. Un cathéter sans ballonnet est plus sûr qu’un cathéter à ballonnet, en particulier entre des mains inexpérimentées. Il existe un risque de traumatisme urétral en gonflant le ballonnet dans l’urètre postérieur plutôt que dans la vessie.
Chez les nouveau-nés chez lesquels il n’est pas possible de réaliser une cathétérisation urétrale, le plus souvent en raison soit de l’indisponibilité d’un cathéter 6 Fr soit d’un col vésical très haut rendant la cathétérisation impossible, un cathéter sus-pubien devient nécessaire. Après un drainage vésical réussi, une attention particulière doit être portée à la diurèse et aux dosages des électrolytes, ces patients pouvant développer une diurèse post-obstructive entraînant des anomalies des taux de sodium, de potassium et de bicarbonate. La créatinine doit être surveillée quotidiennement jusqu’à l’obtention d’un nadir de créatinine. Chez les patients présentant une dysfonction rénale significative et des troubles électrolytiques, il convient d’impliquer précocement un collègue néphrologue afin d’optimiser la fonction rénale et l’homéostasie.
Chez les garçons nés avec des antécédents d’oligoamnios et une hypoplasie pulmonaire importante, la priorité de la prise en charge est le soutien respiratoire et le drainage vésical. Une sonde urétrale ou sus-pubienne suffit à optimiser le drainage urinaire en attendant l’homéostasie et la stabilité respiratoire.
Les nouveau-nés et les nourrissons chez qui les VUP n’ont pas été suspectées en période prénatale peuvent présenter un sepsis d’origine urinaire, des symptômes mictionnels obstructifs, une vessie distendue ou des reins palpables, et les principes de prise en charge sont les mêmes. Bien qu’un jet urinaire faible suggère une obstruction sous-vésicale, l’observation d’un jet urinaire normal n’exclut pas le diagnostic.
Confirmation du diagnostic en période néonatale
Une fois le nouveau-né stabilisé, le diagnostic doit être confirmé. L’échographie rénale (USS) fournira des informations sur la taille et la qualité du parenchyme rénal, le degré d’urétéro-hydronéphrose et l’évaluation de l’épaisseur de la paroi vésicale. Elle peut également montrer une dilatation de l’urètre postérieur.
La cystouréthrographie mictionnelle (MCUG) confirmera le diagnostic et doit comporter des clichés après retrait de la sonde afin de démontrer le calibre de l’urètre postérieur (Figure 1) L’enfant est couvert par une antibioprophylaxie de 3 jours afin de réduire le risque d’infection et d’urosepsis.
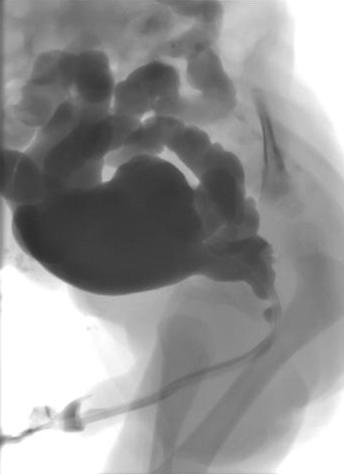
Figure 1 Urétrocystographie mictionnelle montrant un urètre postérieur dilaté, une vessie irrégulière et un reflux vésico-urétéral bilatéral.
Les informations supplémentaires obtenues à partir de la MCUG comprennent la taille vésicale, les irrégularités vésicales dues à un épaississement, à une trabéculation et à la formation de diverticules, le reflux vésico-urétéral (RVU) et la configuration du col vésical. Environ 50 % des nouveau-nés atteints de VUP présenteront un RVU. Si le RVU est de haut grade et unilatéral, un “pop-off” peut avoir permis une dissipation sélective de la contre-pression résultant de l’obstruction urétrale.
Le syndrome VURD (valves, reflux unilatéral, dysplasie) décrit par Hoover et Duckett entraîne une fonction rénale très médiocre, voire nulle, du rein du côté du reflux, avec une préservation relative de la fonction rénale du côté controlatéral, non refluxif.16 Ces auteurs ont également postulé que ce mécanisme de ‘pop-off’ aboutit à une fonction rénale normale à long terme, le rein controlatéral étant épargné et normal. Cette hypothèse a ensuite été remise en question par Cuckow et al., qui ont montré, au moyen des mesures de la créatinine sérique et du DFG, que la fonction rénale était altérée dans les cas de VURD, ce qui implique que la protection offerte par le mécanisme de ‘pop-off’ n’était pas complète.17
Résection primaire des valves
La procédure de choix pour les PUV est l’ablation primaire des valves, réalisée une fois que le nourrisson est stable sur le plan médical. À l’induction de l’anesthésie, une dose d’antibiotique intraveineux est administrée, p. ex., amoxicilline-acide clavulanique 30 mg/kg. Le nourrisson est placé en position de lithotomie et une cystoscopie diagnostique à l’aide d’un cystoscope néonatal 0° 6/8 Fr est réalisée. L’urètre postérieur doit être inspecté avec soin et la configuration des valves notée. La configuration du col vésical et l’aspect de la vessie ainsi que des orifices urétéraux doivent également être notés. Le résectoscope 11 Fr est assemblé soit avec une lame froide/en faucille, soit avec une électrode de Bugbee, et la résection des valves est généralement réalisée aux positions de 5, 7 et 12 heures (Figure 2)
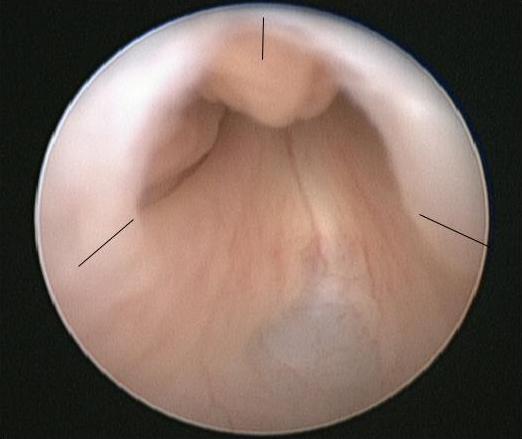
Figure 2 Vue endoscopique de PUV avec les sites d’incision des valves marqués.
Une sonde urétrale est mise en place à la fin de l’intervention et retirée 24 à 48 heures plus tard. La créatinine doit être contrôlée après l’ablation de la sonde urétrale et les couches doivent être pesées afin de documenter la diurèse. La prophylaxie antibiotique et la supplémentation rénale doivent être poursuivies jusqu’à la prochaine réévaluation.
Les complications de l’ablation primaire des valves comprennent le saignement, la résection incomplète des valves, la sténose urétrale ou une lésion accidentelle du sphincter externe. Le choix de la technique est dicté par les instruments disponibles, le calibre de l’urètre néonatal et la taille ainsi que la maturité du nouveau-né.
Pour les nouveau-nés prématurés ou de très petite taille, la résection endoscopique est différée en raison des difficultés liées au faible calibre de l’urètre et des complications potentielles associées à l’utilisation d’instruments relativement plus volumineux. Ces enfants peuvent être pris en charge avec une sonde urétrale ou sus-pubienne jusqu’à ce qu’ils soient suffisamment grands pour l’intervention. À titre indicatif, un poids corporel de 2,5 kg devrait permettre une résection des PUV sûre et précise avec des instruments endoscopiques standard.
Chez certains petits nouveau-nés, des problèmes répétés peuvent survenir avec les cathéters urétraux ou sus-pubiens qui tombent, se bouchent, se délogent ou ne drainent pas de façon adéquate; dans ces circonstances, la confection d’une vésicostomie peut être considérée comme l’option la plus sûre pour assurer un drainage vésical adéquat et continu.
Nous recommandons que tous les garçons bénéficient d’une cystoscopie de contrôle dans les 3 mois suivant l’intervention initiale afin de s’assurer du caractère complet de l’ablation des valves. Cela est dû à la faible corrélation d’une nouvelle MCUG pour le diagnostic de feuillets valvulaires résiduels et de l’évaluation cystoscopique de feuillets valvulaires résiduels nécessitant une résection supplémentaire ; valeur prédictive positive de 56 %.18 Toutefois, certains centres choisiraient d’effectuer une nouvelle MCUG à ce stade et de ne procéder à une cystoscopie que si la MCUG suggère une obstruction urétrale persistante. Un autre avantage de procéder directement à une cystoscopie de contrôle est qu’elle offre la possibilité de réaliser une circoncision, dont il a été démontré qu’elle réduit le taux d’infections urinaires d’au moins 83 % chez les garçons présentant des valves de l’urètre postérieur.19 Cela a été validé par un essai contrôlé randomisé multicentrique récent, l’essai CIRCUP. Dans la population de l’étude de 91 garçons, la probabilité de présenter une infection urinaire fébrile était de 20 % dans le groupe antibiotique contre 3 % dans le groupe circoncision + antibiotique.20
Présentation, diagnostic et prise en charge chez l’enfant plus âgé
Un plus petit nombre de patients atteints de PUV ne se présentent pas en période néonatale ou durant la petite enfance, mais consultent pendant l’enfance ou au début de l’adolescence avec des symptômes d’énurésie diurne, de gouttement ou de jet urinaire faible, d’infection ou, plus rarement, d’hématurie. Une anamnèse mictionnelle minutieuse peut suggérer le diagnostic et des examens non invasifs, tels que la débitmétrie mictionnelle et la mesure des volumes résiduels post-mictionnels, peuvent aussi orienter vers l’anomalie. Le cathétérisme urétral chez l’enfant plus âgé est invasif et comporte de nombreuses difficultés; par conséquent, nous préférons omettre la MCUG et, à la place, procéder directement à une cystoscopie diagnostique et à une ablation primaire des valves si le diagnostic est confirmé. Le suivi après une ablation complète et réussie des valves est conforme à ce qui est décrit ci-dessous, avec une suspicion accrue de dysfonction vésicale persistante chez ceux qui se présentent tardivement.
Suivi
Chaque établissement disposera d’un protocole de suivi propre pour les enfants atteints de valves urétrales postérieures. Cependant, les objectifs du suivi sont :
- Optimiser la fonction rénale
- Minimiser les infections urinaires et les cicatrices rénales
- Évaluation et prise en charge de la dysfonction mictionnelle dans le but d’atteindre une continence urinaire totale
- Transition vers les services pour adolescents et adultes
L’implication de la néphrologie pédiatrique est impérative pour optimiser les résultats et garantir une prise en charge médicale appropriée de ces enfants.
Tableau 2 Exemple de protocole de suivi des patients atteints de PUV utilisé au Great Ormond Street Hospital, Royaume-Uni. FBC=numération sanguine complète, GFR=débit de filtration glomérulaire, US=échographie des voies urinaires, MCUG=cystouréthrographie mictionnelle, MSU=prélèvement d’urine du milieu de jet comprenant un test de protéinurie, BFA=évaluation de la fonction vésicale. Défini selon l’âge ; chez les nourrissons, alarmes de couches et mesures du résidu post-mictionnel ; chez les enfants plus âgés, tableaux fréquence-volume, études de débit et mesures du résidu post mictionnel, SPC=cathéter sus-pubien.
| Créatinine et électrolytes | NFS | DFG corrigé | Échographie | CUM | MAG3 | Cystoscopie/ablation des valves | ECBU | Bilan de fonction vésicale | Urodynamique vidéo via CSP | |
|---|---|---|---|---|---|---|---|---|---|---|
| Naissance | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| 3 mois | ✓ | ✓ | ✓ | ✓ | +/- circoncision | ✓ | ||||
| 1 an | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 2 ans | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 3 ans | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 4 ans | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 5 ans | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | |||
| 6 ans | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 7 ans | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| 8 ans | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 9 ans | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| 10 ans | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | |||
| 11-14 ans annuel | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| >15 ans | ✓ | ✓ | ✓ | ✓ | +/- | ✓ | ✓ | Orientation en médecine de l’adolescent |
Dérivation urinaire précoce
Il existe un petit groupe de garçons chez qui les mesures standard décrites ci‑dessus ne produisent pas le résultat souhaité et dont la fonction rénale demeure fragile ou se détériore, ou qui souffrent d’infections urinaires récidivantes, ou chez qui l’on observe une détérioration significative de l’aspect des voies urinaires supérieures, ou encore une vidange vésicale incomplète aux échographies sériées. L’objectif chez ces enfants est d’optimiser leur potentiel rénal et de retarder ou d’éviter un traitement de suppléance rénale. Une dérivation urinaire précoce, soit par vésicostomie, soit par urétérostomie bilatérale, soit par pyélostomie, vise à protéger les voies urinaires supérieures et à réduire au minimum les risques d’infection.
Chua et al. ont réalisé une analyse rétrospective portant sur 40 garçons ayant bénéficié soit d’une ablation des valves seule, soit d’une ablation + vésicostomie/ dérivation supravésicale. Ils ont noté que la dérivation urinaire après ablation des valves chez des enfants présentant une maladie rénale chronique de stade 3 associée à des valves urétrales postérieures pouvait retarder temporairement la progression vers l’insuffisance rénale terminale. Par conséquent, cela pourrait ne pas apporter de bénéfices à long terme et constitue plutôt une mesure de temporisation.21 Cela réitère les résultats des travaux antérieurs de Tietjen et de Lopez-Pereira et al.22,23
Le concept d’une urétérostomie refluxante comme forme de dérivation urinaire a montré une certaine promesse. Il s’agit d’une technique élégante qui permet de poursuivre le cycle vésical tout en dissipant les hautes pressions de stockage et de miction présentes dans la vessie à valves à cet âge. La condition essentielle est un uretère à reflux libre et l’intervention est réalisée par une incision cutanée basse dans le pli inguinal. L’uretère est identifié et isolé de façon extravésicale dans le rétropéritoine. On confectionne ensuite une urétérostomie en anse refluxante, qui se drainera dans la couche. Contrairement à l’urétérostomie terminale, la fermeture et le rétablissement de continuité sont relativement simples. Une fois que la procédure a rempli son objectif ou qu’il n’existe plus de reflux, l’urétérostomie est simplement fermée et l’uretère réintégré dans l’espace rétropéritonéal. L’urétérostomie refluxante est particulièrement utile chez les garçons ayant une fonction rénale fragile, car elle minimise les effets potentiellement délétères de la vessie à haute pression présente dans la période précoce suivant l’ablation des valves. Ceci est crucial dans la prise en charge de ces nouveau-nés, car la suppléance rénale chez le nourrisson est extrêmement précaire et difficile à maintenir.
Des préoccupations légitimes ont été soulevées quant au fait que le contournement de la vessie ou le fait de maintenir une vessie en permanence vide pourrait avoir un impact négatif sur la fonction vésicale future. En outre, il n’existe pas de preuves convaincantes que la dérivation urinaire améliore la fonction rénale à long terme.
En comparant l’ablation primaire des valves à la vésicostomie primaire, Godbole et al. n’ont pas trouvé de différence significative de créatinine sérique et de débit de filtration glomérulaire (DFG) à l’âge de 1 an entre les deux groupes.24 Le groupe ayant eu une vésicostomie comme intervention primaire avait été dérivé pendant une durée médiane de 18 mois, et chez 7 garçons ayant bénéficié d’examens urodynamiques ultérieurs, la capacité vésicale était normale. Jaureguizar et al. ont comparé les résultats de la fonction vésicale chez des garçons traités par dérivation supravésicale à ceux traités par ablation primaire des valves seule.25 La durée moyenne pendant laquelle la dérivation supravésicale était en place était de 13 mois et tous avaient été dérivés au cours des 2 premiers mois de vie. Ils ont réalisé des explorations urodynamiques invasives à l’âge de 9–10 ans et ont trouvé des proportions très similaires de vessies normales, peu compliantes, instables et décompensées dans les deux groupes.
Des résultats vésicaux plus favorables, une capacité améliorée, une pression détrusorienne en fin de remplissage plus faible à la capacité vésicale attendue, et une instabilité détrusorienne moins fréquente ont été démontrés chez 8 patients pris en charge par ablation primaire des valves comparativement à 11 garçons pris en charge par urétérostomie cutanée en anse haute ou basse.26 Les études urodynamiques ont été réalisées chez ces garçons à un âge moyen minimal de 11 ans et la durée de la dérivation était en moyenne de 57 mois.
Ainsi, la place de la dérivation urinaire précoce dans la prise en charge des garçons atteints de PUV est limitée. Elle a le potentiel d’améliorer la fonction rénale à court terme, ce qui est très important chez les garçons dont la fonction rénale est fragile, et peut différer le recours à une suppléance rénale à un stade ultérieur. Il n’existe pas de données convaincantes étayant son rôle comme moyen d’améliorer la fonction rénale à long terme, et son effet sur la fonction vésicale à long terme reste incertain. Par conséquent, la dérivation urinaire doit être envisagée dans des cas sélectionnés avec des objectifs et des critères de décision clairement définis, et elle a une place dans la prise en charge des garçons atteints de PUV.
Résultats à long terme : voies urinaires supérieures
La production d’urine débute à 8-9 semaines de gestation et le système collecteur est formé à la fin du premier trimestre. La vessie fœtale peut être visualisée peu après à l’échographie prénatale. La présence d’une obstruction à l’écoulement vésical transmet une pression intraluminale élevée au parenchyme rénal en développement et, une fois un seuil critique atteint, entraîne une apoptose, une différenciation cellulaire anormale et des altérations glomérulaires survenant au sein du rein. Ces modifications précoces conditionnent le potentiel fonctionnel rénal ultérieur. Lorsque l’obstruction est moins sévère ou se manifeste plus tard au cours de la grossesse, les effets de l’obstruction concernent davantage la vessie et les effets rénaux se limitent à une dilatation du système collecteur avec une perturbation minimale de la néphrogenèse normale. Une théorie alternative, ou peut-être complémentaire, pour expliquer la dysplasie rénale observée en association avec des valves de l’urètre postérieur, met en cause une position anormale du bourgeon urétéral et son implantation dans le blastème métanéphrogène.27 La dysfonction rénale apparaît donc résulter de degrés variables de dysplasie intrinsèque et des effets de l’obstruction à l’écoulement vésical. Dans la vie postnatale, ces effets peuvent être encore aggravés par des infections urinaires, un RVU et une dysfonction vésicale
Lorsqu’il y a une perte significative de néphrons, une hyperfiltration des néphrons fonctionnels existants se produit via une vasodilatation des artérioles afférentes. L’hypertension capillaire glomérulaire qui en résulte permet de maintenir temporairement une fonction rénale normale. Avec le temps, ce mécanisme compensatoire se décompense, une glomérulosclérose s’installe, entraînant une protéinurie, une hypertension et une diminution du débit de filtration glomérulaire. L’atteinte du néphron distal altère la capacité de concentration du rein, entraînant une polyurie et une polydipsie (diabète insipide néphrogénique), ce qui peut aggraver la fonction vésicale et, par conséquent, compromettre davantage la fonction des voies urinaires supérieures.
L’article de Parkhouse et al est souvent cité et décrit les résultats à long terme de 98 garçons chez qui des valves urétrales postérieures ont été diagnostiquées, se présentant entre 1966 et 1975, avant l’ère du diagnostic anténatal.28 La période de suivi de cette étude allait de 11 à 22 ans. 66% de la cohorte s’est présentée au cours de la première année de vie et la moitié de la cohorte de patients a été prise en charge par ablation primaire des valves, le reste étant dérivé. 32% (31 patients) ont eu un ‘mauvais résultat rénal à long terme’; 10 patients sont décédés d’une insuffisance rénale aiguë, 15 ont développé une insuffisance rénale terminale et 6 présentaient une insuffisance rénale chronique établie au cours de la période de suivi. Une présentation avant l’âge d’un an (p<0.05), la présence d’un reflux vésico-urétéral bilatéral (p<0.0010), une urée plasmatique à la sortie initiale de >10 mmol/litre, et, à l’âge de 5 ans, la présence d’une protéinurie (p<0.001) ainsi qu’une incontinence urinaire persistante étaient toutes associées à un mauvais résultat rénal.
Des séries plus récentes rapportent des résultats assez similaires. Kousidis et al ont rapporté une série de 42 patients présentant des valvules urétrales postérieures diagnostiquées en période prénatale et postnatale entre 1984–1996.29 La durée du suivi était de 10 à 23 ans. Il y a eu 3 (7 %) décès (2 en période néonatale et 1 patient âgé de 3 ans après une transplantation infructueuse), 11 patients (26 %) avaient évolué vers une insuffisance rénale terminale, dont l’un n’est survenu qu’à la fin de l’adolescence.
Dans un groupe de 65 patients atteints de PUV se présentant entre 1987–2004 et suivis sur une période plus courte (intervalle 1–14.3 ans; suivi médian 6.8 ans), Sarhan et al. ont trouvé un taux global de 17% d’atteinte rénale, dont 9% avaient évolué vers une insuffisance rénale terminale.30 Un âge gestationnel précoce au moment du diagnostic (<24 semaines; p=0.003) et un oligohydramnios ou un anhydramnios prénatal (p=0.02) étaient associés à une issue défavorable. Il n’y a eu aucun décès dans ce groupe, mais durant la même période d’étude, il y a eu 14 fœtus avec un diagnostic prénatal pour lesquels la grossesse a été interrompue. Une analyse de l’urine fœtale avait été réalisée dans tous les cas et les constatations post mortem ont confirmé des altérations histologiques rénales sévères. Cela suggère que l’incidence globale de l’insuffisance rénale, en tenant compte des fœtus pour lesquels la grossesse a été interrompue, est similaire à celle des autres études mentionnées ci-dessus.
La cohorte plus importante de DeFoor, comprenant 119 patients atteints de VUP, suivis pendant une durée similaire (intervalle 3–24 ans ; durée moyenne de suivi de 7,2 ans), a constaté que 13 % avaient développé une insuffisance rénale terminale à un âge médian de 8,2 ans (intervalle 7 jours–17,5 ans).31 Dans cette étude, une dysfonction vésicale, nécessitant un cathétérisme intermittent propre et/ou l’utilisation de médicaments anticholinergiques, était associée à un risque accru d’IRT. Un nadir de créatinine sérique > 1,0 mg/dl était également associé à un risque accru d’IRT (OR 71, IC 10–482) et cela a été confirmé dans plusieurs études antérieures et ultérieures où une créatinine sérique <1,0 mg/dl à l’âge de 1 an est de bon pronostic rénal à long terme.
Heikkila et al ont évalué une cohorte plus importante de patients (n=193) atteints de valves urétrales postérieures sur une période beaucoup plus longue (intervalle 6–69 ans; suivi médian de 31 ans).32 Le taux de progression vers l’insuffisance rénale terminale était de 22.8%, 68% développant une IRT avant l’âge de 17 ans et le reste après l’âge de 17 ans. La détérioration de la fonction rénale autour de la puberté chez les enfants ayant des reins dysplasiques est bien reconnue, et une explication probable est qu’elle représente des modifications intrarénales en réponse à la croissance, à l’augmentation de la masse corporelle et à l’élévation de la pression artérielle.33 Cependant, cette détérioration tardive de la fonction rénale après la puberté, mise en évidence par cet article, souligne la nécessité d’un suivi de ces patients à l’âge adulte et au-delà.
Pereira et al. dans leur série de 77 cas de PUV, diagnostiqués à un âge < 6 mois et suivis pendant une durée moyenne de 11,7 ans, ont constaté que 27 (35,1 %) présentaient une IRC, dont 14 étaient en IRT. Parmi ces 27 garçons en IRC, 22 ont évolué vers l’IRC au cours des 3 premières années de vie : 4 entre 15 et 16 ans et 1 à l’âge de 20 ans.34
L’apparition de l’insuffisance rénale terminale (IRT) demeure imprévisible. La protéinurie peut témoigner du début d’une dégradation de la fonction rénale et doit être surveillée. La polyurie peut augmenter les volumes résiduels post-mictionnels, entraînant une uropathie progressive et une altération de la capacité de concentration de la médullaire rénale, ce qui aggrave encore la polyurie et crée un cercle vicieux de dégradation. Une bonne vidange vésicale est essentielle; dans les cas extrêmes, un drainage vésical nocturne peut retarder la détérioration rénale et peut améliorer le sommeil des patients polyuriques.35
Reflux vésico-urétéral
Lors de la présentation, environ 50 % des patients présentent un reflux vésico-urétéral (RVU) sur la CUM initiale. On pense que cela est secondaire à l’obstruction de la voie d’évacuation vésicale et à une dysfonction vésicale associée. Environ 15 % des patients présentent un RVU unilatéral de haut grade avec absence de fonction du rein ipsilatéral. Après l’ablation des valves, la sévérité du RVU peut diminuer ou se résoudre complètement dans 25 à 50 % des cas, et cette amélioration est plus probable chez ceux qui se présentent à la période néonatale ou durant la petite enfance. La persistance d’un RVU, en particulier de haut grade et bilatéral, après une ablation des valves réussie, est associée à un mauvais pronostic rénal à long terme et constitue l’un des indicateurs pronostiques défavorables identifiés par Parkhouse et al.28 Il n’est plus d’usage de pratiquer des procédures antireflux chez les garçons porteurs de VUP, car les taux d’échec associés à cette approche sont élevés. Dans les cas où le grade du reflux est élevé et associé à une mauvaise fonction du rein ipsilatéral, l’uretère capacieux a été utilisé pour augmenter la vessie, en association avec l’ablation du rein non fonctionnel. D’autres stratégies innovantes incluent la création d’une urétérostomie refluxante comme discuté précédemment et, occasionnellement, l’uretère distal a été utilisé comme conduit de Mitrofanoff avec ou sans procédure antireflux associée. La persistance de reflux de grades élevés constitue un facteur de risque potentiel d’infections urinaires récurrentes et peut avoir un impact négatif sur les reins transplantés; ces reflux sont donc généralement traités chirurgicalment avant la transplantation rénale.
Dans un ERC récent, Abdelhalim et al. ont observé une certaine amélioration du reflux après ablation des valves avec de l’oxybutynine. Il y avait 24 patients dans le bras oxybutynine et 25 dans le bras témoin. Les unités rénales du groupe oxybutynine présentaient une probabilité plus élevée d’amélioration de l’hydronéphrose (61.9% vs 34.8%, p=0.011) et de résolution du reflux vésico-urétéral (62.5% vs 25%, p=0.023).36
Hydro-urétéro-néphrose
La majorité des nouveau-nés présentant des valves urétrales postérieures auront une hydro-urétéro-néphrose bilatérale. Celle-ci s’améliore souvent avec la cathétérisation initiale mais peut s’aggraver transitoirement en raison d’une obstruction fonctionnelle au niveau de la jonction vésico-urétérale (VUJ) due à l’affaissement de la paroi vésicale épaissie, pinçant les orifices urétéraux après cathétérisation et décompression. Il est important de reconnaître ce phénomène et, occasionnellement, cela peut entraîner une anurie durant 24-48 heures. L’obstruction se résout spontanément en 48-72 heures et est habituellement suivie d’une diurèse post-obstructive. Il est important de garder son sang-froid et de résister à la tentation de tenter de décomprimer les voies urinaires supérieures par la pose d’une sonde double J interne ou la mise en place de néphrostomies. Après l’ablation primaire des valves, on doit s’attendre à ce que le degré de dilatation des voies urinaires supérieures s’améliore progressivement ou se résolve complètement.37 Cette amélioration sera influencée par un VUR persistant, une dysfonction vésicale, une polyurie et une motilité urétérale anormale, et tous ces facteurs doivent être pris en compte lors de l’évaluation des résultats après ablation des valves. La réimplantation urétérale, avec ou sans effilage, n’est plus réalisée dans le contexte d’une aggravation de l’hydro-urétéro-néphrose dans les cas de PUV, car le rôle de la vessie et de sa dysfonction associée, ainsi que la dysfonction tubulaire rénale avec polyurie résultante, sont de plus en plus reconnus à mesure que s’améliore la compréhension de la physiopathologie de l’obstruction de l’écoulement vésical.
Résultats à long terme: Bas appareil urinaire
L’étiologie sous-jacente du comportement vésical dans les valves urétrales postérieures demeure un sujet de vifs débats. Deux mécanismes principaux sont incriminés dans cette étiologie : la vessie anormale résulterait de modifications in utero en réponse à une obstruction de l’écoulement urinaire et/ou le dysfonctionnement vésical serait la conséquence d’une dérivation urinaire. La question reste ouverte concernant la seconde théorie, car, à l’heure actuelle, la majorité des cas ne font pas l’objet d’une dérivation, bien que l’incidence du dysfonctionnement vésical demeure élevée. Godbole et coll. ont montré que la dérivation n’est pas nécessairement délétère pour l’évolution de la fonction vésicale et peut même l’améliorer.24
Histologiquement, la vessie obstruée dans les modèles animaux fœtaux montre une augmentation de la masse musculaire lisse, une augmentation du nombre de récepteurs muscariniques et une augmentation des dépôts de collagène. Mais des travaux plus récents impliquent une fibrose accrue dans la physiopathologie de la dysfonction vésicale.38 Un article de l’un des auteurs de ce chapitre a mis en évidence que le remplacement du muscle lisse par de la fibrose est un facteur majeur contribuant à la dysfonction contractile de la vessie PUV hypertonique. Cela ouvre des perspectives de recherche sur le potentiel des agents antifibrotiques pour restaurer une contractilité normale.39
Les chercheurs ont également démontré la réversibilité de certaines de ces modifications après levée de l’obstruction, bien que la récupération puisse être partielle selon le moment de la levée et le degré de lésions irréversibles déjà survenues. La présentation précoce résultant du diagnostic prénatal permet un traitement rapide et, par conséquent, il serait raisonnable de s’attendre à de meilleurs résultats concernant la fonction vésicale dans la population actuelle de garçons chez lesquels une obstruction de l’évacuation vésicale est suspectée en période prénatale.
Le terme ‘syndrome vésical des valves’ a été introduit comme concept dans les années 1980 afin d’englober les schémas mictionnels anormaux et les symptômes de dysfonction mictionnelle, une vessie à paroi épaissie persistante, une vidange vésicale incomplète et une dilatation des voies urinaires supérieures associée observés chez de nombreux garçons porteurs de valves urétrales postérieures traitées. Peters et al, dans leur cohorte de 41 garçons évalués principalement pour une incontinence urinaire persistante et un ‘syndrome vésical des valves’, ont identifié trois profils urodynamiques dominants lors d’explorations invasives ; une hyperactivité vésicale, une mauvaise compliance vésicale ou une vessie acontractile, avec un certain chevauchement entre ces profils.40
Au cours des 30 dernières années, les cliniciens ont commencé à reconnaître et à comprendre l’importance du dysfonctionnement vésical et son impact sur le pronostic de la continence urinaire et de la fonction rénale chez les garçons présentant des valves de l’urètre postérieur. Des différences marquées dans la méthodologie des explorations urodynamiques, la classification des différents profils et le moment de réalisation des examens sont constatées lors de la revue de la littérature sur ce sujet.
Holmdahl et al. ont suivi 12 garçons atteints de VUP âgés de moins de 15 ans. Une instabilité au cours du remplissage urodynamique a été observée chez 2/3 des patients à l’âge de 5 ans, mais à la puberté elle avait diminué.41 La capacité vésicale à l’âge de 5 ans semblait normale, mais après la puberté la capacité s’est avérée être environ deux fois la capacité attendue. Le profil urodynamique a changé au fil du temps, l’instabilité diminuant au profit d’un profil de surdistension vésicale avec l’augmentation de l’âge. Cette modification du comportement vésical a également été montrée par De Gennaro et al., où 71 % des 48 patients étudiés présentaient des explorations urodynamiques anormales entre 10 mois et 15 ans.42 Dans le groupe d’âge <8 ans, 44 % avaient des vessies hypercontractiles et 31 % hypocontractiles, et les patients >8 ans présentaient 28 % de profils hypercontractiles et 50 % de profils hypocontractiles. Misseri et al. ont mis en évidence un taux plus faible (5,9 %) d’insuffisance myogène (acontractile ou incapable de générer une contraction détrusorienne soutenue permettant une vidange vésicale adéquate) dans leur étude rétrospective portant sur 51 garçons et ont conclu que l’insuffisance détrusorienne était due à un traitement anticholinergique concomitant dans leur cohorte de cas.43
La dysfonction vésicale est déterminante pour les résultats de la fonction rénale à long terme, comme l’illustre l’étude de suivi à long terme de Parkhouse et al., où la constatation d’une incontinence à 5 ans chez 44% des patients, définie comme une absence de continence diurne, était associée à une issue rénale défavorable chez 46% de ce groupe (p<0.001).20,24 Dans le groupe d’Ansari de 227 garçons porteurs de valves de l’urètre postérieur, ils ont montré un risque global de 30% de développer une maladie rénale chronique, dont 10% évoluaient vers une insuffisance rénale terminale.1 Une dysfonction vésicale sévère, définie par une faible compliance avec une pression de fin de remplissage >40 cm d’H20 ou un volume résiduel post-mictionnel >30% ou un détrusor hypoactif ou la nécessité de CIC, était plus fréquente chez les patients évoluant vers l’IRT (p<0.0001). L’étude de Mazen portant sur 116 patients atteints de VUP suivis pendant une moyenne de 10.3 ans (intervalle 18 mois–22 ans) a trouvé que 42% des patients présentaient une IRT ou avaient été transplantés. Des anomalies urodynamiques ont été observées chez 80% de l’ensemble du groupe de patients et l’instabilité vésicale et la faible compliance étaient corrélées à une issue fonctionnelle rénale défavorable (p=0.04).44
Dans la cohorte de PUV traitées prénatalement, les données relatives à la dysfonction vésicale sont rares. Abbo et al. ont comparé l’évolution de 38 garçons diagnostiqués en prénatal et de 31 diagnostiqués en postnatal, atteints de PUV, ne retrouvant pas de différence significative de l’incidence de la dysfonction mictionnelle (27% vs. 31%) au terme d’un suivi de 7,2 ans.45
La fonction vésicale continue d’évoluer pendant l’adolescence, et une prise en charge vésicale efficace doit se poursuivre à l’âge adulte. La croissance prostatique modifie la dynamique de l’écoulement vésical, et le schéma de la dynamique vésicale observé dans la petite enfance continue d’évoluer au cours de l’adolescence, l’augmentation de la capacité vésicale et des volumes résiduels post-mictionnels importants étant les plus fréquentes. Certains jeunes hommes peuvent devoir recourir à un cathétérisme intermittent propre pour faire face à cette détérioration irréversible de la fonction vésicale.
Transplantation rénale
Étant donné le nombre important de garçons atteints de PUV évoluant vers une insuffisance rénale terminale, l’importance d’un bilan vésical complet dans le cadre du bilan pré-transplantatoire ne saurait être trop soulignée. Une vessie à haute pression, peu compliante et de faible capacité peut mettre en péril le rein transplanté et la perte du greffon devient une possibilité bien réelle. Les taux de survie du greffon à cinq ans dans la population PUV se sont améliorés au cours des deux dernières décennies, passant de 40 % dans les années 1980 à 70 % dans les années 1990 pour atteindre près de 90 % dans les années 2000.46
Pour les patients nécessitant une intervention chirurgicale afin d’obtenir une vessie considérée comme un réceptacle ‘sûr’ pour la greffe, les avis divergent quant à savoir si cette chirurgie doit être réalisée avant ou après la transplantation. Réaliser une augmentation vésicale avec/sans conduit cathétérisable avant la greffe rénale permet une cicatrisation postopératoire sans immunosuppression, mais expose au risque d’une ‘cystoplastie à sec’, qui doit être prise en charge par un cyclage vésical et des lavages, en particulier en cas d’absence ou de production urinaire native minimale. Un risque supplémentaire avec cette approche est que cette chirurgie majeure puisse faire basculer une fonction rénale fragile et accélérer la nécessité d’un traitement de suppléance et d’une dialyse temporaire dans un scénario de transplantation préemptive. En cas d’augmentation vésicale pré-transplantation, toute procédure supplémentaire, y compris la transplantation elle-même, ne doit pas endommager le pédicule vasculaire de l’augmentation, en particulier lorsqu’il existe un court intervalle entre les procédures, et des précautions supplémentaires doivent être prises pour assurer la sécurité de la vessie reconstruite. Chez les patients chez qui une cystoplastie d’augmentation est réalisée après la transplantation rénale, il est important que les besoins en immunosuppression aient été stabilisés et l’amélioration de la fonction rénale offre des avantages clairs. Dans ce contexte, l’uretère du greffon peut être réimplanté dans la vessie native ou extériorisé sous forme d’urétérostomie cutanée. Jesus et Pippi Salle ont conclu, après une revue de la littérature disponible, que l’augmentation accroît le risque d’infection urinaire après la transplantation.47 Ils ont convenu que l’augmentation préemptive ne devrait être réalisée que dans des cas sélectionnés, où les risques associés à l’augmentation des pressions vésicales dépassent ceux liés à l’augmentation et aux infections urinaires. Sachant qu’un nombre significatif de garçons avec VUP développeront une défaillance myogène, l’augmentation peut être différée tant qu’ils restent sous étroite surveillance. Dans le contexte des valves urétrales postérieures et de la transplantation rénale, il est crucial que la surveillance de la fonction vésicale se poursuive après la transplantation. Riley et al. présente une revue complète des différentes stratégies de prise en charge de la vessie dans le contexte d’une dysfonction du bas appareil urinaire et de la transplantation rénale.48
Fertilité
Il existe peu d’études rapportant les résultats en termes de fertilité et de paternité chez les hommes ayant des antécédents de valves urétrales postérieures (PUV). Une dilatation persistante de l’urètre postérieur, des lésions des tissus autour du veru montanum ou des sténoses urétrales secondaires consécutives à une chirurgie antérieure influenceront toutes l’efficacité de l’éjaculation. La dysfonction érectile est plus fréquente chez les patients atteints de maladie rénale chronique et chez ceux sous dialyse. Chez 9 patients ayant des antécédents de PUV étudiés par Woodhouse, le spermogramme était considéré comme dans les limites de la normale tandis que, parmi 6 hommes ayant soumis un échantillon de sperme pour analyse à Lopez Pereira, 2 patients présentaient des formes anormales ou un pourcentage élevé de spermatozoïdes immobiles.49,50
Pistes de recherche supplémentaires
La prise en charge des valves urétrales postérieures offre un vaste champ d’exploration pour de nouvelles stratégies de prédiction des résultats et de la survie. Un outil récent d’apprentissage automatique a été développé par Kwong et al. pour prédire des résultats cliniquement pertinents. Celui-ci est prometteur et justifie une validation supplémentaire.51
Points clés
- Les valves urétrales postérieures restent la cause la plus fréquente d’obstruction de la sortie vésicale néonatale chez les garçons.
- Un nombre croissant de cas est diagnostiqué au cours de la période prénatale, mais l’intervention prénatale ne semble pas apporter de bénéfice sur l’évolution à long terme de la fonction rénale.
- L’ablation primaire des valves est le traitement de choix recommandé, la dérivation étant réservée à des cas individuels spécifiques.
- Un nombre significatif de garçons porteurs de VUP développeront une maladie rénale chronique et une insuffisance rénale terminale.
- Un suivi structuré vise à prévenir la dégradation du haut appareil urinaire, à prévenir les infections urinaires, à optimiser la croissance et à permettre la surveillance d’une dysfonction vésicale chez les patients porteurs de VUP, avant et après transplantation.
Références
- Ansari MS. Risk factors for progression to end-stage renal disease in children with posterior urethral valves. Journal of Pediatric Urology 6 (ue 3): 261–264. DOI: 10.1590/s1677-55382011000200030.
- Krishnan A, Souza A, Konijeti R, Baskin LS. The anatomy and embryology of posterior urethral valves. J Urol 2006; Apr;175(4):1214-20. DOI: 10.1016/s0022-5347(05)00642-7.
- Dewan PA, Zappala SM, Ransley PG, Duffy PG. Endoscopic reappraisal of the morphology of congenital obstruction of the posterior urethra. J Urol 1992; 70: 439–444. DOI: 10.1111/j.1464-410x.1992.tb15805.x.
- Casella DP, Tomaszewski JJ, Ost MC. Posterior urethral valves: renal failure and prenatal treatment. Int J Nephrol 2012; 2012 (351067). DOI: 10.1155/2012/351067.
- Thakkar D, Deshpande AV, Kennedy SE. Epidemiology and demography of recently diagnosed cases of posterior urethral valves. Pediatr Res 2014; Dec;76(6):560-3. DOI: 10.1038/pr.2014.134.
- Brownlee E, Wragg R, Robb A, Chandran H, Knight M, L. MC, et al.. Current epidemiology and antenatal presentation of posterior urethral valves: Outcome of BAPS CASS National Audit. J Pediatr Surg 2019; Feb;54(2):318-321. DOI: 10.1016/j.jpedsurg.2018.10.091.
- Chiaramonte C, Bommarito D, Zambaiti E, Antona V, Li Voti G. Genetic Basis of Posterior Urethral Valves Inheritance. Urology 2016. DOI: 10.1016/j.urology.2016.05.043.
- A. HS, D. RP, H. PD, L. M-JM, obstruction CWHP. Prenatal sonographic findings and clinical outcome in fourteen cases. Journal of Ultrasound in Medicine 1988; 7 (7). DOI: 10.7863/jum.1988.7.7.371.
- J. C, R M. A case of hypospadias, anterior and posterior urethral valves. Journal of Surgical Case Reports 2013; 2013 (2). DOI: 10.1093/jscr/rjt003.
- L. RK, B. E, P M. Anterior and posterior urethral valves: a rare association. Journal of Pediatric Surgery 2003; 38 (7). DOI: 10.1016/s0022-3468(03)00218-5.
- Johnson MP, Danzer E, Koh J, Polzin W, Harman C, O’Shaughnessy R. Natural history of fetal lower urinary tract obstruction with normal amniotic fluid volume at initial diagnosis. Fetal Diagn Ther 2018; 44 (1): 10–17. DOI: 10.1159/000478011.
- Johnson MP, Bukowski TP, Reitleman C, Isada NB, Pryde PG, Evans MI. In utero surgical treatment of fetal obstructive uropathy: a new comprehensive approach to identify appropriate candidates for vesicoamniotic shunt therapy. Am J Obs Gynecol 1994; 170 (6): 1770–1779. DOI: 10.1016/s0002-9378(12)91847-5.
- Ruano R, Dunn T, Braun MC, Angelo JR, Safdar A. Lower urinary tract obstruction: fetal intervention based on prenatal staging, Pediatr. Nephrol 2017; 32 (10): 1871–1878. DOI: 10.1007/s00467-017-3593-8.
- Saccone G, D’Alessandro P, Escolino M, Esposito R, Arduino B, Vitagliano A. Antenatal intervention for congenital fetal lower urinary tract obstruction (LUTO): a systematic review and meta-analysis. J Matern Fetal Neonatal Med 2020; 33 (15): 2664–2670. DOI: 10.1080/14767058.2018.1555704.
- group PLUTO, M K, K K, K M, J D. PLUTO trial protocol: percutaneous shunting for lower urinary tract obstruction randomised controlled trial. BJOG 2007; 114 (7): 904–905. DOI: 10.1111/j.1471-0528.2007.01382.x.
- Hoover DL, Duckett JJ. Posterior urethral valves, unilateral reflux and renal dysplasia: a syndrome. J Urol 1982; 128 (5): 994–997. DOI: 10.1016/s0022-3468(83)80243-7.
- Cuckow PM, Dineen MD, Risdon RA, PG R. Longterm renal function in posterior urethral valves, unilateral reflux and renal dysplasia syndrome. J Urol 1997; 158(3: 2 1004–1007. DOI: 10.1016/s0022-5347(01)64375-1.
- Smeulders N, Makin E, Desai D, P D. The predictive value of a repeat micturating cystourethrogram for remnant leaflets after primary endoscopic ablation of posterior urethral valves. J Ped Urol 2011; 7 (2): 203–208. DOI: 10.1016/j.jpurol.2010.04.011.
- Mukherjee S, Joshi A, Carroll D, al CH. What is the effect of circumcision on risk of urinary tract infection in boys with posterior urethral valves? J Ped Surg 2009; 44: 417–421. DOI: 10.1016/j.jpedsurg.2008.10.102.
- Harper L, Blanc T, Peycelon M, Michel JL, Leclair MD, Garnier S, et al.. Circumcision and Risk of Febrile Urinary Tract Infection in Boys with Posterior Urethral Valves: Result of the CIRCUP Randomized Trial. Eur Urol 2021; 22:S0302-2838(21)01993-X. DOI: 10.1016/j.eururo.2021.08.024.
- Chua ME, Ming JM, Carter S, El Hout Y, Koyle MA, Noone D, et al.. Impact of Adjuvant Urinary Diversion versus Valve Ablation Alone on Progression from Chronic to End Stage Renal Disease in Posterior Urethral Valves: A Single Institution 15-Year Time-to-Event Analysis. J Urol 2018. DOI: 10.1016/j.juro.2017.10.024.
- Tietjen DN, Gloor JM, Husmann DA. Proximal urinary diversion in the management of posterior urethral valves: is it necessary? J Urol 1997; 158: 1008–1010. DOI: 10.1016/s0022-3468(98)90257-3.
- P LP, L E, MJ MU, R L. Posterior urethral valves: prognostic factors. BJU Int 2003; 91: 687–690. DOI: 10.1016/s0022-5347(05)61251-7.
- Godbole P, Wade A, Mushtaq I, Wilcox D. Vesicostomy vs. primary valve ablation of posterior urethral valves: Always a difference in outcome? J Ped Urol 2007; 3: 273–275. DOI: 10.1016/j.jpurol.2006.11.007.
- Jaureguizar E, Lopez Pereira P, Urrutina MJM, L E. Does neonatal pyeloureterostomy worsen bladder function in children with posterior urethral valves? J Urol 2000; 164: 1031–1034. DOI: 10.1097/00005392-200009020-00027.
- Podesta M, Ruarte A, Garguilo C, R M. Bladder function associated with posterior urethral valves after primary valve ablation or proximal urinary diversion in children and adolescents. J Urol 2002; 168: 1830–1835. DOI: 10.1097/00005392-200210020-00042.
- Henneberry MO, Stephens FD. Renal hypoplasia and dysplasia in infants with posterior urethral valves. J Urol 1980; 123: 912–915. DOI: 10.1016/s0022-5347(17)56190-x.
- Parkhouse HF, Barratt TM, Dillon MJ, al DPG. Long-term otcome of boys with posterior urethral valves. Br J Urol 1988; 62: 59–62. DOI: 10.1111/j.1464-410x.1988.tb04267.x.
- Kousidis G, Thomas DFM, Morgan H, N H. The long-term outcome of prenatally detected posterior urethral valves:10 to 23 year follow-up study. BJU Int 2008; 102: 1020–1024. DOI: 10.1111/j.1464-410x.2008.07745.x.
- Sarhan O, Zaccaria I, Macher M, F M. Long-term outcome of prenatally detected posterior urethral valves: a single centre study of 65 cases managed by primary valve ablation. J Urol 2008; 179 (1): 307–312. DOI: 10.1016/j.juro.2007.08.160.
- DeFoor W, Clark C, Jackson E, P R. Risk factors for end stage renal disease in children with posterior urethral valves. J Urol 2008; 180: 1705–1708. DOI: 10.1016/s0084-3954(09)79530-2.
- Heikkila J, Holmberg C, Kyllonen L, al RR. Long term risk of end stage renal disease in patients with posterior urethral valves. J Urol 2011; 186: 2392–2396. DOI: 10.1016/j.juro.2011.07.109.
- Celedon CG, Bitsori M, Tullus K. Progression of chronic renal failure in children with dysplastic kidneys. Pediatr Nephrol 2007; 22: 1014–1020. DOI: 10.1007/s00467-007-0459-5.
- P LP, MJ MU, L E, E J. Long-term consequences of posterior urethral valves. J Pediatr Urol 2013; Oct;9(5):590-6. DOI: 10.1016/j.jpurol.2013.06.007.
- Nguyen MT, Pavlock CL, Zderic SA, Carr MC, Canning DA. Overnight catheter drainage in children with poorly compliant bladders improves post-obstructive diuresis and urinary incontinence. J Urol 2005; 174 (1633). DOI: 10.1097/01.ju.0000179394.57859.9d.
- Abdelhalim A, El-Hefnawy AS, Dawaba ME, Bazeed MA, Hafez AT. Effect of Early Oxybutynin Treatment on Posterior Urethral Valve Outcomes in Infants: A Randomized Controlled Trial. J Urol 2020; Apr;203(4):826-831. DOI: 10.1097/ju.0000000000000691.
- Farhat W, McLorie G, Capolicchio G, A K. Outcomes of primary valve ablation versus upper tract diversion in patients with posterior urethral valves. Urology 2000; 56 (4): 653–657. DOI: 10.1016/s0090-4295(00)00784-6.
- Metcalfe PD, Wang J, Jiao H, Huang Y, Hori K, Moore RB. Bladder outlet obstruction: progression from inflammation to fibrosis. BJU Int 2010; 106 (1686). DOI: 10.1111/j.1464-410x.2010.09445.x.
- Johal N, Cao K, Arthurs C, Millar M, Thrasivoulou C, Ahmed A, et al.. Contractile function of detrusor smooth muscle from children with posterior urethral valves - The role of fibrosis. J Pediatr Urol 2021; 100 (e1-100.e10). DOI: 10.1016/j.jpurol.2020.11.001.
- Peters CA, Bolkier M, Bauer SB, WH H. The urodynamic consequences of posterior urethral valves. J Urol 1990; 144 (1): 122–126. DOI: 10.1016/s0022-5347(17)39388-6.
- Holmdahl G, Sillen U, Hanson E, G H. Bladder dysfunction in boys with posterior urethral valves before and after puberty. J Urol 1996; 155: 694–698. DOI: 10.1016/s0022-5347(01)66502-9.
- M G, G M, ML C, M S. Early detection of bladder dysfunction following posterior urethral valves ablation. Eur J Pediatr Surg 1996; 6: 163–165. DOI: 10.1055/s-2008-1066497.
- Misseri R, Combs AJ, Hrowitz DJM. Myogenic failure in posterior urethral valve disease: real or imagined? J Urol 2002; 168: 1844–1848. DOI: 10.1097/00005392-200210020-00045.
- Ghanem MA, Wolffenbuttel KP, Vylder A, Nijman RJM. Long-term bladder dysfunction and renal function in boys with posterior urethral valves based on urodynamic findings. J Urol 2004; 171: 2409–2412. DOI: 10.1097/01.ju.0000127762.95045.93.
- Abbo O, Bouali O, Ballouhey Q, Mouttalib S, Lemandat A. Decramer S, et al.\[Is there an outcome difference between posterior urethral valves diagnosed prenatally and postnatally at the time of antenatal screening?\. Prog Urol 2013; 23: 144–149.
- Marchal S, Kalfa N, Iborra F, Badet L, Karam G, Broudeur L, et al.. Long-term Outcome of Renal Transplantation in Patients with Congenital Lower Urinary Tract Malformations: A Multicenter Study. Transplantation 2020; Jan;104(1):165-171. DOI: 10.1097/tp.0000000000002746.
- Jesus LE, Pippi Salle JL. Pre-transplant management of valve bladder: a critical literature review. J Pediatr Urol 2015; Feb;11(1):5-11. DOI: 10.1016/j.jpurol.2014.12.001.
- Riley P, Marks SD, Desai D, I M. Challenges facing renal transplantation in pediatric patients with lower urinary tract dysfunction. Transplantation 2010; 89 (11): 1299–1307. DOI: 10.1097/tp.0b013e3181de5b8c.
- Woodhouse C, Reilly JM, Bahadur G. Sexual function and fertility in patients treated for posterior urethral valves. J Urol 1989; 142 (2 part 2): 586–588. DOI: 10.1016/s0022-5347(17)38824-9.
- P LP, M M, MJ MU, JA M. Long-term bladder function, fertility and sexual function in patients with posterior urethral valves treated in infancy. J Pediatr Urol 2011. DOI: 10.1016/j.jpurol.2011.11.006.
- Wong JC, Khondker A, Kim JK, Chua M, Keefe DT, Dos Santos J, et al.. Posterior Urethral Valves Outcomes Prediction (PUVOP): a machine learning tool to predict clinically relevant outcomes in boys with posterior urethral valves. Pediatr Nephrol 2021. DOI: 10.1007/s00467-021-05321-3.
Dernière mise à jour: 2025-09-22 07:59