20: Dysfonction mictionnelle
Ce chapitre prendra environ 44 minutes de lecture.
Introduction
Les symptômes du bas appareil urinaire (LUTS), la dysfonction vésico-intestinale (BBD) ou le syndrome d’élimination dysfonctionnelle sont autant de termes qui décrivent l’éventail habituel de symptômes allant du syndrome de vessie hyperactive (OAB), à l’ajournement mictionnel, l’incontinence d’effort, l’incontinence au rire, jusqu’à la miction dysfonctionnelle, entre autres.1 L’impact des fuites urinaires diurnes chez l’enfant peut être considérable—avec des répercussions sociales, émotionnelles et comportementales sur la vie quotidienne.2 D’après notre compréhension de la vessie hyperactive (OAB), nous savons que si elle persiste sur une période prolongée, on observe un épaississement de la paroi vésicale, ce qui peut avoir un impact à vie. À mesure que les patients avancent en âge, les conséquences deviennent plus marquées et exigent davantage d’efforts pour être corrigées.3,4
Du point de vue de l’urologie pédiatrique, l’enfant présentant une hyperactivité vésicale (OAB) est susceptible de présenter des problèmes d’OAB à l’âge adulte. Cette corrélation a été observée dans deux rapports publiés. Dans la première étude, Fitzgerald et al3 ont montré que des mictions diurnes fréquentes pendant l’enfance étaient corrélées à l’urgence mictionnelle à l’âge adulte, et qu’il existait une corrélation entre la nycturie de l’enfance et celle de l’adulte. L’incontinence diurne pendant l’enfance et l’énurésie nocturne étaient associées à un risque plus que doublé d’incontinence urinaire par impériosité à l’âge adulte. En outre, des antécédents d’infection urinaire (IU) dans l’enfance étaient corrélés aux IU à l’âge adulte. Dans une autre étude de Minassian et al portant sur 170 femmes adultes, ils ont constaté une prévalence plus élevée de dysfonction mictionnelle pendant l’enfance chez les femmes présentant une pollakiurie, une urgence mictionnelle, et une incontinence d’effort ou par impériosité.4 Ils ont également noté que les patientes symptomatiques étaient plus susceptibles d’avoir un IMC plus élevé. La tendance a été de rassurer les parents en indiquant que ces problèmes sont spontanément résolutifs et se résoudront à mesure que l’enfant mûrit. Il semble que la résolution spontanée ne survienne pas toujours et que certains enfants, en grandissant, deviennent simplement plus aptes à compenser leurs problèmes et finissent par être perdus de vue. Une meilleure compréhension des causes potentielles de l’OAB chez l’enfant peut prévenir des problèmes indus à l’âge adulte et rendre beaucoup d’enfants, de parents et d’enseignants bien plus heureux.
Génétique
Il existe de plus en plus de preuves que les facteurs génétiques jouent un rôle majeur dans l’incontinence urinaire. Les enfants de parents présentant une vessie hyperactive (OAB) et/ou des troubles psychiatriques sous-jacents ont tendance à être plus réfractaires aux traitements conventionnels de l’OAB.3,5 Ces constatations ont été corroborées par Labrie et al, dont les travaux montrent que les mères d’enfants présentant une vessie hyperactive (OAB) ou une miction dysfonctionnelle sont plus susceptibles d’avoir eu des symptômes similaires dans leur enfance que les mères d’enfants sans symptômes du bas appareil urinaire (SBAU) (28,9 % vs 16,3 %, p<0,02, respectivement).5 Les pères d’enfants présentant des symptômes du bas appareil urinaire (SBAU) étaient plus susceptibles d’avoir eu une résolution tardive de leur énurésie nocturne (6 % et 6,5 % chez les garçons et les filles, respectivement) et, de plus, les pères présentant une incontinence diurne avaient, en tant qu’enfants, un taux d’incontinence statistiquement significatif de 9,25 % vs 4,6 % (p<0,0001).5 Les données chez l’adulte peuvent être utilisées comme proxy pour les enfants. À l’examen des données disponibles, certaines études indiquent une prédisposition génétique aux SBAU chez certains patients. Une méthodologie couramment utilisée pour déterminer l’importance de l’influence génétique est l’utilisation d’études chez des jumeaux. Une étude suédoise portant sur plus de 25 000 jumeaux a mis en évidence un lien génétique de susceptibilité à l’incontinence urinaire, à la fréquence mictionnelle et à la nycturie chez les femmes.6 Les données étaient insuffisantes chez les patients de sexe masculin pour tirer des conclusions. En revanche, dans une étude examinant une méta-analyse des polymorphismes/gènes candidats chez l’homme, cinq gènes ont été identifiés: ACE, ELAC2, GSTM1, TERT et VDR. L’hétérogénéité était élevée dans trois de ces méta-analyses. Le variant rs731236 du récepteur de la vitamine D avait un effet protecteur vis-à-vis des SBAU (odds ratio: 0,64; intervalle de confiance à 95 %, 0,49–0,83) avec une hétérogénéité modérée (I2 = 27,2 %).7
En consultant la littérature psychiatrique, on trouve un grand nombre d’études établissant un lien entre les troubles psychologiques et les LUTS. Une association entre l’incontinence urinaire et le bien-être psychologique chez l’adulte a également été notée par Botlero et al.8 La dépression majeure peut prédire la survenue d’une incontinence urinaire chez les femmes dans un échantillon de population à risque.9 Une étude a mis en évidence des taux accrus d’énurésie chez les adultes atteints de trouble bipolaire (18 %).10 Une association avec le trouble panique et la cystite interstitielle a également été décrite.11 L’incontinence diurne a également été identifiée comme un marqueur développemental prémorbide de la schizophrénie (SCZ).12 Les auteurs ont constaté que les patients atteints de SCZ présentaient des taux plus élevés d’énurésie durant l’enfance (21 %) par rapport aux frères et sœurs (11 %) ou aux patients témoins (7 %), et le risque relatif d’énurésie était augmenté chez les frères et sœurs. Les patients présentant une énurésie ont obtenu de moins bons résultats à deux tests cognitifs des lobes frontaux (fluence verbale par lettres et par catégories) que les patients non énurétiques. Fait notable, les anomalies cérébrales associées à ces troubles tendent à se regrouper autour du cortex cingulaire antérieur (ACC) et du cortex préfrontal (PFC), exactement là où des anomalies sont observées chez des patients présentant une urgenturie et une incontinence d’urgence à l’IRMf.13,14
Épidémiologie
La prévalence de l’incontinence diurne varie largement d’une étude à l’autre. À l’âge de 7 ans, le taux d’incontinence diurne varie de 4,9 à 11,7 %.15,16 À l’âge de 11–12 ans, le taux de prévalence se situe entre 0,8 % et 12,5 %.17,18,19,20,21 Une méta-analyse de ces 3 études a été réalisée, montrant une prévalence globale de 6,4 %. L’étude la plus importante apportant un éclairage de manière continue est l’étude longitudinale anglaise ALSPAC, qui a identifié les trajectoires suivantes pour l’incontinence diurne sur la tranche d’âge 4,5-9,5 ans:22
i. Normatif (86.2%); continent à 4.5 ans ii. Retardé (6.9%); probabilité d’incontinence diurne diminuant régulièrement de 80% à 4.5 ans à < 10% à 9.5 ans iii. Persistant (3.7%); probabilité d’incontinence diurne > 80% jusqu’à l’âge de 7.5 ans avec réduction régulière à 60% à 9.5 ans iv. Récidivant (3.2%); probabilité d’incontinence diurne <10% à 5.5 ans augmentant jusqu’à 60% à 6.5 ans avec déclin lent par la suite.
Il n’y avait pas de différence entre les sexes dans le groupe retardé, mais les filles étaient plus nombreuses que les garçons dans les groupes persistant et récidivant. Une étude de Stone et al qui a évalué des enfants présentant une incontinence urinaire persistante ayant bénéficié d’explorations urodynamiques et d’une imagerie du rachis a montré que, en extrapolant jusqu’à l’âge de 18 ans, jusqu’à 33 % des enfants qui avaient des fuites urinaires à l’âge de 10 ans étaient susceptibles de continuer à présenter une forme quelconque de symptômes urinaires.23
Comorbidité neuropsychiatrique
Les enfants présentant des troubles de l’élimination ont un taux accru de troubles comportementaux et psychologiques concomitants ; environ 20–40 % des enfants ayant une incontinence urinaire diurne sont concernés par des troubles du comportement.24,25,26 Dans une vaste étude épidémiologique portant sur 8 213 enfants âgés de 7,5–9 ans, les enfants présentant une incontinence urinaire diurne avaient des taux significativement accrus de troubles psychologiques, en particulier l’anxiété de séparation (11,4 %), le trouble déficit de l’attention avec hyperactivité (TDAH) (24,8 %), les comportements oppositionnels (10,9 %) et les troubles des conduites (11,8 %).27 Dans la même cohorte, 10 000 enfants âgés de 4–9 ans ont été évalués ; un développement retardé, un tempérament difficile et une dépression/anxiété maternelle étaient associés à l’incontinence urinaire diurne et aux souillures fécales.28 Dans une autre étude de population incluant 2 856 enfants, l’incidence de l’incontinence était de 16,9 % au cours des 6 mois précédents.29 Dans une étude rétrospective de patients atteints de TDAH, 20,9 % présentaient une énurésie nocturne et 6,5 % une incontinence urinaire diurne. Les rapports de cotes étaient de 2,7 et 4,5, respectivement, ce qui montre une association non spécifique du TDAH avec l’énurésie nocturne et l’incontinence urinaire diurne.30 Parmi les troubles possibles de l’élimination gastro-intestinale, les enfants présentant une incontinence fécale (ou encoprésie) avaient les taux les plus élevés de troubles comportementaux comorbides : 30–50 % de l’ensemble des enfants présentaient des perturbations comportementales cliniquement significatives.24,25 Dans une étude épidémiologique portant sur plus de 8 242 enfants, ceux âgés de 7 à 8 ans présentaient un large éventail de troubles associés (DSM-IV), dont l’anxiété de séparation (4,3 %), les phobies sociales (1,7 %), les phobies spécifiques (4,3 %), l’anxiété généralisée (3,4 %), les troubles dépressifs (2,6 %), le TDAH (9,2 %) et le trouble oppositionnel avec provocation (11,9 %). Une étude antérieure a constaté que les patients décrits comme présentant un psychonévrosisme répondaient moins bien au traitement de l’instabilité du détrusor que ceux ne présentant aucune forme de psychonévrosisme. La plupart des bons répondeurs et un tiers des non-répondeurs étaient indemnes de problèmes psychiatriques.31 Fait important, 25 % des patients de cette étude présentaient des symptômes de syndrome de l’intestin irritable.
Évaluation
Historique
L’évaluation de l’enfant atteint de BBD commence par une anamnèse détaillée et un examen physique. Une anamnèse claire aide à déterminer la symptomatologie prédominante et le moment où les symptômes ont tendance à survenir. De manière générale, il est préférable d’obtenir l’anamnèse pertinente directement auprès de l’enfant s’il est coopératif. Lorsque l’anamnèse ne peut pas être obtenue auprès de l’enfant, il peut ne pas y avoir d’autre choix que de l’obtenir auprès des parents. Des signes d’urgence mictionnelle tels que croiser les jambes, courir aux toilettes, se tenir le pénis, frotter le clitoris, s’accroupir et s’asseoir sur les talons (révérence de Vincent) sont autant de signes d’urgence. La tenue d’un journal mictionnel est essentielle. La pollakiurie est une autre manifestation de la vessie hyperactive (OAB), et quantifier le volume et le nombre de mictions est utile pour déterminer s’il existe une véritable pollakiurie. L’incontinence urinaire par urgenturie est un signe cardinal de la vessie hyperactive. Le moment auquel l’incontinence survient doit être documenté afin d’aider à identifier toute association avec l’intestin. Il n’est pas rare, chez les enfants présentant une charge fécale importante, d’avoir une urgenturie et une incontinence par urgenturie après un repas. Cela est très probablement dû à la stimulation des contractions coliques par le réflexe gastrocolique. Il est bien établi qu’il existe un dialogue croisé au niveau de la moelle épinière entre le côlon et la vessie.32,33,34,35 Cela peut déclencher des contractions vésicales ou, à tout le moins, entraîner des symptômes d’urgenturie. Le goutte-à-goutte post-mictionnel est un signe soit d’une relaxation incomplète de l’ensemble du complexe sphinctérien, soit du sphincter externe. C’est fréquent chez les enfants présentant des mictions dysfonctionnelles. On observe également fréquemment chez ces patients une dysurie ou une urétrorragie qui ne sont pas associées à une infection mais plutôt dues à une miction dyssynergique.33
La dyssynergie du sphincter interne a été associée à des étourdissements et à une dysfonction autonome (hypotension en position debout sans augmentation concomitante de la fréquence cardiaque) chez les hommes comme chez les femmes lorsqu’on demande aux patients s’ils ressentent des étourdissements en se mettant debout.36
Il convient de recueillir directement auprès du patient un interrogatoire détaillé de ses habitudes intestinales. De nombreux parents ne sont pas conscients de la véritable nature des selles de leurs enfants et beaucoup déclareront que les selles de leurs enfants sont normales, tandis que les enfants les contrediront fermement. Il convient de documenter la taille et la nature des selles. L’utilisation d’un schéma est très bénéfique et elle facilite la communication avec l’enfant.37 Il est important de noter si les selles sont douloureuses ou associées à un saignement rectal. Des selles très volumineuses sont généralement un indicateur de selles peu fréquentes. La douleur ou le saignement rectal peuvent être associés à une dyssynergie du sphincter externe. Les patients présentant une diarrhée ou des symptômes de colite peuvent également présenter des problèmes d’hyperactivité vésicale. La douleur péri-ombilicale chronique est un autre signe qu’il existe un problème de constipation ou des troubles de l’homéostasie de la sérotonine dans l’intestin. De nombreux enfants se plaindront de cette douleur et, une fois qu’un programme de défécation est instauré, la douleur disparaît.
Un questionnaire standardisé devrait être utilisé pour évaluer les patients lors de la première consultation et lors du suivi. Deux questionnaires couramment utilisés ont été validés chez l’enfant, le premier est le DVSS et l’autre est l’échelle de Vancouver.38,39 De plus, il existe un questionnaire qui évalue le profil psychiatrique de l’enfant et qui est très utile pour dépister rapidement des troubles sous-jacents de l’attention, de l’hyperactivité, de la dépression et de l’anxiété chez les enfants, fréquemment associés aux LUTS.40
Examen clinique
L’examen clinique est utile pour l’évaluation et peut être très révélateur. L’examen de l’abdomen est essentiel pour déterminer s’il existe des selles palpables dans le côlon. La palpation du quadrant inférieur gauche jusqu’au quadrant supérieur gauche met généralement en évidence de grandes quantités de selles présentes dans l’abdomen. Dans de nombreux cas, les parents peuvent nier l’existence de problèmes intestinaux. La distension gazeuse du côlon est tout aussi problématique et doit être notée, car elle peut entraîner les mêmes problèmes que la constipation.
L’examen du dos révèle généralement un dos d’aspect normal et des plis anocutanés. Les rares cas d’aplatissement des fesses ou de plis anormaux au niveau de l’articulation sacro-iliaque (SI) sont évocateurs d’une anomalie du sacrum (Figure 1) et (Figure 2) Observer la marche de l’enfant peut également aider à identifier un éventuel problème neurologique si l’enfant marche sur la pointe des pieds. Les pieds creux sont un autre indice potentiel d’une affection neurologique. Les fossettes sacrées basses ne sont généralement pas préoccupantes. Seules les fossettes associées à des touffes de poils ou situées plus haut sur le dos sont préoccupantes et doivent être évaluées par une IRM du rachis lombo-sacré.
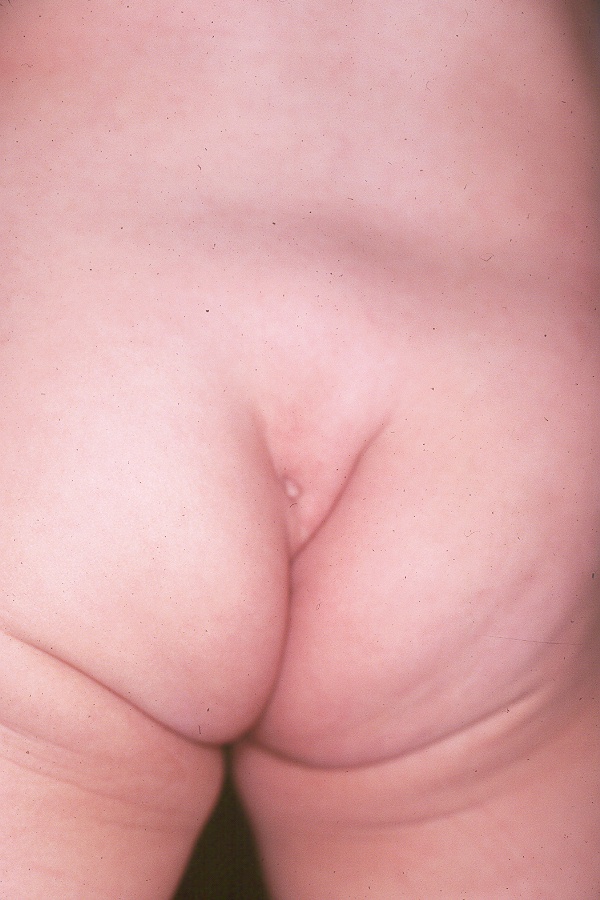
Figure 1 Sillon interfessier anormal associé à une moelle épinière attachée.
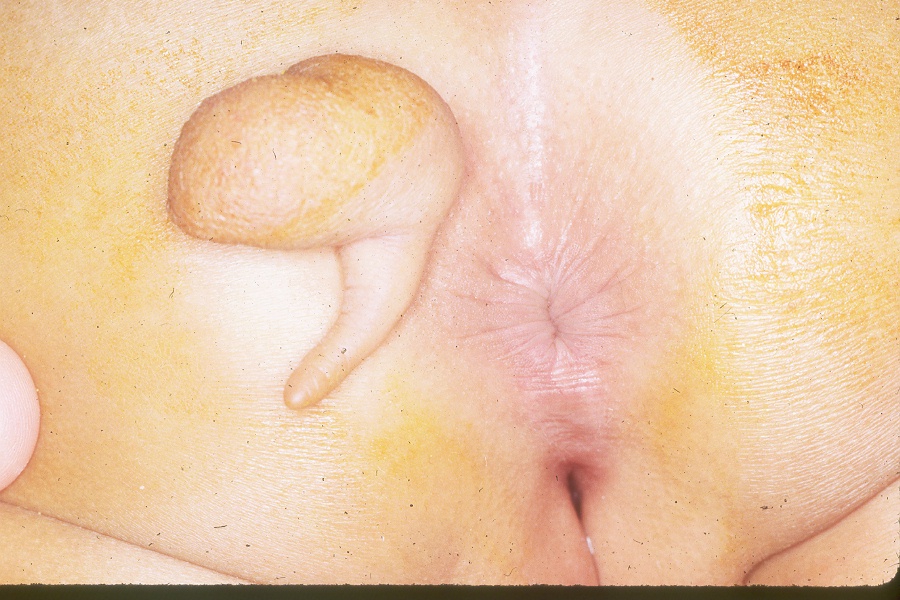
Figure 2 Appendice parasacré associé à un ancrage médullaire.
Examens diagnostiques
Ci-dessous, nous présentons les examens diagnostiques que nous réalisons, dans l’ordre où nous les effectuons, afin d’optimiser notre prise en charge et de minimiser les examens invasifs chez les patients.
Analyse d’urine
Le premier et le plus important examen clinique qui devrait être réalisé chez tous les enfants atteints de BBD est l’analyse d’urine. Une simple analyse d’urine devrait aider à déterminer si les symptômes sont dus à une infection ou au BBD. Il n’est pas rare d’observer une microhématurie chez des patients présentant une miction dyssynergique, qui est couramment associée au BBD.
Résidu post-mictionnel
Un RPM doit être effectué chez tous les patients vus pour des SVUI et une miction dysfonctionnelle. C’est l’information la plus importante dont vous disposez aux premiers stades de l’évaluation et elle peut vous fournir immédiatement des indications supplémentaires sur les problèmes potentiels à traiter. Des résidus élevés peuvent être associés à des IU récidivantes ou à des mictions fréquentes, tandis qu’un RPM bas peut aussi être associé à des mictions fréquentes, mais l’étiologie sous-jacente de cette fréquence sera différente.
Un dispositif capable de fournir une image réelle de la vessie est préférable à un dispositif qui donne une image représentative. Cela est utile, car on peut également mesurer le diamètre rectal. Des diamètres rectaux supérieurs à 4 cm sont associés à la BBD, et des études ont montré que la correction de cette dilatation est associée à une amélioration des symptômes.
Débitmétrie urinaire/EMG
La débitmétrie mictionnelle est un outil important pour aider à déterminer si l’enfant mictionne de façon anormale. L’utilisation des 5 courbes classiques, la cloche, la tour ou hypervidangeur, la saccadée, l’interrompue et la courbe en plateau, est en passe d’être supplantée par un système modifié qui repose sur le caractère lisse ou fractionné de la courbe et sur un indice de débit. L’indice de débit est indépendant du volume et peut donc être utilisé pour comparer les débits à tous les volumes et à différents âges.41,42,43 De plus, les indices de débit sont une mesure de l’efficacité mictionnelle, ce qui fournit une représentation du débit bien plus précise que les descriptions de forme.
L’utilisation de l’uroflow est davantage renforcée par l’utilisation concomitante d’un EMG des muscles périnéaux. L’utilisation de l’EMG périnéal nous permet de déterminer si l’enfant urine avec une dyssynergie du sphincter externe (augmentation de l’activité des muscles périnéaux) et de diagnostiquer une dyssynergie du sphincter interne sur la base du temps de latence et de la forme de la courbe de débit (typiquement un plateau ou un indice de débit <=0.7).44
Échographie rénale et vésicale
L’échographie réno-vésicale n’est pas indispensable chez les enfants présentant des LUTS non associés à une infection. En revanche, un patient avec des infections récidivantes devrait faire examiner les voies urinaires supérieures afin de rechercher des asymétries de taille et une hydronéphrose, pouvant être évocatrices d’un reflux ou de ses conséquences. Chez les patients présentant une incontinence persistante, une échographie est utile pour exclure une duplication rénale associée à un uretère ectopique. La dilatation d’un uretère peut constituer un autre indice suggérant un uretère ectopique. Chez les patients présentant une miction obstructive, l’échographie vésicale aide à identifier la présence d’un urétérocèle obstructif. L’épaississement de la paroi vésicale peut être mis en évidence à l’échographie et constitue un indicateur utile d’obstruction ou d’hyperactivité vésicale.
KUB et AP et latérale du rachis
Chez certains enfants dont la morphologie corporelle rend la palpation des selles peu fiable, il peut être nécessaire d’envisager un KUB pour évaluer la charge fécale colique ou pour apprécier l’évolution d’un programme intestinal. Si un KUB est réalisé, il est raisonnable d’envisager un cliché AP et un cliché de profil du sacrum afin de confirmer l’absence d’anomalies sacrées (Figure 3) Chez certains enfants, un KUB peut être insuffisant pour vérifier que la colonne vertébrale est normale en raison de selles sus-jacentes qui masquent le sacrum.
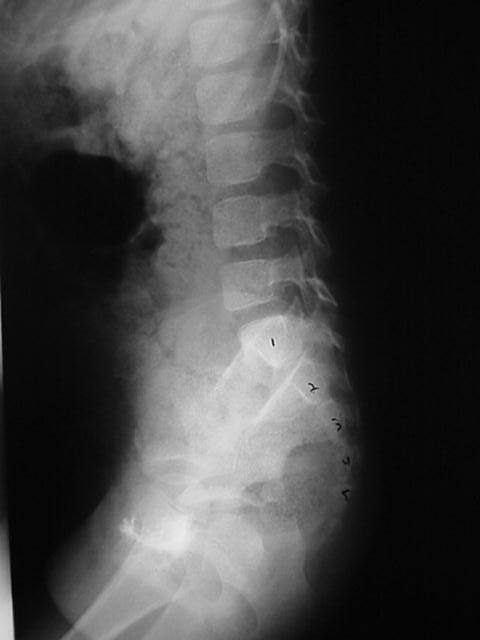
Figure 3 Le cliché latéral de la colonne vertébrale montre clairement des segments sacrés qui ne seraient pas visibles en raison d’une importante surcharge fécale chez ce patient.
Urétrocystographie mictionnelle
Une cysto-urétrographie mictionnelle bien réalisée fournit une quantité considérable d’informations sur la dynamique de la miction en plus de la présence ou de l’absence de reflux, d’uretères ectopiques ou de valvules. On peut voir le col vésical s’ouvrir et l’on peut également voir le sphincter externe s’ouvrir et se fermer. La présence de l’aspect en toupie de l’urètre est un exemple classique de dyssynergie du sphincter externe (Figure 4) Une cysto-urétrographie mictionnelle n’est pas indiquée chez tous les patients présentant des SBAU. Une cysto-urétrographie mictionnelle doit être réalisée dans les cas réfractaires pour préciser davantage la dynamique de la miction et confirmer qu’aucune anomalie anatomique n’a été méconnue.
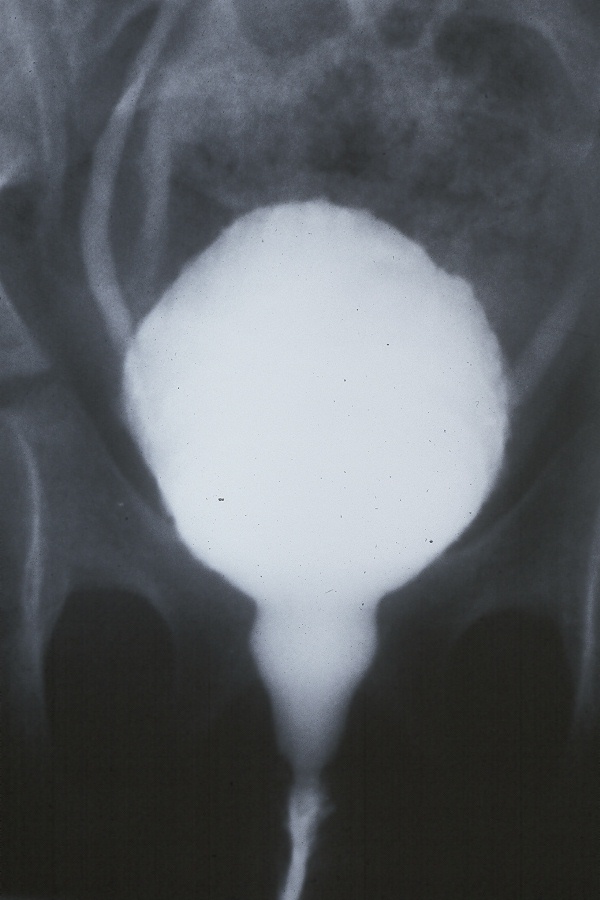
Figure 4 Urètre en toupie chez une femme présentant un reflux et des infections urinaires récidivantes.
IRM du rachis
L’imagerie sacrée est indiquée lorsque le patient présente une lésion évidente du dos, comme mentionné précédemment dans la section de l’examen physique. Chez les patients pour lesquels toutes les tentatives de traitement ont échoué et chez qui l’incontinence persiste, une IRM du rachis peut également être indiquée. Nous recommandons de réaliser l’IRM avant le bilan urodynamique, car une hyperactivité détrusorienne au bilan urodynamique n’est pas diagnostique d’un dysfonctionnement vésical neurogène. Par conséquent, le patient aura de toute façon besoin d’une IRM du rachis et il est préférable de commencer par l’examen de référence. Un syndrome de moelle attachée occulte survient très rarement en l’absence de stigmates cutanés.45
Urodynamique
Chez les patients présentant des LUTS, l’examen urodynamique ne fait souvent que confirmer ce que suggère une anamnèse minutieuse, à savoir la présence de contractions non inhibées (UIC). Bael et al justifient cette affirmation, ayant démontré l’absence de bénéfice à réaliser une étude urodynamique chez des enfants atteints de BBD.46 La présence d’UIC ne permet ni d’affirmer ni d’exclure l’existence d’une lésion neurologique. Le seul élément significatif est l’absence de contraction détrusorienne, déjà évidente à l’urofluxométrie montrant une courbe de débit médiocre. Cela ne signifie pas qu’il n’existe aucune indication à réaliser des UDS chez l’enfant. Dans certaines situations, des examens urodynamiques sont réalisés simultanément avec une VCUG. Dans certains cas, les UDS peuvent aider à identifier l’origine des fuites, en particulier lorsqu’elles sont associées à la fluoroscopie.
Options de traitement
Urothérapie
L’urothérapie est un terme générique désignant l’ensemble des interventions non chirurgicales et non pharmacologiques pour les troubles fonctionnels de la vessie et de l’intestin chez l’enfant et l’adolescent. Elle constitue le traitement de première intention de l’incontinence urinaire diurne, ainsi que de l’incontinence nocturne, de la constipation fonctionnelle et de l’incontinence fécale.47,48
L’objectif de l’urothérapie est de normaliser la miction et le transit intestinal et de prévenir d’autres troubles fonctionnels. On distingue l’urothérapie standard et l’urothérapie spécifique. Trois conditions doivent être remplies avant de commencer l’urothérapie. Premièrement, un diagnostic clair d’incontinence fonctionnelle. Deuxièmement, l’enfant doit être apte à la scolarisation; s’il est trop immature, il peut ne pas disposer des compétences cognitives ou des capacités motrices nécessaires pour comprendre et mener à bien l’urothérapie. Troisièmement, une bonne anamnèse psychosociale, car des problèmes psychosociaux ou comportementaux peuvent également influencer l’efficacité du traitement et nécessiter une évaluation psychiatrique ou une thérapie familiale.49,50
L’urothérapie standard consiste en une éducation et une démystification, des consignes de modification du comportement, des conseils de mode de vie concernant l’apport hydrique, l’enregistrement des fréquences mictionnelles, des volumes mictionnels et des épisodes d’incontinence, ainsi que du soutien et des encouragements destinés aux enfants et à leurs parents.51 L’urothérapie commence par une explication du fonctionnement et des dysfonctionnements vésicaux et intestinaux, expliquant les causes de l’incontinence. Des instructions doivent être données sur un apport hydrique approprié et une miction régulière au cours de la journée. Des consignes sur la posture correcte aux toilettes doivent également être fournies. Un journal mictionnel doit être tenu pour l’auto-surveillance et la motivation. Ce journal offre à l’enfant et à ses parents un aperçu de l’évolution du traitement. Après les explications et les consignes, l’enfant s’exerce à domicile pendant au maximum trois mois. Pendant cette période, un accompagnement fréquent doit être assuré et les progrès doivent être évalués fréquemment. Ces évaluations intermédiaires peuvent être réalisées par télémédecine et/ou lors de visites régulières à la clinique.
La constipation ou les infections des voies urinaires (IVU) doivent être prises en charge avant l’urothérapie.47,48 Comme les dysfonctions de l’intestin et de la vessie s’influencent mutuellement, l’urothérapie est moins efficace si la fonction intestinale et/ou les IVU ne sont pas prises en charge pendant le traitement.51,52
La réussite d’un traitement est déterminée par la mesure dans laquelle l’enfant et ses parents sont satisfaits des résultats. La satisfaction et l’amélioration de la qualité de vie peuvent justifier l’arrêt du traitement plutôt que de s’efforcer d’obtenir les meilleurs résultats possibles. En cas d’échec du traitement, il est important d’en identifier la cause.
Lorsque les résultats de l’urothérapie standard sont insatisfaisants, une urothérapie spécifique est recommandée. Cette thérapie associe des interventions spécialisées telles que le biofeedback du plancher pelvien, la thérapie cognitivo-comportementale, la psychothérapie, la neurostimulation, ou le cathétérisme intermittent propre.47,48,51,53 L’urothérapie spécifique est adaptée au type spécifique de dysfonction vésico-intestinale et se compose de programmes spécifiques destinés aux enfants présentant des symptômes résistants au traitement. Ces programmes aident les enfants à apprendre comment mictionner, quand mictionner, et à quelle fréquence mictionner. Une pratique répétée est nécessaire pour s’habituer au nouveau comportement mictionnel.50
Les enfants présentant des troubles du comportement nécessitent un plan personnalisé adapté aux besoins spécifiques de l’enfant.54 En cas de comorbidités et d’hyperactivité vésicale sévère, un traitement médicamenteux peut être nécessaire.47
L’urothérapie est un traitement efficace qui permet d’obtenir la continence chez 56 % des enfants en l’espace d’un an, alors que le taux de guérison spontanée de l’incontinence est de 15 % par an. L’urothérapie aborde tous les aspects de l’incontinence, ce qui conduit au meilleur résultat clinique. Cela inclut les problèmes somatiques, psychosociaux et comportementaux ainsi que la qualité de vie.55
Gestion intestinale
Dans de nombreux cas, une constipation aiguë, simple, ou une distension colique peuvent être prises en charge en augmentant simplement l’hydratation et/ou en ajoutant à l’alimentation habituelle de l’enfant des jus riches en sorbitol, tels que les jus de pruneau, de poire et de pomme, ainsi que des fruits et légumes réduits en purée. L’extrait de malt d’orge ou le sirop de maïs peuvent également être utilisés pour ramollir les selles. D’autres modifications alimentaires comprennent la diminution d’une consommation excessive de lait, car le calcium saponifie les selles et entraîne leur durcissement. En outre, il n’existe actuellement aucune preuve étayant l’utilisation de compléments alimentaires prébiotiques et/ou probiotiques comme traitement de la constipation.56 En cas d’échec des interventions diététiques, d’autres options thérapeutiques comprennent des laxatifs osmotiques tels que le polyéthylène glycol (0.7 g/kg de poids corporel par jour), le lactulose, le sorbitol ou le lait de magnésie (dose: 1–3 mL/kg de poids corporel par jour). Il n’existe aucune preuve que la supplémentation en fibres alimentaires ou le biofeedback seuls soient des interventions efficaces pour une constipation qui nécessite un traitement médical.56 De nombreux patients nécessitent un traitement d’entretien afin de gérer leurs symptômes persistants de constipation. D’après notre propre expérience, les agents osmotiques ne sont pas aussi efficaces utilisés seuls que lorsqu’ils sont associés à des laxatifs à base de séné ou au bisacodyl. La crainte que les alcaloïdes du séné induisent une dépendance ou altèrent la motilité colique relève d’une ‘vieille croyance’ et devrait être ignorée : l’utilisation agressive de tels médicaments est justifiée chez certains enfants.57
L’utilisation d’agents osmotiques à elle seule a été corroborée par Bush et al dont les travaux ont montré que le polyéthylène glycol 350 n’était pas supérieur au placebo au cours d’un essai d’un mois.58 La prise en charge de la constipation peut aboutir à une résolution des symptômes de vidange vésicale allant jusqu’à 50 % ou davantage.59
Pharmacologique
Anticholinergiques
Les anticholinergiques, (également appelés antimuscariniques) sont généralement utilisés comme traitements de première intention de l’OAB chez les enfants dont les symptômes ont persisté après l’urothérapie. Actuellement, seuls trois antimuscariniques (oxybutynine [FDA et EMA] , Solifénacine [FDA et EMA] et toltérodine [EMA]) ont officiellement reçu une approbation pour une utilisation chez l’enfant. Les essais cliniques réalisés chez l’enfant (études sur l’oxybutynine, la solifénacine, la darifénacine) ont généralement inclus des patients présentant des troubles mictionnels neurogènes avérés et n’ont pas étudié les effets des antimuscariniques chez des patients ayant des symptômes LUT non neurogènes ou idiopathiques. Des données publiées en 2006 suggèrent que les effets thérapeutiques des antimuscariniques chez des patients considérés comme n’ayant pas de déficit neurologique sont médiés principalement par des interactions avec le bras sensoriel/afférent de l’arc réflexe plutôt qu’avec le côté efférent/moteur.60 Les récepteurs muscariniques se trouvent dans les cellules urothéliales, les cellules sous-urothéliales de Cajal et sur les nerfs afférents.61 Les antimuscariniques sont actifs pendant la phase de remplissage/stockage de la miction, lorsque les nerfs cholinergiques (efférents ou moteurs) ne sont pas actifs. L’acétylcholine peut être produite et libérée par l’urothélium en réponse au remplissage vésical/à l’augmentation de la tension et pourrait également ‘fuir’ des terminaisons nerveuses cholinergiques pendant le remplissage vésical62 suivie d’une liaison aux récepteurs M2 et M3 et pourrait constituer un mécanisme d’hyperactivité chez des patients présentant des maladies vésicales..63
Cinq sous-types distincts de récepteurs cholinergiques muscariniques ont été identifiés (M1–M5), et le muscle lisse vésical exprime principalement deux de ces sous-types : M2 (70–80 %) et M3 (20–30 %). Il a été démontré que l’activation des récepteurs M3 déclenche une contraction du muscle lisse, qui constitue le stimulus principal de la contraction vésicale. On a postulé que les récepteurs M2 et M3 sont impliqués non seulement dans l’activation de la contraction du muscle lisse par les nerfs efférents, mais aussi dans l’activation des nerfs sensoriels/afférents.61 L’activation des récepteurs M2 dans l’urothélium pourrait inverser la relaxation du muscle lisse médiée par le système sympathique qui permet la phase de remplissage, ou de stockage, du cycle mictionnel ; cependant, l’activation des récepteurs M2 pourrait provoquer une contraction du muscle lisse par d’autres mécanismes encore mal compris.64
Les récepteurs M1 se trouvent dans le cerveau, les glandes (telles que les glandes salivaires) et les ganglions sympathiques. L’activation de ces récepteurs est responsable de la plupart des effets indésirables des médicaments antimuscariniques. La sécheresse buccale est le symptôme le plus fréquent. La constipation, le reflux gastro-œsophagien, la vision trouble, la rétention urinaire et les effets indésirables cognitifs peuvent également survenir ; ces symptômes sont généralement moins gênants chez les enfants. La possibilité d’effets indésirables cognitifs et de délire existe également chez l’enfant, mais elle est généralement limitée aux situations de surdosage.65,66,67 Dans des essais cliniques chez l’adulte, des données électroencéphalographiques quantitatives suggèrent que l’oxybutynine a davantage d’effets sur le SNC que le trospium ou la toltérodine.68,69
Alpha-bloquants
Le recours aux α-bloquants (également appelés antagonistes des récepteurs α-adrénergiques) pour la dysfonction mictionnelle non neuropathique a été popularisé par Austin et al pour traiter la dysfonction mictionnelle chez l’enfant.70 Ces médicaments ont été utilisés dans la prise en charge des patients présentant une dysfonction du col vésical et une rétention urinaire; ces agents sont également utiles pour atténuer les symptômes d’urgence mictionnelle et d’incontinence d’urgence chez certains enfants.71 Des études chez l’adulte indiquent que les α-bloquants sont efficaces pour la prise en charge des symptômes irritatifs dus aux stents et chez les hommes âgés atteints d’hyperplasie bénigne de la prostate.72,73 Il existe des éléments indiquant que l’alfuzosine réduit la pression anale au repos et lors d’une évacuation simulée chez des femmes en bonne santé et constipées par rapport au placebo, mais n’améliore pas les symptômes intestinaux chez les femmes constipées.74 Chez de nombreux patients, la térazosine, un α-bloquant non sélectif, est le traitement de première intention de l’urgence mictionnelle et de l’augmentation de la fréquence des mictions, en raison des propriétés non sélectives de cet agent et de sa capacité potentielle à traverser la barrière hémato-encéphalique; toutefois, des bloqueurs plus sélectifs du récepteur α1 tels que la tamsulosine ou l’alfuzosine conviennent mieux à la prise en charge de la dysfonction du col vésical pouvant conduire à une hypertrophie et à une instabilité du détrusor. Les α-bloquants non sélectifs peuvent provoquer une hypotension orthostatique. Par conséquent, ces agents doivent être utilisés avec prudence et un ajustement progressif de la dose est nécessaire. Chez les patients ayant des antécédents familiaux de syncope facile ou d’hypotension orthostatique, l’ajustement des doses est essentiel, même avec l’utilisation d’α-bloquants plus sélectifs. Dans l’ensemble, les enfants tolèrent bien les α-bloquants.75
Agonistes des récepteurs bêta-3
Les agonistes du récepteur adrénergique β3, tels que le mirabégron, peuvent augmenter la capacité vésicale sans augmenter la pression mictionnelle ni le volume résiduel post-mictionnel.76 Le traitement par ces agents induit une relaxation du muscle lisse, et le mécanisme de relaxation généralement admis passe par l’activation en aval de l’adénylate cyclase, avec la production subséquente d’adénosine monophosphate cyclique (AMPc), suivie de l’inhibition de la voie de la Rho-kinase.77,78 Cependant, des données indiquent également que l’élévation de l’AMPc active aussi la protéine kinase A, qui active ensuite des canaux K+ dépendants du calcium à grande conductance (BK). L’activation de ces canaux BK entraîne une hyperpolarisation du muscle lisse vésical et une stabilité accrue du détrusor.79 Le mirabégron est approuvé pour le traitement de l’HAV chez l’adulte et l’enfant aux États-Unis et en Europe.
Autres médicaments
L’imipramine est un antidépresseur tricyclique qui agit à la fois sur les récepteurs muscariniques et les récepteurs α-adrénergiques, avec un effet central possible sur les réflexes de miction.80 Lors de l’introduction de l’imipramine pour traiter la dépression, on a constaté qu’elle avait des effets marqués sur l’incontinence urinaire des patients. Nous avons constaté que l’imipramine est un agent efficace pour contrôler l’incontinence par impériosité chez certains enfants auparavant jugés réfractaires au traitement antimuscarinique.81 Les effets de l’imipramine sur l’incontinence urinaire pourraient résulter d’une action sur les régions frontales du cerveau impliquées dans les fonctions exécutives, y compris le contrôle de l’impériosité mictionnelle. Alternativement, les effets urologiques de l’imipramine pourraient refléter une action sur les niveaux de dopamine dans le striatum, ce qui affecte ainsi les niveaux d’acide ɣ-aminobutyrique (GABA) dans la PAG. Une augmentation des niveaux de GABA dans la PAG entraîne une suppression du réflexe de miction.82,83
L’imipramine s’est également révélée utile pour traiter nos patients atteints d’incontinence au rire. L’imipramine peut provoquer une hypotension orthostatique et peut également être dangereuse chez les patients présentant des anomalies de la conduction cardiaque; elle doit être utilisée avec prudence.
ISRS et IRNS
Il a été démontré que les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) agissent au niveau du noyau d’Onuf en modulant les réflexes de miction et de stockage qui dépendent du glutamate. En présence de glutamate, les ISRS potentialisent les effets des signaux afférents favorisant le stockage vésical et potentialisent également la commande vers le sphincter urétral externe, maintenant ainsi la contraction de ce sphincter. En l’absence de glutamate, les ISRS n’ont aucun effet sur la signalisation, et l’activation parasympathique normale entraîne la contraction de la vessie et le relâchement du sphincter.84 Cet effet des ISRS sur le versant stockage de l’arc réflexe pourrait expliquer comment l’hyperactivité vésicale de certains patients s’améliore après un traitement par ISRS. Ces agents pourraient également agir dans des régions cérébrales associées au traitement des signaux d’urgence, telles que l’ACG et le PFC.
Stimulation électrique
Neurostimulation sacrée
La neurostimulation sacrée (également appelée neuromodulation sacrée) consiste à placer un fil-électrode dans les foramens S3 et le long du nerf sacré, avec implantation sous-cutanée d’un stimulateur afin de fournir une stimulation continue de faible intensité du nerf. La stimulation de la moelle épinière est fréquemment utilisée chez les patients adultes et l’intérêt pour l’utilisation de cette approche chez l’enfant est croissant. Dans une série de 20 patients suivis prospectivement pour un syndrome d’élimination dysfonctionnelle, décrite par Roth et al, la disparition des symptômes ou une amélioration >50% des symptômes est survenue chez 88% des enfants, dont 63% présentaient une énurésie nocturne, 89% une fréquence urinaire diurne augmentée et 59% une constipation. Ce groupe dispose désormais d’une expérience de la neurostimulation sacrée chez 187 patients, avec des résultats constants.85,86
Stimulation parasacrée par stimulation électrique nerveuse transcutanée
La stimulation parasacrée implique l’utilisation d’un dispositif de TENS et de patchs conducteurs parasacrés, qui sont placés de façon parasacrée dans la région S2–3 tandis que les électrodes sont reliées en surface à un générateur de courant. Des études ont utilisé des stimulations à différentes fréquences, allant de 10–80 Hz, et des fréquences de traitement allant d’hebdomadaire à quotidienne. Les durées de stimulation ont également varié de 20 minutes jusqu’à 1 heure par jour. Walsh et al ont décrit pour la première fois l’utilisation du TENS chez l’adulte en 1999, suivis par Hoebeke et al en 2001, qui en ont décrit l’utilisation chez l’enfant.87,88 Dans des études ultérieures, la résolution complète des symptômes a été observée chez 47–61.9% des enfants traités par cette modalité.89,90,91 Cette modalité s’est également avérée utile pour stimuler la motilité intestinale à l’aide d’un courant interférentiel croisé.92
Stimulation périphérique du nerf tibial
La stimulation électrique percutanée du nerf tibial (PTNS) repose sur la pratique chinoise traditionnelle consistant à utiliser des points d’acupuncture situés au niveau des nerfs fibulaire commun et tibial postérieur afin d’inhiber l’activité vésicale.87,88 Une technique consiste à utiliser une aiguille en acier inoxydable de calibre 34, insérée à environ 5 cm en direction céphalique de la malléole médiale, juste en arrière du bord du tibia. Une électrode autocollante est placée sur la face médiale du calcanéum. Cette approche a été évaluée dans des essais cliniques avec des résultats variables. Hoebeke et al ont rapporté que 17 des 28 enfants dont les symptômes d’OAB étaient réfractaires au traitement médical avaient soit une disparition, soit une amélioration de leurs symptômes en réponse à des séances hebdomadaires de PTNS de 30 minutes.91 DeGennaro et al ont rapporté, après un suivi à long terme, que 12 sur 14 enfants avec OAB et 14 sur 14 avec mictions dysfonctionnelles étaient asymptomatiques après deux ans.88 Les auteurs ont toutefois noté qu’un recours ‘chronic’ persistant à long terme à la PTNS était nécessaire chez 50 % et 29 % des enfants atteints d’OAB et de mictions dysfonctionnelles, respectivement, pour maintenir ces résultats. Dans une étude ayant comparé l’efficacité de la TENS appliquée à la région parasacrée à celle de la PTNS chez des enfants atteints d’OAB, des résultats significativement meilleurs ont été observés avec la TENS qu’avec la PTNS (résolution complète observée chez 70 % versus 9 % des patients, respectivement; P = 0.02).93 Figure 5 illustre un tel dispositif.
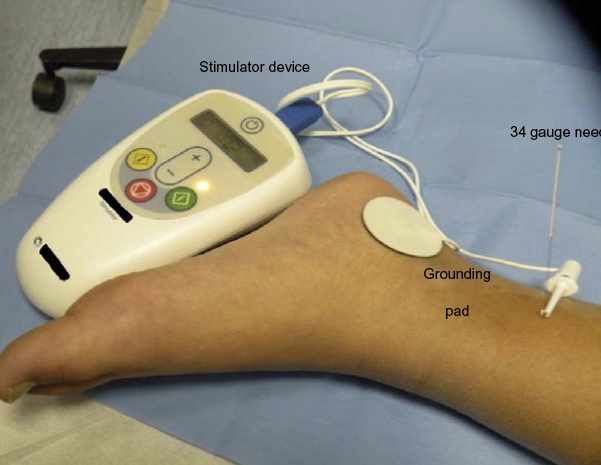
Figure 5 Stimulation par PTNS chez un enfant.
Une autre forme de stimulation du nerf tibial consiste à appliquer des patchs au-dessus du nerf et à stimuler le nerf comme une TENS parasacrée. Dans une étude comparant la stimulation tibiale postérieure transcutanée et une stimulation simulée chez 40 enfants, les scores de QoL, ainsi que les scores DVISS globaux et diurnes, ont significativement diminué dans les deux groupes, simulé et test (p < 0,05). En outre, la fréquence des épisodes d’incontinence et d’impériosité était également significativement réduite (p < 0,05) dans le groupe traité par PTNS. Cet effet dans le groupe test persistait encore 2 ans après l’intervention.94
Options chirurgicales
Toxine botulinique de type A
Les injections intravésicales de toxine botulinique de type A (BoNT-A) dans le détrusor ont été approuvées chez les adultes présentant une OAB. Une étude récente publiée par Austin et al chez des patients d’étiologie neurologique a démontré l’innocuité de la BoNT-A chez l’enfant et a abouti à une approbation par la FDA chez des enfants présentant une NDO.95 Chez l’adulte, les injections de BoNT-A se sont révélées un traitement utile chez des patients présentant une OAB réfractaire et offrent une alternative pour les patients qui ne tolèrent pas le traitement anticholinergique. Les études publiées sur l’utilisation de la BoNT-A chez l’enfant sont limitées et consistent principalement en cohortes cliniques sélectionnées non randomisées d’enfants neurologiquement sains présentant une OAB réfractaire au traitement et une incontinence d’urgence.96,97,98 La dose de BoNT-A est variable dans ces études et va de 50–200 unités.96,97,98 Les données de suivi de ces trois études, total de 55 patients, révèlent qu’une réponse complète, définie par une continence complète, a été obtenue chez 38–70% de ces enfants après une injection unique, ou des injections répétées. Peu d’événements indésirables cliniquement significatifs ont été rapportés ; un patient a présenté une infection urinaire et un patient une rétention urinaire transitoire.96,97
Biofeedback
Le biofeedback est le processus visant à améliorer la prise de conscience de l’action des muscles du plancher pelvien/sphincter à l’aide d’instruments externes qui fournissent des informations sur l’action de ces muscles, dans le but d’augmenter la prise de conscience et le contrôle volontaire par l’enfant.
Dans le cadre de l’urothérapie spécifique, l’accent est souvent mis sur la rééducation du plancher pelvien à l’aide d’un entraînement par biofeedback. Le bénéfice théorique du biofeedback est que les enfants peuvent visualiser directement l’activité de leurs muscles du plancher pelvien par EMG ou par la courbe d’urofluxmétrie.99 Cela facilite la défécation et aide l’enfant à prendre conscience des muscles du plancher pelvien (contraction versus relaxation). En cas de mictions dysfonctionnelles dues à une dyssynergie du sphincter externe, l’objectif est d’obtenir une miction détendue, non obstructive, et une vidange vésicale complète. Un retour d’information peut être donné immédiatement sur la performance, comme avec l’EMG ou l’échographie, ou sous forme de connaissance des résultats, comme avec l’urofluxmétrie et la mesure du résidu post-mictionnel.100
Le biofeedback EMG peut être utilisé pour apprendre à l’enfant à contracter et à relâcher à volonté les muscles du plancher pelvien.99 L’utilisation de la débitmétrie urinaire en temps réel aide l’enfant à observer la courbe de débit pendant la miction. On peut apprendre aux enfants à uriner avec des muscles du plancher pelvien relâchés et un volume mictionnel normal en obtenant une courbe de débit continue en forme de cloche. L’échographie peut être utilisée pour vérifier si la vessie est vide après la miction et en informer l’enfant.
L’impact du biofeedback chez les patients présentant une miction dysfonctionnelle et un reflux est significatif, dans la mesure où nous avons constaté 60 % de résolution spontanée du reflux chez des enfants de 6 ans et plus traités par biofeedback.101 Certains ont avancé que le biofeedback est également efficace sur l’urgence mictionnelle; son mécanisme pourrait passer par une réduction de la résistance de sortie pendant la miction, ce qui entraîne une hypertrophie du détrusor, conduisant ainsi à une instabilité détrusorienne. En revanche, il existe des études chez l’adulte indiquant qu’il pourrait être efficace chez des patients OAB en raison de la thérapie individuelle continue reçue par le patient et de l’amélioration de son bien-être mental.102
La thérapie par biofeedback est limitée par la capacité de l’enfant à coopérer avec le professionnel de santé qui mène la séance. Les enfants de moins de cinq ans sont généralement incapables d’effectuer le biofeedback de façon régulière. Les enfants présentant d’importants troubles des apprentissages, des problèmes de comportement et d’autres troubles neurologiques ne sont pas des candidats idéaux pour le biofeedback. Des études supplémentaires révèlent que la thérapie par biofeedback est utile pour l’élimination du reflux chez les enfants qui présentent des signes de dyssynergie du sphincter externe.103,104
Il est erroné de croire que le biofeedback, à lui seul, suffit à atteindre la continence. En pratique, les professionnels associent involontairement le biofeedback à l’éducation et aux instructions. Ce faisant, ils proposent également une modification comportementale tout en pensant ne fournir qu’un entraînement au biofeedback. En urothérapie, le biofeedback n’est qu’un des éléments du traitement; le type de biofeedback n’est pas un facteur déterminant de l’issue du traitement.51
Troubles
Hyperactivité vésicale
Évaluation et diagnostic
Le signe cardinal de la vessie hyperactive (OAB) est l’urgence mictionnelle et, par définition, les enfants présentant ce symptôme peuvent être considérés comme ayant une OAB. L’incontinence et une augmentation de la fréquence mictionnelle sont souvent présentes. L’incontinence urinaire par impériosité signifie simplement une incontinence en présence d’une urgence mictionnelle et s’applique à de nombreux enfants atteints d’OAB. De plus en plus de données indiquent que l’OAB est un trouble sensoriel; la question de savoir s’il est localisé dans le système nerveux central (SNC) ou au niveau de la vessie fait débat. Les enfants dont l’incontinence n’est pas associée à une impériosité mictionnelle soudaine ou qui reconnaissent tardivement l’impériosité sont plus susceptibles de présenter un problème neurologique ou un trouble du fonctionnement du lobe frontal, tel que le TDAH.
Options thérapeutiques et écueils
- Urothérapie, programme intestinal
- Éviter la diarrhée ou les accidents fécaux dus à une utilisation mal contrôlée ou trop agressive des agents osmotiques et des cathartiques
- Éviter l’excès de gaz dû à une surcharge en fibres; les gaz sont tout aussi délétères que la constipation et entraînent une distension de l’intestin
- La supplémentation en fibres sans eau entraîne une aggravation de la constipation
- Anticholinergiques ou Terazosin ou Doxazosin
- La sécheresse buccale ou des troubles de la mémoire peuvent être dus aux médicaments anticholinergiques. Surveiller une aggravation de la constipation sous anticholinergiques
- Les étourdissements et la fatigue liés aux alpha-bloquants peuvent être prévenus en s’assurant que les patients s’hydratent et augmentent leurs apports en sel.
- Évaluer la présence de problèmes neuropsychiatriques et traiter en conséquence
- Les ISRS peuvent être associés à de l’irritabilité et à des idées suicidaires
- Les sympathomimétiques utilisés pour le TDAH peuvent entraîner un resserrement du col vésical et des effets négatifs potentiels sur les débits urinaires, voire une dysurie. Une perte de poids et la constipation sont associées aux sympathomimétiques.
- Envisager la PTNS ou la TENS
- Certains enfants ont peur des aiguilles et la PTNS n’est pas faisable
- Certains enfants peuvent réagir de manière excessive à la sensation et ne pas tolérer le traitement
- En cas de résistance, envisager l’imipramine si les traitements ont échoué
- Peut être associée à de l’irritabilité et à des idées suicidaires
- Peut démasquer un trouble bipolaire, en particulier s’il existe des antécédents familiaux
- Ne pas administrer le médicament aux patients ayant des antécédents familiaux de troubles de la conduction ou de mort subite d’origine cardiaque
- Le médicament doit être sous le contrôle d’un adulte en permanence
- En l’absence d’arguments en faveur de résidus élevés, on peut envisager des injections de toxine botulique de type A dans le détrusor
- Les patients ayant des indices de débit inférieurs à 0.3 ou des résidus élevés >150 cc ne doivent pas recevoir d’injections de toxine botulique de type A en raison du risque de rétention/CIC
- En dernier recours, on peut envisager la neuromodulation sacrée
- Complications liées au déplacement de l’électrode
Miction dysfonctionnelle
Évaluation et diagnostic
L’enfant présentant des mictions dysfonctionnelles contracte habituellement le sphincter urétral pendant la miction. L’uroflowmétrie avec EMG est nécessaire pour confirmer la présence d’une contraction sphinctérienne pendant la miction. À noter que le terme ne décrit qu’un dysfonctionnement pendant la phase mictionnelle. Le terme mictions dysfonctionnelles est indépendant de la phase de stockage. Il est tout à fait possible qu’un enfant présente des mictions dysfonctionnelles et des symptômes de stockage tels que l’incontinence, l’urgenturie ou la pollakiurie, posant ainsi deux problèmes nécessitant une correction.
Options de traitement et leurs écueils
- Urothérapie, programme intestinal
- Éviter la diarrhée ou les accidents fécaux liés à l’utilisation mal contrôlée ou trop agressive d’agents osmotiques et de cathartiques
- Éviter l’excès de gaz dû à une surcharge en fibres; les gaz sont tout aussi délétères que la constipation et entraînent une distension de l’intestin
- Une supplémentation en fibres sans eau entraîne une aggravation de la constipation
- Problèmes comportementaux, comme le TDAH et le TSA
- Même si l’enfant semble coopératif, une attitude d’évitement vis‑à‑vis des comportements mictionnels appropriés peut persister, sans fournir l’effort réel nécessaire pour obtenir le résultat.
- Infections urinaires
- Répéter la débitmétrie mictionnelle et confirmer si le problème persiste
- Si l’étiologie est une dyssynergie du sphincter externe (ESS)
- Biofeedback
- Mictions programmées pour prévenir les mictions trop peu fréquentes
- Prendre en charge l’hyperactivité détrusorienne si présente. Si l’hyperactivité n’est pas suffisamment contrôlée, les patients continueront à présenter des urgences mictionnelles, ce qui annulera le biofeedback réalisé.
- Si l’étiologie est une dyssynergie du sphincter interne (ISS)
- Alpha-bloquants
- Les vertiges et la fatigue dus aux alpha-bloquants peuvent être prévenus en veillant à ce que les patients s’hydratent bien et augmentent leurs apports en sel.
- En cas d’éléments en faveur d’une ESS, traiter par biofeedback
- Poursuivre le programme intestinal
- Prendre en charge l’hyperactivité détrusorienne si présente
- Anticholinergiques ou Terazosin ou Doxazosin
- La sécheresse buccale ou des troubles de la mémoire peuvent être dus aux médicaments anticholinergiques. Surveiller une aggravation de la constipation sous anticholinergiques.
- Les vertiges et la fatigue dus aux alpha-bloquants peuvent être prévenus en veillant à ce que les patients s’hydratent bien et augmentent leurs apports en sel.
- Anticholinergiques ou Terazosin ou Doxazosin
- Alpha-bloquants
Urétrite bulbaire/urétrorragie
Évaluation et diagnostic
La douleur associée à la miction est fréquemment observée chez les patients présentant une forme de dyssynergie vésico-sphinctérienne. Chez les patients atteints d’urétrite bulbaire (syndrome dysurie/urétrorragie), la douleur au niveau du gland ou le long du corps de la verge est très probablement due à une dyssynergie vésico-sphinctérienne. La correction du schéma mictionnel a fait disparaître les symptômes.33 Chez les filles, une douleur vaginale ou urétrale peut également indiquer un schéma mictionnel anormal.
Vessie hypoactive
Évaluation et diagnostic
L’ancienne entité “vessie paresseuse” a été remplacée par le terme neutre “vessie hypoactive” et est réservée aux enfants présentant une faible fréquence mictionnelle et la nécessité d’augmenter la pression intra-abdominale pour initier, maintenir ou compléter la miction (c.-à-d., efforts de poussée). Les enfants présentent souvent un tracé interrompu à la débitmétrie mictionnelle. Le diagnostic formel est confirmé par des explorations urodynamiques montrant de faibles pressions mictionnelles. Malheureusement, il n’existe pas de définitions formelles des pressions mictionnelles normales chez l’enfant, de sorte que nous avons tendance à utiliser les pressions de l’adulte.
Options thérapeutiques et pièges
- Les évaluations comprendront une débitmétrie mictionnelle avec EMG du plancher pelvien et, si possible, un deuxième EMG des muscles abdominaux.
- Si une poussée abdominale est évidente avec un débit faible et inefficace (indice de débit <0.7) et un résidu post-mictionnel élevé, envisager le diagnostic d’UAB.
- Confirmer par un examen urodynamique
- Commencer l’urothérapie
- Envisager des alpha-bloquants pour aider à ouvrir le col vésical et améliorer la vidange
- Jusqu’à 50 % des patients présentent également une OAB et nécessitent un traitement de l’OAB pour prévenir l’incontinence ou les infections urinaires récidivantes
- L’ISS est fréquemment observé chez les patients atteints d’UAB et un traitement par alpha-bloquants est nécessaire chez ces patients.
- Envisager le CIC si les patients ont un PVR élevé et/ou des infections urinaires récidivantes; certains ont eu recours à la neuromodulation sacrée mais avec un succès limité
Pollakiurie
Évaluation et diagnostic
Ce terme s’applique aux enfants qui mictionnent fréquemment et en petits volumes uniquement pendant la journée. La fréquence mictionnelle diurne est d’au moins une fois par heure et les volumes mictionnels moyens sont inférieurs à 50 % de la capacité vésicale estimée (EBC), le plus souvent bien inférieurs. L’incontinence n’est pas un élément habituel ni nécessaire de ce trouble et le comportement vésical nocturne est normal pour l’âge de l’enfant. Le terme est applicable à partir de l’acquisition du contrôle mictionnel diurne ou à partir de 3 ans.
Options thérapeutiques et écueils
- Évaluer l’environnement, fréquemment observé lorsqu’un événement de vie récent est survenu ou lorsqu’un événement est imminent, tel que la rentrée scolaire, un camp ou des vacances
- S’assurer qu’il n’y a pas d’apparition d’une constipation ni de changement de régime alimentaire
- Initier l’urothérapie et un programme intestinal
- Éviter la diarrhée ou les accidents fécaux liés à une utilisation mal contrôlée ou trop agressive d’agents osmotiques et de cathartiques
- Éviter l’excès de gaz dû à une surcharge en fibres; les gaz sont tout aussi délétères que la constipation et entraînent une distension de l’intestin
- Une supplémentation en fibres sans eau entraîne une aggravation de la constipation
- Envisager des anticholinergiques ou Terazosin ou Doxazosin
- La sécheresse buccale ou des troubles de la mémoire peuvent être dues aux médicaments anticholinergiques. Surveiller l’aggravation de la constipation sous anticholinergiques
- Les étourdissements et la fatigue dus aux alpha-bloquants peuvent être prévenus en veillant à ce que les patients s’hydratent bien et augmentent leurs apports en sel.
- Évaluer la présence de problèmes neuropsychiatriques; s’ils sont présents, envisager un traitement approprié
- Les ISRS peuvent être associés à de l’irritabilité et à des idées suicidaires
- Les sympathomimétiques prescrits pour le TDAH peuvent entraîner un resserrement du col vésical et des effets négatifs potentiels sur les débits urinaires, voire une dysurie. Une perte de poids et la constipation sont associées aux sympathomimétiques.
- Peut se résoudre spontanément
Incontinence du rire
Évaluation et diagnostic
L’incontinence au rire est associée à une vidange complète de la vessie qui survient spécifiquement pendant ou immédiatement après un éclat de rire. La fonction vésicale est normale lorsque l’enfant ne rit pas. L’incontinence au rire se distingue clairement de l’incontinence d’effort, où la miction peut être empêchée ou interrompue volontairement.
Options thérapeutiques et écueils
- Confirmer le diagnostic par une anamnèse approfondie
- Fréquent chez les enfants présentant des troubles neuropsychiatriques sous-jacents
- Urothérapie et prise en charge du transit afin de s’assurer qu’il ne s’agit pas d’une simple hyperactivité vésicale
- En l’absence de réponse, instaurer un traitement
- Imipramine : débuter à 10 mg et augmenter jusqu’à un maximum de 75 mg
- Atomoxétine : débuter à 10 mg et augmenter en conséquence
- Sympathomimétiques : la posologie dépend du médicament choisi ; utiliser une forme à action prolongée, sinon le patient risque des accidents lorsque l’effet du médicament s’estompe
- ISRS : la posologie dépend du médicament ; choisir la dose la plus faible et l’augmenter progressivement.
- Tous les traitements ci-dessus comportent les mêmes problèmes
- peuvent être associés à de l’irritabilité et à des idées suicidaires
- peuvent démasquer un trouble bipolaire en cas d’antécédents familiaux
- ne pas administrer le médicament aux patients ayant des antécédents familiaux de troubles de la conduction ou de mort subite d’origine cardiaque
- Le médicament doit être sous le contrôle d’un adulte en permanence
Miction vaginale
Évaluation et diagnostic
Les filles prépubères ayant acquis la propreté qui mouillent leurs sous-vêtements dans les 10 minutes suivant la miction présentent probablement un reflux vaginal en l’absence d’autre mécanisme sous-jacent évident que le piégeage vaginal de l’urine. La miction vaginale n’est pas associée à d’autres symptômes des voies urinaires basses. Il est essentiel de différencier la miction vaginale de la fuite post-mictionnelle, car le traitement est très différent.
Options de traitement et écueils
- Confirmer le diagnostic et le différencier des gouttes retardataires post-mictionnelles, de l’incontinence d’effort et de l’incontinence par impériosité
- Fréquent chez les jeunes filles qui ne baissent pas leurs vêtements en dessous des genoux
- Fréquent chez les filles ayant une graisse des lèvres vulvaires proéminente
- Fréquent chez les filles obèses
- Recommander que les patientes s’assoient sur les toilettes les jambes écartées et les cuisses en abduction, ou qu’elles s’assoient face au mur derrière les toilettes, ce qui force l’écartement des jambes
- Fréquemment associé à des pertes vaginales et à une vaginite
- Peut être associé au lichen scléreux des lèvres vulvaires
Incontinence urinaire d’effort
Évaluation et diagnostic
L’incontinence urinaire d’effort est la fuite de petites quantités d’urine à l’effort ou lors d’une augmentation de la pression intra-abdominale, généralement associée à la manœuvre de Valsalva. Elle est rare chez les enfants neurologiquement normaux. On observe une association accrue chez les filles hyperlaxes pratiquant la gymnastique et la danse.105
Options thérapeutiques et écueils
- Confirmer le diagnostic et le différencier des gouttes retardataires post-mictionnelles, de l’incontinence d’effort et de l’incontinence par impériosité
- Correction chirurgicale par colposuspension de Burch par voie ouverte ou coelioscopique106,107
Points clés
Conclusions
asdf
Références
- Ruarte AC, E Q. Urodynamic Evaluation in Normal Children. J Urol 1987; 127 (4): 831–831. DOI: 10.1016/s0022-5347(17)54062-8.
- Landgraf JM, Abidari J, Cilento BG, Cooper CS, Schulman SL, Ortenberg J. Coping, Commitment, and Attitude: Quantifying the Everyday Burden of Enuresis on Children and Their Families. Pediatrics 2004; 113 (2): 334–344. DOI: 10.1542/peds.113.2.334.
- Rovner ES. Childhood Urinary Symptoms Predict Adult Overactive Bladder Symptoms. Yearbook of Urology 2006; 2007: 65–66. DOI: 10.1016/s0084-4071(08)70046-0.
- Minassian VA, Lovatsis D, Pascali D, Alarab M, Drutz HP. The Effect of Childhood Dysfunctional Voiding on Urinary Incontinence in Adult Women. Obstet Gynecol 2006; 107 (Supplement): 47s. DOI: 10.1097/00006250-200604001-00112.
- Labrie J, Jong TPVM de, Nieuwhof-Leppink A, Deure J van der, Vijverberg MAW, Vaart CH van der. The Relationship Between Children With Voiding Problems and Their Parents. J Urol 2010; 183 (5): 1887–1891. DOI: 10.1016/j.juro.2010.01.004.
- Wennberg A-L, Altman D, Lundholm C, Klint Å, Iliadou A, Peeker R, et al.. Genetic Influences Are Important for Most But Not All Lower Urinary Tract Symptoms: A Population-Based Survey in a Cohort of Adult Swedish Twins. Eur Urol 2011; 59 (6): 1032–1038. DOI: 10.1016/j.eururo.2011.03.007.
- Kaplan SA. Re: Systematic Review and Meta-Analysis of Candidate Gene Association Studies of Lower Urinary Tract Symptoms in Men. J Urol 2014; 195 (6): 1839–1840. DOI: 10.1016/j.juro.2016.03.051.
- Botlero R, Bell RJ, Urquhart DM, Davis SR. Urinary incontinence is associated with lower psychological general well-being in community-dwelling women. Menopause 2010; 17 (2): 332–337. DOI: 10.1097/gme.0b013e3181ba571a.
- Melville JL, Fan M-Y, Rau H, Nygaard IE, Katon WJ. Major depression and urinary incontinence in women: temporal associations in an epidemiologic sample. Am J Obstet Gynecol 2009; 201 (5): 490.e1–490.e7. DOI: 10.1016/j.ajog.2009.05.047.
- Henin A, Biederman J, Mick E, Hirshfeld-Becker DR, Sachs GS, Wu Y, et al.. Childhood antecedent disorders to bipolar disorder in adults: A controlled study. J Affect Disord 2007; 99 (1-3): 51–57. DOI: 10.1016/j.jad.2006.09.001.
- Weissman MM, Gross R, Fyer A, Heiman GA, Gameroff MJ, Hodge SE, et al.. Interstitial Cystitis and Panic Disorder. Arch Gen Psychiatry 2004; 61 (3): 273. DOI: 10.1001/archpsyc.61.3.273.
- Stockman JA. Enuresis as a premorbid developmental marker of schizophrenia. Yearbook of Pediatrics 2008; 2010: 396–398. DOI: 10.1016/s0084-3954(09)79524-7.
- Fowler CJ, Griffiths DJ. A decade of functional brain imaging applied to bladder control. Neurourol Urodyn 2010; 29 (1): 49–55. DOI: 10.1002/nau.20740.
- Fowler CJ, Griffiths D, Groat WC de. The neural control of micturition. Nat Rev Neurosci 2008; 9 (6): 453–466. DOI: 10.1038/nrn2401.
- Hansen A, Hansen B, Dahm TL. Urinary tract infection, day wetting and other voiding symptoms in seven-to eight-year-old Danish children. Acta Paediatr 1997; 86 (12): 1345–1349. DOI: 10.1111/j.1651-2227.1997.tb14911.x.
- Hellström A-L, Hanson E, Hansson S, Hjälmås K, Jodal U. Micturition habits and incontinence in 7-year-old Swedish school entrants. Eur J Pediatr 1990; 149 (6): 434–437. DOI: 10.1007/bf02009667.
- Lee SD, Sohn DW, Lee JZ, Park NC, Chung MK. An epidemiological study of enuresis in Korean children. BJU Int 2000; 85 (7): 869–873. DOI: 10.1046/j.1464-410x.2000.00617.x.
- Safarinejad MR. Prevalence of nocturnal enuresis, risk factors, associated familial factors and urinary pathology among school children in Iran. J Pediatr Urol 2007; 3 (6): 443–452. DOI: 10.1016/j.jpurol.2007.06.001.
- Wekke J Spee-van der, Hirasing RA, Meulmeester JF, Radder JJ. Childhood Nocturnal Enuresis in the Netherlands. Urology 1998; 51 (6): 1022–1026. DOI: 10.1016/s0090-4295(98)00106-x.
- Swithinbank LV, Brookes ST, Shepherd AM, Abrams P. The natural history of urinary symptoms during adolescence. BJU Int 1998; 81 (s3): 90–93. DOI: 10.1046/j.1464-410x.1998.00016.x.
- Deshpande AV, Craig JC, Smith GHH, Caldwell PHY. Management of daytime urinary incontinence and lower urinary tract symptoms in children. J Paediatr Child Health 2003; 48 (2): E44–e52. DOI: 10.1111/j.1440-1754.2011.02216.x.
- Heron J, Joinson C, Croudace T, Gontard A von. Trajectories of Daytime Wetting and Soiling in a United Kingdom 4 to 9-Year-Old Population Birth Cohort Study. J Urol 2008; 179 (5): 1970–1975. DOI: 10.1016/j.juro.2008.01.060.
- Stone JJ, Rozzelle CJ, Greenfield SP. Intractable Voiding Dysfunction in Children With Normal Spinal Imaging: Predictors of Failed Conservative Management. Urology 2010; 75 (1): 161–165. DOI: 10.1016/j.urology.2009.06.100.
- Tekgul S, R. N, Hoebeke P, Canning D, Bower W, Gontard A. Incontinence. 2009: 701–792.
- Gontard A, Nevéus T. Management of disorders of bladder and bowel control in childhood. 2006. DOI: 10.1136/adc.2006.110023.
- Gontard A, Hussong J, Yang SS, Chase J, Franco I, Wright A. Neurodevelopmental disorders and incontinence in children and adolescents: Attention-deficit/hyperactivity disorder, autism spectrum disorder, and intellectual disability–A consensus document of the International Children’s Continence Society. Neurourol Urodyn 2021; 41 (1): 102–114. DOI: 10.1002/nau.24798.
- Joinson C, Heron J, Butler U, Gontard A von, Parents the Avon Longitudinal Study of, Team CS. Psychological Differences Between Children With and Without Soiling Problems. Pediatrics 2006; 117 (5): 1575–1584. DOI: 10.1542/peds.2005-1773.
- Joinson C, Heron J, Gontard A von, Butler U, Golding J, Emond A. Early Childhood Risk Factors Associated with Daytime Wetting and Soiling in School-age Children. J Pediatr Psychol 2008; 33 (7): 739–750. DOI: 10.1093/jpepsy/jsn008.
- Sureshkumar P, Jones M, Cumming R, Craig J. A Population Based Study of 2,856 School-Age Children With Urinary Incontinence. J Urol 2009; 181 (2): 808–816. DOI: 10.1016/j.juro.2008.10.044.
- ROBSON WMLANEM, JACKSON HAROLDP, BLACKHURST DAWN, LEUNG ALEXANDERk. C. Enuresis in Children With Attention–Deficit Hyperactivity Disorder. South Med J 1997; 90 (5): 503–505. DOI: 10.1097/00007611-199705000-00007.
- MOORE KATEH, SUTHERST JR. Response to Treatment of Detrusor Instability in Relation to Psychoneurotic Status. Br J Urol 1990; 66 (5): 486–490. DOI: 10.1111/j.1464-410x.1990.tb14993.x.
- WARNE STEPHANIEA, GODLEY MARGARETL, WILCOX DUNCANT. Surgical Reconstruction Of Cloacal Malformation Can Alter Bladder Function: A Comparative Study With Anorectal Anomalies. J Urol 2381; 172 (6 Part 1): 2377–2381. DOI: 10.1097/01.ju.0000145201.94571.67.
- Coplen DE. Dysfunctional Elimination Syndrome as an Etiology of Idiopathic Urethritis in Childhood. Yearbook of Urology 2005; 2006: 257–258. DOI: 10.1016/s0084-4071(08)70411-1.
- Pezzone MA, Liang R, Fraser MO. A Model of Neural Cross-Talk and Irritation in the Pelvis: Implications for the Overlap of Chronic Pelvic Pain Disorders. Gastroenterology 2005; 128 (7): 1953–1964. DOI: 10.1053/j.gastro.2005.03.008.
- Ustinova EE, Fraser MO, Pezzone MA. Colonic irritation in the rat sensitizes urinary bladder afferents to mechanical and chemical stimuli: an afferent origin of pelvic organ cross-sensitization. Am J Physiol Renal Physiol 2006; 290 (6): F1478–f1487. DOI: 10.1152/ajprenal.00395.2005.
- Franco I, Grantham EC, Cubillos J, Franco J, Collett-Gardere T, Zelkovic P. Can a simple question predict prolonged uroflow lag times in children? J Pediatr Urol 2016; 12 (3): 157.e1–157.e8. DOI: 10.1016/j.jpurol.2015.12.009.
- Lewis SJ, Heaton KW. Stool Form Scale as a Useful Guide to Intestinal Transit Time. Scand J Gastroenterol 1997; 32 (9): 920–924. DOI: 10.3109/00365529709011203.
- FARHAT WALID, B??GLI DARIUSJ, CAPOLICCHIO GIANPAOLO, O???REILLY SHEILA, MERGUERIAN PAULA, KHOURY ANTOINE, et al.. The Dysfunctional Voiding Scoring System: Quantitative Standardization Of Dysfunctional Voiding Symptoms In Children. J Urol 2000; 164: 1011–1015. DOI: 10.1097/00005392-200009020-00023.
- Afshar K, Mirbagheri A, Scott H, MacNeily AE. Development of a Symptom Score for Dysfunctional Elimination Syndrome. J Urol 2009; 182 (4s): 1939–1944. DOI: 10.1016/j.juro.2009.03.009.
- Van Hoecke E, Baeyens D, Vanden Bossche H, Hoebeke P, Vande Walle J. Early Detection of Psychological Problems in a Population of Children With Enuresis: Construction and Validation of the Short Screening Instrument for Psychological Problems in Enuresis. J Urol 2007; 178 (6): 2611–2615. DOI: 10.1016/j.juro.2007.08.025.
- Franco I, Shei-Dei Yang S, Chang S-J, Nussenblatt B, Franco JA. A quantitative approach to the interpretation of uroflowmetry in children. Neurourol Urodyn 2016; 35 (7): 836–846. DOI: 10.1002/nau.22813.
- Franco I, Franco JA, Nussenblatt B. Can the idealized voider derived flow indexes be a measure of voiding efficiency and how accurate are they? Neurourol Urodyn 2018; 37 (6): 1913–1924. DOI: 10.1002/nau.23585.
- Franco I, Franco J, Lee YS, Choi EK, Han SW. Can a quantitative means be used to predict flow patterns: Agreement between visual inspection vs. flow index derived flow patterns. J Pediatr Urol 2016; 12 (4): 218.e1–218.e8. DOI: 10.1016/j.jpurol.2016.05.026.
- COMBS ANDREWJ, GRAFSTEIN NEIL, HOROWITZ MARK, GLASSBERG KENNETHI. Primary Bladder Neck Dysfunction In Children And Adolescents I: Pelvic Floor Electromyography Lag Time–a New Noninvasive Method To Screen For And Monitor Therapeutic Response. J Urol 2005; 173 (1): 207–211. DOI: 10.1097/01.ju.0000147269.93699.5a.
- Tuite GF, Thompson DNP, Austin PF, Bauer SB. Evaluation and management of tethered cord syndrome in occult spinal dysraphism: Recommendations from the international children’s continence society. Neurourol Urodyn 2018; 37 (3): 890–903. DOI: 10.1002/nau.23382.
- Coplen DE. The Relevance of Urodynamic Studies for Urge Syndrome and Dysfunctional Voiding: A Multicenter Controlled Trial in Children. Yearbook of Urology 2008; 2009: 83–84. DOI: 10.1016/s0084-4071(09)79276-0.
- Birder LA. Faculty Opinions recommendation of Treatment of daytime urinary incontinence: A standardization document from the International Children’s Continence Society. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2017; 36: 43–50, DOI: 10.3410/f.725854188.793540473.
- Yang S, Chua ME, Bauer S, Wright A, Brandström P, Hoebeke P, et al.. Diagnosis and management of bladder bowel dysfunction in children with urinary tract infections: a position statement from the International Children’s Continence Society. Pediatr Nephrol 2018; 33 (12): 2207–2219. DOI: 10.1007/s00467-017-3799-9.
- Gontard A von, Kuwertz-Bröking E. The Diagnosis and Treatment of Enuresis and Functional Daytime Urinary Incontinence. Dtsch Arztebl Int 2019; 116: 279–285, DOI: 10.3238/arztebl.2019.0279.
- MacNeily AE. Should Psychological Assessment be a Part of Incontinence Management in Children and Adolescents? J Urol 2016; 195 (5): 1327–1328. DOI: 10.1016/j.juro.2016.02.071.
- Nieuwhof-Leppink AJ, Hussong J, Chase J, Larsson J, Renson C, Hoebeke P, et al.. Definitions, indications and practice of urotherapy in children and adolescents: - A standardization document of the International Children’s Continence Society (ICCS). J Pediatr Urol 2021; 17 (2): 172–181. DOI: 10.1016/j.jpurol.2020.11.006.
- Borch L, Hagstroem S, Bower WF, Siggaard Rittig C, Rittig S. Bladder and bowel dysfunction and the resolution of urinary incontinence with successful management of bowel symptoms in children. Acta Paediatr 2013; 102 (5): e215–e220. DOI: 10.1111/apa.12158.
- Hagstroem S, Mahler B, Madsen B, Djurhuus JC, Rittig S. Transcutaneous Electrical Nerve Stimulation for Refractory Daytime Urinary Urge Incontinence. J Urol 2009; 182 (4s): 2072–2078. DOI: 10.1016/j.juro.2009.05.101.
- Niemczyk J, Equit M, Hoffmann L, Gontard A von. Incontinence in children with treated attention-deficit/hyperactivity disorder. J Pediatr Urol 2015; 11 (3): 141.e1–141.e6. DOI: 10.1016/j.jpurol.2015.02.009.
- Schäfer SK, Niemczyk J, Gontard A von, Pospeschill M, Becker N, Equit M. Standard urotherapy as first-line intervention for daytime incontinence: a meta-analysis. Eur Child Adolesc Psychiatry 2018; 27 (8): 949–964. DOI: 10.1007/s00787-017-1051-6.
- Medina-Centeno R. Medications for constipation in 2020. Curr Opin Pediatr 2020; 32 (5): 668–673. DOI: 10.1097/mop.0000000000000938.
- Wald A. Constipation. Jama 2016; 315 (2): 185. DOI: 10.1001/jama.2015.16994.
- Cruz F. Faculty of 1000 evaluation for Randomized, double-blind, placebo-controlled trial of polyethylene glycol (MiraLAX(®)) for urinary urge symptoms. F1000 - Post-Publication Peer Review of the Biomedical Literature 2013; 9: 597–604, DOI: 10.3410/f.717964565.793474432.
- Loening-Baucke V. Urinary Incontinence and Urinary Tract Infection and Their Resolution With Treatment of Chronic Constipation of Childhood. Pediatrics 1997; 100 (2): 228–232. DOI: 10.1542/peds.100.2.228.
- Finney SM, Andersson KE, Gillespie JI, Stewart LH. Faculty Opinions recommendation of Antimuscarinic drugs in detrusor overactivity and the overactive bladder syndrome: motor or sensory actions? Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2006; 98: 503–507, DOI: 10.3410/f.1040721.489750.
- Andersson K-E. Antimuscarinic Mechanisms and the Overactive Detrusor: An Update. Eur Urol 2011; 59 (3): 377–386. DOI: 10.1016/j.eururo.2010.11.040.
- Wein AJ, Rackley RR. Overactive Bladder: A Better Understanding of Pathophysiology, Diagnosis and Management. J Urol 2006; 175 (3s): 5–10, DOI: 10.1016/s0022-5347(05)00313-7.
- Kullmann FA, Artim DE, Birder LA, Groat WC de. Activation of Muscarinic Receptors in Rat Bladder Sensory Pathways Alters Reflex Bladder Activity. J Neurosci 2008; 28 (8): 1977–1987. DOI: 10.1523/jneurosci.4694-07.2008.
- Andersson K. Step-by-Step Guide to Treatment of Overactive Bladder (OAB)/Detrusor Overactivity. Urogynecology: Evidence-Based Clinical Practice 2004; 2: 77–91. DOI: 10.1007/1-84628-165-2_7.
- Ferrara P, D’Aleo CM, Tarquini E, Salvatore S, Salvaggio E. Side-effects of oral or intravesical oxybutynin chloride in children with spina bifida. BJU Int 2001; 87 (7): 674–678. DOI: 10.1046/j.1464-410x.2001.02152.x.
- SOMMER BARBARAR, O’HARA RUTH, ASKARI NUSHA, KRAEMER HELENAC, KENNEDY WILLIAMA. The Effect Of Oxybutynin Treatment On Cognition In Children With Diurnal Incontinence. J Urol 2AD; 173 (6): 2125–2127. DOI: 10.1097/01.ju.0000157685.83573.79.
- Giramonti KM, Kogan BA, Halpern LF. The effects of anticholinergic drugs on attention span and short-term memory skills in children. Neurourol Urodyn 2008; 27 (4): 315–318. DOI: 10.1002/nau.20507.
- Todorova A, Vonderheid-Guth B, Dimpfel W. Effects of Tolterodine, Trospium Chloride, and Oxybutynin on the Central Nervous System. J Clin Pharmacol 2001; 41 (6): 636–644. DOI: 10.1177/00912700122010528.
- GUPTA S, SATHYAN G, LINDEMULDER E, HO P, SHEINER L, AARONS L. Quantitative characterization of therapeutic index: Application of mixed-effects modeling to evaluate oxybutynin dose–efficacy and dose–side effect relationships. Clin Pharmacol Ther 1999; 65 (6): 672–684. DOI: 10.1016/s0009-9236(99)90089-9.
- AUSTIN PAULF, HOMSY YVESL, MASEL JONATHANL, CAIN MARKP, CASALE ANTHONYJ, RINK RICHARDC. alpha-ADRENERGIC BLOCKADE IN CHILDREN WITH NEUROPATHIC AND NONNEUROPATHIC VOIDING DYSFUNCTION. J Urol 1999; 162: 1064–1067. DOI: 10.1097/00005392-199909000-00029.
- Franco I, S. C, Collett T, Reda E. Unknown. American Academy of Pediatrics Meeting. San Francisco, CA: 2007.
- Dellis AE, Keeley FX, Manolas V, Skolarikos AA. Role of \ensuremathα-blockers in the Treatment of Stent-related Symptoms: A Prospective Randomized Control Study. Urology 2014; 83 (1): 56–62. DOI: 10.1016/j.urology.2013.08.067.
- Lepor H, Kaplan SA, Klimberg I, Mobley DF, Fawzy A, Gaffney M, et al.. Doxazosin for Benign Prostatic Hyperplasia: Long-term Efficacy and Safety in Hypertensive and Normotensive Patients. J Urol 1997; 157 (2): 525–530. DOI: 10.1016/s0022-5347(01)65193-0.
- Chakraborty S, Feuerhak K, Muthyala A, Harmsen WS, Bailey KR, Bharucha AE. Effects of Alfuzosin, an \ensuremathα1-Adrenergic Antagonist, on Anal Pressures and Bowel Habits in Women With and Without Defecatory Disorders. Clin Gastroenterol Hepatol 2019; 17 (6): 1138–1147.e3. DOI: 10.1016/j.cgh.2018.08.036.
- VanderBrink BA, Gitlin J, Toro S, Palmer LS. Effect of Tamsulosin on Systemic Blood Pressure and Nonneurogenic Dysfunctional Voiding in Children. J Urol 2009; 181 (2): 817–822. DOI: 10.1016/j.juro.2008.10.045.
- Andersson K. Ch. 8. Incontinence 2009.
- Uchida H, Shishido K, Nomiya M, Yamaguchi O. Involvement of cyclic AMP-dependent and -independent mechanisms in the relaxation of rat detrusor muscle via \ensuremathβ-adrenoceptors. Eur J Pharmacol 2005; 518 (2-3): 195–202. DOI: 10.1016/j.ejphar.2005.06.029.
- Frazier EP, Mathy M-J, Peters SLM, Michel MC. Does Cyclic AMP Mediate Rat Urinary Bladder Relaxation by Isoproterenol? J Pharmacol Exp Ther 2005; 313 (1): 260–267. DOI: 10.1124/jpet.104.077768.
- Kobayashi H, Adachi-Akahane S, Nagao T. Involvement of BKCa channels in the relaxation of detrusor muscle via \ensuremathβ-adrenoceptors. Eur J Pharmacol 2000; 404 (1-2): 231–238. DOI: 10.1016/s0014-2999(00)00606-3.
- Hunsballe JM, Djurhuus JC. Clinical options for imipramine in the management of urinary incontinence. Urol Res 2001; 29 (2): 118–125. DOI: 10.1007/s002400100175.
- Franco I, Arlen AM, Collett-Gardere T, Zelkovic PF. Imipramine for refractory daytime incontinence in the pediatric population. J Pediatr Urol 2018; 14 (1): 58.e1–58.e5. DOI: 10.1016/j.jpurol.2017.08.016.
- Groat WC de, Griffiths D, Yoshimura N. Neural Control of the Lower Urinary Tract. Compr Physiol 2015; 5: 327–396. DOI: 10.1002/cphy.c130056.
- Numata A, Iwata T, Iuchi H, Taniguchi N, Kita M, Wada N, et al.. Micturition-suppressing region in the periaqueductal gray of the mesencephalon of the cat. Am J Physiol Regul Integr Comp Physiol 2008; 294 (6): R1996–r2000. DOI: 10.1152/ajpregu.00393.2006.
- Schuessler B. What do we know about duloxetine’s mode of action? Evidence from animals to humans. Bjog 2006; 113: 5–9. DOI: 10.1111/j.1471-0528.2006.00877.x.
- Roth TJ, Vandersteen DR, Hollatz P, Inman BA, Reinberg YE. Sacral Neuromodulation for the Dysfunctional Elimination Syndrome: A 10-Year Single-center Experience With 105 Consecutive Children. Urology 2008; 84 (4): 911–918. DOI: 10.1016/j.urology.2014.03.059.
- Boswell TC, Hollatz P, Hutcheson JC, Vandersteen DR, Reinberg YE. Device outcomes in pediatric sacral neuromodulation: A single center series of 187 patients. J Pediatr Urol 2021; 17 (1): 72.e1–72.e7. DOI: 10.1016/j.jpurol.2020.10.010.
- BOWER WF, MOORE KH, ADAMS RD. A Pilot Study Of The Home Application Of Transcutaneous Neuromodulation In Children With Urgency Or Urge Incontinence. J Urol 2001; 166: 2420–2422. DOI: 10.1097/00005392-200112000-00112.
- Lordelo P, Teles A, Veiga ML, Correia LC, Barroso U Jr. Faculty Opinions recommendation of Transcutaneous electrical nerve stimulation in children with overactive bladder: a randomized clinical trial. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2010; 184: 683–689, DOI: 10.3410/f.4324972.4410069.
- HOEBEKE P, RENSON C, PETILLON L, WALLE JVANDE, DE PAEPE H. Percutaneous Electrical Nerve Stimulation in Children With Therapy Resistant Nonneuropathic Bladder Sphincter Dysfunction: A Pilot Study. J Urol 2002; 168: 2605–2608. DOI: 10.1097/00005392-200212000-00085.
- CHASE JANET, ROBERTSON VALJ, SOUTHWELL BRIDGET, HUTSON JOHN, GIBB SUSIE. Pilot study using transcutaneous electrical stimulation (interferential current) to treat chronic treatment-resistant constipation and soiling in children. J Gastroenterol Hepatol 2005; 20 (7): 1054–1061. DOI: 10.1111/j.1440-1746.2005.03863.x.
- BALKEN MICHAELR van, VERGUNST HENK, BEMELMANS BARTLH. The Use Of Electrical Devices For The Treatment Of Bladder Dysfunction: A Review Of Methods. J Urol 2004; 172 (3): 846–851. DOI: 10.1097/01.ju.0000134418.21959.98.
- Capitanucci ML, Camanni D, Demelas F, Mosiello G, Zaccara A, De Gennaro M. Long-Term Efficacy of Percutaneous Tibial Nerve Stimulation for Different Types of Lower Urinary Tract Dysfunction in Children. J Urol 2009; 182 (4s): 2056–2061. DOI: 10.1016/j.juro.2009.03.007.
- Barroso U, Viterbo W, Bittencourt J, Farias T, Lordêlo P. Posterior Tibial Nerve Stimulation vs Parasacral Transcutaneous Neuromodulation for Overactive Bladder in Children. J Urol 2013; 190 (2): 673–677. DOI: 10.1016/j.juro.2013.02.034.
- Jafarov R, Ceyhan E, Kahraman O, Ceylan T, Dikmen ZG, Tekgul S, et al.. Efficacy of transcutaneous posterior tibial nerve stimulation in children with functional voiding disorders. Neurourol Urodyn 2021; 40 (1): 404–411. DOI: 10.1002/nau.24575.
- Austin PF, Franco I, Dobremez E, Kroll P, Titanji W, Geib T, et al.. OnabotulinumtoxinA for the treatment of neurogenic detrusor overactivity in children. Neurourol Urodyn 2021; 40 (1): 493–501. DOI: 10.1002/nau.24588.
- Hoebeke P, De Caestecker K, Vande Walle J, Dehoorne J, Raes A, Verleyen P, et al.. The Effect of Botulinum-A Toxin in Incontinent Children With Therapy Resistant Overactive Detrusor. J Urol 2006; 176 (1): 328–331. DOI: 10.1016/s0022-5347(06)00301-6.
- Lahdes-Vasama TT, Anttila A, Wahl E, Taskinen S. Urodynamic assessment of children treated with botulinum toxin A injections for urge incontinence: a pilot study. Scand J Urol Nephrol 2011; 45 (6): 397–400. DOI: 10.3109/00365599.2011.590997.
- Marte A, Borrelli M, Sabatino MD, Balzo BD, Prezioso M, Pintozzi L, et al.. Effectiveness of Botulinum-A Toxin for the Treatment of Refractory Overactive Bladder in Children. Eur J Pediatr Surg 2010; 20 (03): 153–157. DOI: 10.1055/s-0029-1246193.
- Chase J, Austin P, Hoebeke P, McKenna P, International Children’s Continence S. The Management of Dysfunctional Voiding in Children: A Report From the Standardisation Committee of the International Children’s Continence Society. J Urol 2010; 183 (4): 1296–1302. DOI: 10.1016/j.juro.2009.12.059.
- Clothier JC, Wright AJ. Dysfunctional voiding: the importance of non-invasive urodynamics in diagnosis and treatment. Pediatr Nephrol 2018; 33 (3): 381–394. DOI: 10.1007/s00467-017-3679-3.
- PALMER LANES, FRANCO ISRAEL, ROTARIO PAUL, REDA EDWARDF, FRIEDMAN STEVENC, KOLLIGIAN MARKE, et al.. Biofeedback Therapy Expedites the Resolution of Reflux In Older Children. J Urol 2002; 168: 1699–1703. DOI: 10.1097/00005392-200210020-00010.
- Resnick NM, Perera S, Tadic S, Organist L, Riley MA, Schaefer W, et al.. What Predicts and what Mediates the response of urge urinary incontinence to biofeedback? Neurourol Urodyn 2013; 32 (5): 408–415. DOI: 10.1002/nau.22347.
- Kibar Y, Demir E, Irkilata C, Ors O, Gok F, Dayanc M. Effect of Biofeedback Treatment on Spinning Top Urethra in Children with Voiding Dysfunction. Urology 2007; 70 (4): 781–784. DOI: 10.1016/j.urology.2007.04.054.
- Kibar Y, Ors O, Demir E, Kalman S, Sakallioglu O, Dayanc M. Results of Biofeedback Treatment on Reflux Resolution Rates in Children with Dysfunctional Voiding and Vesicoureteral Reflux. Urology 2007; 70 (3): 563–566. DOI: 10.1016/j.urology.2007.03.085.
- Bauer SB, Vasquez E, Cendron M, Wakamatsu MM, Chow JS. Pelvic floor laxity: A not so rare but unrecognized form of daytime urinary incontinence in peripubertal and adolescent girls. J Pediatr Urol 2018; 14 (6): 544.e1–544.e7. DOI: 10.1016/j.jpurol.2018.04.030.
- Dobrowolska-Glazar BA, Groen LA, Nieuwhof-Leppink AJ, Klijn AJ, Jong TPVM de, Chrzan R. Open and Laparoscopic Colposuspension in Girls with Refractory Urinary Incontinence. Front Pediatr 2017; 5: 284, DOI: 10.3389/fped.2017.00284.
- Colposuspension in girls: clinical and urodynamic aspects. J Pediatr Urol 2005; 1 (2): 69–74. DOI: 10.1016/j.jpurol.2004.11.011.
Dernière mise à jour: 2025-09-22 07:59