19: Vessie neurogène
Ce chapitre prendra environ 14 minutes de lecture.
Introduction
Le dysraphisme rachidien congénital représente la grande majorité des cas de dysfonction neurogène de la vessie et de l’intestin chez l’enfant.1 Parmi les autres causes de dysfonction neurogène impliquant la colonne vertébrale figurent l’agénésie sacrée, la moelle attachée, les malformations cloaquales et les lésions médullaires. Les enfants présentant des anomalies du système nerveux central telles que la diplégie spastique (paralysie cérébrale) peuvent également présenter une vessie neurogène.
Des troubles de la dynamique vésicale peuvent entraîner une maladie rénale chronique et une multitude de séquelles potentielles.2 La prise en charge de la vessie neurologique comprend l’obtention d’un stockage urinaire à basse pression et l’assurance de la continence urinaire tout en préservant la fonction des voies urinaires supérieures. Un traitement optimal nécessite une équipe de soins multidisciplinaire afin de prévenir et de prendre en charge les séquelles potentielles susceptibles d’affecter la fonction, la qualité de vie et la survie. Étant donné que le spina bifida est responsable de la majorité des cas de vessie neurologique, il sera au centre du présent chapitre.
Embryologie
Les défauts de fermeture du tube neural (DTN) sont des malformations du cerveau et de la moelle épinière résultant d’un défaut de fermeture du tube neural au cours des troisième et quatrième semaines du développement intra-utérin.3 Le spina bifida survient lorsque la moelle épinière est exposée et/ou fait saillie à la surface avec les méninges à travers un défaut de la paroi vertébrale. Le développement du canal rachidien débute au 18e jour de gestation et s’achève vers le 35e jour, sa fermeture se faisant dans une direction caudale à partir de l’extrémité céphalique du corps. Le dysraphisme spinal est attribuable à un développement anormal du mésoderme crânien.3 L’absence d’envahissement mésodermique au-dessus de la moelle épinière en développement entraîne une lésion ouverte, le plus souvent observée dans la région lombo-sacrée (Tableau 1). La moelle épinière exposée et ses racines nerveuses, qui peuvent faire saillie dans le sac de méningocèle, ainsi que la tension exercée sur la moelle lorsqu’elle remonte crânialement dans le canal avec l’allongement du fœtus (de L2, L3 au milieu et à la fin de la gestation, à L1 à la naissance), contribuent au tableau variable des lésions neurologiques touchant les voies urinaires basses et les membres inférieurs.4 L’hydrocéphalie et la malformation d’Arnold-Chiari de type II (association d’un myéloméningocèle et d’une hernie des amygdales cérébelleuses) sont fréquemment associées au spina bifida.5
Tableau 1 Niveau rachidien de la myéloméningocèle.
| Localisation | Incidence |
|---|---|
| Cervical-thoracique supérieur | 2% |
| Thoracique inférieur | 5% |
| Lombaire | 26% |
| Lombo-sacré | 47% |
| Sacré | 20% |
Épidémiologie
Le spina bifida est l’anomalie du tube neural la plus fréquente, survenant chez environ 1 naissance vivante sur 3 000 aux États-Unis et 1 pour 1 000 naissances vivantes dans le monde.6,7 Bien que l’incidence du spina bifida ait nettement diminué après l’introduction de la fortification obligatoire des produits céréaliers enrichis en acide folique aux États-Unis, le fardeau populationnel du spina bifida persiste, tant en termes de prévalence à la naissance que d’issues à long terme inégales.8,9,10 Il a été montré que des différences de race/ethnicité maternelle influent sur la prévalence du spina bifida, les mères hispaniques présentant une prévalence plus élevée que les femmes caucasiennes et noires.11 La prédominance selon le sexe diffère selon les pays; aux États-Unis, on estime que le spina bifida est plus fréquent chez les filles que chez les garçons.12
Pathogénie
Le spina bifida est généralement visible à la naissance sous forme de tissu neural exposé avec ou sans sac saillant au site de la lésion. La myéloméningocèle correspond à une protrusion de la moelle épinière hors du canal rachidien dans un sac rempli de liquide résultant d’une fermeture incomplète du tube neural primaire (Figure 1) L’étendue et la gravité des déficits neurologiques dépendent de la localisation de la lésion le long du névraxe - selon le niveau, l’interruption de la moelle épinière au site du défaut entraîne une paralysie des jambes, une incontinence urinaire et fécale, une anesthésie cutanée, et des anomalies des hanches, des genoux et des pieds.13,14 Il existe un impact variable sur l’innervation somatique, parasympathique et sympathique du détrusor et des muscles sphinctériens, ce qui affecte la capacité de la vessie à stocker et à évacuer l’urine - la myéloméningocèle est presque toujours associée à une vessie neurogène. Une mauvaise dynamique vésicale peut alors conduire à une maladie rénale chronique et à une multitude de séquelles potentielles.2
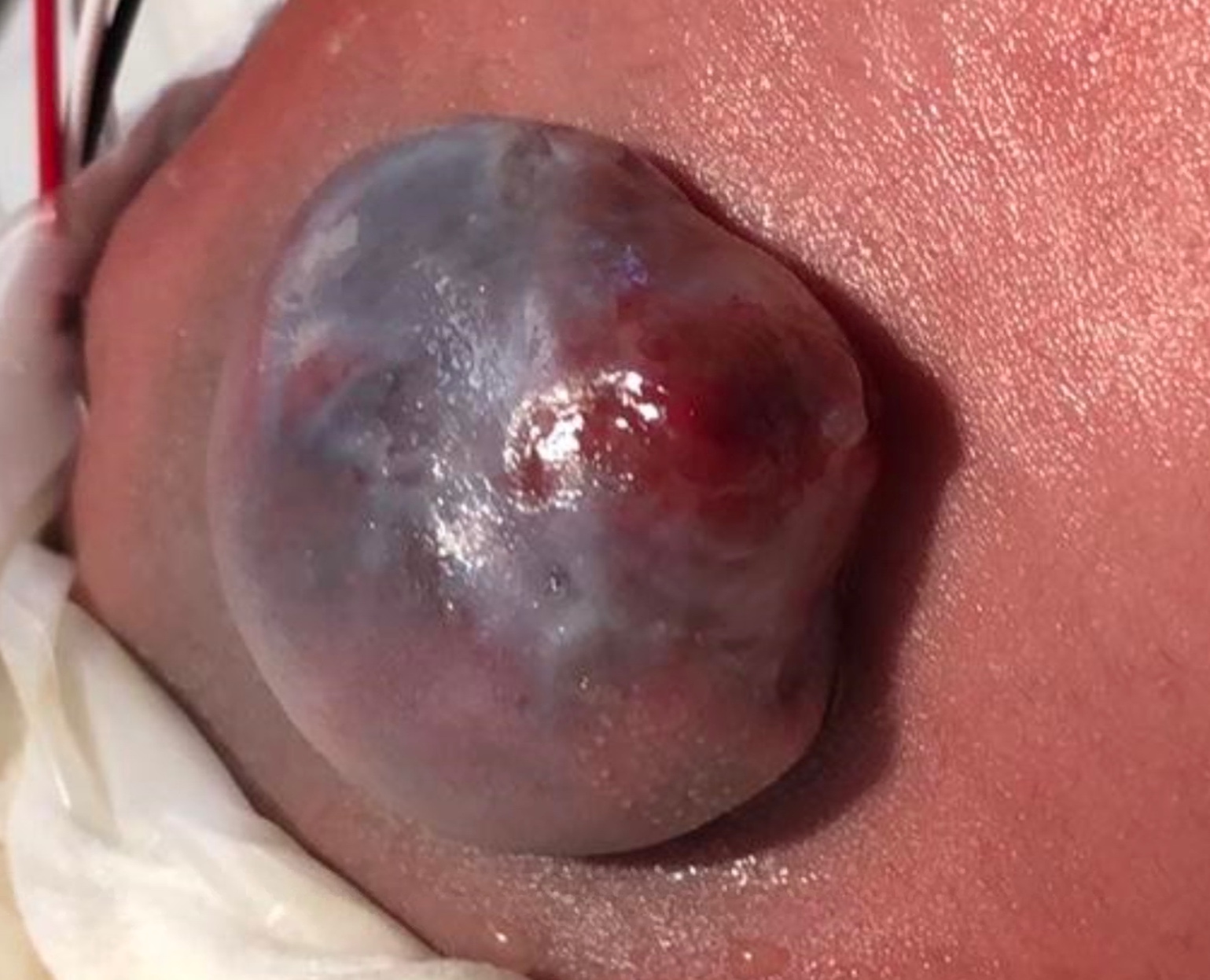
Figure 1 Myéloméningocèle ouverte.
La myéloméningocèle est généralement associée à une malformation rhombencéphalique de Chiari de type II, une ventriculomégalie et une hydrocéphalie.15 La malformation de Chiari de type II correspond à la descente du vermis cérébelleux dans le canal rachidien cervical.5 Il en résulte un allongement du tronc cérébral et une oblitération du quatrième ventricule, entraînant une obstruction de la circulation du liquide céphalorachidien et le développement d’une hydrocéphalie chez 90 % des patients.5,13 Le traitement de l’hydrocéphalie est nécessaire dans environ 82 % des cas et consiste à drainer le liquide céphalorachidien vers la cavité péritonéale ou une autre cavité corporelle au moyen d’une dérivation.16
Évaluation et diagnostic
Bien que la prise en charge optimale de la dysfonction vésicale liée au spina bifida reste inconnue, on observe une tendance récente à une prise en charge proactive plutôt que réactive des enfants présentant une vessie neurologique.17 L’observation consiste en une surveillance périodique par des examens non invasifs, notamment une échographie réno-vésicale, afin d’évaluer une dilatation et/ou une altération du haut appareil urinaire. Cependant, de nombreux urologues pédiatriques préconisent désormais une exploration complète des voies urinaires basses dès la période néonatale, avec instauration d’un traitement prophylactique soit à la naissance, soit en cas de signes d’obstruction de la sortie vésicale et/ou d’élévation des pressions vésicales de remplissage ou mictionnelles lors du bilan urodynamique initial.18,19,20
En 2012, les Centers for Disease Control and Prevention (CDC) ont convoqué un groupe de travail composé d’urologues pédiatres, de néphrologues, d’épidémiologistes cliniques, de méthodologistes, de représentants de la communauté et de membres du personnel du CDC afin d’élaborer un protocole standardisé pour optimiser la prise en charge urologique des enfants atteints de spina-bifida, de la période néonatale jusqu’à l’âge de 5 ans (Figure 2)21 Une échographie réno-vésicale est réalisée pour déterminer la dilatation de référence des voies urinaires supérieures.17 Un examen vidéourodynamique est réalisé avant l’âge de 3 mois – les images fluoroscopiques mettent en évidence un reflux vésico-urétéral s’il est présent ainsi qu’un contour vésical irrégulier/trabéculation (Figure 3)]. La question prépondérante à la naissance est de savoir si une dyssynergie détrusor-sphinctérienne est présente et si le nourrisson peut vider la vessie à basse pression. Une pression de remplissage détrusorienne élevée, une dyssynergie sphinctérienne vésicale ou des pressions de point de fuite élevées (>40 cm H2O) peuvent entraîner des lésions des voies urinaires supérieures et justifient une intervention précoce par cathétérisme intermittent propre (CIC) et anticholinergiques.22,23,24,25 Dans une approche proactive, les nourrissons sont mis sous cathétérisme intermittent propre (CIC) programmé toutes les 6 heures – la fréquence des cathétérismes peut être diminuée si les volumes sont constamment ≤30 mL; un élément clé est l’apprentissage par la famille de la réalisation des cathétérismes avant la sortie.21,26
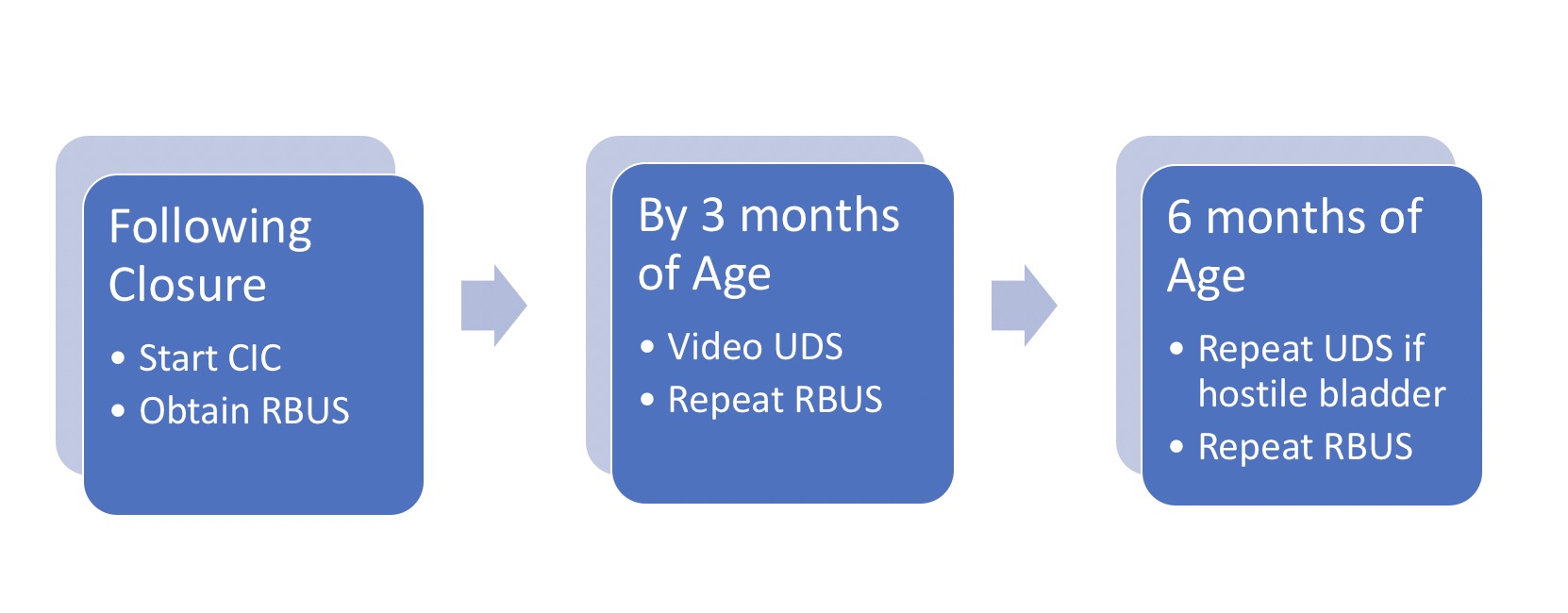
Figure 2 Protocole de prise en charge initiale du nourrisson atteint de spina bifida. À noter que tous les nouveau-nés sont mis au cathétérisme intermittent propre (CIC) toutes les 6 heures conformément au protocole; l’intervalle entre les cathétérismes peut être augmenté puis interrompu si les résidus post-mictionnels sont de façon constante ≤30 mL et si l’hydronéphrose à l’échographie réno-vésicale (RBUS) est ≤ grade 2. *Adapté de.21
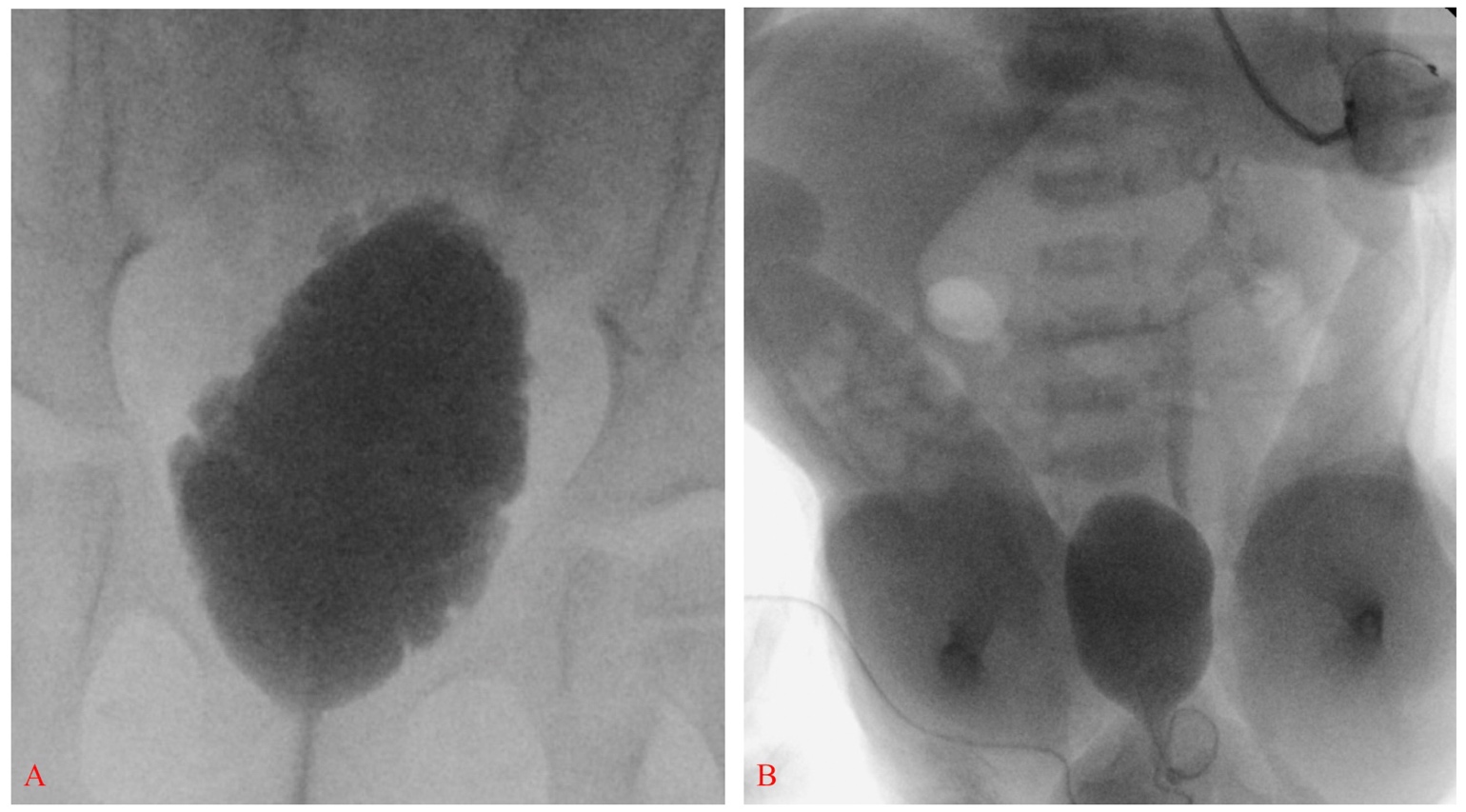
Figure 3 Vessie allongée avec contour irrégulier et trabéculation, compatible avec une vessie neurogène (A). Vessie à paroi lisse avec reflux vésico-urétéral de grade III à gauche chez un nouveau-né atteint de spina bifida; noter également des pieds bots bilatéraux et une flexion sévère des hanches (B).
Options thérapeutiques et leurs résultats
Les objectifs de la prise en charge de la vessie neurologique pédiatrique comprennent d’obtenir un stockage urinaire à basse pression et d’assurer la continence urinaire tout en préservant la fonction des voies urinaires supérieures. L’incidence de la détérioration des voies urinaires est importante, rapportée à plus de 50 %, lorsque les enfants présentant un risque de détérioration sont suivis avec une attitude expectative plutôt qu’une prise en charge préemptive.20,23,24 La sévérité du dysfonctionnement vésical varie largement et évolue avec le temps, une évaluation urodynamique précoce est essentielle pour identifier les enfants à risque accru – une prise en charge urologique plus agressive est recommandée pour les sujets présentant des paramètres hostiles.27,28,29
La mise en œuvre précoce du CIC et d’un traitement anticholinergique s’est avérée avantageuse au fil du temps. Le cathétérisme intermittent est généralement instauré toutes les 6 heures, avec une augmentation de la fréquence à toutes les 4 heures pendant les périodes d’éveil et l’ajout d’oxybutynine 0,2 mg/kg/8 heures chez ceux présentant des résultats défavorables à l’UDS. Les anticholinergiques constituent la pierre angulaire du traitement de l’hyperactivité détrusorienne et réduisent les pressions de stockage intravésicales chez les enfants présentant une faible compliance détrusorienne les exposant à un risque d’atteinte rénale.30,31 Outre l’oxybutynine, plusieurs nouveaux anticholinergiques sélectifs (tels que la solifénacine et la toltérodine) ont été conçus pour atténuer les effets indésirables soit en ciblant des sous-types spécifiques de récepteurs muscariniques, soit en modifiant les composés structuraux afin qu’ils franchissent moins les barrières tissulaires.32 Mirabegron, un agoniste des récepteurs adrénergiques β3, constitue une option thérapeutique alternative aux antimuscariniques et s’est montré efficace et bien toléré chez les enfants et les adolescents présentant une dysfonction vésicale neurogène.33 Avec un drainage adéquat et une prise en charge de l’hyperactivité détrusorienne, la vessie reste souvent compliante, s’agrandit à mesure que l’enfant grandit et maintient une épaisseur pariétale appropriée. L’hydronéphrose et le reflux vésico-urétéral se développent chez moins de 10 % des patients et la continence sociale est facilement obtenue chez la majorité des patients sans interventions supplémentaires.20,34,35
La toxine botulinique de type A (BTX-A) inhibe la libération du neurotransmetteur acétylcholine au niveau de la jonction neuromusculaire et est considérée comme une alternative pour améliorer la continence et les paramètres urodynamiques de la dysfonction vésicale neurogène chez l’enfant.31 Des études ont démontré une amélioration significative des paramètres cliniques et urodynamiques, attestée par une continence complète chez environ 65 % à 87 % des enfants, ainsi qu’une réduction de la pression détrusorienne maximale et une augmentation de la compliance détrusorienne chez la majorité des patients traités.36
Le recours à une augmentation vésicale utilisant l’intestin grêle ou le côlon représente la méthode de référence pour créer un organe capacitaire à basse pression pour le stockage des urines chez un nombre important d’enfants en échec du traitement médical, mais son utilité peut être limitée par une morbidité à court et à long terme.37,38,39 Des procédures concomitantes sur le col vésical sont réalisées selon les indications. L’intervention chirurgicale doit être individualisée en fonction des données urodynamiques, des antécédents médicaux, de l’âge, de la dextérité manuelle ainsi que des facteurs sociaux. Le clinicien doit pouvoir raisonnablement estimer que la famille est prête à entreprendre des protocoles de cathétérisme et d’irrigation postopératoires. Au moins un tiers des enfants subissant une augmentation vésicale présenteront une complication, notamment une perforation vésicale, la formation de calculs et la nécessité de procédures supplémentaires telles qu’une révision stomiale.40,41,42 Les anomalies métaboliques sont une conséquence connue de l’incorporation de l’intestin dans l’appareil urinaire, et les patients doivent être surveillés pour des déséquilibres métaboliques, y compris une acidose chronique.43 La malignité, bien que rare, est une complication tardive grave de l’augmentation et souligne l’importance d’un suivi à vie pour ces patients.44,45,46 Il convient de noter que le besoin de cystoplastie d’augmentation pour maintenir une capacité de stockage adéquate est nettement réduit, passant de presque 60 % à 16 %, lorsqu’on le compare aux enfants suivis de manière expectative.47
Suivi recommandé
- Une échographie réno-vésicale doit être réalisée à la naissance, tous les 3 mois pendant la première année de vie, puis annuellement, conjointement avec le dosage de la créatinine sérique, l’examen clinique et la mesure de la pression artérielle.21
- Bilan urodynamique de référence à 3 mois; étude annuelle aux âges de 1, 2 et 3 ans, puis tous les deux ans pendant l’enfance (les UDS sont réalisées plus fréquemment en cas de paramètres hostiles, pour évaluer la réponse au traitement ou en présence d’une nouvelle hydrouretéronéphrose/incontinence/infection urinaire récidivante).21,48
- À mesure que la population atteinte de spina bifida vieillit, les patients, les aidants et les médecins généralistes doivent être informés du risque de base de cancer associé à la vessie neurogène et de la nécessité d’une surveillance étroite, même en l’absence de procédures reconstructrices et de dérivation qui augmentent le risque néoplasique dans les voies urinaires.46
Conclusions
La vessie neurogène recouvre un large spectre d’affections selon le degré d’atteinte de l’appareil urinaire inférieur et l’interaction entre la capacité de stockage vésicale et la fonction sphinctérienne. Le pilier de la prise en charge actuelle de la vessie neurogène est non chirurgical, reposant sur les anticholinergiques et le cathétérisme intermittent propre. Une prise en charge proactive des enfants atteints de spina bifida s’est avérée efficace pour réduire le recours à la chirurgie et la survenue d’une insuffisance rénale terminale (IRT), en minimisant les effets du reflux à haute pression sur les voies urinaires supérieures. Lorsque cela est indiqué, la prise en charge chirurgicale est personnalisée pour chaque patient, sur la base d’une analyse attentive des données urodynamiques, des antécédents médicaux, de l’âge et de la présence d’un autre handicap.
Points clés
- La prise en charge proactive réduit les séquelles à long terme de la vessie neurologique
- Une pression de remplissage détrusorienne élevée, une dyssynergie vésico-sphinctérienne ou des pressions de point de fuite élevées (>40 cm H20) peuvent entraîner une atteinte des voies urinaires supérieures
- La pharmacothérapie et le CIC sont les pierres angulaires de la prise en charge
Lectures recommandées
- Bauer SB. Neurogenic bladder: etiology and assessment. Pediatr Nephrol 2008; 23 (4): 541–551. DOI: 10.1007/s00467-008-0764-7.
- Routh JC, Cheng EY, Austin JC, Baum MA, Gargollo PC, Grady RW, et al.. Design and Methodological Considerations of the Centers for Disease Control and Prevention Urologic and Renal Protocol for the Newborn and Young Child with Spina Bifida. J Urol 2016; 196 (6): 1728–1734. DOI: 10.1016/j.juro.2016.07.081.
- Rawashdeh YF, Austin P, Siggaard C, Bauer SB, Franco I, Jong TP de, et al.. International children’s continence society’s recommendations for therapeutic intervention in congenital neuropathic bladder and bowel dysfunction in children. Neurourol Urodyn 2012; 31 (5): 615–620. DOI: 10.1002/nau.22248.
Références
- Bauer SB. Neurogenic bladder: etiology and assessment. Pediatr Nephrol 2008; 23 (4): 541–551. DOI: 10.1007/s00467-008-0764-7.
- OAKESHOTT PIPPA, HUNT GILLIANM, POULTON ALISON, REID FIONA. Expectation of life and unexpected death in open spina bifida: a 40-year complete, non-selective, longitudinal cohort study. Dev Med Child Neurol 2010; 52 (8): 749–753. DOI: 10.1111/j.1469-8749.2009.03543.x.
- Hadžagić-Ćatibušić F, Maksić H, Užičanin S, Heljić S, Zubčević S, Merhemić Z, et al.. Congenital Malformations of the Central Nervous System: Clinical Approach. Bosn J Basic Med Sci 2008; 8 (4): 356–360. DOI: 10.17305/bjbms.2008.2897.
- Blaivas JG, Labib KL, Bauer SB, Retik AB. Changing Concepts in the Urodynamic Evaluation of Children. J Urol 1977; 117 (6): 778–781. DOI: 10.1016/s0022-5347(17)58623-1.
- Northrup H, Volcik KA. Spina bifida and other neural tube defects. Curr Probl Pediatr 2000; 30 (10): 317–332. DOI: 10.1067/mpp.2000.112052.
- Parker SE, Mai CT, Canfield MA, Rickard R, Wang Y, Meyer RE, et al.. Updated national birth prevalence estimates for selected birth defects in the United States, 2004-2006. Birth Defects Res A Clin Mol Teratol 2010; 88 (12): 1008–1016. DOI: 10.1002/bdra.20735.
- Ryznychuk MO, Kryvchanska MI, Lastivka IV. Teaching children with spina bifida. The Child with Spina Bifida 2018; 71 (339-344): 202–236. DOI: 10.4324/9781315656861-9.
- Honein MA, Paulozzi LJ, Mathews TJ. Impact of Folic Acid Fortification of the US Food Supply on the Occurrence of Neural Tube Defects–Correction. Jama 2001; 286 (18): 2236. DOI: 10.1001/jama.286.18.2236.
- Williams LJ, Rasmussen SA, Flores A, Kirby RS, Edmonds LD. Decline in the Prevalence of Spina Bifida and Anencephaly by Race/Ethnicity: 1995–2002. Pediatrics 2005; 116 (3): 580–586. DOI: 10.1542/peds.2005-0592.
- Bestwick JP, Huttly WJ, Morris JK, Wald NJ. Prevention of Neural Tube Defects: A Cross-Sectional Study of the Uptake of Folic Acid Supplementation in Nearly Half a Million Women. PLoS One 2014; 9 (2): e89354. DOI: 10.1371/journal.pone.0089354.
- Agopian AJ, Canfield MA, Olney RS, Lupo PJ, Ramadhani T, Mitchell LE, et al.. Spina bifida subtypes and sub-phenotypes by maternal race/ethnicity in the National Birth Defects Prevention Study. Am J Med Genet A 2012; 158a (1): 109–115. DOI: 10.1002/ajmg.a.34383.
- Mitchell LE, Adzick NS, Melchionne J, Pasquariello PS, Sutton LN, Whitehead AS. Spina bifida. Lancet 2004; 364 (9448): 1885–1895. DOI: 10.1016/s0140-6736(04)17445-x.
- Jobe AH. Fetal Surgery for Myelomeningocele. N Engl J Med 2002; 347 (4): 230–231. DOI: 10.1056/nejmp020073.
- Mohd-Zin SW, Marwan AI, Abou Chaar MK, Ahmad-Annuar A, Abdul-Aziz NM. Spina Bifida: Pathogenesis, Mechanisms, and Genes in Mice and Humans. Scientifica (Cairo) 2017; 2017: 1–29. DOI: 10.1155/2017/5364827.
- Stevenson KL. Chiari Type II malformation: past, present, and future. Neurosurg Focus 2004; 16 (2): 1–7. DOI: 10.3171/foc.2004.16.2.6.
- Adzick NS, Thom EA, Spong CY. A Randomized Trial of Prenatal versus Postnatal Repair of Myelomeningocele. Yearbook of Pediatrics 2011; 2012 (11): 404–406. DOI: 10.1016/j.yped.2011.06.029.
- Wang H-HS, Lloyd JC, Wiener JS, Routh JC. Nationwide Trends and Variations in Urological Surgical Interventions and Renal Outcome in Patients with Spina Bifida. J Urol 2016; 195 (4 Part 2): 1189–1195. DOI: 10.1016/j.juro.2015.11.033.
- KURZROCK ERICA, POLSE SANFORD. Renal Deterioration In Myelodysplastic Children: Urodynamic Evaluation And Clinical Correlates. J Urol 1998; 159 (5): 1657–1661. DOI: 10.1097/00005392-199805000-00084.
- HOPPS CARINV, KROPP KENNETHA. Preservation of Renal Function in Children With Myelomeningocele Managed With Basic Newborn Evaluation And Close Followup. J Urol 2003; 169: 305–308. DOI: 10.1097/00005392-200301000-00092.
- Wu H-Y, Baskin L, Kogan BA. Neurogenic Bladder Dysfunction Due to Myelomeningocele: Neonatal Versus Childhood Treatment. J Urol 1997; 157 (6): 2295–2297. DOI: 10.1016/s0022-5347(01)64766-9.
- Routh JC, Cheng EY, Austin JC, Baum MA, Gargollo PC, Grady RW, et al.. Design and Methodological Considerations of the Centers for Disease Control and Prevention Urologic and Renal Protocol for the Newborn and Young Child with Spina Bifida. J Urol 2016; 196 (6): 1728–1734. DOI: 10.1016/j.juro.2016.07.081.
- Mcguire EJ, Wang C-C, Usitalo H, Savastano J. Modified Pubovaginal Sling in Girls with Myelodysplasia. J Urol 1986; 135 (1): 94–96. DOI: 10.1016/s0022-5347(17)45528-5.
- Bauer SB, Hallet M, Khoshbin S. Predictive value of urodynamic evaluation in newborns with myelodysplasia. Jama 1984; 252 (5): 650–652. DOI: 10.1001/jama.252.5.650.
- Ami Sidi A, Dykstra DD, Gonzalez R. The Value of Urodynamic Testing in the Management of Neonates with Myelodysplasia: A Prospective Study. J Urol 1986; 135 (1): 90–93. DOI: 10.1016/s0022-5347(17)45527-3.
- Perez LM, Khoury J, Webster GD. The Value of Urodynamic Studies in Infants Less than 1 Year Old with Congenital Spinal Dysraphism. J Urol 1992; 148 (2 Part 2): 584–587. DOI: 10.1016/s0022-5347(17)36660-0.
- BASKIN LS, KOGAN BA, BENARD F. Treatment of Infants with Neurogenic Bladder Dysfunction using Anticholinergic Drugs and Intermittent Catheterisation. Br J Urol 1990; 66 (5): 532–534. DOI: 10.1111/j.1464-410x.1990.tb15004.x.
- Joseph DB, Bauer SB, Colodny AH, Mandell J, Retik AB. Clean, Intermittent Catheterization of Infants With Neurogenic Bladder. Pediatrics 1989; 84 (1): 78–82. DOI: 10.1542/peds.84.1.78.
- Tanaka ST, Yerkes EB, Routh JC, Tu DD, Austin JC, Wiener JS, et al.. Urodynamic characteristics of neurogenic bladder in newborns with myelomeningocele and refinement of the definition of bladder hostility: Findings from the UMPIRE multi-center study. J Pediatr Urol 2021; 17 (5): 726–732. DOI: 10.1016/j.jpurol.2021.04.019.
- Snow-Lisy DC, Yerkes EB, Cheng EY. Update on Urological Management of Spina Bifida from Prenatal Diagnosis to Adulthood. J Urol 2015; 194 (2): 288–296. DOI: 10.1016/j.juro.2015.03.107.
- Ghoniem GM, Roach MB, Lewis VH, Harmon EP. The Value of Leak Pressure and Bladder Compliance in the Urodynamic Evaluation of Meningomyelocele Patients. J Urol 1990; 144 (6): 1440–1442. DOI: 10.1016/s0022-5347(17)39761-6.
- Galloway NTM, Mekras JA, Helms M, Webster GD. An Objective Score to Predict Upper Tract Deterioration in Myelodysplasia. J Urol 1991; 145 (3): 535–537. DOI: 10.1016/s0022-5347(17)38389-1.
- Andersson K-E, Chapple CR, Cardozo L, Cruz F, Hashim H, Michel MC, et al.. Pharmacological treatment of overactive bladder: report from the International Consultation on Incontinence. Curr Opin Urol 2009; 19 (4): 380–394. DOI: 10.1097/mou.0b013e32832ce8a4.
- Rawashdeh YF, Austin P, Siggaard C, Bauer SB, Franco I, Jong TP de, et al.. International children’s continence society’s recommendations for therapeutic intervention in congenital neuropathic bladder and bowel dysfunction in children. Neurourol Urodyn 2012; 31 (5): 615–620. DOI: 10.1002/nau.22248.
- Franco I, Hoebeke P. Baka-Ostrowska M, et al. Long-term efficacy and safety of solifenacin in pediatric patients aged 6 months to 18 years with neurogenic detrusor overactivity: results from two phase 3 prospective open-label studies. J Pediatr Urol 2019. 6 (2): 80 1–180 8. DOI: 10.1016/j.jpurol.2019.12.012.
- REINBERG Y, CROCKER J, WOLPERT J, VANDERSTEEN D. Therapeutic Efficacy Of Extended Release Oxybutynin Chloride, And Immediate Release And Long Acting Tolterodine Tartrate In Children With Diurnal Urinary Incontinence. J Urol 2003; 169 (317-319): 317–319. DOI: 10.1097/00005392-200301000-00095.
- Baka-Ostrowska M, Bolong DT, Persu C, Tøndel C, Steup A, Lademacher C, et al.. Efficacy and safety of mirabegron in children and adolescents with neurogenic detrusor overactivity: An open-label, phase 3, dose-titration study. Neurourol Urodyn 2021; 40 (6): 1490–1499. DOI: 10.1002/nau.24657.
- Edelstein RA, Bauer SB, Kelly MD. The long-term urologic response of neonates with myelodysplasia treated proactively with intermittent catheterization and anticholinergic therapy. J Pediatr Surg 1995; 31 (3): 455–456. DOI: 10.1016/s0022-3468(96)90810-6.
- Karsenty G, Denys P, Amarenco G, De Seze M, Gamé X, Haab F, et al.. Botulinum Toxin A (Botox®) Intradetrusor Injections in Adults with Neurogenic Detrusor Overactivity/Neurogenic Overactive Bladder: A Systematic Literature Review. Eur Urol 2009; 53 (2): 275–287. DOI: 10.1016/j.eururo.2007.10.013.
- Lemelle JL, Guillemin F, Aubert D, Guys JM, Lottmann H, Lortat-Jacob S, et al.. A Multicenter Evaluation of Urinary Incontinence Management and Outcome in Spina Bifida. J Urol 2006; 175 (1): 208???212. DOI: 10.1097/00005392-200601000-00056.
- Metcalfe PD, Rink RC. Bladder augmentation: Complications in the pediatric population. Curr Urol Rep 2007; 8 (2): 152–156. DOI: 10.1007/s11934-007-0065-x.
- Walker RD. The management of the failed bladder neck procedure in patients with spina bifida. BJU Int 2016; 92: 35–37. DOI: 10.1046/j.1464-410x.92.s1.13.x.
- Scales CD, Wiener JS. Evaluating Outcomes of Enterocystoplasty in Patients With Spina Bifida: A Review of the Literature. J Urol 2008; 180 (6): 2323–2329. DOI: 10.1016/j.juro.2008.08.050.
- Kurzrock EA. Pediatric enterocystoplasty: long-term complications and controversies. World J Urol 2009; 27 (1): 69–73. DOI: 10.1007/s00345-008-0335-3.
- Merriman LS, Arlen AM, Kirsch AJ, Leong T, Smith EA. Does augmentation cystoplasty with continent reconstruction at a young age increase the risk of complications or secondary surgeries? J Pediatr Urol 2015; 11 (1): 41.e1–41.e5. DOI: 10.1016/j.jpurol.2014.08.016.
- Hensle TW, Gilbert SM. A review of metabolic consequences and long-term complications of enterocystoplasty in children. Curr Urol Rep 2007; 8 (2): 157–162. DOI: 10.1007/s11934-007-0066-9.
- Husmann DA. Malignancy after gastrointestinal augmentation in childhood. Ther Adv Urol 2009; 1 (1): 5–11. DOI: 10.1177/1756287209104163.
- Austin JC. Long-term risks of bladder augmentation in pediatric patients. Curr Opin Urol 2008; 18 (4): 408–412. DOI: 10.1097/mou.0b013e328300587c.
- Arlen AM, Dudley AG, Kieran K. Association of spina bifida with cancer. Transl Androl Urol 2020; 9 (5): 2358–2369. DOI: 10.21037/tau-19-771.
- Kaefer M, Pabby A, Kelly M. Improved Bladder Function After Prophylactic Treatment Of The High Risk Neurogenic Bladder In Newborns With Myelomeningocele. J Urol 1999; 162: 1071. DOI: 10.1097/00005392-199909000-00032.
- Bauer SB, Nijman RJM, Drzewiecki BA, Sillen U, Hoebeke P. International Children’s Continence Society standardization report on urodynamic studies of the lower urinary tract in children. Neurourol Urodyn 2015; 34 (7): 640–647. DOI: 10.1002/nau.22783.
Dernière mise à jour: 2025-09-22 07:59