17: Méga-uretère
Ce chapitre prendra environ 23 minutes de lecture.
Introduction
Les anomalies congénitales de la jonction urétérovésicale (UVJ) se manifestent souvent par un uretère dilaté ou « méga-uretère » (Figure 1). De nombreux synonymes de cette affection existent, notamment hydrouretère et mégalourétère, mais tous désignent un uretère de diamètre supérieur à la normale, avec ou sans dilatation associée du bassinet rénal. Smith a classé les méga-uretères en quatre catégories : obstructifs, refluxifs, refluxifs avec obstruction et non refluxifs/non obstructifs, ultérieurement subdivisées en primaires et secondaires par King.1,2 La classification de Pfister-Hendren, établie en 1978, était basée sur l’aspect morphologique : le type I concernait l’uretère distal sans hydronéphrose associée ; le type II s’étendait à l’uretère et au bassinet ; et le type III était associé à une hydro-urétéro-néphrose sévère et à une tortuosité urétérale.3 Les méga-uretères congénitaux sont deux fois plus fréquents chez les patients de sexe masculin et présentent un ratio gauche:droit de 1.8:1.4 Comme l’anomalie de l’UVJ avec reflux est abordée en détail ailleurs, ce chapitre se concentrera sur les méga-uretères obstructifs et les méga-uretères non obstructifs non refluxifs.
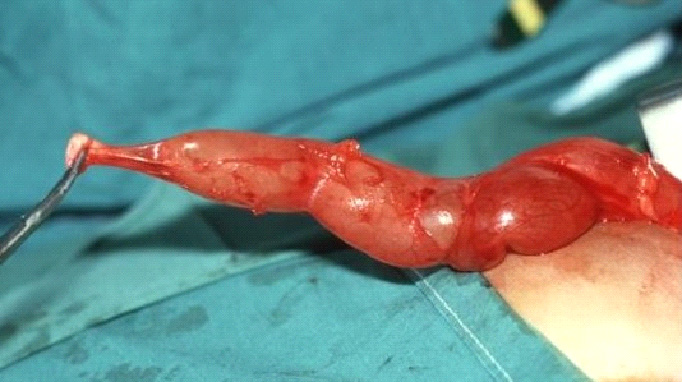
Figure 1 Vue peropératoire du méga-uretère (MU) et du segment juxta-vésical rétréci et apéristaltique (AS).
La définition d’un uretère dilaté n’est pas bien établie dans la littérature. Cussen a examiné les uretères de fœtus de plus de 20 semaines de gestation et d’enfants jusqu’à l’âge de 12 ans, et a établi des dimensions urétérales moyennes pour les fœtus à 30 semaines de gestation, et pour les nourrissons et les enfants à 3 mois et à 3, 6 et 12 ans.5 La limite supérieure de la plage des diamètres du segment moyen de l’uretère, de la naissance à 12 ans, était de 0,5–0,65 cm ; par conséquent, la limite supérieure de la normale était considérée comme très proche de 0,7 cm. Hellstrom et al ont fourni des données radiologiques sur le diamètre urétéral normal chez 194 enfants âgés de 0 à 16 ans, et ont également conclu qu’un diamètre urétéral supérieur à 7 mm était anormal dans ce groupe d’âge.6
Embryologie et génétique de la jonction urétérovésicale
Les anomalies de la JUV font partie des anomalies congénitales du rein et des voies urinaires (CAKUT). Les CAKUT regroupent un spectre d’anomalies affectant le développement des voies urinaires, incluant l’agénésie rénale, la dysplasie ou l’hypoplasie; l’obstruction urétérale proximale ou distale (obstruction de la jonction pyélo-urétérale (JPU) ou de la JUV); la dilatation de l’uretère (mégauretère); le reflux vésico-urétéral (RVU) et l’obstruction urétrale (p. ex., due à des valves urétrales postérieures ou à une atrésie urétrale).7 Sur le plan embryologique, le rein des mammifères dérive de deux éléments: le bourgeon urétérique, un épithélium qui se ramifie de façon répétée pour former les canaux collecteurs, et le mésenchyme métanéphrique. Le bourgeon urétérique donne également naissance à l’épithélium du bassinet et de l’uretère, connu sous le nom d’urothélium.
À ce jour, nos connaissances sur le développement urétéral normal se limitent à des travaux sur des modèles animaux, y compris des souris transgéniques présentant des phénotypes rénaux/ urétéraux anormaux. Ces études suggèrent que plusieurs gènes, des facteurs de transcription, ainsi que des protéines sécrétées, contribuent au développement urétéral normal et, lorsqu’ils sont perturbés, se manifestent par diverses formes de CAKUT.8 Un acteur clé du développement urétérique est l’axe GDNF/c-ret, constitué du facteur neurotrophique dérivé de la lignée cellulaire gliale et de la tyrosine kinase à protéine transmembranaire c-ret.9 L’émergence et la ramification du bourgeon urétérique dépendent de l’interaction entre le GDNF et son co-récepteur 1 ancré au glycosyl-phosphaditylinositol (Gfrα1), qui se lient à c-ret et l’activent. Le GDNF est principalement exprimé dans le mésenchyme métanéphrique, le coin trigonal de l’uretère distal et le sinus urogénital. Chez les mutants c-ret -/-, on a observé une agénésie rénale, une hypodysplasie sévère et des uretères se terminant en cul-de-sac; les mutants GDNF -/- et Gfrα1 -/- présentaient également des phénotypes similaires, ce qui suggère que l’axe GDNF-c-ret est nécessaire à l’initiation du bourgeon urétérique et à la morphogenèse précoce de la ramification.
L’expression de C-ret dépend de l’acide rétinoïque (un métabolite de la vitamine A).9 Batourina et al ont montré que la vitamine A et le proto-oncogène Ret sont nécessaires à la formation d’une jonction correcte entre la vessie et l’uretère.10 Des mutants murins dépourvus de Ret ou de Rara et Rarb, deux membres de la famille des récepteurs des rétinoïdes, présentaient une hydronéphrose et un mégauretère, tous deux liés à des anomalies aux stades précoces de la maturation de l’uretère, lorsque le remodelage du “common nephritic duct” (CND — nom donné par Batourina et al à la partie du canal mésonéphrique proximale à l’origine du bourgeon urétéral) entraîne la séparation des orifices urétéraux des canaux mésonéphriques. Leurs études ont suggéré que la vitamine A et Ret étaient nécessaires à l’expansion du CND en une structure appelée le wedge, qui, selon eux, était probablement le précurseur du trigone.11,12
Le moment de la différenciation du muscle lisse dans l’uretère distal est inconnu, mais pourrait être la clé pour comprendre pourquoi le VUR ou l’obstruction s’améliorent après la naissance. Pirker et al ont étudié des prélèvements vésicaux provenant de fœtus porcins, de porcelets nouveau-nés et de porcelets âgés de 6 mois.13 Ils ont constaté qu’à 60 jours, le muscle détrusor vésical était bien développé et innervé, alors que l’uretère intra- et extravésical venait tout juste de commencer à se différencier. À 90 jours, l’uretère extravésical était bien innervé, mais l’uretère intravésical n’atteignait sa maturité qu’après la naissance. Tous les composants du muscle lisse ont montré une augmentation marquée de la masse entre les coupes néonatales et ultérieures. La cinétique du développement musculaire dans cette étude correspond aux observations chez l’humain, chez qui des faisceaux de muscle lisse de l’uretère extramural apparaissent d’abord entre 17 et 22 semaines de gestation, et le développement du muscle urétéral progresse selon une direction crânio-caudale.14 Les auteurs ont également remarqué que le développement de la gaine périurétérale précède celui du muscle lisse urétéral, ce qui a également été rapporté chez l’humain. La gaine périurétérale présentait un développement neuromusculaire postnatal considérable. Ses fibres musculaires ont nettement augmenté et formaient presque une couche continue à 6 mois.13 Tanagho a également observé que l’uretère distal est la dernière portion à développer sa tunique musculaire, et que la différenciation musculaire précoce concerne principalement les muscles circulaires. D’autres études ont suggéré des explications possibles au développement de l’obstruction de l’UVJ.15 Celles-ci incluent un manchon musculaire épais autour de la portion distale de l’uretère, une augmentation du dépôt de fibres de collagène et une neuromodulation dérégulée dans le segment juxtavésical des mégauretères obstrués.11,16,17
Diagnostic prénatal
La dilatation urétérale est associée à l’hydronéphrose anténatale dans 5–10% des cas.18 Actuellement, près de 79% des patients atteints d’hydrouretéronéphrose sont détectés à l’échographie périnatale (USS), le reste se présentant après une infection urinaire fébrile (UTI).19 La détection, par échographie, d’un uretère dilaté in utero est une entreprise difficile. Le fœtus peut ne pas être dans l’orientation adéquate, ou l’uretère peut être masqué par des structures sus-jacentes ou par des gaz intestinaux maternels. En outre, les techniciens peuvent ne pas être formés à rechercher spécifiquement des uretères dilatés lors du dépistage de routine. Par conséquent, la détection prénatale des uretères dilatés est vraisemblablement peu fiable. Dans une étude portant sur 101 patients présentant une hydrouretéronéphrose identifiée en postnatal et adressés au Great Ormond Street Hospital, seulement 20% avaient un uretère dilaté documenté en prénatal. Quarante-huit (47.5%) nourrissons présentaient un VUR ou une autre pathologie, et 53 (52.5%) étaient suspectés d’avoir une obstruction de la jonction urétéro-vésicale (UVJ).4
Prise en charge postnatale
Les patients présentant une dilatation urétérale supérieure à 7 mm présentent un risque accru d’infection des voies urinaires (IVU) et une prophylaxie antibiotique continue (PAC) est donc recommandée.20 Une récente étude prospective multicentrique portant sur 237 patients présentant une dilatation urétérale a conclu que les patients ayant des uretères de 7 mm ou plus avaient un risque d’IVU presque triplé après ajustement pour le sexe, le statut de circoncision, la prophylaxie antibiotique et le grade d’hydronéphrose. Ce risque accru était également présent chez les patients explorés par cystouréthrographie mictionnelle (CUM) et chez lesquels aucun reflux vésico-urétéral (RVU) n’a été mis en évidence. La PAC était significativement protectrice contre les IVU.21
Une échographie postnatale (US) est recommandée entre 48 heures et 4 semaines (consensus UTD), lorsque la dilatation est unilatérale (Figure 2).22 Une hydro-urétéro-néphrose bilatérale doit être explorée de manière plus urgente, et une obstruction de la voie d’évacuation vésicale doit être exclue avant la sortie postnatale. La présence d’un ou de plusieurs uretères dilatés constitue une indication de VCUG, afin d’exclure une obstruction urétrale ou un VUR. La présence de VUR confirme un “méga-uretère refluxif”. Il est important de s’assurer du drainage des voies urinaires supérieures après la vidange vésicale sur la MCUG. Un mauvais drainage en VCUG, surtout lorsqu’il existe une dilatation importante des voies urinaires supérieures à l’USS, peut faire suspecter un “méga-uretère refluxif et obstructif”.20
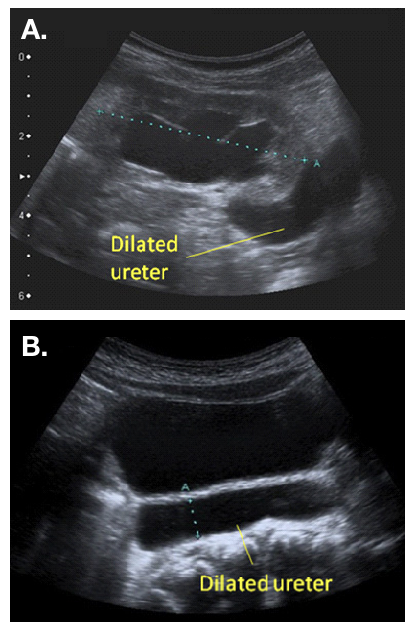
Figure 2 Aspect échographique d’un uretère dilaté, vu sortant d’un bassinet rénal dilaté (a) et visible en arrière de la vessie (b)
En l’absence de RVU ou d’obstruction urétrale, un rénogramme dynamique, tel qu’une rénographie diurétique au 99mTc-MAG-3, et une échographie de contrôle doivent être réalisés après l’âge de 6 semaines. Ces examens aideront à différencier un mégauretère “obstructif” d’un mégauretère “non obstructif-non refluxant”. Les nourrissons se présentant en période postnatale (p. ex., avec une infection urinaire) sont également explorés de manière similaire, bien qu’il soit préférable d’attendre la guérison de l’urosepsis avant d’entreprendre une CUM ou un rénogramme MAG-3.20
Selon les recommandations de l’Association européenne de médecine nucléaire (EANM) concernant la rénographie standard et diurétique chez l’enfant, la rénographie permet d’estimer deux aspects de la fonction rénale.23 Le premier aspect est la clairance rénale, ou fonction rénale différentielle (DRF). L’estimation de la DRF est de préférence réalisée entre une et deux minutes après l’injection du traceur. Le second aspect est l’excrétion, ou disparition, du traceur hors du rein. Traditionnellement, un retard important d’excrétion est suggéré par une courbe continuellement ascendante et un transit retardé, c’est-à-dire un Tmax (temps pour atteindre le maximum, ou le pic, de la courbe) supérieur à 20 minutes (Figure 3). Cependant, le retard de transit peut être dû à l’augmentation de capacité offerte par un bassinet et un uretère dilatés. Ainsi, du furosémide est administré afin de distinguer entre une obstruction et l’effet d’un système dilaté. Un mauvais drainage peut également être apparent parce que la vessie est pleine, ou parce que l’effet de la gravité sur le drainage est incomplet. Pour toutes ces raisons, l’interprétation d’un “drainage altéré” en rénographie diurétique est controversée.24
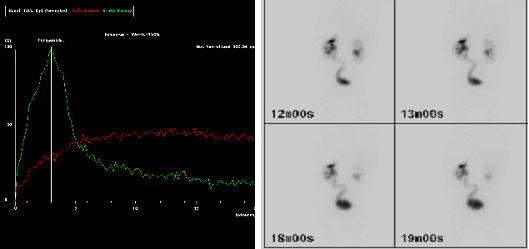
Figure 3 Images au MAG-3 montrant un drainage retardé du traceur (courbe rouge) à 20 minutes (a) et un uretère gauche (L) visible sur les images tardives (b), suggérant un obstacle au niveau de l’UVJ gauche.
Une combinaison de données cliniques et radiologiques doit être prise en compte pour qualifier un méga-uretère comme “obstructif” ou “non obstructif”. La présence de symptômes, tels qu’une infection urinaire fébrile ou une douleur, constitue un indicateur clinique d’une obstruction possible. Chez le patient asymptomatique, la présence d’une DRF inférieure à 40 %, et/ou une dilatation croissante sur des échographies sériées, sont également évocatrices d’obstruction et constituent des indications d’intervention. Un transit retardé au MAG-3, en présence d’une dilatation stable ou en amélioration, et d’une DRF supérieure à 40 %, chez un patient asymptomatique, peut être pris en charge de façon conservatrice.20 Liu et al et McLellan et al ont suggéré que les enfants présentant un diamètre urétéral rétrovésical supérieur à 10 mm étaient plus susceptibles de nécessiter une intervention chirurgicale.4,25
Il est important de savoir que des obstructions ipsilatérales de la JPU et de la JUV peuvent coexister. Le MAG-3 préopératoire peut suggérer une double pathologie lorsque l’uretère obstrué se remplit lentement puis ne se draine pas. Dans ce contexte, une pyélographie rétrograde peut être utile pour poser le diagnostic.26
Prise en charge
La prise en charge des méga-uretères primaires a évolué au cours des 30 dernières années. En 1989, Peters et al ont rapporté que 89 % des patients nécessitaient une intervention chirurgicale avant l’âge de 8 mois.27 Cette même année, Keating et al ont rapporté que, lorsque la décision d’intervenir se fondait sur la fonction rénale absolue, jusqu’à 87 % des patients pouvaient être suivis de manière conservatrice.28 Une autre publication de la même unité a confirmé, lors du suivi à long terme, la stabilité ou l’amélioration du même groupe de patients pris en charge de façon conservatrice.29 Liu et al ont également suggéré que la majorité des méga-uretères peuvent être suivis de manière conservatrice et ont montré qu’avec un suivi moyen de 3,1 ans, 34 % des méga-uretères primaires ont régressé spontanément. Parmi les cas restants, 17 % ont été réimplantés en raison d’une infection urinaire d’échappement ou d’une détérioration de la fonction rénale, tandis que 49 % présentaient une dilatation persistante au suivi et faisaient toujours l’objet d’une surveillance conservatrice.4
Mégauretères non obstructifs non refluxifs
Les méga-uretères associés à une fonction rénale différentielle (DRF) >40 % chez un patient asymptomatique peuvent faire l’objet d’une prise en charge conservatrice. Un suivi rapproché avec des échographies (USS) à intervalles réguliers et une prophylaxie antibiotique sont recommandés, en particulier lorsque la dilatation urétérale dépasse 7 mm21 Song et al ont montré que le risque d’infection des voies urinaires (IVU) est plus élevé en cas d’obstruction de la jonction urétéro-vésicale (UVJ) qu’en cas d’obstruction de la jonction pyélo-urétérale (UPJ), et que les IVU ont tendance à survenir au cours des six premiers mois de vie.30 Une fois qu’une amélioration de l’hydronéphrose est constatée, les consultations de suivi peuvent être espacées à un rythme semestriel puis annuel, et la prophylaxie antibiotique arrêtée. La résolution de l’hydrouretéronéphrose peut prendre plusieurs années. McLellan et al ont montré que l’hydronéphrose s’était complètement résolue dans 72 % des cas lors d’un suivi médian de 25,8 mois.25
Un suivi à long terme est recommandé lorsque la dilatation persiste. Une étude de suivi à long terme de Shukla et al a rapporté une détérioration tardive chez un garçon de 14 ans atteint de méga-uretères primaires bilatéraux, qui s’est présenté avec une augmentation de la dilatation et une détérioration fonctionnelle six ans après l’arrêt du suivi conservateur.31 Hemal et al. 30 ont rapporté les résultats de 55 patients atteints de méga-uretères congénitaux consultant pour la première fois au cours de la troisième décennie de vie, dont 20 patients avaient des calculs rénaux. Cinq patients avec des méga-uretères bilatéraux étaient en insuffisance rénale chronique au diagnostic, dont deux sont finalement décédés de la maladie.32 Ainsi, une résolution précoce après une prise en charge conservatrice n’est pas une garantie à vie, et un suivi jusqu’à l’âge adulte est recommandé.
Mégauretères obstructifs
Le diagnostic d’obstruction repose sur une DRF réduite <40% au moment du diagnostic, ou sur une diminution de la DRF >10% lors de rénographies répétées à intervalles. Une dilatation croissante à l’USS et des symptômes (infection urinaire/douleur) sont également évocateurs d’une obstruction. Le choix de l’intervention chirurgicale dépend de l’âge de l’enfant (moins d’un an ou plus d’un an) et de la disponibilité du matériel et de l’expertise lorsqu’une option endoscopique est envisagée. Les options chirurgicales comprennent :
- Réimplantation urétérale (ouverte/ laparoscopique ou assistée par robot)
- Pose temporaire d’une sonde JJ
- Dilatation endoscopique au ballonnet ± endourétérotomie
- Urétérocystostomie refluxante
- Urétérostomie cutanée
Réimplantation urétérale
L’objectif de la réimplantation urétérale est d’exciser le segment UVJ apéristaltique et étroit, et d’acheminer l’uretère dans la vessie en tunnel de manière anti-reflux. Le tunnel doit mesurer au moins cinq fois le diamètre urétéral pour être efficace, données fondées sur une étude de Paquin en 1959.33 Pour obtenir ce ratio lorsque le diamètre urétéral est supérieur à 10 mm, les 10 cm distaux de l’uretère peuvent nécessiter un effilage. Un psoas hitch peut également être nécessaire afin d’assurer une entrée rectiligne de l’uretère dans la vessie. Les deux techniques les plus répandues pour la mise au calibre des méga-uretères sont la plicature telle que rapportée par Starr et Kalicinski et al., et l’effilage tel que modifié par Hendren.34,35,36 Kalicinski et al ont décrit une technique de pliage selon laquelle la partie latérale, avasculaire de l’uretère était exclue de la lumière par une suture continue longitudinale, puis repliée en arrière avant la réimplantation. Starr a modifié cette procédure en introduisant de nombreuses sutures de Lembert interrompues qui repliaient la paroi urétérale vers l’intérieur, préservant ainsi sa vascularisation, mais rendant la réimplantation ultérieure plus lourde. Hendren a préconisé un effilage par exérèse, dans lequel une bande longitudinale d’uretère redondant est excisée, et l’uretère suturé en deux plans.35,36 Ben-Meir et al ont comparé les résultats de la réimplantation des méga-uretères avec et sans mise au calibre et ont montré qu’il n’y avait pas de différence significative de résultats (taux de succès de 94 % dans le groupe avec mise au calibre, et 96 % dans le groupe sans mise au calibre).37 Un exemple de réimplantation avec effilage est fourni dans (Figure 4 et Figure 5).
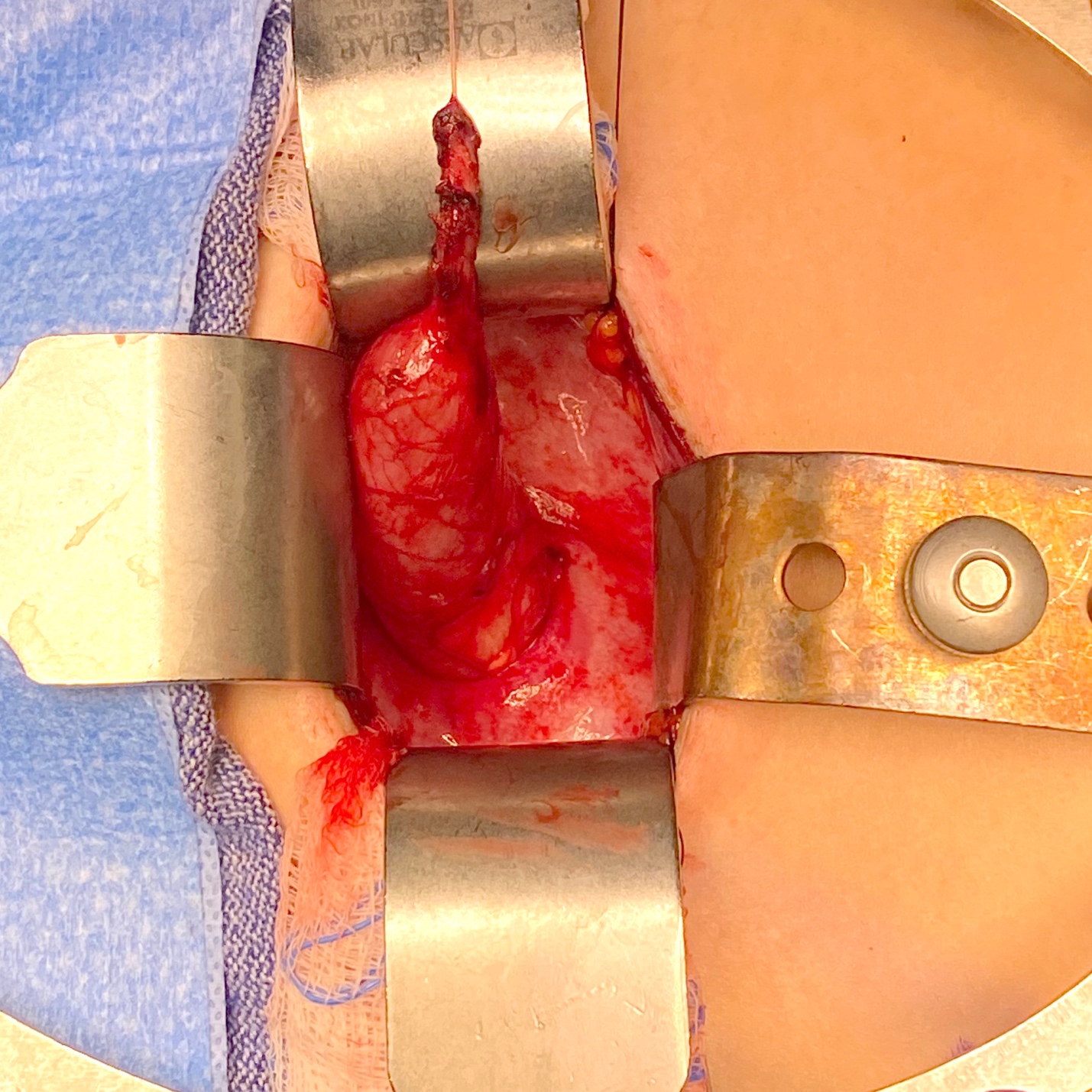
Figure 4 Vue peropératoire d’un méga-uretère avec segment apéristaltique et dilatation proximale.
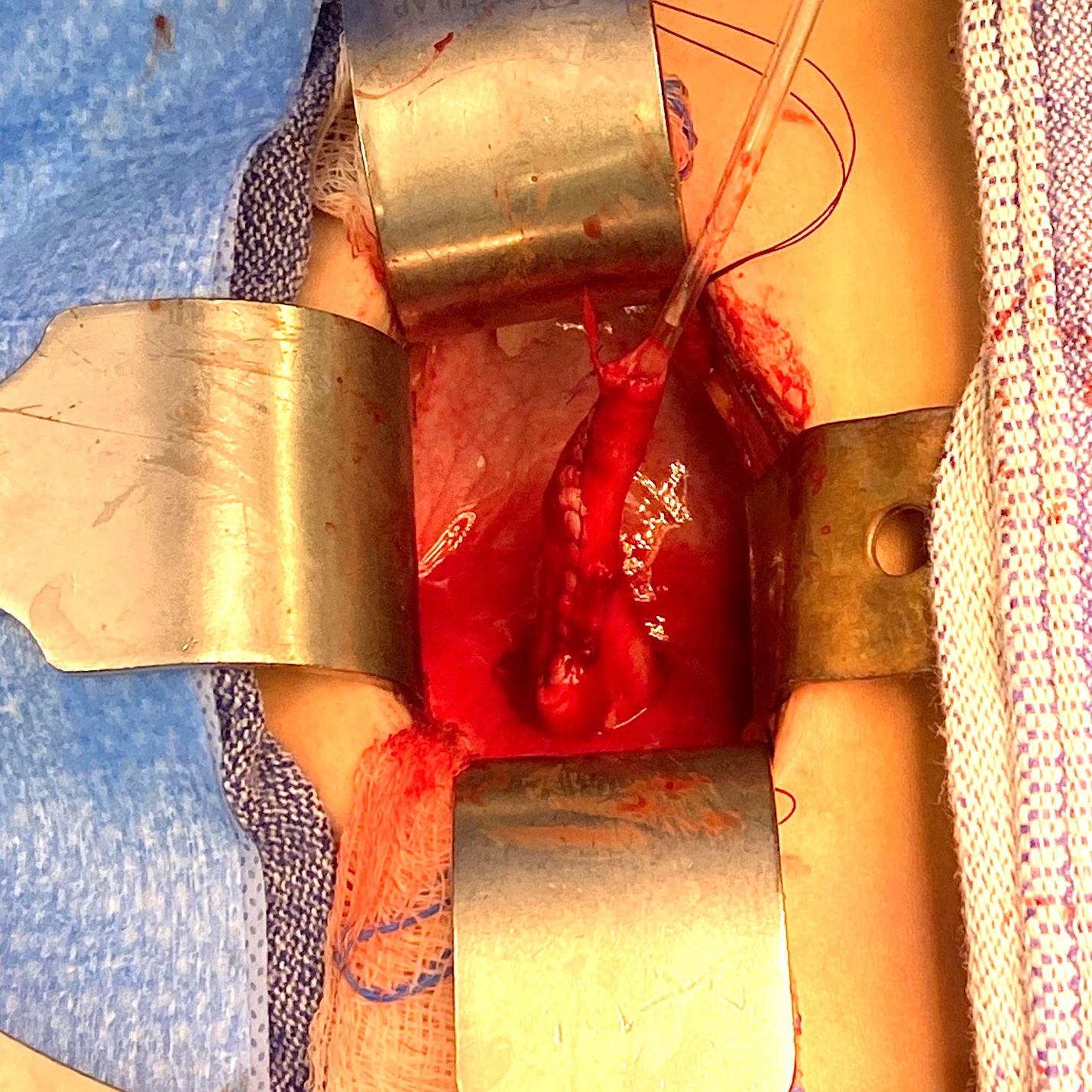
Figure 5 Vue peropératoire du même uretère que dans la Figure 4 après effilage sur une sonde de 10 Fr. L’uretère a ensuite été réimplanté après création d’un tunnel trans-trigonal, en le faisant passer à travers ce tunnel puis en le fixant. Une endoprothèse urétérale a été laissée en place pendant 2 semaines.
Une réimplantation extravésicale de Lich–Gregoir est couramment préférée lorsque des techniques laparoscopiques ou assistées par robot (RALUR) sont utilisées.38,39,40 L’uretère dilaté est identifié sous les vaisseaux iliaques, et le péritoine est disséqué le long de l’uretère jusqu’au niveau du croisement avec le canal déférent. L’uretère est mobilisé par dissection émoussée afin de minimiser le risque de lésions de l’innervation et de la vascularisation, puis sectionné au niveau de la sténose. Le tunnel séro-musculaire est délimité à l’aide d’une électrocoagulation au crochet, puis les fibres du détrusor sont sectionnées nettement aux ciseaux jusqu’à ce que la muqueuse vésicale bombe librement. La muqueuse vésicale est ouverte à l’extrémité du tunnel et l’anastomose urétérovésicale est réalisée avec des sutures interrompues. L’uretère est ensuite mis en place dans le tunnel, qui est rapproché par des sutures continues ou interrompues.
Les taux de résolution du RVU après RALUR extravésicale rapportés dans la littérature varient de 66.7 à 100% dans plusieurs séries relativement petites.40 Le succès global après mise en commun de ces séries est de 91%. Une étude rétrospective multi-institutionnelle a rapporté une résolution radiographique dans 87.9% de 280 uretères. Plus récemment, une grande étude prospective multi-institutionnelle a rapporté 93.8% de résolution dans 199 uretères.40 La RALUR peut être réalisée de façon bilatérale; toutefois, il existe une crainte que la dissection bilatérale de la face postérieure de la vessie puisse perturber le plexus nerveux pelvien, entraînant des taux plus élevés de rétention urinaire postopératoire. Une dissection avec épargne nerveuse a été proposée pour réduire cette complication. En 2008, Casale et al ont rapporté un taux de succès de 97.6% après une RALUR bilatérale avec épargne nerveuse chez 41 patients.41 Il n’y a eu aucune complication ni cas de rétention urinaire. Herz et al ont rapporté un taux de succès de 91.7% pour la RALUR unilatérale mais seulement 77.8% des uretères (72.2% des enfants) pour les cas bilatéraux. Dans cette étude, les taux de complications (incluant l’obstruction urétérale, la réadmission et la rétention urinaire) étaient plus élevés pour les cas bilatéraux. Une technique d’épargne nerveuse n’a pas été utilisée.42
La réimplantation urétérale chez les nourrissons de moins d’un an peut être délicate en raison de la discordance entre l’uretère fortement dilaté et la petite vessie infantile, ainsi que de la crainte d’une dysfonction vésicale iatrogène éventuelle. De Jong et al ont étudié le résultat fonctionnel vésical de 49 nouveau-nés et nourrissons présentant des méga-uretères primaires obstructifs ou refluxifs, ayant bénéficié d’une intervention de Politano-Leadbetter, avec un suivi moyen de 7,3 ans.43 Aucune apparition de dysfonction mictionnelle n’a été notée au suivi, et la capacité vésicale pour l’âge était significativement augmentée. Aucune obstruction urétérale postopératoire n’a été observée. L’auteur a conclu que les reconstructions majeures précoces des voies urinaires basses n’altèrent pas les propriétés urodynamiques de la vessie et du plancher pelvien, à condition que la chirurgie soit réalisée par des chirurgiens urologues pédiatriques spécialisés. Une autre étude du même groupe 41 a comparé les résultats urodynamiques chez des patients ayant subi une réimplantation urétérale avant ou après l’âge d’un an. Aucune différence significative de capacité vésicale, de compliance ou d’incidence de l’instabilité n’a été trouvée.44
Pose temporaire d’une sonde JJ
En 1999, Shenoy et Rance ont rapporté l’utilisation de sondes JJ comme mesure de temporisation chez les nourrissons présentant des mégauretères obstructifs primitifs.45 La procédure consiste à insérer une sonde double J, par voie endoscopique lorsque c’est possible. Une obstruction serrée de la jonction urétéro-vésicale peut empêcher l’introduction endoscopique, auquel cas une mise en place par voie ouverte via une cystostomie, associée à une dilatation de l’orifice urétéral à l’aide d’une sonde lacrymale, peut être réalisée. Les sondes sont homologuées pour rester in situ pendant six mois, au terme desquels elles doivent être retirées ou remplacées. Le mégauretère doit rester drainé par une sonde JJ jusqu’à ce que l’enfant ait plus d’un an, moment auquel une réimplantation urétérale peut être réalisée en toute sécurité si la dilatation ne s’est pas résolue.45 L’enfant doit rester sous antibioprophylaxie tant que la sonde est en place, en raison du risque d’infection de la sonde, et doit être surveillé par échographie afin de s’assurer de la décompression du système et de vérifier la position de la sonde.46 Une échographie et une rénographie au MAG-3 réalisées trois mois après le retrait de la sonde orienteront la suite de la prise en charge. En présence d’une amélioration de la dilatation et du drainage, et d’une fonction préservée, il se peut qu’aucune autre intervention ne soit nécessaire. La persistance ou l’aggravation de la dilatation après une période de sondage JJ, ou la survenue d’une nouvelle infection, constitue une indication de réimplantation urétérale. Une étude des résultats à long terme a révélé que dans 56% des cas, aucune autre intervention n’était requise après le retrait de la sonde. Cependant, deux tiers des patients ont nécessité une mise en place de la sonde par voie ouverte, et un tiers a présenté des complications (migration, formation de calculs et infection).47
Dilatation endoscopique par ballonnet
La prise en charge endoscopique est désormais reconnue comme une option thérapeutique moins invasive. Les avantages de l’approche endoscopique comprennent un abord minimalement invasif, l’absence de manipulation de la vascularisation de l’uretère distal et l’absence de nécessité de cathétérisation prolongée.48 De plus, en cas d’échec de la prise en charge endoscopique, une réimplantation urétérale reste possible. Toutefois, la nécessité potentielle d’une seconde anesthésie pour le retrait de la sonde doit être prise en compte dans les discussions concernant les risques de l’approche endoscopique. La procédure est réalisée à l’aide d’un cystoscope rigide pédiatrique (8F–10.5F) et un fil-guide souple est monté jusqu’au bassinet rénal. Pour la dilatation au ballonnet haute pression (HPBD), un cathéter à ballonnet (habituellement 3F–5F, longueur du ballon 2–4 cm, diamètre du ballon gonflé 3–7 mm) est utilisé pour dilater la jonction urétérovésicale, suivi de la mise en place d’une sonde urétérale Double-J. Pour l’uréterotomie incisionnelle, Kajbafzadeh et al et Shirazi et et al réalisent des incisions à 6 heures.49,50,51
Doudt et al ont publié une revue systématique des résultats à long terme de la prise en charge endoscopique.48 Onze séries de cas rétrospectives et 1 prospective, monocentriques, ont été analysées. L’âge moyen au moment de la chirurgie était de 24.6 mois (intervalle 3–84). Les tentatives initiales de prise en charge endoscopique n’ont pas été efficaces dans 10.5%, soit en raison d’une impossibilité de faire passer le stent par voie endoscopique, soit en raison de difficultés de progression du cystoscope pédiatrique à travers l’urètre. Les approches endoscopiques menées à bien étaient cystoscopie+dilatation au ballonnet à haute pression (HPBD)+ pose d’un stent urétéral en Double-J dans 49.5%, cystoscopie+urétérotomie incisionnelle+pose d’un stent urétéral en Double-J dans 27.8%, cystoscopie+pose d’un stent urétéral en Double-J dans 18.9% et cystoscopie+HPBD+ urétérotomie incisionnelle+pose d’un stent urétéral en Double-J dans 3.7%. La durée moyenne de maintien du stent était de 2.3 mois (intervalle 0.25–6). Avec un suivi moyen de 3.2 ans, le taux de succès initial était de 76.7%. Une reprise endoscopique a été réalisée dans 15.1% des cas, avec un taux global de réintervention chirurgicale de 36.7%. Les auteurs ont conclu que la prise en charge endoscopique du POM persistant ou progressif chez les enfants >12 mois constitue une alternative mini-invasive à la réimplantation urétérale avec des taux de succès modestes. Chez le nourrisson, elle peut être mieux utilisée comme procédure de temporisation. Environ un tiers des patients nécessitent une réintervention chirurgicale.48
Réimplantation refluxante
Kaefer a proposé une approche novatrice pour la prise en charge des méga-uretères obstructifs chez les nourrissons, réalisée en deux temps.52 Le premier temps lève l’obstruction sans se soucier de créer un mécanisme antireflux, en se contentant de sectionner l’uretère en amont de l’obstruction et de réaliser une anastomose termino-latérale refluxante à la vessie; puis, à mesure que la taille vésicale augmente au cours de la petite enfance, le second temps est réalisé, une réimplantation urétéro-vésicale standard avec effilement et création d’un mécanisme valvulaire antireflux.52,53 Alyami et al ont publié leur expérience avec l’approche de réimplantation refluxante chez 32 patients présentant une obstruction urétérale distale diagnostiquée en anténatal.54 L’âge moyen au moment de la chirurgie était de 3,7 mois (intervalle 0 à 33) et la durée moyenne de suivi était de 34,3 mois (intervalle 6 à 58). Une circoncision a également été réalisée chez la plupart des garçons. Sur 32 patients, 86 % ont montré une amélioration significative de la dilatation. Six patients ont subi des interventions supplémentaires, notamment une circoncision et 2 réimplantations urétéro-vésicales pour des infections récidivantes. Les auteurs ont conclu que, malgré le compromis consistant à lever l’obstruction au prix d’un reflux, cette procédure peut être considérée comme une intervention potentiellement définitive chez les patients qui restent indemnes d’infection. Un suivi rapproché est essentiel pour documenter des résultats satisfaisants à long terme.54
Urétérostomie cutanée
Une urétérostomie cutanée temporaire reste une option sûre et efficace, surtout en cas d’urosepsis, ou lorsque la technologie endoscopique n’est pas disponible. Shrestha et al ont publié les résultats de 25 patients ayant subi une urétérostomie cutanée terminale (ECU) POM à un âge moyen de 7 mois (intervalle de 23 jours à 2,5 ans). Après la dérivation, l’insuffisance rénale s’était résolue chez tous, et une infection des voies urinaires fébrile (UTI) s’est développée chez un en attendant la réimplantation.55 Aucune complication stomiale n’a été rapportée dans cette étude, bien que d’autres aient rapporté des complications, notamment une sténose stomiale et une pyélonéphrite.56
Conclusion
Les anomalies de la jonction urétéro-vésicale (JUV), associées à un méga-uretère, peuvent être obstructives, refluxives, non obstructives et sans reflux, ou à la fois refluxives et obstructives. Seuls 10 à 20 % des méga-uretères nécessitent une intervention, tandis que les autres peuvent être surveillés de façon conservatrice. Les options chirurgicales comprennent la réimplantation urétéro-vésicale, avec ou sans réduction calibrée de l’uretère, des procédures endoscopiques, une urétéro-néocystostomie avec reflux ou une urétérostomie cutanée. La persistance d’une dilatation dans les méga-uretères non obstructifs et sans reflux justifie une surveillance en raison du risque à long terme de formation de calculs.
Points clés
- Attention au mégauretère refluxant et obstructif, rare : prenez note du drainage des voies excrétrices supérieures après la vidange vésicale lorsqu’un VUR de haut grade est diagnostiqué à la VCUG. En présence d’un drainage médiocre associé à une dilatation significative des voies excrétrices supérieures, une scintigraphie rénale au MAG-3 avec épreuve diurétique est indiquée. La réimplantation urétérale est la meilleure option dans cette situation.
- Les obstructions de l’UVJ et de l’UPJ peuvent coexister. Recherchez des discordances entre la dilatation du bassinet et celle de l’uretère, en particulier lorsque l’une semble s’améliorer alors que l’autre ne s’améliore pas. Examinez l’imagerie de scintigraphie rénale au MAG-3 pour vérifier le drainage aux deux jonctions. En cas de suspicion, une pyélographie rétrograde peut aider au diagnostic. Une stratégie chirurgicale pourrait être une pyéloplastie avec mise en place d’une sonde double J dans un premier temps, suivie d’une imagerie complémentaire après ablation de la sonde.
- Lorsque la prise en charge conservatrice d’un mégauretère non obstructif et non refluxant est entreprise, la littérature actuelle recommande une prophylaxie antibiotique pour une dilatation urétérale supérieure à 7 mm; le risque d’infection urinaire est maximal durant la première année de vie.
- Un suivi à long terme est recommandé lorsque la dilatation urétérale ne se résout pas pendant l’enfance, en raison du risque à long terme de formation de calculs ou de détérioration de la fonction rénale dans les cas bilatéraux.
Références
- Ferenci P, Lockwood A, Mullen K, Tarter R, Weissenborn K, Blei AT. Hepatic encephalopathy-Definition, nomenclature, diagnosis, and quantification: Final report of the Working Party at the 11th World Congresses of Gastroenterology, Vienna, 1998. Hepatology 1977; 35 (3): 716–721. DOI: 10.1053/jhep.2002.31250.
- King LR. Megaloureter: Definition, Diagnosis and Management. J Urol 1980; 123 (2): 222–223. DOI: 10.1016/s0022-5347(17)55867-x.
- Pfister RC, Hendren WH. Primary megaureter in children and adults Clinical and pathophysiologic features of 150 ureters. Urology 1978; 12 (2): 160–176. DOI: 10.1016/0090-4295(78)90327-8.
- Liu HYA, Dhillon HK, Yeung CK, Diamond DA, Duffy PG, Ransley PG. Clinical Outcome and Management of Prenatally Diagnosed Primary Megaureters. J Urol 1994; 152 (2 Part 2): 614–617. DOI: 10.1016/s0022-5347(17)32664-2.
- Cussen LJ. Normal Position of the Ureteral Orifice in Infancy and Childhood: A Quantitative Study. J Urol 1967; 121 (5): 646–647. DOI: 10.1016/s0022-5347(17)56920-7.
- Hellström M, Hjälmås K, Jacobsson B, Jodal U, Odén A. Normal Ureteral Diameter in Infancy and Childhood. Acta Radiol Diagn (Stockh) 1985; 26 (4): 433–439. DOI: 10.1177/028418518502600412.
- Stahl DA, Koul HK, Chacko JK, Mingin GC. Congenital anomalies of the kidney and urinary tract (CAKUT): A current review of cell signaling processes in ureteral development. J Pediatr Urol 2006; 2 (1): 2–9. DOI: 10.1016/j.jpurol.2005.04.006.
- Woolf AS. A molecular and genetic view of human renal and urinary tract malformations. Kidney Int 2000; 58 (2): 500–512. DOI: 10.1046/j.1523-1755.2000.00196.x.
- Takahashi M. The GDNF/RET signaling pathway and human diseases. Cytokine Growth Factor Rev 2001; 12 (4): 361–373. DOI: 10.1016/s1359-6101(01)00012-0.
- Batourina E, Choi C, Paragas N, Bello N, Hensle T, Costantini FD. Faculty Opinions recommendation of Distal ureter morphogenesis depends on epithelial cell remodeling mediated by vitamin A and Ret. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2002; 32. DOI: 10.3410/f.1009006.124259.
- Viana R, Batourina E, Huang H, Dressler GR, Kobayashi A, Behringer RR, et al.. The development of the bladder trigone, the center of the anti-reflux mechanism. Development 2007; 134 (20): 3763–3769. DOI: 10.1242/dev.011270.
- Batourina E, Tsai S, Lambert S, Sprenkle P, Viana R, Dutta S. Faculty Opinions recommendation of Apoptosis induced by vitamin A signaling is crucial for connecting the ureters to the bladder. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2005; 37. DOI: 10.3410/f.1029077.343528.
- Pirker ME, Rolle U, Shinkai T, Shinkai M, Puri P. Prenatal and Postnatal Neuromuscular Development of the Ureterovesical Junction. J Urol 2007; 177 (4): 1546–1551. DOI: 10.1016/j.juro.2006.11.081.
- Matsuno T, Tokunaka S, Koyanagi T. Muscular Development in the Urinary Tract. J Urol 1984; 132 (1): 148–152. DOI: 10.1016/s0022-5347(17)49508-5.
- Tanagho EA, Meyers FH, Smith DR. The Trigone: Anatomical and Physiological Considerations. 1. In Relation to the Ureterovesical Junction. J Urol 1968; 100 (5): 623–632. DOI: 10.1016/s0022-5347(17)62584-9.
- Tanagho EA. Intrauterine Fetal Ureteral Obstruction. J Urol 1973; 109 (2): 196–203. DOI: 10.1016/s0022-5347(17)60388-4.
- Lee BR, Silver RI, Partin AW, Epstein JI, Gearhart JP. A Quantitative Histologic Analysis of Collagen Subtypes: The Primary Obstructed and Refluxing Megaureter of Childhood. Urology 1998; 51 (5): 820–823. DOI: 10.1016/s0090-4295(98)00013-2.
- Nguyen HT, Herndon CDA, Cooper C, Gatti J, Kirsch A, Kokorowski P. The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis. Yearbook of Urology 2010; 2010: 209. DOI: 10.1016/s0084-4071(10)79537-3.
- Rubenwolf P, Herrmann-Nuber J, Schreckenberger M, Stein R, Beetz R. Primary non-refluxive megaureter in children: single-center experience and follow-up of 212 patients. Int Urol Nephrol 2016; 48 (11): 1743–1749. DOI: 10.1007/s11255-016-1384-y.
- Farrugia M-K, Hitchcock R, Radford A, Burki T, Robb A, Murphy F. British Association of Paediatric Urologists consensus statement on the management of the primary obstructive megaureter. J Pediatr Urol 2014; 10 (1): 26–33. DOI: 10.1016/j.jpurol.2013.09.018.
- Holzman SA, Braga LH, Zee RS, Herndon CDA, Davis-Dao CA, Kern NG. Correspondence to the article ‘risk of urinary tract infection in patients with hydroureter: an analysis from the society of fetal urology prenatal hydronephrosis registry.’ J Pediatr Urol 2021; 18 (5): 722–723. DOI: 10.1016/j.jpurol.2022.07.031.
- Nguyen HT, Benson CB, Bromley B, Campbell JB, Chow J, Coleman B. Faculty Opinions recommendation of Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2014; 10: 982–998. DOI: 10.3410/f.725257762.793506733.
- Gordon I, Piepsz A, Sixt R. Guidelines for standard and diuretic renogram in children. Eur J Nucl Med Mol Imaging 2011; 38 (6): 1175–1188. DOI: 10.1007/s00259-011-1811-3.
- Gordon I. Diuretic renography in infants with prenatal unilateral hydronephrosis: an explanation for the controversy about poor drainage. BJU Int 2001; 87 (6): 551–555. DOI: 10.1046/j.1464-410x.2001.00081.x.
- McLELLAN DAWNL, RETIK ALANB, BAUER STUARTB, DIAMOND DAVIDA, ATALA ANTHONY, MANDELL JAMES, et al.. Rate and Predictors of Spontaneous Resolution of Prenatally Diagnosed Primary Nonrefluxing Megaureter. J Urol 2002: 2177–2180. DOI: 10.1097/00005392-200211000-00091.
- CAY ALI, IMAMOGLU MUSTAFA, BAHAT ELIF, SARIHAN HALUK. Diagnostic difficulties in children with coexisting pelvi-ureteric and vesico-ureteric junction obstruction. BJU Int 2006; 98 (1): 177–182. DOI: 10.1111/j.1464-410x.2006.06187.x.
- Peters CA, Mandell J, Lebowitz RL, Colodny AH, Bauer SB, Hendren WH. Congenital obstructed megaureters in early infancy: Diagnosis and treatment. J Pediatr Surg 1989; 25 (5): 576. DOI: 10.1016/0022-3468(90)90639-q.
- Keating MA, Escala J, Snyder HMC, Heyman S, Duckett JW. Changing Concepts in Management of Primary Obstructive Megaureter. J Urol 1989; 142 (2 Part 2): 636–640. DOI: 10.1016/s0022-5347(17)38841-9.
- Baskin LS, Zderic SA, Snyder HM, Duckett JW. Primary Dilated Megaureter: Long-Term Followup. J Urol 1994; 152 (2 Part 2): 618–621. DOI: 10.1016/s0022-5347(17)32665-4.
- Song S-H, Lee S-B, Park YS, Kim KS. Is Antibiotic Prophylaxis Necessary in Infants With Obstructive Hydronephrosis? J Urol 2007; 177 (3): 1098–1101. DOI: 10.1016/j.juro.2006.11.002.
- SHUKLA ASEEMR, COOPER JEFFREY, PATEL RAKESHP, CARR MICHAELC, CANNING DOUGLASA, ZDERIC STEPHENA, et al.. Prenatally Detected Primary Megaureter: A Role For Extended Followup. J Urol 2005; 173 (4): 1353–1356. DOI: 10.1097/01.ju.0000152319.72909.52.
- Hemal AK, Ansari MS, Doddamani D, Gupta NP. Symptomatic and complicated adult and adolescent primary obstructive megaureter–indications for surgery: analysis, outcome, and follow-up. Urology 2003; 61 (4): 703–707. DOI: 10.1016/s0090-4295(02)02590-6.
- Paquin AJ. Ureterovesical Anastomosis: the Description and Evaluation of a Technique. J Urol 1959; 82 (5): 573–583. DOI: 10.1016/s0022-5347(17)65934-2.
- Villanueva CA. Extracorporeal ureteral tailoring during HIDES laparoscopic robotic-assisted ureteral reimplantation for megaureter. J Pediatr Urol 1979; 11 (6): 362–363. DOI: 10.1016/j.jpurol.2015.08.006.
- Kaliciński ZH, Kansy J, Kotarbińska B, Joszt WLELA. Surgery of megaureters–Modification of Hendren’s operation. J Pediatr Surg 1977; 12 (2): 183–188. DOI: 10.1016/s0022-3468(77)80005-5.
- Hendren WH. Operative Repair of Megaureter in Children. J Urol 1969; 101 (4): 491–507. DOI: 10.1016/s0022-5347(17)62370-x.
- Ben-Meir D, McMullin N, Kimber C, Gibikote S, Kongola K, Hutson JM. Reimplantation of obstructive megaureters with and without tailoring. J Pediatr Urol 2006; 2 (3): 178–181. DOI: 10.1016/j.jpurol.2005.05.010.
- Stanasel I, Atala A, Hemal A. Robotic Assisted Ureteral Reimplantation: Current Status. Curr Urol Rep 2013; 14 (1): 32–36. DOI: 10.1007/s11934-012-0298-1.
- LEE S, AKBAL C, KAEFER M, Chertin B, Pollack A, Koulikov D. Laparoscopic Ureteral Reimplantation With Extracorporeal Tailoring for Megaureter: A Simple Technical Nuance. J Urol 2006; 176 (6): 2640–2642. DOI: 10.1016/j.juro.2006.08.025.
- Bilgutay AN, Kirsch AJ. Robotic Ureteral Reconstruction in the Pediatric Population. Front Pediatr 2019; 7. DOI: 10.3389/fped.2019.00085.
- Casale P, Patel RP, Kolon TF. Nerve Sparing Robotic Extravesical Ureteral Reimplantation. J Urol 2008; 179 (5): 1987–1990. DOI: 10.1016/j.juro.2008.01.062.
- Herz D, Fuchs M, Todd A, McLeod D, Smith J. Robot-assisted laparoscopic extravesical ureteral reimplant: A critical look at surgical outcomes. J Pediatr Urol 2016; 12 (6): 402.e1–402.e9. DOI: 10.1016/j.jpurol.2016.05.042.
- Nelson CP. Obstructing congenital anomalies of the urinary tract: ureteropelvic junction obstruction, ureterocele, megaureter, and posterior urethral valves. The Brady Urology Manual 1997; 65: 207–220. DOI: 10.1201/9780429194993-21.
- KORT LAETITIAMO de, KLIJN AARTJ, UITERWAAL CUNOSPM, JONG TOMPVM de. Ureteral Reimplantation In Infants And Children: J Urol 2002; 167: 285–287. DOI: 10.1097/00005392-200201000-00084.
- Shenoy, Rance. Is there a place for the insertion of a JJ stent as a temporizing procedure for symptomatic partial congenital vesico-ureteric junction obstruction in infancy? BJU Int 1999; 84 (4): 524–525. DOI: 10.1046/j.1464-410x.1999.00256.x.
- Farrugia M-K, Steinbrecher HA, Malone PS. The utilization of stents in the management of primary obstructive megaureters requiring intervention before 1 year of age. J Pediatr Urol 2011; 7 (2): 198–202. DOI: 10.1016/j.jpurol.2010.04.015.
- Farrugia MK, Steinbrecher HA, Malone PS. Re: The Utilization of Stents in the Management of Primary Obstructive Megaureters Requiring Intervention Before 1 Year of Age. J Urol 2011; 186 (5): 2063–2063. DOI: 10.1016/j.juro.2011.07.142.
- Doudt AD, Pusateri CR, Christman MS. Endoscopic Management of Primary Obstructive Megaureter: A Systematic Review. J Endourol 2018; 32 (6): 482–487. DOI: 10.1089/end.2017.0434.
- Kajbafzadeh A-M, Payabvash S, Salmasi AH, Arshadi H, Hashemi S-M, Arabian S, et al.. Endoureterotomy for Treatment of Primary Obstructive Megaureter in Children. J Endourol 2007; 21 (7): 743–749. DOI: 10.1089/end.2006.0330.
- Tourchi A, Kajbafzadeh AM, Mazaheri T, Raad M. Endoscopic Management of Obstructive Refluxing Megaureter: a Novel Approach. J Pediatr Urol 2010; 6: S62. DOI: 10.1016/j.jpurol.2010.02.110.
- Shirazi M, Natami M, Hekmati P, Farsiani M. Result of Endoureterotomy in the Management of Primary Obstructive Megaureter in the First Year of Life: Preliminary Report. J Endourol 2014; 28 (1): 79–83. DOI: 10.1089/end.2013.0098.
- LEE SANGDON, AKBAL CEM, KAEFER MARTIN. Refluxing Ureteral Reimplant As Temporary Treatment Of Obstructive Megaureter In Neonate And Infant. J Urol 2005; 173 (4): 1357–1360. DOI: 10.1097/01.ju.0000152317.72166.df.
- Kaefer M, Misseri R, Frank E, Rhee A, Lee D. Re: Refluxing Ureteral Reimplantation: A Logical Method for Managing Neonatal UVJ Obstruction. J Urol 2014; 194 (2): 518–518. DOI: 10.1016/j.juro.2015.05.043.
- Alyami FA, Koyle MA, Bowlin PR, Gleason JM, Braga LH, Lorenzo AJ. Side-to-Side Refluxing Nondismembered Ureterocystotomy: A Novel Strategy to Address Obstructed Megaureters in Children. J Urol 2017; 198 (5): 1159–1167. DOI: 10.1016/j.juro.2017.05.078.
- Shrestha AL, Bal HS, Kisku SMC, Sen S. Commentary to “Outcome of end cutaneous ureterostomy (ECU) as a non conservative option in the management of primary obstructive megaureters (POM).” J Pediatr Urol 2018; 15 (3): 294–295. DOI: 10.1016/j.jpurol.2019.02.024.
- Kitchens DM, DeFoor W, Minevich E, Reddy P, Polsky E, McGregor A, et al.. End Cutaneous Ureterostomy for the Management of Severe Hydronephrosis. J Urol 2007; 177 (4): 1501–1504. DOI: 10.1016/j.juro.2006.11.076.
Dernière mise à jour: 2025-09-22 07:59