16: Reflux vésico-urétéral
Ce chapitre prendra environ 39 minutes de lecture.
Introduction
Le reflux vésico-urétéral (RVU) est le flux rétrograde d’urine de la vessie vers les uretères et parfois vers les reins. Le RVU est un facteur de risque de pyélonéphrite récidivante, de cicatrices rénales, d’insuffisance rénale et d’hypertension artérielle et il est cité comme une cause d’insuffisance rénale terminale chez les enfants.1,2,3,4 La prise en charge du reflux vise principalement à réduire la survenue de ces effets indésirables à long terme par la prévention de la pyélonéphrite.
Un changement de paradigme dans l’évaluation et la prise en charge du RVU est survenu au cours des dernières décennies, et les cliniciens doivent être conscients des controverses entourant la prise en charge du RVU. Il semble que le traitement actif du reflux ait amélioré les résultats pour certains enfants, de sorte que l’incidence de la néphropathie associée au reflux continue de diminuer, mais la littérature urologique récente suggère que l’histoire naturelle du RVU ne suit pas une trajectoire uniforme. De nombreux enfants présentant un reflux ne tirent bénéfice ni du diagnostic ni du traitement, car le taux de résolution spontanée sans effets indésirables est élevé.5,6 Déterminer quels enfants bénéficient réellement du traitement constitue le principal défi pour les progrès de la prise en charge du reflux vésico-urétéral.
Contexte, incidence et physiopathologie
Le RVU survient chez environ 1 à 3 % des enfants, et il est rapporté que 2,3 % des patients présentant une IRCT incidente âgés de 0 à 21 ans aux États-Unis ont un diagnostic principal attribué à une néphropathie de reflux. L’incidence de l’IRCT dont l’étiologie principale est une néphropathie de reflux a diminué de façon régulière au cours des vingt dernières années.7 Des études internationales antérieures ont estimé une prévalence plus élevée, d’environ 10 %.5,8
Bien que des références anatomiques à la notion de reflux aient été formulées dès le Ier siècle apr. J.-C., des études déterminantes dans les années 1950 ont, pour la première fois, contribué à notre compréhension de l’association entre le RVU, la pyélonéphrite chronique et les cicatrices rénales telle que nous la concevons aujourd’hui.9,10
Le RVU peut être classé en primaire ou secondaire. Le RVU primaire est dû à une portion intramurale anormalement courte de l’uretère s’engageant en tunnel à travers le muscle détrusor au niveau de la jonction urétérovésicale. Dans une jonction normale, l’uretère intramural est comprimé passivement pendant le remplissage vésical, créant un mécanisme antireflux. Ce mécanisme dépend du rapport longueur/diamètre de la portion intramurale et de l’angle d’insertion urétérovésical.11
Un tunnel intravésical court est associé au RVU, et la longueur du tunnel est inversement proportionnelle à la gravité du reflux.12
Le RVU secondaire se développe lorsque des troubles de la fonction des voies urinaires inférieures et des pressions intravésicales élevées dépassent le mécanisme antireflux et est associé à des affections telles qu’une obstruction de la voie d’évacuation vésicale (p. ex., valve urétrale postérieure) ou une vessie neurologique. Le RVU secondaire peut également être observé chez des enfants ne présentant pas d’anomalie anatomique génito-urinaire ou neurologique, mais souffrant d’une dysfonction vésico-intestinale.13 La cause la plus fréquente de reflux secondaire est la dysfonction vésico-intestinale non neurologique, qui constitue également l’un des facteurs de risque les plus importants d’infections urinaires d’échappement.
Hérédité
Le RVU primaire présente un fort caractère héréditaire, avec jusqu’à 80 % des jumeaux monozygotes et 35 % des jumeaux dizygotes concordants pour la présence de RVU.2 De multiples polymorphismes associés à des anomalies du bourgeonnement urétéral ont été identifiés chez des patients atteints de RVU primaire, bien qu’aucun gène unique n’ait été identifié comme prédominant.14 La probabilité qu’un membre de la fratrie non jumeau présente un RVU est d’environ 25 % et le risque pour la descendance d’avoir un RVU est approximativement de 35 à 50 %.15,16 Fait intéressant, cette relation n’est pas aussi forte chez les enfants présentant une dysfonction de l’élimination, ce qui plaide probablement pour la nature secondaire du RVU dans cette cohorte.17
Reflux vésico-urétéral, infections des voies urinaires et cicatrices rénales
L’importance clinique du RVU tient largement à son association avec la dysplasie rénale congénitale ainsi qu’aux lésions du parenchyme rénal secondaires à des pyélonéphrites récidivantes. Au moins un tiers des patients atteints de RVU présentent des cicatrices rénales.18,19 La présence de cicatrices implique des zones de lésions rénales et augmente le risque de séquelles défavorables à long terme.
Néphropathie de reflux congénitale
Chez les nouveau-nés atteints de RVU, des cicatrices ont été détectées en association avec un reflux de haut grade avant la survenue d’une infection urinaire clinique.20 Ces « cicatrices congénitales » seraient des zones de dysplasie ou d’hypoplasie focales résultant d’une néphrogenèse anormale, par opposition à des lésions de tissu normal consécutives à une pyélonéphrite. La dysplasie rénale congénitale peut être indiscernable des cicatrices rénales acquises secondaires à une infection. Les scintigraphies au DMSA n’étant pas réalisées en routine chez les nouveau-nés, on ignore quelle proportion des cicatrices rénales attribuées à une atteinte infectieuse est en réalité due à des anomalies de l’embryogenèse.21 Bien que l’étiologie ultime demeure incertaine, il s’agit de régions de fonction rénale diminuée et elles peuvent être associées à une morbidité et une mortalité significatives, indépendamment du développement de cicatrices rénales liées à l’infection.22
Pyélonéphrite et cicatrices rénales
Les infections urinaires sont fréquentes chez les enfants, touchant environ 5 % des filles et environ la moitié de ce taux chez les garçons.23 On estime que 30-40 % des enfants de moins de 5 ans qui développent des infections urinaires présentent un reflux vésico-urétéral (RVU) lors d’une évaluation complémentaire.24,25 La formation de cicatrices rénales surviendrait lorsque l’urine infectée est au contact du parenchyme rénal, provoquant une réaction inflammatoire ; elle a été associée à un risque accru d’hypertension artérielle, de protéinurie et d’insuffisance rénale.3,26
Le RVU, en tant que facteur prédisposant aux lésions rénales dues à l’infection, a été reconnu pour la première fois chez des patients atteints d’une lésion de la moelle épinière. Après correction chirurgicale, ces enfants ont présenté moins d’épisodes de pyélonéphrite et d’urosepsie.27 Des études ultérieures ont montré un taux plus faible de survenue de nouvelles cicatrices rénales chez les enfants présentant un RVU primaire, comparativement à ceux avec un RVU secondaire lié à une vessie neurogène ou à une dysfonction mictionnelle.28,29
Les atteintes rénales permanentes résultant d’une pyélonéphrite peuvent être identifiées sous forme de cicatrices rénales à la scintigraphie au 99mTc acide dimercaptosuccinique (DMSA). Dans une méta-analyse examinant la présence de lésions rénales chez des enfants hospitalisés pour infection urinaire, environ 34 % des enfants atteints de pyélonéphrite présentaient un RVU et, parmi ceux présentant un RVU et une pyélonéphrite, 72 % avaient une scintigraphie DMSA anormale.30
Les cicatrices rénales peuvent être détectées à la scintigraphie nucléaire pendant ou peu de temps après un épisode aigu de pyélonéphrite. Les séquelles des cicatrices rénales peuvent ne pas devenir apparentes pendant de nombreuses années; des délais allant jusqu’à 30 à 40 ans ont été rapportés entre la première pyélonéphrite avec cicatrisation rénale et la survenue d’une hypertension artérielle ou d’une insuffisance rénale terminale.27 La durée prolongée entre l’agression rénale initiale apparente et les effets cliniquement apparents souligne la nécessité d’un suivi à long terme des patients atteints de RVU.
Classification du reflux et autres facteurs prédictifs des résultats
Étant donné qu’il existe un taux élevé de résolution spontanée du RVU chez la plupart des enfants, mais des séquelles cliniques potentiellement dévastatrices chez d’autres, identifier ceux qui sont le plus à risque constitue un objectif primordial de la prise en charge du RVU. L’International Reflux Study a classé le RVU selon une échelle à 5 niveaux définie par le degré de reflux urinaire rétrograde et la déformation concomitante du système pyélocaliciel (Figure 1)31 Les grades plus élevés sont associés à une diminution des taux de résolution spontanée et à une augmentation de la prévalence des cicatrices rénales.23,32
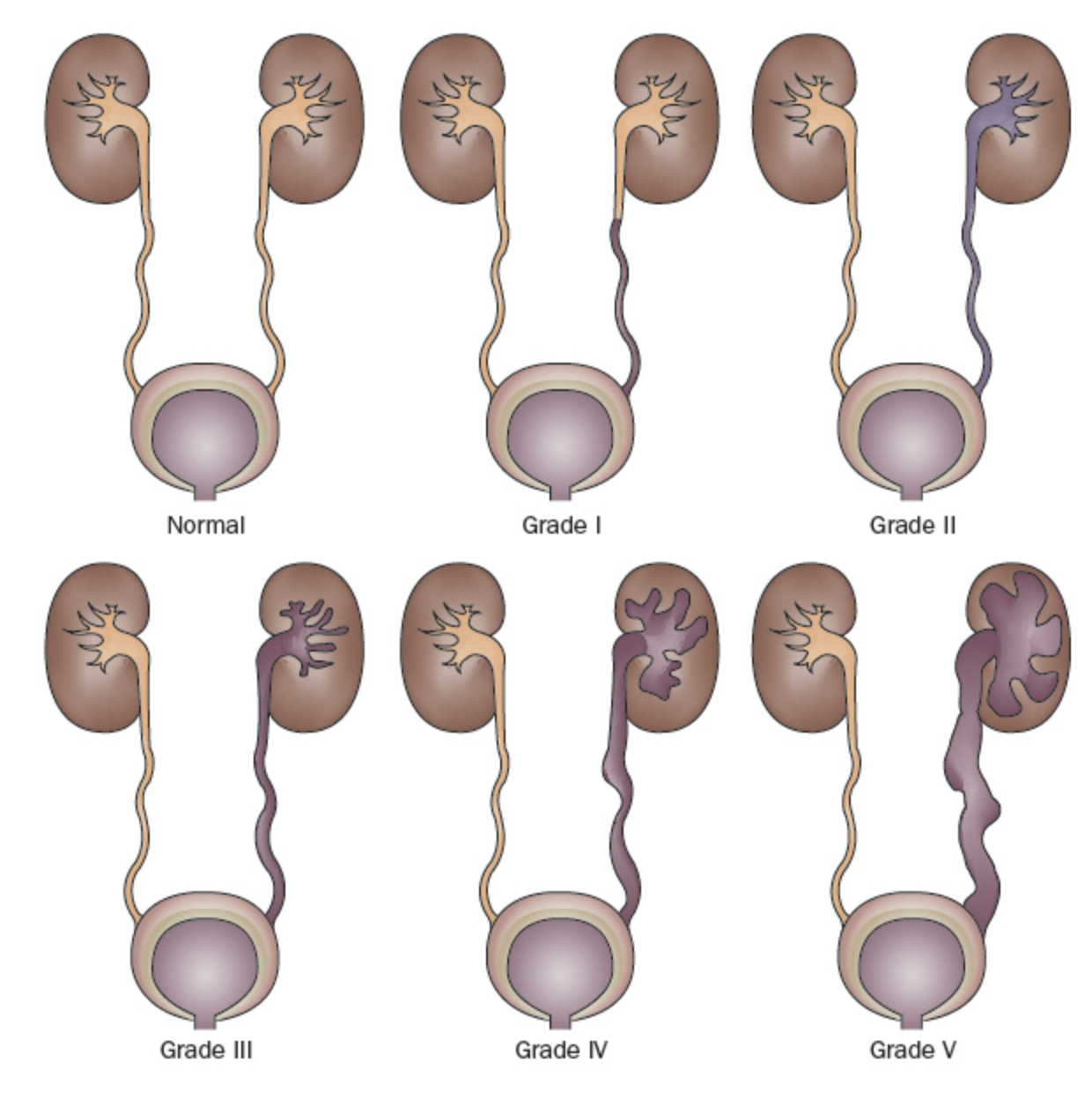
Figure 1 Système international de classification du reflux.31
- Grade I: reflux uniquement dans l’uretère
- Grade II: reflux dans un système pyélocaliciel non dilaté
- Grade III: dilatation du système collecteur (Figure 2)
- Grade IV: dilatation plus étendue avec émoussement des calices et tortuosité de l’uretère (Figure 3)
- Grade V: dilatation massive du système collecteur et tortuosité sévère de l’uretère (Figure 4)
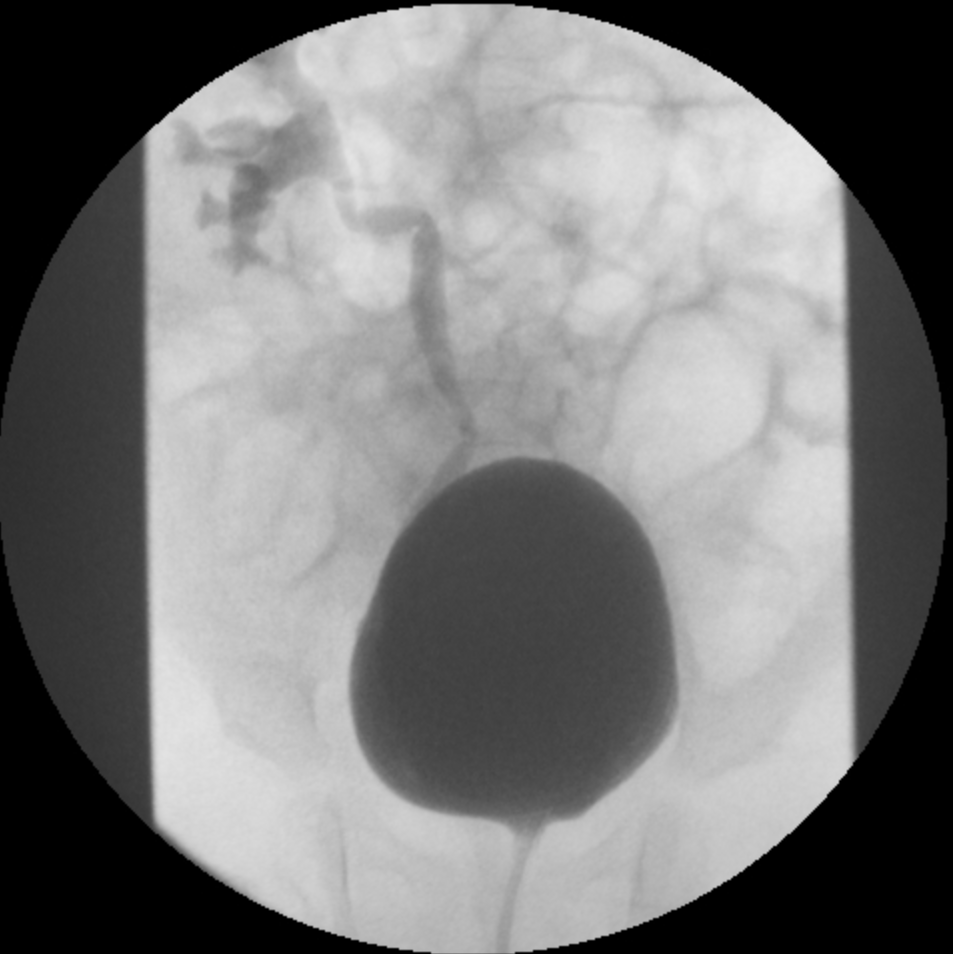
Figure 2 RVU de grade III
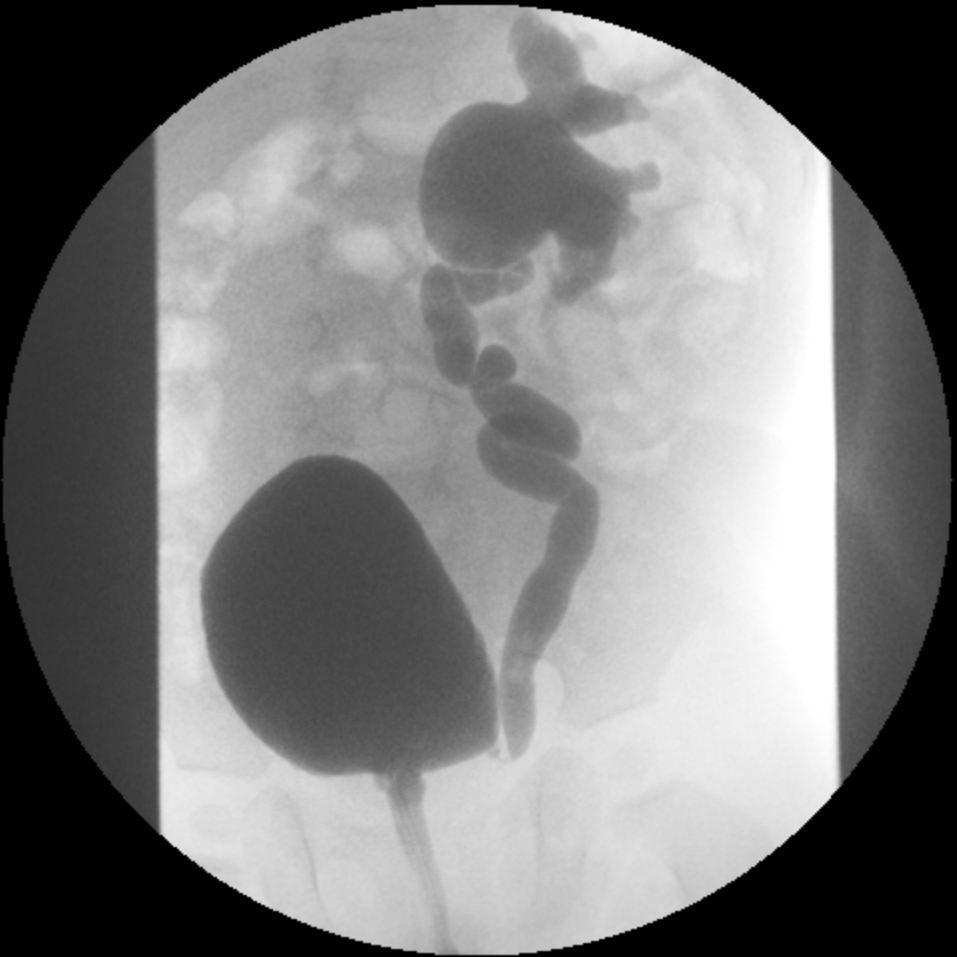
Figure 3 RVU de grade IV
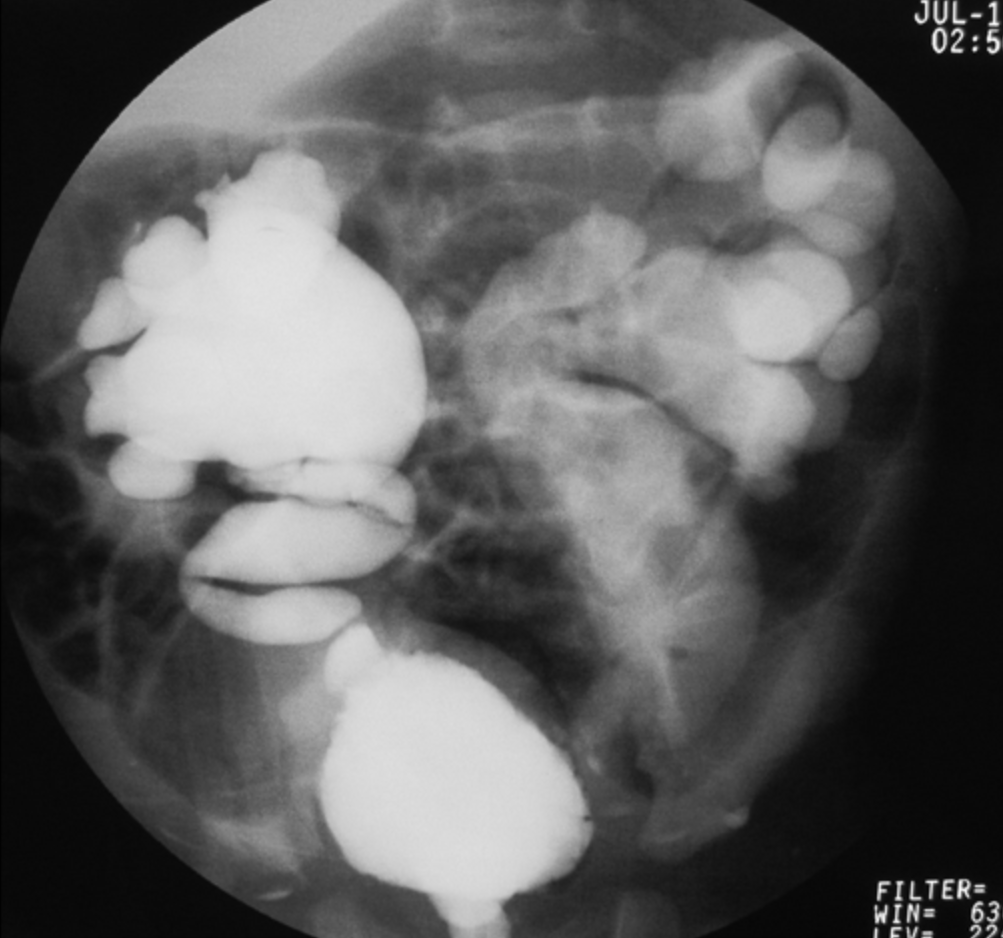
Figure 4 RVU de grade V
De multiples études démontrent une corrélation directe entre la prévalence des cicatrices rénales et le grade du reflux..33 Les cicatrices rénales se développent moins souvent en cas de reflux non dilatant.22,34,35 Le risque de développer une perte supplémentaire du parenchyme rénal s’est avéré plus élevé chez les enfants présentant un reflux de grade III-V que chez ceux de grade I-II.36,37 Les cicatrices rénales se sont également révélées être un facteur prédictif négatif de la résolution du RVU, indépendamment du grade du reflux.38 Malheureusement, le système international de gradation du reflux est subjectif et présente une faible fiabilité interobservateur.39,40
Plus récemment, des facteurs supplémentaires influençant la résolution du reflux et les infections urinaires de percée ont été identifiés. Les facteurs cliniques prédictifs de la résolution du reflux, du risque d’atteinte rénale et/ou d’IU de percée comprennent l’âge, le sexe (le sexe féminin augmente le risque), le statut de circoncision (la circoncision est protectrice vis-à-vis des IU), la présence d’une dysfonction vésico-intestinale et des antécédents d’IU. Les facteurs prédictifs radiographiques comprennent la latéralité (unilatéral vs. bilatéral), le rapport du diamètre urétéral distal (relatif à la distance entre les corps vertébraux L1-L3),41,42,43,44,45 le volume vésical au début du reflux (normalisé en pourcentage de la capacité vésicale prédite pour l’âge),46 la pression vésicale au début du reflux, le fait que le reflux survienne en phase de remplissage ou de miction, et la présence de cicatrices rénales.38,47
Chez les nouveau-nés, un indice de reflux vésico-urétéral à six points, utilisant le sexe, le grade de VUR, les anomalies anatomiques de l’uretère et le moment du reflux pendant la VCUG, s’est révélé prédictif de la résolution du VUR, du délai d’amélioration et des IVU d’échappement.48,49 De même, un réseau de neurones facile d’utilisation a été créé, utilisant les informations démographiques, le grade de VUR, la latéralité, le volume vésical au début du VUR, les antécédents d’IVU, une dysfonction vésicale ou intestinale et la présence d’IVU fébriles d’échappement, afin de prédire la probabilité de résolution du VUR, et est disponible à l’adresse http://pedsurocomp.lab.uiowa.edu.50 La prise en compte de multiples facteurs de risque améliore la prédiction des résultats cliniques et permet une prise en charge plus individualisée de chaque patient.
Dysfonction vésico-intestinale
Il a été constamment démontré que les enfants présentant un dysfonctionnement intestinal ou vésical ont une incidence plus élevée d’infections urinaires en percée, davantage de cicatrices rénales, un taux de résolution spontanée du RVU plus faible et un taux d’échec plus élevé après traitement chirurgical que les enfants ayant des habitudes d’élimination « normales ».1,51 Ces constatations doivent être prises en considération lors de la détermination des options de prise en charge pour les enfants ayant acquis la propreté et présentant un RVU.
Néphropathie de reflux/Cicatrices rénales
Les enfants présentant des cicatrices rénales sont plus susceptibles de développer de nouvelles infections urinaires et des cicatrices supplémentaires que les enfants sans cicatrices rénales.34,52,53 Une étude rétrospective portant sur 120 patients a montré une probabilité significativement plus élevée de développer une infection urinaire d’échappement chez ceux ayant un reflux de grade III à V et une anomalie à la scintigraphie DMSA initiale (60 %) par rapport à ceux sans anomalie (6 %), et une autre étude a montré un risque relatif d’infection urinaire d’échappement de 5,1 chez les patients présentant des cicatrices rénales.54,55 Dans une étude avec un suivi moyen de 12 ans après une intervention anti-reflux, les enfants avec des cicatrices rénales unilatérales avaient une probabilité de 11 % de développer une hypertension et de 18,5 % s’ils présentaient des cicatrices rénales bilatérales.56 D’autres ont suggéré que l’incidence de l’hypertension chez les enfants avec des cicatrices rénales bilatérales est d’environ 20 %.57 Les enfants avec des cicatrices rénales bilatérales sévères sont significativement plus susceptibles de développer une protéinurie, une insuffisance rénale chronique et une insuffisance rénale que ceux ayant des cicatrices unilatérales ou des reins sans cicatrices.58,59 Ces données suggèrent fortement que les enfants avec des cicatrices sont exposés à un risque accru de développer d’autres cicatrices et des séquelles cliniques à long terme.
Diagnostic et évaluation
Cystouréthrographie mictionnelle et cystographie isotopique
Les seuls examens qui détectent de manière routinière et fiable le reflux sont l’urétrocystographie mictionnelle (VCUG) et la cystographie isotopique. Une VCUG est réalisée en instillant, en rétrograde, un produit de contraste via une sonde urétrale dans la vessie et en obtenant des images fluoroscopiques des voies urinaires supérieures et inférieures pendant le remplissage et la miction. Une cystographie isotopique est réalisée à l’aide d’une technique de scintigraphie aux radioisotopes. La VCUG est un examen initial approprié car elle fournit de meilleurs détails anatomiques, y compris la présence ou l’absence de diverticules périurétéraux, de duplication urétérale et d’anomalies vésicales ou urétrales. Elle permet également une gradation plus précise du reflux. En outre, elle permet de mesurer le diamètre urétéral distal, ce qui s’est avéré plus objectif et plus fiable que le grade et d’une valeur prédictive égale ou supérieure en termes de résolution et d’issues cliniques.41,42,43,44,45
La cystographie isotopique présente l’avantage de réduire la dose d’irradiation par rapport au VCUG. La cystographie isotopique détecte de manière fiable tous les grades de reflux vésico-urétéral et peut être plus sensible pour la détection du reflux vésico-urétéral intermittent (Figure 5)60,61
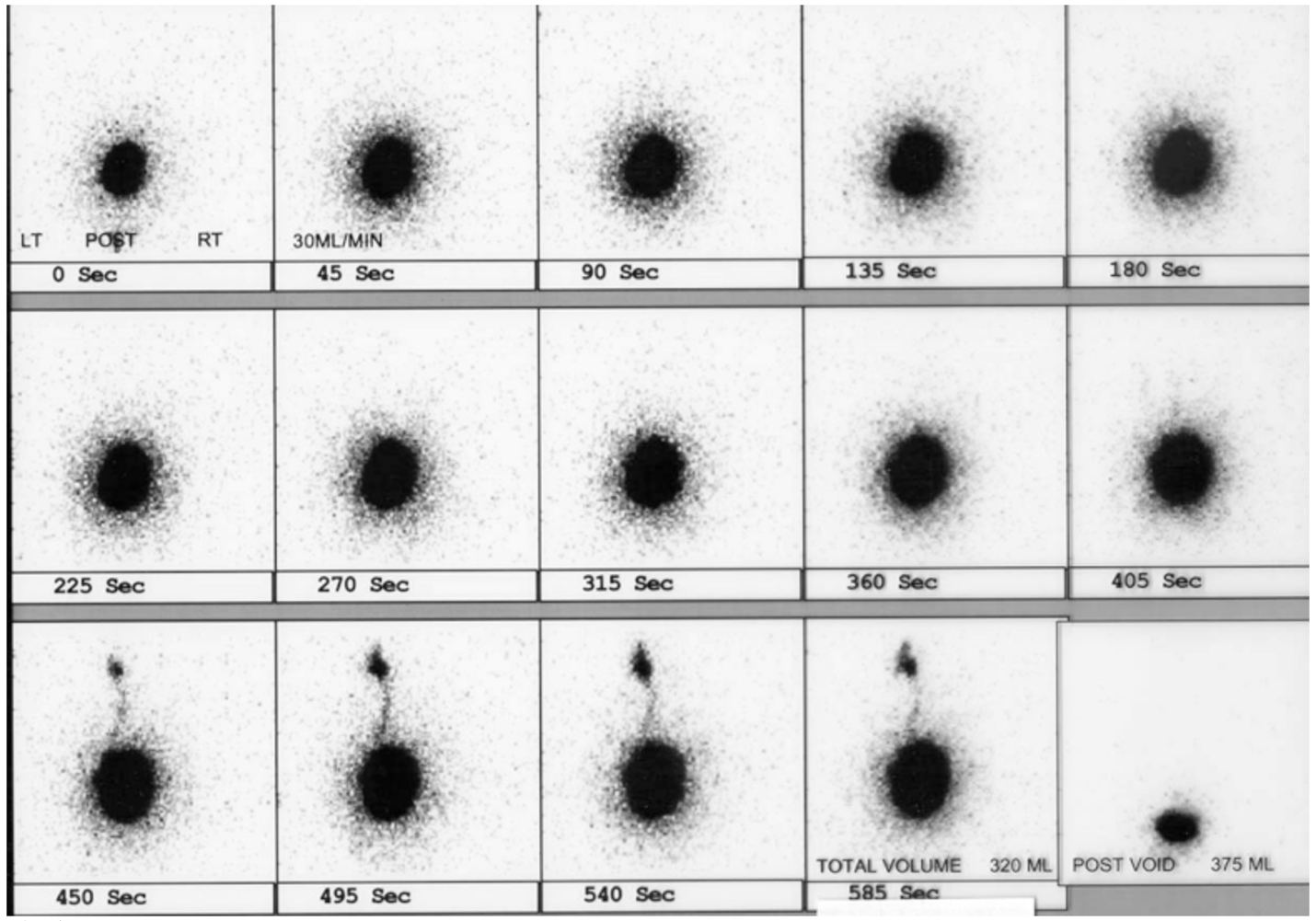
Figure 5 RVU gauche à la cystographie isotopique
Si une cysto-urétrographie mictionnelle (CUM) ne met en évidence aucune anomalie anatomique significative, une cystographie isotopique peut être réalisée lors des examens de suivi afin de limiter l’exposition aux rayonnements. Bien que la cystographie isotopique soit fréquemment considérée comme un test plus sensible, le médecin prescripteur doit être conscient que chaque type de cystographie présente des limites quant à sa capacité à détecter le reflux dans une population donnée.62
Les Sections d’urologie et de radiologie de l’American Academy of Pediatrics ont élaboré en 2016 un protocole standard pour la réalisation de la cysto-urétrographie mictionnelle (VCUG) afin de maximiser la sécurité des patients et de garantir des résultats précis ayant un impact direct sur la prise en charge des patients.63 Les principales recommandations comprenaient le respect des principes ALARA,64 le remplissage de la vessie par gravité à 100 cm au-dessus de la table d’examen, l’obtention d’images de l’urètre pendant la phase mictionnelle, la réalisation d’une étude cyclique (cycles de remplissage multiples), l’estimation de la capacité vésicale maximale, la consignation du volume vésical au moment où survient le VUR, la consignation du résidu post-mictionnel, la consignation des anomalies vésicales ou urétrales (p. ex., diverticules vésicaux ou valve urétrale postérieure), et la classification du reflux selon l’International Reflux Study.
Outre l’exposition aux rayonnements, le sondage vésical peut être une expérience traumatisante pour un jeune enfant. Parmi les efforts visant à réduire le caractère traumatisant de l’urétrocystographie mictionnelle figurent l’utilisation de lubrifiants contenant des anesthésiques locaux, le recours à des spécialistes en accompagnement de l’enfant à l’hôpital et la sédation consciente. Historiquement, les cystographies étaient répétées annuellement; cependant, avec l’amélioration de la capacité à prédire le moment de la résolution, il a été suggéré que, chez les enfants chez qui la résolution du reflux vésico-urétéral (RVU) est moins probable, l’intervalle entre les cystographies devrait être allongé afin de réduire l’exposition aux rayonnements, le nombre d’examens traumatisants et les coûts.50,65,66,67
Une modalité d’imagerie adoptée relativement récemment dans certains centres est l’urosonographie mictionnelle avec contraste (ceVUS), qui s’est révélée dans plusieurs études sûre et comparable à la VCUG pour détecter un reflux vésico-urétéral (VUR) de grade 2 ou plus, détecter le reflux intrarénal et présenter une bonne fiabilité interobservateur (Figure 6) Elle permet d’éviter complètement l’exposition aux rayonnements ionisants, mais nécessite néanmoins un sondage vésical et une instillation intravésicale de l’agent de contraste. Les agents de contraste échographiques de deuxième génération n’étaient pas largement disponibles jusqu’à leur approbation récente par la FDA aux États-Unis.68,69 La VCUG demeure la référence pour le diagnostic du VUR tant que d’autres méthodes d’exploration n’auront pas démontré une sensibilité et une spécificité équivalentes.
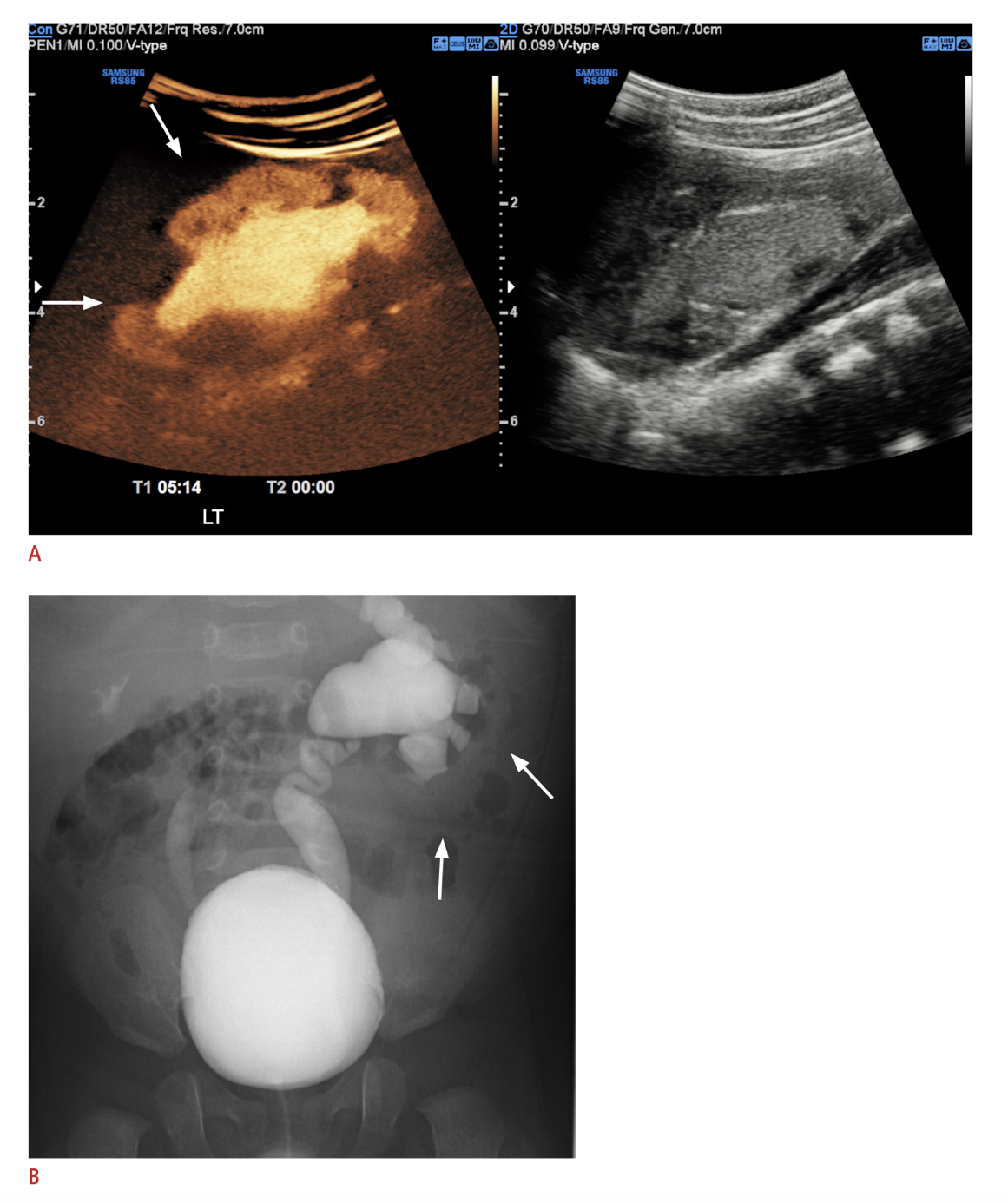
Figure 6 A. Image d’échographie de contraste du rein gauche présentant un reflux intrarénal comparée à B. VCUG montrant un VUR gauche de grade V et un VUR droit de grade III. Image reproduite conformément aux termes de la licence Creative Commons Attribution Non-Commercial. Image réimprimée à partir de. Droits d’auteur 2021 Korean Society of Ultrasound in Medicine.
Scintigraphie nucléaire (DMSA, MAG3)
La scintigraphie au DMSA, dans laquelle l’agent radioactif se fixe aux tubules proximaux, s’est révélée être un examen plus sensible que l’urographie intraveineuse (UIV) pour la détection de la néphropathie de reflux.70 L’examen fournit des informations sur la fonction rénale différentielle et peut également détecter des modifications liées à une pyélonéphrite aiguë avec une sensibilité et une spécificité supérieures à celles du scanner, de l’imagerie par résonance magnétique ou de l’échographie.71(Figure 7)
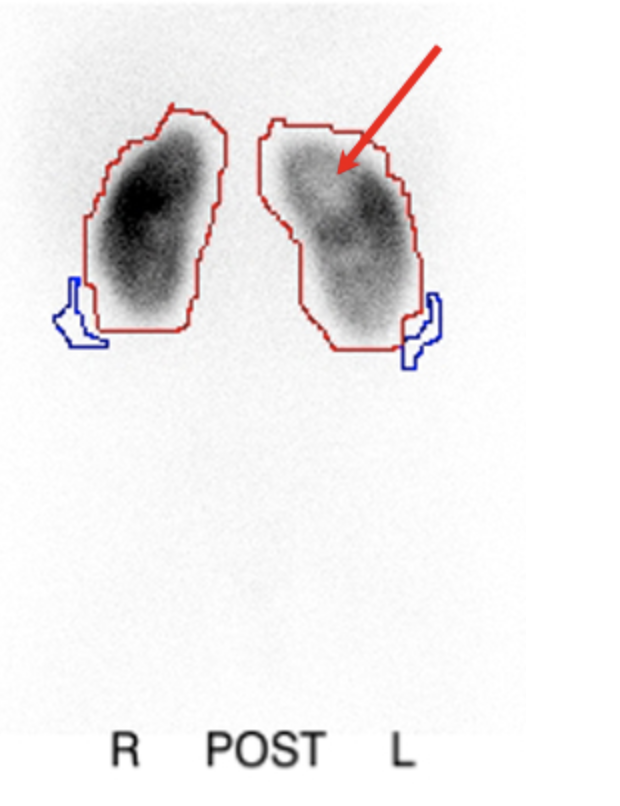
Figure 7 Scintigraphie au DMSA après une pyélonéphrite mettant en évidence des défauts photopéniques du rein gauche
L’association des cicatrices rénales avec des grades plus élevés de reflux et un risque de cicatrices ultérieures, ainsi que la diminution des taux de résolution, a conduit certains à conclure que l’évaluation initiale standard d’un enfant présentant une infection urinaire fébrile devrait commencer par une scintigraphie rénale et non par une VCUG (l’« approche top-down »). En utilisant cette approche, une VCUG ne devrait être réalisée que chez les enfants ayant une scintigraphie anormale. L’avantage d’une telle approche serait une réduction du nombre d’enfants subissant une VCUG et l’identification du reflux dans un groupe à plus haut risque; en théorie, les patients présentant un reflux mais sans anomalies rénales structurelles ou fonctionnelles pourraient ne pas être diagnostiqués, mais l’absence de telles anomalies rénales suggère que le reflux n’est probablement pas cliniquement significatif. L’utilisation de l’échographie comme alternative à la scintigraphie rénale n’a pas été acceptée en raison d’une sensibilité diminuée. Une étude a noté que jusqu’à 25 % des patients présentant des défauts corticaux au DMSA avaient une échographie normale, apportant des données supplémentaires sur l’utilité des scintigraphies rénales dans l’évaluation des enfants présentant des infections urinaires fébriles.72
La scintigraphie à la mercaptoacétyltriglycine (MAG3) présente également une meilleure capacité à détecter les cicatrices rénales par rapport à l’IVP. Bien que la scintigraphie au DMSA soit considérée par beaucoup comme le test le plus sensible pour la détection des cicatrices rénales ; le taux de sensibilité rapporté du MAG3 par rapport au DMSA varie de 88 % à égal ou légèrement supérieur à celui d’une scintigraphie au DMSA.73,74,75 Les avantages du MAG3 incluent une exposition aux rayonnements, un coût et un temps requis moindres, ainsi que la visualisation du système collecteur, ce qui peut améliorer la spécificité par rapport au DMSA chez ceux présentant une dilatation importante du système collecteur.73 La scintigraphie nucléaire est généralement différée jusqu’à l’âge de 4 à 6 semaines afin de garantir un développement rénal adéquat pour des résultats précis.
Indications des examens diagnostiques
Le diagnostic de reflux vésico-urétéral (RVU) est généralement posé après une ou plusieurs infections des voies urinaires (IVU) ou lorsqu’il est suspecté en raison d’anomalies à l’imagerie rénale. Le dépistage du RVU a traditionnellement été recommandé chez les patients ayant une dilatation des voies urinaires diagnostiquée en période prénatale (UTD), car un reflux a été rapporté chez jusqu’à 31 % des nourrissons présentant une UTD prénatale ; cependant, l’UTD prénatale corrèle mal avec la gravité du RVU.76,77,78,79 Le risque de RVU chez les patients ayant un système collecteur non dilaté ou légèrement dilaté peut atteindre jusqu’à 25 %.77,80,81 Heureusement, le RVU associé à une UTD détectée en prénatal présente un taux élevé de résolution spontanée.81,82 Les études ayant évalué si les patients présentant à la fois une UTD et un RVU ont un risque accru d’IVU (comparativement à une UTD en l’absence de RVU) montrent des résultats contradictoires.83,84,85,86,87,88,89,90 La réalisation judicieuse d’une cystographie mictionnelle (VCUG) doit être envisagée en fonction des facteurs de risque d’un RVU cliniquement significatif.
L’utilité du dépistage des frères et sœurs pour le reflux est également controversée.17,91 il existe un risque accru d’anomalies corticales rénales chez les frères et sœurs dépistés ayant des antécédents d’IVU, ainsi que de diagnostic ultérieur de VUR de haut grade.92 Une étude utilisant des données de demandes de remboursement d’assurance n’a pas mis en évidence de différence significative du taux d’IVU entre les frères et sœurs dépistés et non dépistés.93
Il reste à démontrer que la détection et la prise en charge du RVU chez un frère ou une sœur asymptomatique ayant fait l’objet d’un dépistage se traduiront par une diminution significative des conséquences indésirables; par conséquent, il n’existe actuellement aucun consensus concernant la pratique du dépistage des frères et sœurs asymptomatiques pour le RVU. Les lignes directrices cliniques de l’AUA pour la prise en charge du reflux vésico-urétéral primaire chez l’enfant recommandent de dépister les frères et sœurs au moyen d’une échographie réno-vésicale (RBUS), la VCUG étant réservée à ceux chez qui l’échographie réno-vésicale est anormale.94
Le moment de l’évaluation du VUR chez les patients ayant des antécédents d’infection urinaire fébrile reste également controversé. Le Sous-comité de l’AAP sur les infections des voies urinaires a publié des recommandations cliniques en 2011, réaffirmées en 2016, qui préconisaient de différer la prophylaxie antibiotique et la réalisation d’une VCUG après la première infection urinaire fébrile en l’absence d’anomalie à l’échographie rénale chez les enfants âgés de 2 à 24 mois.95 L’essai Randomized Intervention in Children with Vesicoureteral Reflux (RIVUR) a étudié 607 jeunes enfants (2 à 72 mois) présentant un VUR de grade I à IV après une première ou une deuxième infection urinaire fébrile ou symptomatique, et les a répartis aléatoirement pour recevoir soit un placebo, soit une prophylaxie antibiotique. La prophylaxie par triméthoprime/sulfaméthoxazole a réduit la survenue d’infections urinaires de 50 %, mais il n’y avait pas de différence significative en termes de cicatrices rénales entre les groupes, bien que l’étude n’ait pas été dimensionnée pour évaluer les cicatrices rénales.96 Une analyse post hoc de l’essai RIVUR et d’un autre essai prospectif multicentrique (CUTIE) a montré que l’incidence des cicatrices rénales après une infection urinaire fébrile était de 2,8 %, de 25,7 % après deux infections urinaires fébriles, et de 28,6 % après trois infections urinaires fébriles ou plus, ce qui renforce l’utilité du dépistage du VUR après une première infection urinaire fébrile.97
Prise en charge clinique
Il n’existe pas de prise en charge optimale universelle pour les enfants atteints de VUR. Comme indiqué précédemment, de multiples variables anatomiques et physiologiques influencent la probabilité de résolution spontanée du VUR et le risque d’infections urinaires fébriles, tandis que des facteurs extrinsèques tels que les préférences du patient et de sa famille, l’observance du traitement, les situations sociales et les taux d’infections des voies urinaires doivent également être pris en compte. En gardant à l’esprit que la prise en charge du VUR doit être individualisée pour chaque enfant après prise en compte des multiples facteurs intrinsèques et extrinsèques qui influencent l’issue, nous présentons ci-dessous les différentes options thérapeutiques.
Prise en charge non opératoire
L’administration quotidienne d’antibiotiques à faible dose (~ ¼ de la dose thérapeutique) repose sur le constat que les taux de résolution spontanée du RVU primaire sont très élevés (même pour les RVU sévères dans des populations sélectionnées), et que les cicatrices rénales postnatales associées au reflux semblent survenir exclusivement en présence d’urines infectées, en particulier aux pôles des reins, où le système collecteur intrarénal est plus susceptible de présenter des calices composés.98 Ainsi, le maintien d’urines stériles jusqu’à la résolution spontanée du reflux peut éviter la morbidité liée à la chirurgie et les cicatrices rénales. Un certain nombre d’études randomisées ont tenté d’évaluer l’efficacité et les effets indésirables de la prophylaxie antibiotique chez les enfants atteints de RVU.4,99 Ces études n’ont généralement pas montré de réduction significative des pyélonéphrites aiguës ni des cicatrices rénales chez les enfants présentant un RVU traités par prophylaxie antibiotique. Certaines études ont même rapporté une augmentation des infections urinaires chez les enfants sous antibiotiques ainsi qu’une augmentation des bactéries résistantes aux antibiotiques responsables de ces infections.4,99,100 Par analyse de sous-groupes, d’autres études ont identifié un jeune âge et des degrés croissants de reflux comme facteurs de risque d’infections urinaires fébriles récidivantes.99,101 L’essai multicentrique RIVUR a montré une réduction de 50 % des récidives d’infections urinaires avec la prophylaxie antibiotique par rapport au placebo, sans différence du taux de cicatrices rénales.102
Nombreux sont ceux qui remettent en question la nécessité d’une antibioprophylaxie, suggérant que, chez certains patients sélectionnés, la probabilité de pyélonéphrite et d’atteinte rénale en l’absence d’antibioprophylaxie est faible.103,104,105,106 Entre 30 % et 50 % des enfants ayant des antécédents d’un épisode d’infection urinaire présenteront des infections récidivantes et, comme le diagnostic de reflux fait souvent suite à une infection urinaire, cela conduit beaucoup de personnes à supposer à tort que le reflux est responsable de l’infection. Cependant, en général, il ne prédispose pas de façon significative aux infections urinaires, sauf lorsqu’il est de grade élevé.104,107 Le plus souvent, les infections urinaires sont dues à des facteurs prédisposants tels que des antécédents d’infections urinaires, le sexe féminin, la constipation, des mictions peu fréquentes, une vidange vésicale incomplète ou une immunité altérée. De multiples études démontrent désormais que les enfants sous antibioprophylaxie, sans infections d’échappement ni preuve d’atteinte rénale, peuvent être surveillés en toute sécurité sans antibioprophylaxie ni correction du VUR.103,104 en particulier après optimisation de la dysfonction intestino-vésicale.108
En général, la prophylaxie antibiotique quotidienne semble sûre et bien tolérée, mais elle entraîne des coûts et des risques potentiels. Elle a été associée à un risque multiplié par 24 de souches d’Escherichia coli résistantes au triméthoprime-sulfaméthoxazole.109 D’autres études ont démontré l’émergence d’autres bactéries présentant des taux élevés de résistance chez les enfants recevant des antibiotiques prophylactiques.110 Outre la résistance, d’autres préoccupations concernent les effets indésirables potentiels des antibiotiques au long cours sur le microbiome intestinal et urinaire, ainsi que sur la croissance.111,112,113,114 En outre, l’observance médicamenteuse doit être prise en compte. Une étude de 2010 a suggéré que le taux d’observance pour le simple fait de faire exécuter l’ordonnance n’était que de 40 %, laissant penser que de nombreux patients mis sous prophylaxie antibiotique ne reçoivent jamais le médicament.115
L’identification et le traitement de la dysfonction vésicale jouent un rôle majeur dans la prise en charge conservatrice du RVU, qu’elle soit isolée ou associée à une prophylaxie antibiotique. Il est désormais reconnu que le RVU secondaire est plus judicieusement pris en charge en traitant la dysfonction du bas appareil urinaire.116
Plusieurs grandes études prospectives ont tenté d’évaluer l’efficacité de l’intervention chirurgicale par rapport à la prophylaxie antibiotique. Ces études ont généralement montré l’absence de différence significative concernant la fonction rénale ou la croissance, la progression ou l’apparition de nouvelles cicatrices, ou les infections urinaires (IU).23,36,107,117,118 Toutefois, les symptômes pyélonéphritiques, y compris les IU fébriles, avaient tendance à être plus fréquents dans les groupes traités médicalement.18,105,119 De manière générale, les enfants ayant finalement bénéficié d’une intervention chirurgicale avaient tendance à développer des cicatrices rénales à un plus jeune âge, mais, avec un suivi plus long, aucune différence significative n’était observée globalement en termes de nouvelles cicatrices rénales chez ceux traités par antibiotiques comparativement à ceux opérés.24,120 Ces observations laissaient penser qu’un bénéfice potentiel des opérations antireflux, pour certains patients, pourrait être une réduction des pyélonéphrites; toutefois, d’autres chercheurs ont suggéré qu’une fois la cicatrisation rénale survenue, la maladie suit son cours et le traitement chirurgical apporte peu de bénéfice.27,121 Une revue a conclu que neuf chirurgies de réimplantation urétérale seraient nécessaires pour prévenir une IU fébrile, sans réduction du nombre d’enfants développant des lésions rénales,24 ce qui renforce encore la nécessité de mieux définir quels enfants atteints de RVU peuvent bénéficier d’une intervention. L’intervention chirurgicale est généralement réservée aux enfants présentant des IU de percée sous prophylaxie antibiotique, une aggravation de la fonction rénale, ou chez lesquels d’autres considérations favorisent une prise en charge définitive plutôt que l’administration quotidienne d’antibiotiques.
Prise en charge chirurgicale
Traitement endoscopique
Depuis l’approbation par la FDA, en 2001, de l’utilisation du copolymère dextranomère/acide hyaluronique (Dx/HA) (Deflux®, Q-Med, Uppsala, Sweden) pour le traitement du RVU primaire, les praticiens ont de plus en plus recours à l’injection endoscopique comme alternative à une antibiothérapie prolongée.122 Dx/HA est le seul traitement injectable disponible dans le commerce approuvé par la FDA pour le reflux aux États-Unis. Il s’agit d’un mélange synthétique de microsphères de dextrane dans un gel d’acide hyaluronique, injecté selon diverses techniques dans la région des orifices urétéraux. La taille des particules de dextranomère empêche la migration lymphatique.123
La correction endoscopique du RVU offre une procédure mini-invasive, ambulatoire, avec un faible risque de complications. Bien qu’il s’agisse d’une procédure en apparence simple, plusieurs études ont mis en évidence une courbe d’apprentissage, avec des résultats améliorés à mesure que l’expérience augmente.124,125,126 Parmi les autres facteurs associés à une correction endoscopique réussie figurent un grade de reflux plus faible, un UDR plus faible, l’absence de dysfonction intestino-vésicale, un volume de Dx/HA injecté plus important, l’évaluation visuelle de la configuration du bourrelet après l’injection, et la technique chirurgicale.126,127,128,129 Des études sur la technique chirurgicale ont montré que la technique d’implantation sous hydrodistension double (HIT) permet des taux de succès plus élevés que d’autres techniques, notamment la technique STING, se rapprochant de ceux de la réimplantation urétéro-vésicale.130
À court terme, les taux de résolution du RVU pour un uretère simple traité par Dx/HA varient de 59 % à 95 %.126,131 Si les patients bénéficient d’une deuxième injection pour un RVU persistant, le taux de succès s’améliore, mais une troisième injection est rarement curative.122,124,132 Les résultats à long terme chez des patients avec >5 ans de suivi montrent des taux de résolution du RVU allant de 59 à 100 %, influencés de manière significative par le grade du RVU, avec des taux d’infections urinaires fébriles après l’injection allant de 4 à 25 %.130 La VCUG de routine pour confirmer la résolution du RVU est controversée et n’est pas considérée comme obligatoire par certains, sauf si un patient est considéré à haut risque de récidive (RVU de haut grade, présence d’une infection urinaire fébrile après l’injection, âge < 2 ans) ou si c’est la préférence de la famille ou du chirurgien.133 D’autres préconisent de réaliser la VCUG de manière sélective uniquement si un bourrelet n’est pas visualisé à l’échographie. Une échographie doit être réalisée en postopératoire pour exclure une obstruction urétérale.134
Outre l’échec du traitement, la calcification de l’implant secondaire à une réaction à corps étranger a récemment été rapportée comme un autre facteur potentiel à long terme. La calcification du bourrelet n’est pas propre au Dx/HA et a été décrite avec de nombreux agents injectés par voie endoscopique.135,136 La calcification peut être confondue avec une lithiase urétérale, et les cliniciens doivent conserver un fort degré de suspicion pour cette entité afin d’éviter des examens diagnostiques et des interventions chirurgicales inutiles.137 L’obstruction urétérale après Dx/HA est rarement rapportée (< 1%) et peut survenir peu après la chirurgie, mais elle a aussi été rapportée jusqu’à cinq ans après l’opération, ce qui souligne l’importance de poursuivre la surveillance radiographique des patients après Deflux. L’obstruction peut être asymptomatique, se manifester par une colique néphrétique ou une infection urinaire.138,139 L’obstruction nécessite généralement une réimplantation urétérale avec exérèse du segment atteint.139,140,141
Réimplantation urétérale
Le traitement chirurgical du reflux vésico-urétéral a évolué au cours des cinq dernières décennies. Une incision transversale de l’abdomen inférieur pour une technique ouverte est généralement utilisée, laissant une petite cicatrice dans le pli cutané qui est discrète. De nombreuses techniques opératoires de réimplantation urétérale ont été utilisées ; les principales différences concernent l’abord intravésical (Figure 8) par opposition à l’abord extravésical. Il n’existe pas de documentation claire montrant qu’une technique particulière soit supérieure,23 et le choix d’une technique donnée est généralement individualisé chez l’enfant, à la discrétion du chirurgien opérateur.
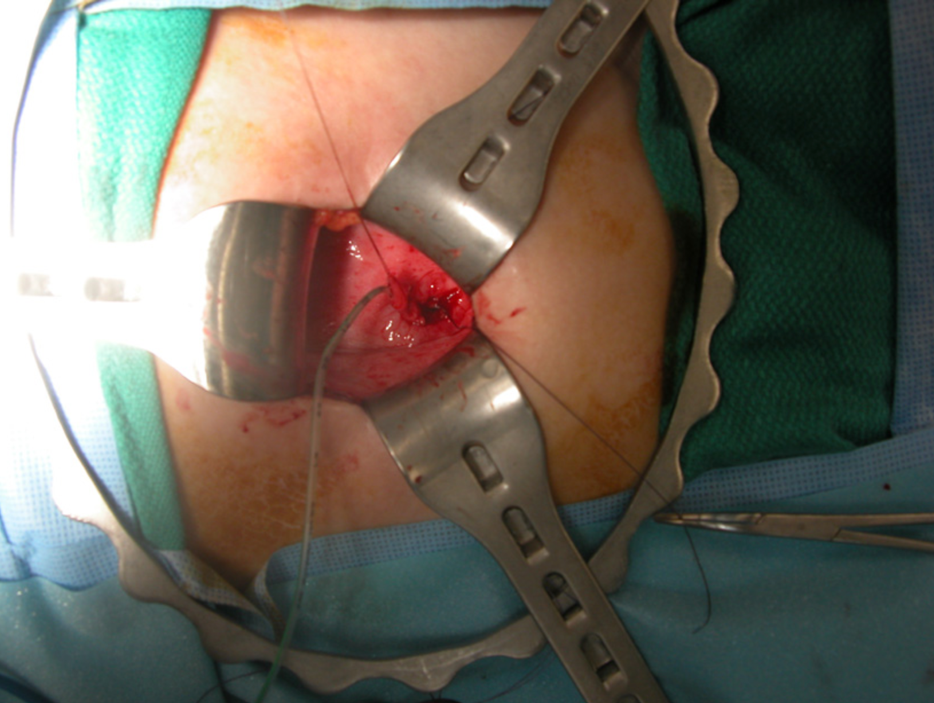
Figure 8 Réimplantation urétéro-vésicale intravésicale
Les progrès de l’analgésie, des techniques chirurgicales, et la compréhension que les enfants subissant une réimplantation urétérovésicale pour un RVU primaire ont rarement besoin de stents urétéraux ou d’un drainage vésical prolongé ont réduit la durée d’hospitalisation et diminué la morbidité de l’intervention.142 Plusieurs séries rapportent des patients subissant une réimplantation urétérovésicale par voie intravésicale et extravésicale en ambulatoire.143,144,145 Les résultats de multiples séries documentent des taux de succès avec la réimplantation urétérovésicale à ciel ouvert supérieurs à 95 % et proches de 100 % pour les grades faibles de reflux.146,147,148 Ces interventions comportent des risques liés à l’anesthésie et des complications potentielles, notamment l’obstruction urétérale, le reflux persistant, l’infection et l’hémorragie.23 Les principes généraux de la réimplantation urétérovésicale comprennent la minimisation de la manipulation de l’uretère, l’excision du segment urétéral intravésical, la confection d’un tunnel d’une longueur au moins cinq fois le diamètre de la lumière urétérale, et la réalisation d’une anastomose sans tension. Pour les uretères de gros calibre, un remodelage par excision ou plicature peut être nécessaire afin de faciliter l’obtention d’un tunnel intravésical adéquat.
Ces dernières années, la réimplantation urétérale extravésicale par laparoscopie assistée par robot a été de plus en plus utilisée, avec des bénéfices rapportés de diminution de la douleur et de séjour postopératoire plus court.149 Une étude multi-institutionnelle portant sur 260 patients a montré une résolution radiographique du RVU chez 88 % des patients, un taux global de complications de 9,6 % et un taux de rétention urinaire de 4 % après réimplantation bilatérale.150 Une analyse de données à l’échelle nationale a montré des taux de complications plus élevés (13 % contre 4,5 %) et des coûts accrus par rapport aux procédures ouvertes.151 Bien que l’utilisation de la réimplantation urétérale robot-assistée se poursuive dans certains centres, la chirurgie ouverte demeure la plus répandue.152
Chez les patients pour lesquels une intervention chirurgicale est envisagée, le moment de la chirurgie programmée demeure sujet à débat. La plupart des études évaluant les taux de résolution spontanée du RVU ont suivi des patients pendant 5 ans. Bien que ce critère d’évaluation soit vraisemblablement fondé sur le fait que la probabilité de néphropathie de reflux de novo diminue après l’âge de cinq ans,153 de nombreux cliniciens et familles en déduisent que les enfants chez qui le reflux ne s’est pas résolu d’ici là devraient bénéficier d’une chirurgie correctrice. Cependant, chez les enfants sans infections, le moment de la chirurgie peut souvent être différé; des réimplantations urétérales chez des enfants post-pubères et des adultes ont été rapportées, avec des modifications de la technique chirurgicale en raison des différences de morphologie corporelle entre adultes et enfants, mais avec des résultats généralement bons.154
Prise en charge individualisée
Bien que le VUR puisse être défini simplement, des recherches plus détaillées confirment que le reflux n’est pas une entité unique mais survient avec de larges variations de sévérité et d’impact. Les réponses à de nombreuses questions concernant le reflux demeurent inconnues; toutefois, il est clair que le traitement définitif, et même le diagnostic, du VUR sont d’un bénéfice clinique discutable pour de nombreux patients. Actuellement, les décisions concernant le traitement reposent sur l’évaluation des risques et des bénéfices par le médecin et les parents. Bien que la décision de recourir à la chirurgie ait traditionnellement été fondée principalement sur le grade du reflux, une décision véritablement éclairée doit prendre en compte de nombreuses autres variables, telles que l’âge du patient, le sexe, les antécédents d’infections urinaires, l’état fonctionnel rénal, la probabilité et le délai de résolution spontanée, et le risque d’infection urinaire fébrile ultérieure. De multiples facteurs pronostiques relatifs à la probabilité de résolution spontanée du reflux chez l’enfant ont été définis.38,47,50,65 La situation sociale du patient et les préférences parentales, ainsi que la volonté d’adhérer soit à une prise en charge conservatrice soit aux soins postopératoires, doivent également être prises en considération.
Tenter de déterminer la probabilité et le moment de la résolution spontanée du RVU chez un enfant donné tout en tenant compte de multiples variables pronostiques telles que l’âge, le sexe, le grade du RVU, le rapport du diamètre urétéral (UDR), le volume vésical au début du reflux, la présence d’une miction dysfonctionnelle, les antécédents d’IVU, la présence de cicatrices rénales, la latéralité et la duplicité est extrêmement complexe. À cette fin, un réseau de neurones facile d’utilisation qui intègre bon nombre de ces facteurs prédictifs est disponible à http://pedsurocomp.lab.uiowa.edu (Figure 9)155
Figure 9 Réseau neuronal intégrant des facteurs prédictifs de la résolution du RVU
L’utilisation et la précision de ce modèle ont été validées à l’échelle internationale dans un groupe d’enfants japonais.66 Pour les enfants qui ont eu une scintigraphie rénale, un second modèle informatique a été généré, intégrant les données supplémentaires de la scintigraphie rénale afin d’améliorer la précision pronostique, et est disponible sur le même site Web (http://pedsurocomp.lab.uiowa.edu).50
Perspectives futures
Bien que l’amélioration de la précision concernant la probabilité et le moment de la résolution spontanée du RVU permette de meilleures décisions de prise en charge, des données supplémentaires sont nécessaires. Des études supplémentaires sont nécessaires pour définir, chez un enfant donné, le risque ultérieur de pyélonéphrite, de lésions rénales et, en définitive, de séquelles cliniques. La poursuite de la collecte de données à partir de registres prospectifs de grande ampleur et multi-institutionnels peut permettre de mieux comprendre l’histoire naturelle du RVU. En outre, des biomarqueurs pour la détection d’un reflux vésico-urétéral cliniquement pertinent pourraient nous permettre de mieux déterminer quels enfants bénéficieront le plus d’un traitement actif.
Points clés
- Bien que le Système international de classification du reflux soit prédictif de la résolution spontanée du RVU et de la présence de cicatrices rénales, sa fiabilité interobservateur est médiocre. Des mesures radiographiques plus objectives en complément du grade, telles que le rapport du diamètre urétéral distal et le volume vésical au début du RVU, sont prédictives de la résolution spontanée et du risque d’infection urinaire de percée.
- De multiples facteurs cliniques et radiographiques, identifiés comme prédictifs des issues cliniques du RVU, sont utilisés en diverses combinaisons dans des calculateurs de risque et des réseaux neuronaux conviviaux tels que http://pedsurocomp.lab.uiowa.edu pour permettre une évaluation individualisée du risque plus précise afin d’améliorer la prise en charge des patients.
- Les enfants présentant des cicatrices rénales associées au RVU sont plus susceptibles de développer une hypertension artérielle, une protéinurie et une maladie rénale chronique et devraient faire l’objet d’une surveillance régulière de la pression artérielle, de bilans de la fonction rénale et d’analyses d’urines à la recherche de protéinurie, tout au long de l’âge adulte.
- La réalisation d’une VCUG fondée uniquement sur la présence d’une dilatation prénatale des voies urinaires n’est souvent pas cliniquement utile, et il est recommandé d’adopter une démarche de décision partagée avec les parents, intégrant le risque d’infection urinaire basé sur des facteurs cliniques et échographiques supplémentaires (c.-à-d. sévérité de l’hydronéphrose, présence d’un hydrouretère), afin de déterminer si un enfant doit bénéficier d’une VCUG
- Une prise en charge adéquate de la dysfonction intestinale et vésicale joue un rôle crucial dans la prise en charge conservatrice du RVU, avec ou sans recours à une prophylaxie antibiotique, et peut, dans certains cas, rendre une intervention chirurgicale inutile.
- Outre l’émergence de bactéries résistantes aux antibiotiques, une prophylaxie antibiotique chronique peut avoir des effets indésirables à long terme, notamment des impacts défavorables sur le microbiome intestinal et urinaire normal, susceptibles d’influencer la croissance et le développement pendant l’enfance.
Références
- Mathews R, Carpenter M, Chesney R. Controversies in the management of vesicoureteral reflux: the rationale for the RIVUR study. J Pediatr Urol 2009; 5 (5): 336–341. DOI: 10.1016/J.JPUROL.2009.05.010.
- Kaefer M, Curran M, Treves ST. Sibling vesicoureteral reflux in multiple gestation births. Pediatrics 2000; 105 (4 Pt 1): 800–804. DOI: 10.1542/PEDS.105.4.800.
- Smellie JM, Poulton A, Prescod NP. Retrospective study of children with renal scarring associated with reflux and urinary infection. 1994; 308 (6938): 1193–1196. DOI: 10.1136/bmj.308.6938.1193.
- Garin EH, Olavarria F, Nieto VG. Clinical significance of primary vesicoureteral reflux and urinary antibiotic prophylaxis after acute pyelonephritis: a multicenter, randomized, controlled study. Pediatrics 2006; 117 (3): 626–632. DOI: 10.1542/PEDS.2005-1362.
- Cooper CS, Austin JC. Vesicoureteral reflux: who benefits from surgery? Urol Clin North Am 2004; 31 (3): 535–541. DOI: 10.1016/j.ucl.2004.04.006.
- Mattoo TK. Vesicoureteral reflux and reflux nephropathy. Adv Chronic Kidney Dis 2011; 18 (5): 348–354. DOI: 10.1053/j.ackd.2011.07.006.
- Cornwell LB, Riddell JV, Mason MD. New-onset ESRD secondary to reflux nephropathy has decreased in incidence in the United States. J Pediatr Urol 2020; 16 (5). DOI: 10.1016/j.jpurol.2020.06.023.
- Zhang Y, Bailey RR. A long term follow up of adults with reflux nephropathy. N Z Med J 1995; 108 (998): 7761049.
- Hutch JA. Vesico-ureteral reflux in the paraplegic: cause and correction. J Urol 1952; 68 (2): 457–469. DOI: 10.1016/s0022-5347(05)65331-1.
- Hodson CJ. The radiological diagnosis of pyelonephritis. Proc R Soc Med 1959; 52 (8): 669–672.
- Kalayeh K, Fowlkes JB, Schultz WW. Ureterovesical junction deformation during urine storage in the bladder and the effect on vesicoureteral reflux. Journal of Biomechanics 2020. DOI: 10.1016/J.JBIOMECH.2020.110123.
- Paquin AJ. Ureterovesical anastomosis: the description and evaluation of a technique. J Urol 1959; 82 (5): 573–583. DOI: 10.1016/S0022-5347(17)65934-2.
- Koff SA. Relationship between dysfunctional voiding and reflux. J Urol 1992. DOI: 10.1016/s0022-5347(17)37007-6.
- AM E, K D, E R. Genes in the ureteric budding pathway: association study on vesico-ureteral reflux patients. PLoS ONE 2012; 7 (4). DOI: 10.1371/journal.pone.0031327.
- Noe HN. The long-term results of prospective sibling reflux screening. J Urol 1992. DOI: 10.1016/s0022-5347(17)37017-9.
- Wan J, Greenfield SP, Ng M. Sibling reflux: a dual center retrospective study. J Urol 1996; 156 (2 Pt 2): 8683758. DOI: 10.1016/s0022-5347(01)65782-3.
- Noe HN. The relationship of sibling reflux to index patient dysfunctional voiding. J Urol 1988; 140 (1): 3379674. DOI: 10.1016/s0022-5347(17)41502-3.
- Weiss R, Duckett J, Spitzer A. Results of a randomized clinical trial of medical versus surgical management of infants and children with grades III and IV primary vesicoureteral reflux (United States. The International Reflux Study in Children J Urol 1992. DOI: 10.1016/s0022-5347(17)36998-7.
- Smellie JM. Reflections on 30 years of treating children with urinary tract infections. J Urol 1991; 146 (2 ( Pt 2): 10 1016 0022–5347 17 37889–37888. DOI: 10.1016/s0022-5347(17)37889-8.
- Nguyen HT, Bauer SB, Peters CA. 99m Technetium dimercapto-succinic acid renal scintigraphy abnormalities in infants with sterile high grade vesicoureteral reflux. J Urol 2000; 164 (5): 10 1016 0022–5347 05 67081–67084. DOI: 10.1097/00005392-200011000-00076.
- Patterson LT, Strife CF. Acquired versus congenital renal scarring after childhood urinary tract infection. J Pediatr 2000; 136 (1): 2–4. DOI: 10.1016/s0022-3476(00)90038-6.
- Bailey RR, Lynn KL, Smith AH. Long-term followup of infants with gross vesicoureteral reflux. J Urol 1992. DOI: 10.1016/s0022-5347(17)37010-6.
- Elder JS, Peters CA, Arant BS Jr.. Pediatric Vesicoureteral Reflux Guidelines Panel summary report on the management of primary vesicoureteral reflux in children. J Urol 1997; 157 (5): 9112544. DOI: 10.1097/00005392-199705000-00093.
- Hodson EM, Wheeler DM, Vimalchandra D. Interventions for primary vesicoureteric reflux. Cochrane Database Syst Rev 2007 (3). DOI: 10.1002/14651858.CD001532.pub3.
- Baker R, Maxted W, Maylath J. Relation of age, sex, and infection to reflux: Data indicating high spontaneous cure rate in pediatric patients. J Urol 1966; 95 (1): 10 1016 0022–5347 17 63403–63407. DOI: 10.1016/s0022-5347(17)63403-7.
- Ransley PG, Risdon RA. Reflux nephropathy: effects of antimicrobial therapy on the evolution of the early pyelonephritic scar. Kidney International 1981; 20 (6): 733–742. DOI: 10.1038/KI.1981.204.
- Winberg J. Management of primary vesico-ureteric reflux in children\–operation ineffective in preventing progressive renal damage. Infection 1994; 22 Suppl 1:S4-7. DOI: 10.1007/bf01716025.
- Sukamoto E, Itoh K, Morita K. Reappraisal of Tc-99m DMSA scintigraphy for follow up in children with vesicoureteral reflux. Ann Nucl Med 1999; 13 (6): 401–406. DOI: 10.1007/bf03164934.
- Naseer S SR, G.F.. New renal scars in children with urinary tract infections, vesicoureteral reflux and voiding dysfunction: a prospective evaluation. J Urol 1997; 158 (2): 9224361. DOI: 10.1016/s0022-5347(01)64552-x.
- Gordon I, Barkovics M, Pindoria S. Primary vesicoureteric reflux as a predictor of renal damage in children hospitalized with urinary tract infection: a systematic review and meta-analysis. J Am Soc Nephrol 2003; 14 (3): 739–744. DOI: 10.1097/01.asn.0000053416.93518.63.
- Lebowitz RL, Olbing H, Parkkulainen KV. International system of radiographic grading of vesicoureteric reflux. International Reflux Study in Children Pediatr Radiol 1985; 15 (2): 105–109. DOI: 10.1007/bf02388714.
- Schwab CW Jr., Wu HY, Selman H. Spontaneous resolution of vesicoureteral reflux: a 15-year perspective. J Urol 2002; 168 (6): 2594–2599. DOI: 10.1016/S0022-5347(05)64225-5.
- Hoberman A, Charron M, Hickey RW. Imaging Studies after a First Febrile Urinary Tract Infection in Young Children. New Engl J Med 2003; 348 (3): 195–202. DOI: 10.1056/NEJMoa021698.
- Ylinen E, Ala-Houhala M, Wikström S. Risk of renal scarring in vesicoureteral reflux detected either antenatally or during the neonatal period. Urology 2003; 61 (6): 1242–1243. DOI: 10.1016/s0090-4295(03)00229-2.
- Rolleston GL, Shannon FT, Utley WL. Relationship of infantile vesicoureteric reflux to renal damage. Br Med J 1970; 1 (5694): 460–463. DOI: 10.1136/bmj.1.5694.460.
- Duckett JW, Walker RD, Weiss R. Surgical results: International Reflux Study in Children\–United States branch. J Urol 1992. DOI: 10.1016/s0022-5347(17)36999-9.
- Berg UB. Long-term followup of renal morphology and function in children with recurrent pyelonephritis. J Urol 1992. DOI: 10.1016/s0022-5347(17)37012-x.
- Nepple KG, Knudson MJ, Austin JC. Abnormal renal scans and decreased early resolution of low grade vesicoureteral reflux. Suppl):1643-7; Discussion 1647 2008; 180(4. DOI: 10.1016/j.juro.2008.03.102.
- Metcalfe CB, Macneily AE, Afshar K. Reliability assessment of international grading system for vesicoureteral reflux. J Urol 2012; 188(4. DOI: 10.1016/j.juro.2012.02.015.
- Greenfield SP, Carpenter MA, Chesney RW. The RIVUR voiding cystourethrogram pilot study: experience with radiologic reading concordance. J Urol 2012; 188(4. DOI: 10.1016/j.juro.2012.06.032.
- Cooper CS, Alexander SE, Kieran K. Utility of the distal ureteral diameter on VCUG for grading VUR. J Pediatr Urol 2015; 11 (4). DOI: 10.1016/j.jpurol.2015.04.009.
- Arlen AM, Leong T, Guidos PJ. Distal Ureteral Diameter Ratio is Predictive of Breakthrough Febrile Urinary Tract Infection. J Urol 2017; 198 (6): 1418–1423. DOI: 10.1016/j.juro.2017.06.095.
- Cooper CS, Birusingh KK, Austin JC. Distal ureteral diameter measurement objectively predicts vesicoureteral reflux outcome. J Pediatr Urol 2013; 9 (1): 99–103. DOI: 10.1016/j.jpurol.2011.12.011.
- Arlen AM, Kirsch AJ, Leong T. Validation of the ureteral diameter ratio for predicting early spontaneous resolution of primary vesicoureteral reflux. J Pediatr Urol 2017; 13 (4). DOI: 10.1016/j.jpurol.2017.01.012.
- Troesch VL, Wald M, Bonnett MA. The additive impact of the distal ureteral diameter ratio in predicting early breakthrough urinary tract infections in children with vesicoureteral reflux. J Pediatr Urol 2021; 17 (2). DOI: 10.1016/j.jpurol.2021.01.003.
- Alexander SE, Arlen AM, Storm DW. Bladder volume at onset of vesicoureteral reflux is an independent risk factor for breakthrough febrile urinary tract infection. J Urol 2015; 193 (4): 1342–1346. DOI: 10.1016/j.juro.2014.10.002.
- McMillan ZM, Austin JC, Knudson MJ. Bladder volume at onset of reflux on initial cystogram predicts spontaneous resolution. J Urol 2006. DOI: 10.1016/s0022-5347(06)00619-7.
- Nepple KG, Knudson MJ, Austin JC. Adding renal scan data improves the accuracy of a computational model to predict vesicoureteral reflux resolution. Suppl):1648-52; Discussion 1652 DOI: 101016/Jjuro200803109 PMID 2008; 180(4: 1648–1652. DOI: 10.1016/j.juro.2008.03.109.
- Knudson MJ, Austin JC, Wald M. Computational model for predicting the chance of early resolution in children with vesicoureteral reflux. Pt 2):1824-7 DOI: 101016/Jjuro200705093 PMID 2007; 178: 1824–1827. DOI: 10.1016/j.juro.2007.05.093.
- Knudson MJ, Austin JC, McMillan ZM. Predictive factors of early spontaneous resolution in children with primary vesicoureteral reflux. J Urol 2007; 178(4. DOI: 10.1016/j.juro.2007.03.161.
- KJ A, MT M, JC A. Nuclear cystometrogram-determined bladder pressure at onset of vesicoureteral reflux predicts spontaneous resolution. Urology 2007; 69 (4): 767–770. DOI: 10.1016/j.urology.2007.01.048.
- Cooper CS, Madsen MT, Austin JC. Bladder pressure at the onset of vesicoureteral reflux determined by nuclear cystometrogram. J Urol 2003; 170: 1537–1540. DOI: 10.1097/01.ju.0000083638.36182.5e.
- Arsanjani A, Alagiri M. Identification of filling versus voiding reflux as predictor of clinical outcome. Urology 2007; 70 (2): 351–354. DOI: 10.1016/j.urology.2007.03.031.
- Garcia-Roig M, Ridley DE, McCracken C. Vesicoureteral Reflux Index: Predicting Primary Vesicoureteral Reflux Resolution in Children Diagnosed after Age 24 Months. J Urol 2017; 197 (4): 1150–1157. DOI: 10.1016/j.juro.2016.12.008.
- Arlen AM, Leong T, Wu CQ. Predicting Breakthrough Urinary Tract Infection: Comparative Analysis of Vesicoureteral Reflux Index, Reflux Grade and Ureteral Diameter Ratio. J Urol 2020; 204 (3): 572–577. DOI: 10.1097/JU.0000000000001035.
- Keren R, Shaikh N, Pohl H. Risk Factors for Recurrent Urinary Tract Infection and Renal Scarring. Pediatrics 2015; 136 (1). DOI: 10.1542/peds.2015-0409.
- Lenaghan D, Whitaker JG, Jensen F. The natural history of reflux and long-term effects of reflux on the kidney. J Urol 1976; 115 (6): 10 1016 0022–5347 17 59352–59350. DOI: 10.1016/s0022-5347(17)59352-0.
- Olbing H, Claësson I, Ebel KD. Renal scars and parenchymal thinning in children with vesicoureteral reflux: a 5-year report of the International Reflux Study in Children (European branch. J Urol 1992. DOI: 10.1016/s0022-5347(17)36995-1.
- Mingin GC, Nguyen HT, Baskin LS. Abnormal dimercapto-succinic acid scans predict an increased risk of breakthrough infection in children with vesicoureteral reflux. J Urol 2004; 172 (3): 1075–1077. DOI: 10.1097/01.ju.0000135750.17348.e4.
- Loukogeorgakis SP, Burnand K, MacDonald A. Renal scarring is the most significant predictor of breakthrough febrile urinary tract infection in patients with simplex and duplex primary vesico-ureteral reflux. J Pediatr Urol 2020; 16 (2). DOI: 10.1016/j.jpurol.2019.11.018.
- Wallace DM, Rothwell DL, Williams DI. The long-term follow-up of surgically treated vesicoureteric reflux. Br J Urol 1978; 50 (7): 10 1111 1464–1410 1978 06195. DOI: 10.1111/j.1464-410x.1978.tb06195.x.
- Edwards D, Normand IC, Prescod N. Disappearance of vesicoureteric reflux during long-term prophylaxis of urinary tract infection in children. Br Med J 1977; 2 (6082): 285–288. DOI: 10.1136/bmj.2.6082.285.
- Jodal U, Lindberg U. Guidelines for management of children with urinary tract infection and vesico-ureteric reflux. Recommendations from a Swedish state-of-the-art conference. Swedish Medical Research Council Acta Paediatr Suppl 1999; 88 (431): 87–89. DOI: 10.1111/j.1651-2227.1999.tb01323.x.
- Mor Y, Leibovitch I, Zalts R. Analysis of the long-term outcome of surgically corrected vesico-ureteric reflux. BJU Int 2003; 92 (1): 10 1046 1464–1410 2003 04264. DOI: 10.1046/j.1464-410x.2003.04264.x.
- Lebowitz RL. The detection and characterization of vesicoureteral reflux in the child. J Urol 1992. DOI: 10.1016/s0022-5347(17)36991-4.
- Dalirani R, Mahyar A, Sharifian M. The value of direct radionuclide cystography in the detection of vesicoureteral reflux in children with normal voiding cystourethrography. Pediatr Nephrol 2014; 29 (12): 10 1007 00467–00014–2871–. DOI: 10.1007/s00467-014-2871-y.
- McLaren CJ, Simpson ET. Direct comparison of radiology and nuclear medicine cystograms in young infants with vesico-ureteric reflux. BJU Int 2001; 87 (1): 10 1046 1464–1410 2001 00997. DOI: 10.1046/j.1464-410x.2001.00997.x.
- Frimberger D, Mercado-Deane MG, McKenna PH. Establishing a Standard Protocol for the Voiding Cystourethrography. Pediatrics 2016; 138 (5): 10 1542 2016–2590. DOI: 10.1542/9781610021494-part05-establishing_a_stand.
- Strauss KJ, Kaste SC. The ALARA (as low as reasonably achievable) concept in pediatric interventional and fluoroscopic imaging: striving to keep radiation doses as low as possible during fluoroscopy of pediatric patients\–a white paper executive summary. Radiology 2006; 240 (3): 621–622. DOI: 10.1148/radiol.2403060698.
- Arant BS Jr. Vesicoureteral reflux and evidence-based management. J Pediatr 2001; 139 (5): 620–621. DOI: 10.1067/mpd.2001.119451.
- Shiraishi K, Matsuyama H, Nepple KG. Validation of a prognostic calculator for prediction of early vesicoureteral reflux resolution in children. J Urol 2009; 182 (2): 690–691. DOI: 10.1016/j.juro.2009.04.036.
- Kim D, Choi YH, Choi G. Contrast-enhanced voiding urosonography for the diagnosis of vesicoureteral reflux and intrarenal reflux: a comparison of diagnostic performance with fluoroscopic voiding cystourethrography. Ultrasonography 2021; 40 (4): 530–537. DOI: 10.14366/usg.20157.
- Ntoulia A, Back SJ, Shellikeri S. Contrast-enhanced voiding urosonography (ceVUS) with the intravesical administration of the ultrasound contrast agent OptisonTM for vesicoureteral reflux detection in children: a prospective clinical trial. Pediatr Radiol 2018; 48 (2): 10 1007 00247–00017–4026–4023. DOI: 10.1007/s00247-017-4026-3.
- Elison BS, Taylor D, Wall H. Comparison of DMSA scintigraphy with intravenous urography for the detection of renal scarring and its correlation with vesicoureteric reflux. Br J Urol 1992; 69 (3): 10 1111 1464–1410 1992 15532. DOI: 10.1111/j.1464-410x.1992.tb15532.x.
- Majd M, Nussbaum Blask AR, Markle BM. Acute pyelonephritis: comparison of diagnosis with 99mTc-DMSA, SPECT, spiral CT, MR imaging, and power Doppler US in an experimental pig model. Radiology 2001; 218 (1): 101–108. DOI: 10.1148/radiology.218.1.r01ja37101.
- Hamoui N, Hagerty JA, Maizels M. Ultrasound fails to delineate significant renal pathology in children with urinary tract infections: a case for dimercapto-succinic acid scintigraphy. Suppl):1639-42; Discussion 1642 2008; 180(4. DOI: 10.1016/j.juro.2008.03.119.
- Smokvina A, Grbac-Ivanković S, Girotto N. The renal parenchyma evaluation: MAG3 vs. DMSA Coll Antropol 2005; 29 (2): 649–654.
- Sfakianakis GN, Cavagnaro F, Zilleruelo G. Diuretic MAG3 scintigraphy (F0) in acute pyelonephritis: regional parenchymal dysfunction and comparison with DMSA. J Nucl Med 2000; 41 (12): 1955–1963.
- Gordon I, Anderson PJ, Lythgoe MF. Can technetium-99m-mercaptoacetyltriglycine replace technetium-99m-dimercaptosuccinic acid in the exclusion of a focal renal defect? J Nucl Med 1992; 33 (12): 1334134.
- Lee RS, Cendron M, Kinnamon DD. Antenatal hydronephrosis as a predictor of postnatal outcome: a meta-analysis. Pediatrics 2006; 118 (2): 586–593. DOI: 10.1542/PEDS.2006-0120.
- Herndon CDA, McKenna PH, Kolon TF. A multicenter outcomes analysis of patients with neonatal reflux presenting with prenatal hydronephrosis. J Urol 1999; 162 (3 Pt 2): 1203–1208. DOI: 10.1097/00005392-199909000-00096.
- Nguyen HT, Herndon CDA, Cooper C. The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis. J Pediatr Urol 2010; 6 (3): 212–231. DOI: 10.1016/J.JPUROL.2010.02.205.
- Upadhyay J, McLorie GA, Bolduc S. Natural history of neonatal reflux associated with prenatal hydronephrosis: Long-term results of a prospective study. J Urol 2003; 169 (5): 1837–1841. DOI: 10.1097/01.ju.0000062440.92454.cf.
- Berrocal T, Pinilla I, Gutiérrez J. Mild hydronephrosis in newborns and infants: can ultrasound predict the presence of vesicoureteral reflux. Pediatr Nephrol 2007; 22 (1): 91–96. DOI: 10.1007/S00467-006-0285-1.
- Farhat W, McLorie G, Geary D. The natural history of neonatal vesicoureteral reflux associated with antenatal hydronephrosis. J Urol 2000; 164 (3 Pt 2): 1057–1060. DOI: 10.1097/00005392-200009020-00033.
- M A, K W-L, BK V. Society for fetal urology recommendations for postnatal evaluation of prenatal hydronephrosis\–will fewer voiding cystourethrograms lead to more urinary tract infections? J Urol 2013. DOI: 10.1016/J.JURO.2013.03.038.
- Braga LH, Farrokhyar F, DĆruz J. Risk factors for febrile urinary tract infection in children with prenatal hydronephrosis: a prospective study. J Urol 2015. DOI: 10.1016/J.JURO.2014.10.091.
- Zee RS, Herndon CDA, Cooper CS. Time to resolution: A prospective evaluation from the Society for Fetal Urology hydronephrosis registry. J Pediatr Urol 2017; 13 (3). DOI: 10.1016/J.JPUROL.2016.12.012.
- Silay MS, Undre S, Nambiar AK. Role of antibiotic prophylaxis in antenatal hydronephrosis: A systematic review from the European Association of Urology/European Society for Paediatric Urology Guidelines Panel. J Pediatr Urol 2017; 13 (3): 306–315. DOI: 10.1016/J.JPUROL.2017.02.023.
- Braga LH, Mijovic H, Farrokhyar F. Antibiotic prophylaxis for urinary tract infections in antenatal hydronephrosis. Pediatrics 2013; 131 (1): 10 1542 2012–1870. DOI: 10.1542/peds.2012-1870.
- Easterbrook B, Capolicchio JP, Braga LH. Antibiotic prophylaxis for prevention of urinary tract infections in prenatal hydronephrosis: An updated systematic review. Can Urol Assoc J 2017; 11 (1-2Suppl1). DOI: 10.5489/CUAJ.4384.
- Zareba P, Lorenzo AJ, Braga LH. Risk factors for febrile urinary tract infection in infants with prenatal hydronephrosis: comprehensive single center analysis. J Urol 2014. DOI: 10.1016/J.JURO.2013.10.035.
- Coelho GM, Bouzada MCF, Pereira AK. Outcome of isolated antenatal hydronephrosis: a prospective cohort study. Pediatr Nephrology 2007; 22 (10): 1727–1734. DOI: 10.1007/S00467-007-0539-6.
- Szymanski KM, Al-Said AN, Pippi Salle JL. Do infants with mild prenatal hydronephrosis benefit from screening for vesicoureteral reflux? J Urol 2012; 188 (2): 576–581. DOI: 10.1016/J.JURO.2012.04.017.
- Routh JC, Grant FD, Kokorowski P. Costs and consequences of universal sibling screening for vesicoureteral reflux: decision analysis. Pediatrics 2010; 126 (5): 10 1542 2010–0744. DOI: 10.1542/peds.2010-0744d.
- Hunziker M, Colhoun E, Puri P. Renal cortical abnormalities in siblings of index patients with vesicoureteral reflux. Pediatrics 2014; 133 (4): 10 1542 2013–3498. DOI: 10.1542/peds.2013-3498d.
- Nelson CP, Finkelstein JA, Logvinenko T. Incidence of Urinary Tract Infection Among Siblings of Children With Vesicoureteral Reflux. Acad Pediatr 2016; 16 (5): 489–495. DOI: 10.1016/j.acap.2015.11.003.
- Skoog SJ, Peters CA, Arant BS Jr.. Pediatric Vesicoureteral Reflux Guidelines Panel Summary Report: Clinical Practice Guidelines for Screening Siblings of Children With Vesicoureteral Reflux and Neonates/Infants With Prenatal Hydronephrosis. J Urol 2010; 184 (3): 1145–1151. DOI: 10.1016/j.juro.2010.05.066.
- Urinary Tract Infection SCoQI S, Management RKB. Urinary Tract Infection: Clinical Practice Guideline for the Diagnosis and Management of the Initial UTI in Febrile Infants and Children 2 to 24 Months. Pediatrics 2011; 128 (3): 595–610. DOI: 10.1542/peds.2011-1330.
- Mattoo TK, Carpenter MA, Moxey-Mims M. The RIVUR trial: a factual interpretation of our data. Pediatr Nephrol 2015; 30 (5): 10 1007 00467–00014–3022–3021. DOI: 10.1007/s00467-014-3022-1.
- Shaikh N, Haralam MA, Kurs-Lasky M. Association of Renal Scarring With Number of Febrile Urinary Tract Infections in Children. JAMA Pediatrics 2019; 173 (10): 949–952. DOI: 10.1001/JAMAPediatrics.2019.2504.
- Coulthard MG, Flecknell P, Orr H. Renal scarring caused by vesicoureteric reflux and urinary infection: a study in pigs. Pediatr Nephrol 2002; 17 (7): 10 1007 00467–00002–0878–0872. DOI: 10.1007/s00467-002-0878-2.
- Montini G, Rigon L, Zucchetta P. Prophylaxis after first febrile urinary tract infection in children? A multicenter, randomized, controlled, noninferiority trial. Pediatrics 2008; 122 (5): 1064–1071. DOI: 10.1542/peds.2007-3770.
- Pennesi M, Travan L, Peratoner L. Is antibiotic prophylaxis in children with vesicoureteral reflux effective in preventing pyelonephritis and renal scars? A randomized, controlled trial. Pediatrics 2008; 121 (6): 10 1542 2007–2652. DOI: 10.1542/peds.2008-2339.
- Roussey-Kesler G, Gadjos V, Idres N. Antibiotic prophylaxis for the prevention of recurrent urinary tract infection in children with low grade vesicoureteral reflux: Results from a prospective randomized study. J Urol 2008; 179 (2): 674–679. DOI: 10.1016/J.JURO.2007.09.090.
- Conway PH, Cnaan A, Zaoutis T. Recurrent urinary tract infections in children: risk factors and association with prophylactic antimicrobials. JAMA 2007; 298 (2): 179–186. DOI: 10.1001/jama.298.2.179.
- Investigators RT, Hoberman A, Greenfield SP. Antimicrobial Prophylaxis for Children with Vesicoureteral Reflux. New Engl J Med 2014; 370 (25): 2367–2376. DOI: 10.1056/NEJMoa1401811.
- Cooper CS, Chung BI, Kirsch AJ. The outcome of stopping prophylactic antibiotics in older children with vesicoureteral reflux. J Urol 2000; 163 (1): 269–273. DOI: 10.1016/S0022-5347(05)68034-2.
- Thompson RH, Chen JJ, Pugach J. Cessation of prophylactic antibiotics for managing persistent vesicoureteral reflux. J Urol 2001; 166 (4): 1465–1469. DOI: 10.1097/00005392-200110000-00072.
- Jodal U, Koskimies O, Hanson E. Infection pattern in children with vesicoureteral reflux randomly allocated to operation or long-term antibacterial prophylaxis. The International Reflux Study in Children. J Urol 1992. DOI: 10.1016/s0022-5347(17)36994-x.
- Bailey RR. Commentary: the management of grades I and II (nondilating) vesicoureteral reflux. J Urol 1992. DOI: 10.1016/s0022-5347(17)37004-0.
- A prospective trial of operative versus non-operative treatment of severe vesico-ureteric reflux: 2 years\’observation in 96 children. The Birmingham Reflux Study Group. Contrib Nephrol 1984; 39 (169-85): 6744870. DOI: 10.1136/bmj.295.6592.237.
- Leslie B, Moore K, Salle JL. Outcome of antibiotic prophylaxis discontinuation in patients with persistent vesicoureteral reflux initially presenting with febrile urinary tract infection: time to event analysis. J Urol 2010; 184 (3): 1093–1098. DOI: 10.1016/j.juro.2010.05.013.
- Allen UD, MacDonald N, Fuite L. Risk factors for resistance to f́irst-line\’antimicrobials among urinary tract isolates of Escherichia coli in children. CMAJ 1999; 160 (10): 1436–1440.
- Cheng CH, Tsai MH, Huang YC. Antibiotic Resistance Patterns of Community-Acquired Urinary Tract Infections in Children With Vesicoureteral Reflux Receiving Prophylactic Antibiotic Therapy. Pediatrics 2008; 122 (6): 1212–1217. DOI: 10.1542/peds.2007-2926.
- Cooper CS. Fat, demented and stupid: An unrecognized legacy of pediatric urology? J Pediatr Urol 2017; 13 (4): 341–344. DOI: 10.1016/J.JPUROL.2017.04.027.
- Guidos PJ, Arlen AM, Leong T. Impact of continuous low-dose antibiotic prophylaxis on growth in children with vesicoureteral reflux. J Pediatr Urol 2018; 14 (4). DOI: 10.1016/J.JPUROL.2018.07.007.
- Gaither TW, Cooper CS, Kornberg Z. Predictors of becoming overweight among pediatric patients at risk for urinary tract infections. J Pediatr Urol 2019; 15 (1). DOI: 10.1016/J.JPUROL.2018.09.002.
- Akagawa Y, Kimata T, Akagawa S. Impact of Long-Term Low Dose Antibiotic Prophylaxis on Gut Microbiota in Children. J Urol 2020; 204 (6): 1320–1325. DOI: 10.1097/JU.0000000000001227.
- Copp HL, Nelson CP, Shortliffe LD. Compliance with antibiotic prophylaxis in children with vesicoureteral reflux: results from a national pharmacy claims database. J Urol 2010; 183 (5): 1994–2000. DOI: 10.1016/J.JURO.2010.01.036.
- Fast AM, Nees SN, Batavia JP. Outcomes of targeted treatment for vesicoureteral reflux in children with nonneurogenic lower urinary tract dysfunction. J Urol 2013; 190 (3): 1028–1032. DOI: 10.1016/j.juro.2013.03.005.
- Smellie JM. Commentary: management of children with severe vesicoureteral reflux. J Urol 1992. DOI: 10.1016/s0022-5347(17)37000-3.
- J BM, editor. Prospective trial of operative versus non-operative treatment of severe vesicoureteric reflux in children: five years\’observation. Birmingham Reflux Study Group. 1987; 295 (6592): 237–241. DOI: 10.1136/bmj.295.6592.237.
- Elo J, Tallgren LG, Alfthan O. Character of urinary tract infections and pyelonephritic renal scarring after antireflux surgery. J Urol 1983; 129 (2): 6834504. DOI: 10.1016/s0022-5347(17)52089-3.
- Belman AB. Vesicoureteral reflux. Pediatr Clin North Am 1997; 44 (5): 9326957. DOI: 10.53347/rid-12076.
- Ransley PG, Risdon RA. The pathogenesis of reflux nephropathy. Contrib Nephrol 1979; 16: 90–97. DOI: 10.1159/000402880.
- Molitierno JA, Scherz HC, Kirsch AJ. Endoscopic treatment of vesicoureteral reflux using dextranomer hyaluronic acid copolymer. J Pediatr Urol 2008; 4 (3): 221–228. DOI: 10.1016/j.jpurol.2007.11.015.
- Stenberg AM, Sundin A, Larsson BS. Lack of distant migration after injection of a 125iodine labeled dextranomer based implant into the rabbit bladder. J Urol 1997; 158 (5): 10 1016 0022–5347 01 64185–64185. DOI: 10.1016/s0022-5347(01)64185-5.
- Läckgren G, Wåhlin N, Sköldenberg E. Long-term followup of children treated with dextranomer/hyaluronic acid copolymer for vesicoureteral reflux. J Urol 2001; 166 (5): 10 1016 0022–5347 05 65713–65718. DOI: 10.1097/00005392-200111000-00076.
- Kirsch AJ, Perez-Brayfield MR, Scherz HC. Minimally invasive treatment of vesicoureteral reflux with endoscopic injection of dextranomer/hyaluronic acid copolymer: the Childrenś Hospitals of Atlanta experience. J Urol 2003; 170 (1): 211–215. DOI: 10.1097/01.ju.0000072523.43060.a0.
- Dave S, Lorenzo AJ, Khoury AE. Learning from the learning curve: factors associated with successful endoscopic correction of vesicoureteral reflux using dextranomer/hyaluronic acid copolymer. J Urol 2008; 180(4: 1594–1599. DOI: 10.1016/j.juro.2008.03.084.
- Kirsch AJ, Perez-Brayfield M, Smith EA. The modified sting procedure to correct vesicoureteral reflux: improved results with submucosal implantation within the intramural ureter. J Urol 2004; 171 (6 Pt 1): 2413–2416. DOI: 10.1097/01.ju.0000127754.79866.7f.
- McMann LP, Scherz HC, Kirsch AJ. Long-term preservation of dextranomer/hyaluronic acid copolymer implants after endoscopic treatment of vesicoureteral reflux in children: a sonographic volumetric analysis. J Urol 2007; 177 (1): 320. DOI: 10.1016/j.juro.2006.08.144.
- Baydilli N, Selvi I, Pinarbasi AS. Additional VCUG-related parameters for predicting the success of endoscopic injection in children with primary vesicoureteral reflux. J Pediatr Urol 2021; 17 (1). DOI: 10.1016/j.jpurol.2020.11.018.
- Kirsch AJ, Cooper CS, Läckgren G. Non-Animal Stabilized Hyaluronic Acid/Dextranomer Gel (NASHA/Dx, Deflux) for Endoscopic Treatment of Vesicoureteral Reflux: What Have We Learned Over the Last 20 Years? Urology 2021; 157: 15–28. DOI: 10.1016/j.urology.2021.07.032.
- Routh JC, Inman BA, Reinberg Y. Dextranomer/hyaluronic acid for pediatric vesicoureteral reflux: systematic review. Pediatrics 2010; 125 (5): 10 1542 2009–2225. DOI: 10.1016/j.yped.2011.04.057.
- Elder JS, Diaz M, Caldamone AA. Endoscopic therapy for vesicoureteral reflux: a meta-analysis. I. Reflux resolution and urinary tract infection. J Urol 2006; 175 (2): 10 1016 0022–5347 05 00210–00217. DOI: 10.1016/s0084-4071(08)70406-8.
- Arlen AM, Scherz HC, Filimon E. Is routine voiding cystourethrogram necessary following double hit for primary vesicoureteral reflux? J Pediatr Urol 2015; 11 (1). DOI: 10.1016/j.jpurol.2014.11.011.
- Wang PZT, Abdelhalim A, Walia A. Avoiding routine postoperative voiding cystourethrogram: Predicting radiologic success for endoscopically treated vesicoureteral reflux. Can Urol Assoc J 2019; 13 (5). DOI: 10.5489/cuaj.5589.
- Knudson MJ, Cooper CS, Block CA. Calcification of glutaraldehyde cross-linked collagen in bladder neck injections in children with incontinence: a long-term complication. J Urol 2006; 176 (3): 1143–1146. DOI: 10.1016/j.juro.2006.04.059.
- Gargollo PC, Paltiel HJ, Rosoklija I. Mound calcification after endoscopic treatment of vesicoureteral reflux with autologous chondrocytes\–a normal variant of mound appearance? J Urol 2009; 181 (6): 2707–2708. DOI: 10.1016/j.juro.2009.02.053.
- Noe HN. Calcification in a Deflux bleb thought to be a ureteral calculus in a child. J Pediatr Urol 2008; 4 (1): 88–89. DOI: 10.1016/j.jpurol.2007.02.005.
- Vandersteen DR, Routh JC, Kirsch AJ. Postoperative ureteral obstruction after subureteral injection of dextranomer/hyaluronic Acid copolymer. J Urol 2006; 176(4. DOI: 10.1016/j.juro.2006.06.101.
- Papagiannopoulos D, Rosoklija I, Cheng E. Delayed Obstruction With Asymptomatic Loss of Renal Function After Dextranomer/Hyaluronic Acid Copolymer (Deflux) Injection for Vesicoureteral Reflux: A Close Look at a Disturbing Outcome. Urology 2017; 101: 63–66. DOI: 10.1016/j.urology.2016.09.013.
- Romain J, Fourcade L, Centi J. Delayed-onset Ureteral Obstruction and Calcification Masquerading as Renal Colic Following Deflux Injection. Urology 2016; 94: 218–220. DOI: 10.1016/j.urology.2016.03.001.
- Christen S, Mendoza M, Gobet R. Late ureteral obstruction after injection of dextranomer/hyaluronic acid copolymer. Urology 2014; 83 (4): 920–922. DOI: 10.1016/j.urology.2013.10.053.
- Austin JC, Cooper CS. Vesicoureteral reflux: surgical approaches. Urol Clin North Am 2004; 31 (3): 543–557. DOI: 10.1016/j.ucl.2004.04.018.
- Sprunger JK, Reese CT, Decter RM. Can standard open pediatric urological procedures be performed on an outpatient basis? J Urol 2001; 166 (3): 1062–1064. DOI: 10.1097/00005392-200109000-00083.
- Marotte JB, Smith DP. Extravesical ureteral reimplantations for the correction of primary reflux can be done as outpatient procedures. J Urol 2001; 165 (6 Pt 2): 10 1097 00005392–200106001–00003. DOI: 10.1016/s0022-5347(05)66171-x.
- Palmer JS. Bilateral extravesical ureteral reimplantation in toilet-trained children: short-stay procedure without urinary retention. Urology 2009; 73 (2): 285–288. DOI: 10.1016/j.urology.2008.07.046.
- Barrieras D, Lapointe S, Reddy PP. Are postoperative studies justified after extravescial ureteral reimplantation? J Urol 2000; 164(3. DOI: 10.1097/00005392-200009020-00035.
- Bisignani G, Decter RM. Voiding cystourethrography after uncomplicated ureteral reimplantation in children: is it necessary? J Urol 1997; 158(3. DOI: 10.1016/s0022-5347(01)64437-9.
- El-Ghoneimi A, Odet E, Lamer S. Cystography after the Cohen ureterovesical reimplantation: is it necessary at a training center? J Urol 1999; 162(3. DOI: 10.1016/s0022-5347(01)68133-3.
- Harel M, Herbst KW, Silvis R. Objective pain assessment after ureteral reimplantation: comparison of open versus robotic approach. J Pediatr Urol 2015; 11 (2). DOI: 10.1016/j.jpurol.2014.12.007.
- Boysen WR, Ellison JS, Kim C. Multi-Institutional Review of Outcomes and Complications of Robot-Assisted Laparoscopic Extravesical Ureteral Reimplantation for Treatment of Primary Vesicoureteral Reflux in Children. J Urol 2017; 197 (6): 1555–1561. DOI: 10.1016/j.juro.2017.01.062.
- Kurtz MP, Leow JJ, Varda BK. Robotic versus open pediatric ureteral reimplantation: Costs and complications from a nationwide sample. J Pediatr Urol 2016; 12 (6). DOI: 10.1016/j.jpurol.2016.06.016.
- Bowen DK, Faasse MA, Liu DB. Use of Pediatric Open, Laparoscopic and Robot-Assisted Laparoscopic Ureteral Reimplantation in the United States: 2000 to 2012. J Urol 2016; 196 (1): 207–212. DOI: 10.1016/j.juro.2016.02.065.
- Rolleston GL, Maling TM, Hodson CJ. Intrarenal reflux and the scarred kidney. Arch Dis Child 1974; 49 (7): 531–539. DOI: 10.1136/adc.49.7.531.
- Austin JC. Treatment of vesicoureteral reflux after puberty. Adv Urol 2008; 2008 (590185). DOI: 10.1155/2008/590185.
Dernière mise à jour: 2025-09-22 07:59