15: Anomalies de duplication, de migration et de fusion
Ce chapitre prendra environ 29 minutes de lecture.
Introduction
Les anomalies de duplication, de migration et de fusion des voies urinaires sont fréquentes et entraînent diverses anomalies structurelles et fonctionnelles. Les séquelles anatomiques de la duplication urétérale comprennent l’uretère ectopique, l’urétérocèle et le reflux vésico-urétéral. Celles-ci peuvent se manifester cliniquement par une obstruction des voies urinaires, une infection, une incontinence et une dysplasie rénale. Parmi les anomalies fréquentes de migration et de fusion figurent l’ectopie rénale et le rein en fer à cheval, qui sont parfois associés à des pathologies telles que la dysplasie rénale, le reflux vésico-urétéral, l’obstruction et la lithiase urinaire. La gravité est très variable, et le traitement va de la simple surveillance à une reconstruction chirurgicale majeure. Le traitement, lorsqu’il est indiqué, est principalement chirurgical et vise à préserver la fonction rénale, à réduire au minimum la morbidité liée aux infections des voies urinaires, à corriger l’incontinence urinaire et à soulager les symptômes associés à l’obstruction des voies urinaires.
Embryologie
Une bonne connaissance de l’embryologie normale du développement rénal est essentielle pour comprendre les anomalies de duplication, de migration et de fusion. Deux structures embryologiques donnent naissance au rein humain mature et aux uretères ; le bourgeon urétéral, qui se développe en système collecteur et en uretères, et le mésenchyme métanéphrogène, qui donne naissance aux néphrons et au parenchyme rénal. Le bourgeon urétéral a pour origine une évagination épithéliale de la portion distale du canal mésonéphrique (de Wolff). Normalement, il existe un unique bourgeon urétéral de chaque côté, qui donne naissance à des uretères uniques bilatéraux. Le bourgeon urétéral pénètre dans le mésenchyme métanéphrogène et un processus d’induction réciproque entraîne la néphrogenèse et la ramification urétérale. L’unité rénale avec son système collecteur ramifié (métanéphros) migre crânialement et subit une rotation de 90 degrés, de sorte que le hile rénal est orienté médialement. L’uretère croît caudalement pour s’aboucher au sinus urogénital, qui devient la vessie. Une fois incorporé au sinus urogénital, l’orifice urétéral migre craniolatéralement du col vésical vers la position orthotopique sur la crête du trigone.1
Les anomalies de duplication seraient dues à des bourgeons urétéraux surnuméraires ou à une ramification précoce. Les anomalies de migration résultent d’une ascension anormale ou d’une rotation anormale. Si les reins entrent en contact l’un avec l’autre, ils peuvent fusionner, entraînant un rein en fer à cheval ou une ectopie rénale croisée avec fusion.2
Épidémiologie et physiopathologie
Tableau 1 Pathologies cliniques courantes dans la duplication rénale.
| Anomaly | Potential problems |
|---|---|
| Duplication incomplète | Obstruction de la jonction pyélo-urétérale du pôle inférieur Reflux urétéro-urétéral (théorique) |
| Uretère ectopique | Obstruction du pôle supérieur Incontinence urinaire Pyélonéphrite Épididymite |
| Urétérocèle | Obstruction du pôle supérieur Obstruction du pôle inférieur Obstacle sous-vésical Dysfonction mictionnelle Incontinence urinaire due à une défaillance du sphincter Pyélonéphrite |
| Reflux vésico-urétéral | Néphropathie de reflux Pyélonéphrite |
Duplication
Les anomalies de duplication rénale sont l’anomalie congénitale des voies urinaires la plus fréquente, avec une incidence de 0,8–5 % observée dans les études d’autopsie.3,4 Le terme rein duplex désigne un rein comportant deux hémireins, supérieur et inférieur, chacun doté d’un système de drainage pyélocaliciel indépendant. La duplication bilatérale survient dans 16–40 % des cas, et la duplication est plus fréquemment détectée chez les femmes.3,5 Les anomalies de duplication peuvent être héréditaires, avec une incidence de 12–30 % dans les familles touchées.6,7
La duplication peut être incomplète (partielle) ou complète. En cas de duplication incomplète, les deux systèmes collecteurs peuvent se rejoindre à n’importe quel point avant de pénétrer dans la vessie. Cela se produit lorsqu’un bourgeon urétéral unique se ramifie avant d’atteindre le mésenchyme métanéphrogène.3 La plupart des duplications urétérales sont incomplètes et cliniquement insignifiantes. La duplication partielle va d’un bassinet rénal bifide à une duplication de type en Y, avec des uretères qui se rejoignent à n’importe quel point avant leur insertion dans la vessie. L’un des problèmes rencontrés avec la duplication incomplète est l’obstruction de la jonction pyélo-urétérale (JPU), qui survient presque exclusivement au pôle inférieur.8,9 L’architecture intrarénale des systèmes dupliqués peut expliquer la prédilection des obstructions de la JPU pour le pôle inférieur. Typiquement, l’uretère du pôle supérieur draine un infundibule unique sans véritable bassinet. Le pôle inférieur, qui représente les deux tiers du parenchyme, contient habituellement au moins deux calices majeurs et un véritable bassinet rénal.9
La pathologie cliniquement significative découle plus fréquemment d’une duplication complète. En cas de duplication complète, des uretères indépendants drainent les moitiés rénales supérieure et inférieure et s’abouchent séparément dans les voies génito-urinaires. Ceci survient lorsque deux bourgeons urétéraux émergent du canal mésonéphrotique. Chaque bourgeon ou ramification induit la maturation d’une unité rénale sus-jacente. Distalement, l’uretère inférieur sera incorporé en premier au sinus urogénital et migrera plus crânio-latéralement. L’uretère supérieur est incorporé plus tardivement ou pas du tout et est donc déplacé médialement et caudalement dans la vessie ou, s’il n’atteint jamais le sinus urogénital, est situé de façon ectopique le long des dérivés du canal mésonéphrotique. L’orifice urétéral crânio-latéral est donc constamment associé à la moitié rénale inférieure et l’orifice urétéral caudo-médial à la moitié rénale supérieure, relation embryologique connue sous le nom de loi de Weigert-Meyer.10,11 Rarement, des bourgeons urétéraux supplémentaires ou une ramification précoce peuvent conduire à une triplication urétérale (Figure 1).
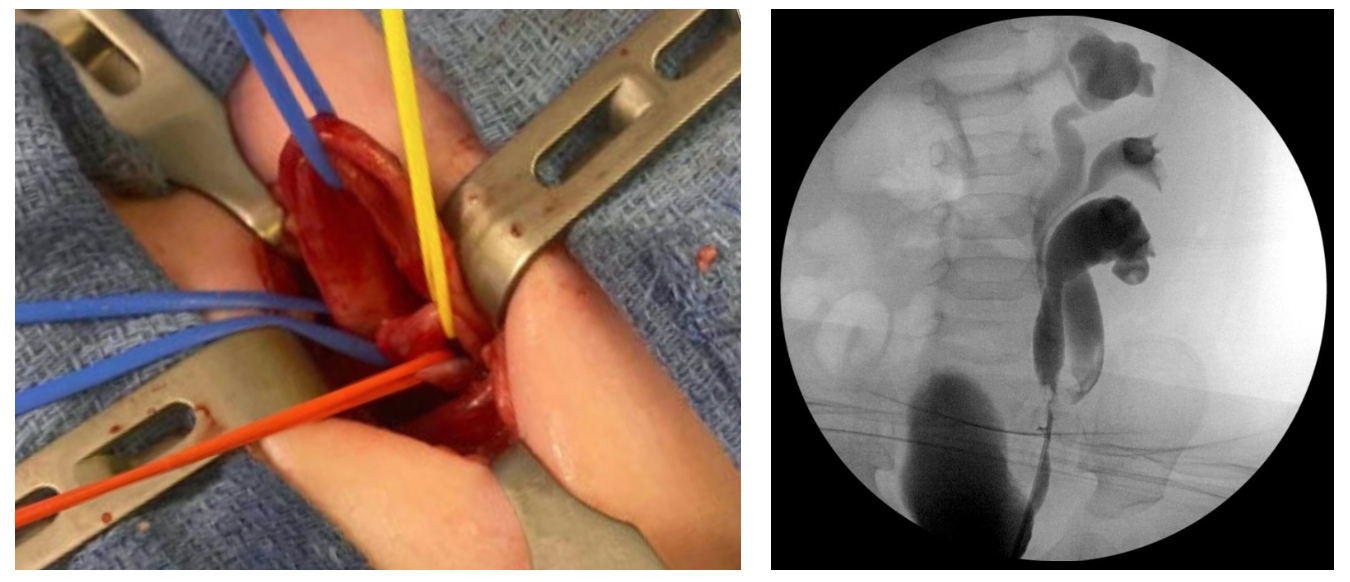
Figure 1 Triplication urétérale. A: Photographie peropératoire lors d’une urétéro-urétérostomie de l’uretère du pôle supérieur vers l’uretère du pôle inférieur. La boucle vasculaire bleue proximale entoure l’uretère du pôle supérieur, qui est ectopique au niveau du col vésical avec obstruction. Les boucles vasculaires rouge et jaune entourent les uretères des pôles moyen et inférieur, qui sont incomplètement dupliqués. B: Urétéropyélogramme rétrograde après urétéro-urétérostomie.
Uretère ectopique
Un uretère ectopique s’insère typiquement en position caudale par rapport à l’emplacement normal sur la crête trigonale, le long de la voie de développement du système mésonéphrique. Chez les garçons, les uretères ectopiques peuvent s’ouvrir dans le col vésical, l’urètre postérieur (le plus fréquent), ou des dérivés du canal mésonéphrique : épididyme, vésicule séminale, ou canal déférent.12 Fait notable, ces localisations sont proximales par rapport au complexe sphinctérien urétral et n’entraînent donc jamais d’incontinence. À l’inverse, chez les filles, les uretères ectopiques peuvent se terminer distalement au sphincter externe et provoquer une incontinence urinaire continue. Les sites terminaux les plus fréquents des uretères ectopiques chez les filles sont le col vésical et l’urètre proximal (1/3), le vestibule vaginal (1/3), le vagin (1/4), et le col de l’utérus, l’utérus, ou le rectum (rare).12,13 Environ 75–90 % des uretères ectopiques sont associés à l’hémirein supérieur d’un rein duplex.14,15
Les problèmes résultant de l’ectopie urétérale comprennent l’obstruction urétérale avec dysplasie rénale consécutive et/ou un risque d’infection, une incontinence urinaire continue chez les filles, et, occasionnellement, une épididymite due au reflux d’urine dans le canal déférent chez les garçons.
Urétérocèle
Un urétérocèle est une dilatation kystique de la portion terminale de l’uretère. L’embryologie n’est pas entièrement élucidée. Selon une théorie, les urétérocèles résultent de la persistance de la membrane de Chwalle, la membrane urétérale primitive qui sépare le bourgeon urétérique du sinus urogénital en développement. D’autres estiment qu’un urétérocèle résulte d’une induction anormale de la musculature du trigone vésical.16,17
Divers systèmes de classification ont été proposés selon la localisation de l’ouverture urétérale, les caractéristiques de l’orifice, ou l’association avec des systèmes collecteurs simples ou duplex. La classification adoptée par la Section d’urologie de l’Académie américaine de pédiatrie est peut-être la plus simple et classe les urétérocèles selon la localisation du tissu urétéral dilaté.18 Les urétérocèles sont classées comme intravésicales (orthotopiques) ou extravésicales (ectopiques). Les urétérocèles intravésicales sont entièrement contenues dans la vessie (Figure 2). Les urétérocèles qui s’étendent au-delà du col vésical sont classées comme extravésicales. Parfois, il peut être difficile de distinguer les deux. Par exemple, une urétérocèle intravésicale peut se prolaber à travers le col vésical et une urétérocèle extravésicale peut présenter un orifice urétéral intravésical (Figure 3). Les urétérocèles extravésicales avec extension sous-muqueuse au-delà du col vésical sont parfois appelées céco-urétérocèles.
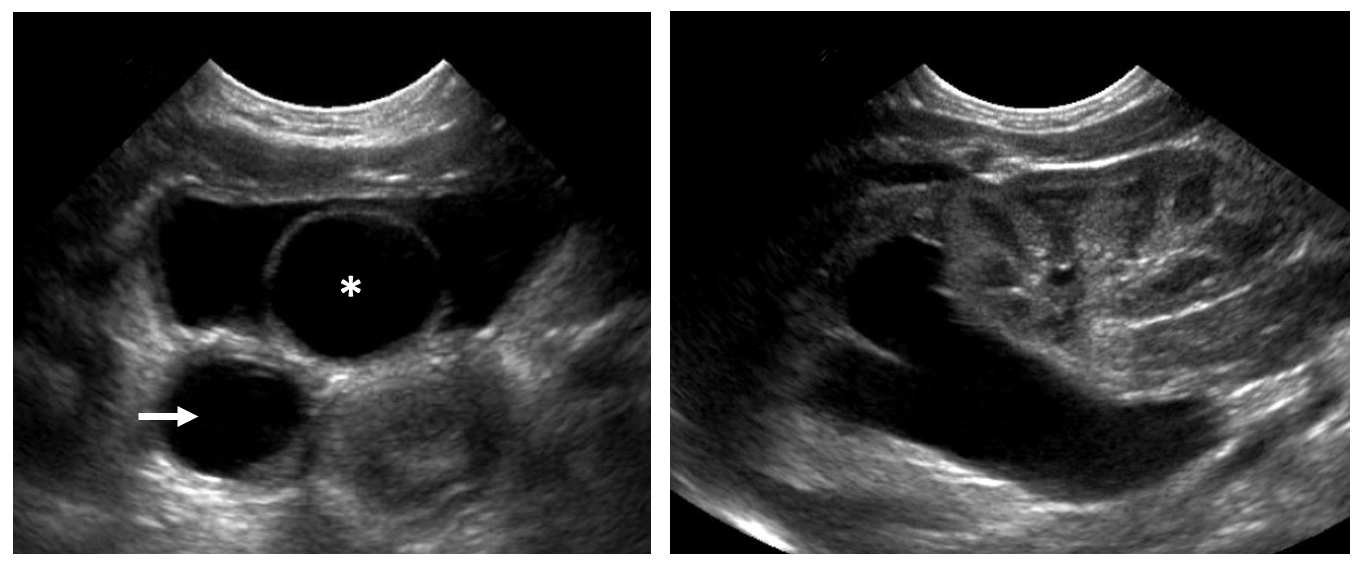
Figure 2 Urétérocèle intravésicale. A : Urétérocèle intravésicale présentant à l’échographie son aspect kystique caractéristique à paroi fine (astérisque). Une dilatation urétérale marquée est notée (flèche). B : L’hémirein supérieur associé à l’urétérocèle est hydronéphrotique avec amincissement du parenchyme rénal. L’hémirein inférieur paraît sain.
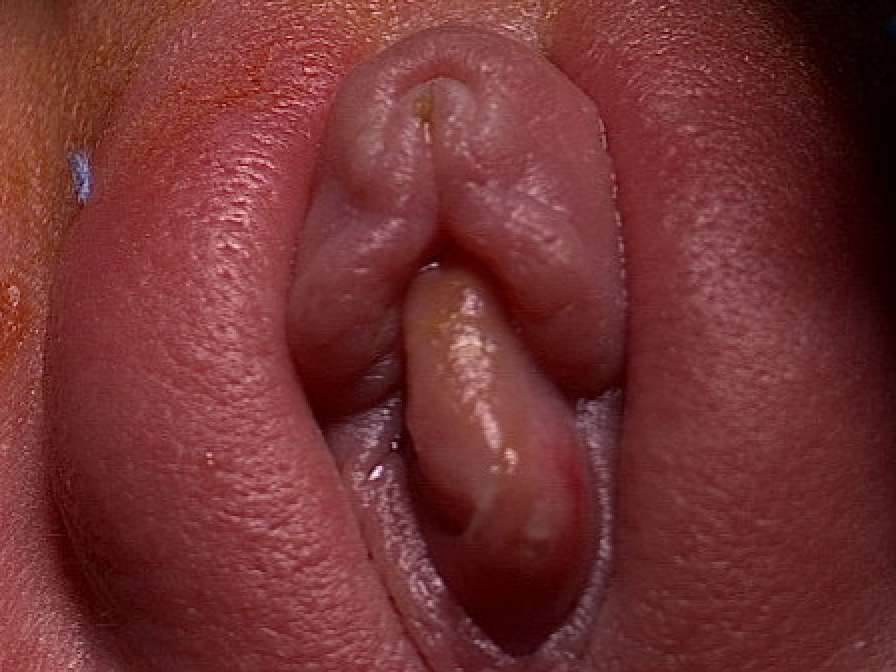
Figure 3 Prolapsus d’urétérocèle chez un nourrisson de sexe féminin.
Dans les systèmes duplex, les urétérocèles sont presque toujours associées au pôle supérieur et 60 % sont extravésicales.16 Les problèmes incluent une obstruction du pôle supérieur et éventuellement du pôle inférieur, qui, dans un contexte d’infection urinaire, peut se manifester par un sepsis fulminant. L’obstruction est souvent associée à un pôle supérieur dysplasique.19 De plus, les urétérocèles prolapsées peuvent obstruer le col vésical. Les urétérocèles volumineuses sont associées à une musculature vésicale sous-jacente déficiente, et les urétérocèles qui dépassent le col vésical peuvent détruire le mécanisme de continence féminin.20,21
Reflux vésico-urétéral
L’association d’une duplication urétérale et d’un reflux vésico-urétéral est fréquente. Le reflux survient classiquement dans l’uretère du pôle inférieur, qui présente un orifice urétéral latéralisé et un tunnel sous-muqueux raccourci, comme le prédit la loi de Weigert-Meyer.22 L’uretère du pôle supérieur, dont l’orifice est plus médial et caudal, possède un tunnel sous-muqueux plus long et le reflux y est moins probable. Lorsque le reflux touche les uretères des pôles supérieur et inférieur, les deux orifices tendent à être latéralisés ou la duplication est partielle. Un reflux dans l’uretère du pôle supérieur peut également survenir si son orifice est ectopique, au niveau du col vésical ou de l’urètre, vraisemblablement parce qu’il contourne le trigone et présente un tunnel sous-muqueux inadéquat. Le reflux dans de tels uretères ne se produit qu’au cours de la miction, et le col vésical, fermé de façon tonique, peut provoquer une obstruction pendant la phase de remplissage (Figure 4). Comme dans les systèmes non dupliqués, les séquelles du reflux vésico-urétéral dans les systèmes dupliqués comprennent la néphropathie de reflux et la pyélonéphrite.
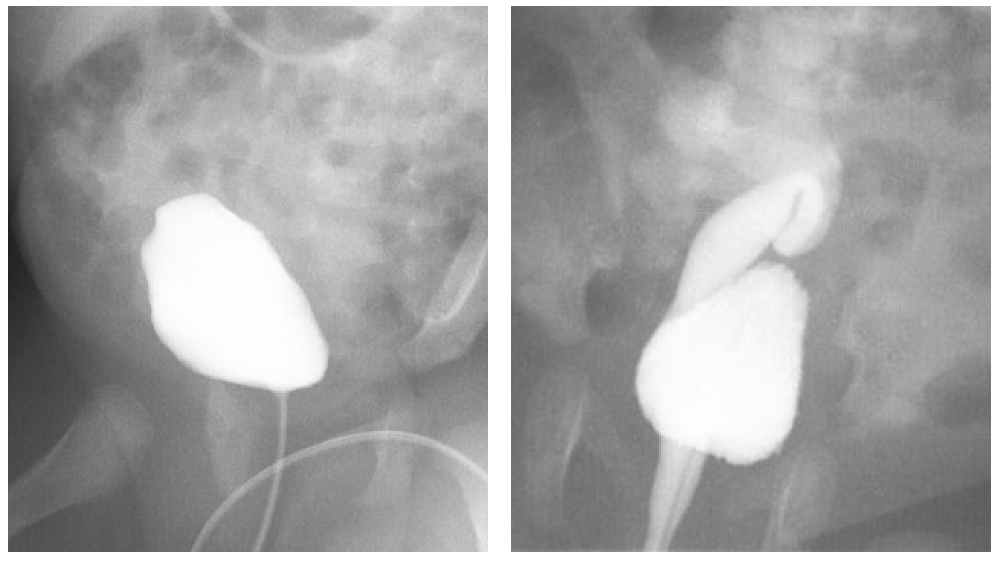
Figure 4 Uretère ectopique s’abouchant au col vésical. A: Pendant le remplissage vésical, aucun reflux vésico-urétéral n’est observé. B: Le reflux vésico-urétéral devient apparent pendant la miction. Ce rein est situé de façon ectopique dans le bassin.
Anomalies de migration et de fusion
L’ectopie rénale désigne un rein qui ne parvient pas à atteindre sa position normale, et résulte d’une migration et/ou d’une fusion rénales anormales au cours du développement embryonnaire.23 Les reins ectopiques peuvent être classés comme simples, en fer à cheval ou croisés. L’incidence rapportée varie de 1 sur 500 à 1 sur 5 000.24,25
Ectopie simple
L’ectopie rénale simple désigne un rein situé n’importe où le long du trajet embryologique d’ascension ipsilatéral depuis le bassin jusqu’à la fosse rénale. Les reins pelviens ne parviennent pas à ascensionner au-delà du rebord pelvien et constituent les reins ectopiques les plus fréquents, représentant 60% de tous les cas.26 Dans 90% des cas, l’anomalie est unilatérale, avec une légère prédominance du côté gauche.26 D’autres positions ectopiques du rein peuvent survenir et se situer à un point entre le bassin et la position normale ou, rarement, dans le thorax.27
Rein en fer à cheval
Le rein en fer à cheval est l’anomalie de fusion rénale la plus fréquente, avec une incidence comprise entre 1:400 et 1:1800.28,29 Dans 95 % des cas, les pôles inférieurs des deux reins sont réunis par un isthme de tissu rénal, qui consiste généralement en parenchyme vascularisé mais est parfois dysplasique ou fibreux.29 Dans environ 40 % des cas, l’isthme se situe au niveau de L4 où il est retenu sous l’origine de l’artère mésentérique inférieure lors de l’ascension rénale. Rarement, l’isthme peut se situer en arrière de l’aorte et/ou de la veine cave inférieure.30 Une petite proportion de reins en fer à cheval sont fusionnés par leurs pôles supérieurs.31 La présence de l’isthme empêche la rotation médiale complète des bassinets rénaux et les uretères doivent se recourber en avant pour passer au-dessus de l’isthme, ce qui explique l’incidence relativement élevée des anomalies urétéro-pyéliques (20 %) associées aux reins en fer à cheval (Figure 5).32,33,34
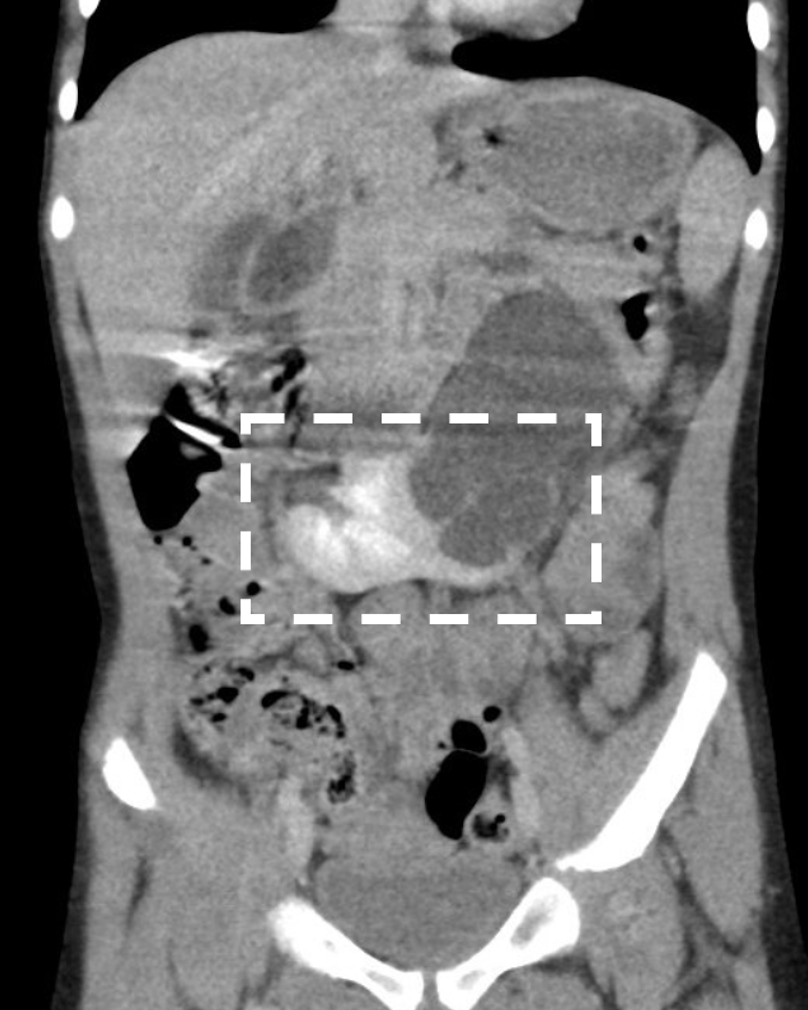
Figure 5 Rein en fer à cheval avec obstruction de la jonction pyélo-urétérale gauche. L’isthme (pôles inférieurs fusionnés) est marqué par un carré. Une hydronéphrose est notée à gauche.
Ectopie rénale croisée
L’ectopie rénale croisée survient lorsqu’un ou les deux reins traversent la ligne médiane au cours de la migration. Il existe quatre variétés d’ectopie rénale croisée : l’ectopie rénale croisée fusionnée, dans laquelle le rein ectopique fusionne avec le rein controlatéral (85 % des cas), l’ectopie rénale croisée sans fusion, l’ectopie rénale croisée bilatérale, et l’ectopie rénale croisée solitaire. On note une légère prédominance masculine, et le croisement de gauche à droite survient plus fréquemment que de droite à gauche. Dans l’ectopie rénale croisée fusionnée, le point de fusion se situe habituellement entre le pôle supérieur du rein croisé et le pôle inférieur du rein en position normale (type fusionné unilatéral (Figure 6).35,36,37,38
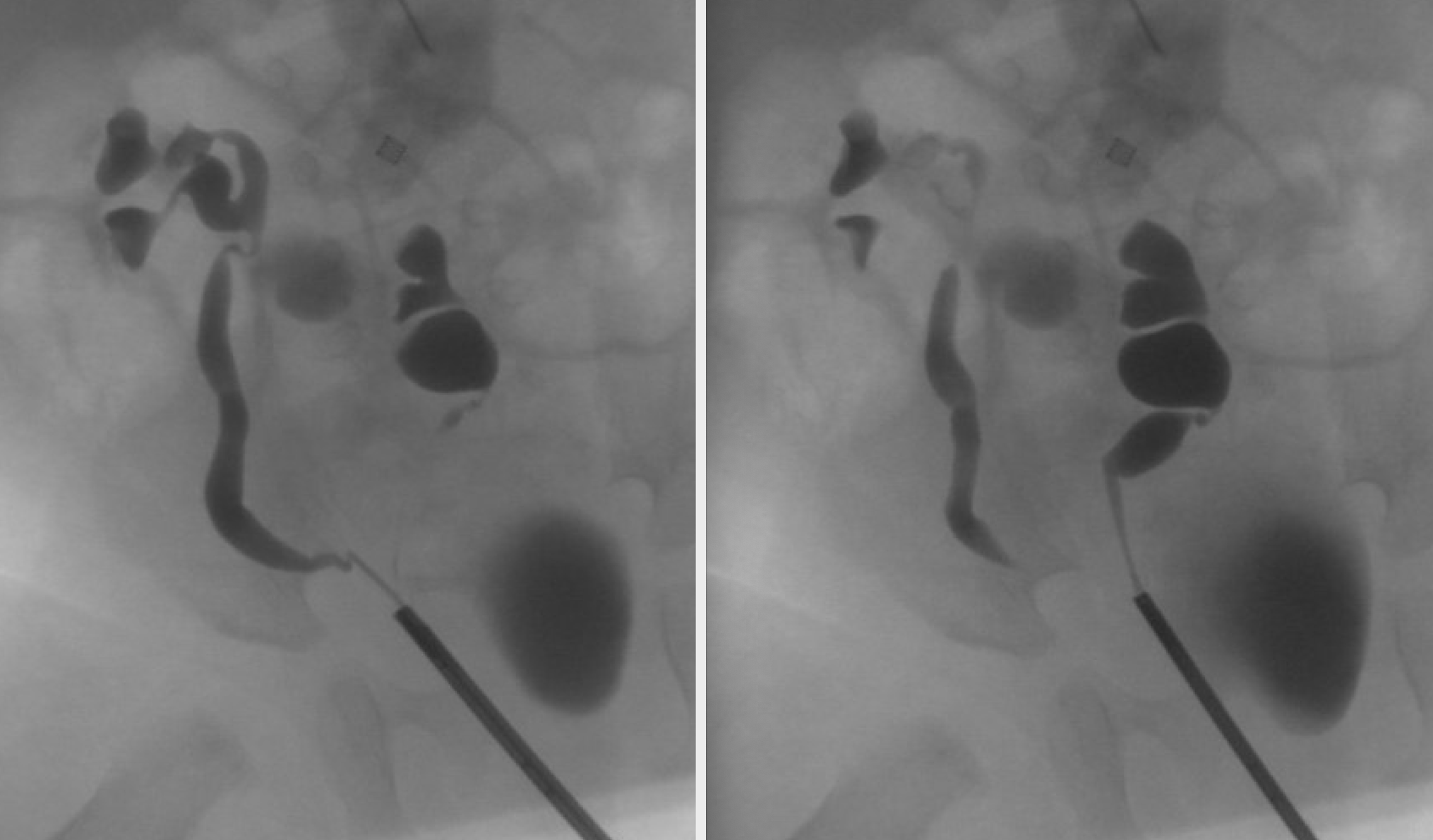
Figure 6 Ectopie rénale croisée avec fusion. La pyélographie rétrograde montre des uretères distincts. Le rein gauche est situé à droite de la ligne médiane. Son pôle supérieur est fusionné avec le pôle inférieur du rein droit.
Les reins ectopiques sont souvent asymptomatiques. Lorsqu’ils sont détectés, ils sont fréquemment hypoplasiques ou de forme irrégulière. Le reflux vésico-urétéral est l’anomalie associée la plus fréquente, rapportée dans 30–70 % des reins chez les enfants présentant une ectopie rénale. Fait intéressant, dans les cas d’ectopie rénale simple, un reflux unilatéral est fréquemment observé dans le rein orthotopique.32,33,39 La malrotation et l’insertion haute de l’uretère peuvent entraîner une obstruction de la jonction pyélo-urétérale, une stase urinaire et une néphrolithiase associée.32,33,34 De plus, comme les reins acquièrent leur vascularisation à partir des vaisseaux voisins au cours de l’ascension embryologique, la vascularisation est, de manière prévisible, anormale dans l’ectopie rénale et les anomalies de fusion. Dans une étude portant sur 90 reins en fer à cheval, 387 artères ont été identifiées, et près d’un quart des patients présentaient une anatomie anormale des veines rénales.40
Les anomalies de migration et de fusion sont également fréquemment associées à des anomalies non urologiques. Le rein en fer à cheval, par exemple, est présent chez 14–20 % des filles atteintes du syndrome de Turner.29 L’ectopie rénale et les reins en fer à cheval sont fréquemment observés chez les enfants présentant des malformations anorectales et des anomalies génitales, parfois dans le cadre du syndrome VACTERL.41 Chez les garçons, les anomalies génitales peuvent comprendre l’hypospadias et la cryptorchidie.32 Bien que l’agénésie rénale soit l’atteinte génito-urinaire classique chez les femmes présentant des anomalies müllériennes, une duplication utérine et une agénésie vaginale ont également été rapportées en association avec des anomalies de migration et de fusion.42,43
Évaluation et diagnostic
Duplication
Les anomalies de duplication peuvent être diagnostiquées en période anténatale par échographie de routine. Après la naissance, la duplication est fréquemment diagnostiquée lors du bilan d’une infection urinaire (IU) ; chez environ 8 % des enfants qui présentent une IU, on retrouve une duplication.44,45,46 Chez les filles ayant acquis la propreté, une duplication peut se manifester par une incontinence si un uretère ectopique s’abouche en aval du complexe sphinctérien urinaire.13,47 Les enfants peuvent également présenter des symptômes d’obstruction des voies urinaires, tels que des douleurs intermittentes ou un retard staturo-pondéral.48 La duplication est fréquemment découverte fortuitement à l’imagerie.49
L’évaluation de la duplication urétérale se concentre sur le diagnostic, la prévention et la prise en charge de l’hydronéphrose, de l’infection des voies urinaires, de la dysfonction rénale et des troubles mictionnels. Une duplication découverte fortuitement en l’absence de ces constatations ne nécessite pas d’exploration complémentaire. De plus en plus, des anomalies de duplication sont détectées en période anténatale lorsqu’une hydronéphrose ou des urétérocèles sont notées à l’échographie obstétricale.50 Rarement, une dysplasie rénale bilatérale ou des cicatrices rénales importantes peuvent être présentes, entraînant une altération de la fonction rénale. Comme pour tous les enfants atteints de dysplasie rénale, la fonction rénale et les électrolytes doivent être surveillés; les enfants doivent être dépistés pour l’hypertension artérielle et la protéinurie. Divers examens peuvent fournir des informations précieuses concernant la duplication urétérale complète ou incomplète, l’ectopie, la dilatation urétérale, les urétérocèles et la fonction rénale différentielle.
Échographie
Essentiellement, tous les patients présentant une duplication rénale nécessitent une échographie des reins et de la vessie. Celle-ci détectera une hydronéphrose du pôle supérieur et/ou inférieur, un hydro-urétère, des urétérocèles, et fournira des informations sur la fonction de chaque unité rénale en fonction de l’aspect du parenchyme rénal. L’hydronéphrose du pôle supérieur peut survenir secondairement à un urétère ectopique obstrué ou à une urétérocèle. Un hydro-urétère associé est fréquemment observé (Figure 2) Une dysplasie marquée est couramment observée secondaire à une néphropathie obstructive. Un parenchyme rénal normal sans dilatation urétérale peut évoquer une duplication fortuite ou un urétère ectopique non obstrué (Figure 7). Chez les filles, cela doit inciter à poser des questions sur une incontinence continue afin d’évaluer l’existence d’uretères ectopiques situés en aval du sphincter urétral (p. ex., “a-t-elle déjà eu une période sans fuites ?”). L’hydronéphrose du pôle inférieur peut être due à un reflux vésico-urétéral, à une obstruction de la jonction pyélo-urétérale (JPU), ou à une obstruction urétérale secondaire à une urétérocèle du pôle supérieur. À l’échographie, une urétérocèle apparaît comme une structure intravésicale kystique à paroi fine (Figure 2), qui peut contenir des débris évoquant une stase urinaire ou une infection.
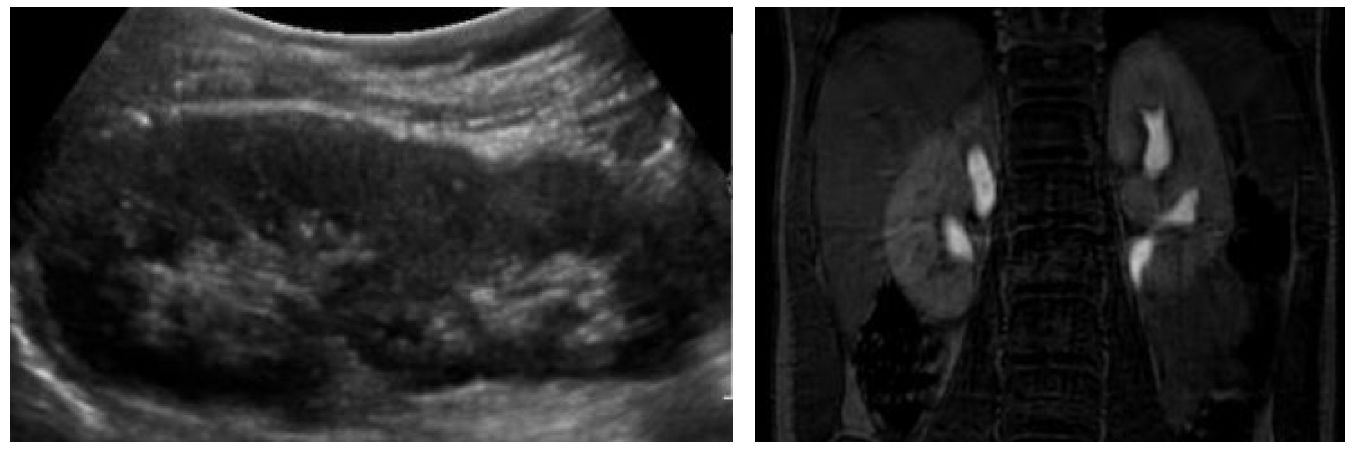
Figure 7 Incontinence urinaire continue chez une patiente due à des uretères ectopiques bilatéraux. A : L’échographie rénale montre deux moitiés rénales saines sans hydronéphrose. B : L’urographie par résonance magnétique précise l’anatomie urétérale. Dans ce cas, les deux uretères du pôle supérieur s’abouchaient dans le vagin.
Urétrocystographie mictionnelle
La VCUG est l’étude de choix pour détecter et caractériser le reflux vésico-urétéral. Dans les systèmes dupliqués, le reflux dans l’uretère inférieur n’atteint que les calices inférolatéraux, un aspect radiographique connu sous le nom de “signe du lys tombant” (Figure 8). La VCUG peut également mettre en évidence des urétérocèles, qui apparaissent comme des défauts de remplissage dans la vessie et sont mieux vues au début du remplissage (Figure 8) La nature dynamique de cette modalité fournit des informations concernant l’obstruction du col vésical, le prolapsus d’urétérocèle et l’éversion d’urétérocèle, qui apparaît comme un diverticule vésical lorsque la vessie est distendue et suggère une faiblesse de la musculature trigonale. La VCUG doit être réalisée si une dilatation des voies urinaires est observée à l’échographie afin d’évaluer un reflux vésico-urétéral de haut grade, et avant toute reconstruction des voies urinaires car la présence de reflux vésico-urétéral influencera la prise de décision chirurgicale.
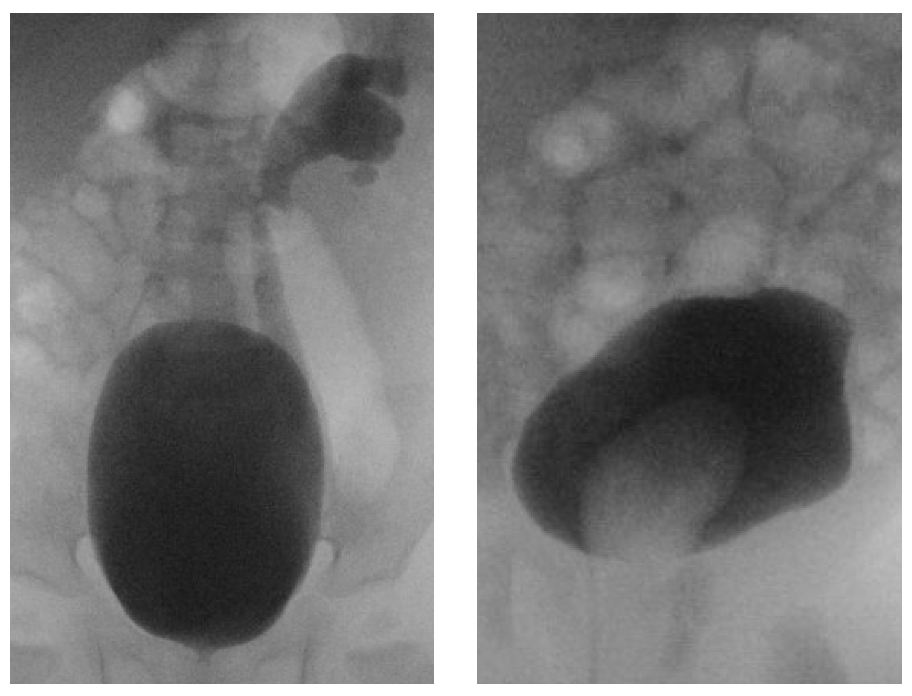
Figure 8 A: « Signe du lys tombant. » Le reflux vésico-urétéral dans l’uretère inférieur opacifie les calices inférieurs et interpolaires. Le système collecteur de l’hémirein supérieur ne s’opacifie pas. B: Un urétérocèle apparaît comme un défaut de remplissage dans la vessie.
Scintigraphie rénale
Les scintigraphies rénales isotopiques mettent en évidence la fonction relative et le drainage des hémireins. Dans un rein duplex non pathologique, la fonction relative des hémireins supérieur et inférieur est respectivement d’un tiers et de deux tiers.51
Urographie par résonance magnétique
La MRU fournit des détails anatomiques précis chez des patients présentant une anatomie complexe qui peut être difficile à visualiser avec d’autres modalités. La MRU peut être particulièrement utile pour repérer le trajet des uretères ectopiques (Figure 7). La MRU est également utile chez des patients présentant des urétérocèles qui masquent d’autres aspects de la vessie, ou chez des patients présentant des anomalies utérines, vaginales ou d’autres anomalies vésicales.52 Des logiciels de calcul permettent de calculer la fonction rénale différentielle et les temps de transit urinaire; toutefois, ces logiciels sont coûteux, complexes et pas encore largement disponibles.53
Urographie intraveineuse
Avec la disponibilité d’autres modalités, l’UIV est désormais rarement réalisée. Elle peut mettre en évidence une duplication et le niveau de confluence, une ectopie urétérale et des urétérocèles, entre autres anomalies. Lorsque la fonction de l’hémi-rein supérieur est médiocre, la pathologie associée n’est pas toujours mise en évidence et des clichés tardifs peuvent être utiles.
Anomalies de migration et de fusion
Les anomalies d’ascension et de fusion sont fréquemment des découvertes fortuites. Les reins ectopiques pelviens non dilatés peuvent être difficiles à visualiser à l’échographie, et l’absence du rein dans la loge rénale peut être interprétée à tort comme une agénésie rénale.24,54 Dans de tels cas, la présence de tissu rénal ectopique fonctionnel est mieux démontrée par une scintigraphie rénale à l’acide dimercaptosuccinique (DMSA).54 La cysto-urétrographie mictionnelle (VCUG) n’est pas obligatoire en l’absence d’infections urinaires et d’hydronéphrose, car le reflux vésico-urétéral dans ce contexte tend à être de faible grade et cliniquement peu significatif.55 Des symptômes tels que la colique néphrétique et l’infection urinaire traduisent généralement une pathologie additionnelle, telle qu’un reflux vésico-urétéral de haut grade, une néphrolithiase, ou une obstruction de la jonction pyélo-urétérale (JPU), toutes plus fréquentes en cas d’ectopie rénale et devant motiver une évaluation complémentaire (Figure 5)32,33,34
Options de traitement, résultats et complications
Duplication
La prise en charge de la duplication rénale dépend de la pathologie en cause et va de la surveillance, avec ou sans prophylaxie antibiotique, à la chirurgie mini-invasive, jusqu’à la reconstruction ouverte des voies urinaires. En l’absence d’infection, d’obstruction ou d’incontinence urinaire, les anomalies de duplication peuvent être surveillées sans risque. La prophylaxie antibiotique est indiquée chez les patients présentant une duplication avec dilatation urétérale due à un uretère ectopique obstructif, une urétérocèle ou un reflux vésico-urétéral dilatant.56,57 La reconstruction définitive des voies urinaires peut se faire au niveau vésical (bas appareil) ou au niveau rénal (haut appareil). Une approche combinée du haut et du bas appareil est rarement nécessaire. La fonction des hémireins et la présence d’un reflux vésico-urétéral sont des facteurs déterminants pour l’élaboration du plan chirurgical. Si un patient présente une pathologie au niveau vésical, notamment un reflux vésico-urétéral ou une urétérocèle volumineuse ou ectopique, une approche du bas appareil est préférable.
Incision de l’urétérocèle
La décompression endoscopique de l’urétérocèle a été initialement proposée au début des années 1960. L’approche initiale consistait à réaliser un détoitement de l’urétérocèle, ce qui était efficace mais s’accompagnait d’un taux élevé de reflux vésico-urétéral de novo. En 1962, Zielinski a proposé une incision basse, médiale et transversale à la base de l’urétérocèle.58 Cela assure une décompression urétérale adéquate tandis que le tissu résiduel de l’urétérocèle crée une valve à clapet fonctionnelle pour prévenir le reflux vésico-urétéral de novo. L’ouverture créée doit être intravésicale afin d’éviter une obstruction par le col vésical fermé de façon tonique. L’incision peut être réalisée à l’électrocoagulation, au laser ou au couteau froid. Une décompression initiale réussie est observée chez plus de 90% des patients.59 Plus récemment, en l’absence d’infection, une approche “en arrosoir” a été préconisée, dans laquelle l’urétérocèle est ponctionnée 10–20 fois au laser.60 Cette technique procure une décompression durable avec un reflux iatrogène nettement réduit, toutefois le besoin d’interventions secondaires est moins bien étudié. Pour les urétérocèles intravésicales, quelle que soit la technique, la décompression endoscopique primaire est fréquemment la seule intervention nécessaire.61,62,63 Pour les urétérocèles ectopiques, les résultats à long terme ne sont pas aussi bons; la décompression de l’urétérocèle peut être considérée comme une opération temporaire, puisque 50% à 80% nécessiteront une reconstruction secondaire en raison d’un reflux symptomatique ou d’une incontinence urinaire.59,62,63
Injection sous-urétérale
Comme dans les systèmes simples, le reflux vésico-urétéral dans les systèmes dupliqués peut être pris en charge par une injection sous-urétérale d’agents volumateurs. Le taux de succès était initialement rapporté comme inférieur à celui observé dans les systèmes simples, bien que des analyses ultérieures aient rapporté des taux de succès comparables.64 Le fabricant de l’acide dextranomère-hyaluronique (Deflux®) a récemment supprimé la duplication comme contre-indication. La résolution du reflux vésico-urétéral après injection sous-urétérale est liée à l’âge, au sexe, au grade et au moment d’apparition du reflux, et est discutée en détail dans le chapitre suivant consacré au reflux vésico-urétéral.
Clippage urétéral
Le clippage urétéral est une technique récemment décrite pour la prise en charge de l’hémirein supérieur obstrué et non fonctionnel.65,66 L’uretère de l’hémirein supérieur est sectionné par voie laparoscopique, drainé et ligaturé près du rein, dans l’attente que le tissu rénal non fonctionnel s’atrophie. Cette technique évite le risque de reflux de novo associé à la ponction d’une urétérocèle et est moins invasive que la reconstruction traditionnelle pour un uretère ectopique, mais elle nécessite une surveillance continue et comporte des risques, notamment une obstruction symptomatique, une infection et même une pionéphrose, et elle n’a pas été largement adoptée.
Reconstruction des voies urinaires basses
Les voies urinaires inférieures peuvent être abordées par voie intra- ou extravésicale. Les interventions extravésicales, telles que l’urétéro-urétérostomie, peuvent être réalisées par une incision inguinale ou de Gibson, selon l’âge du patient. Le plancher du canal inguinal est ouvert, l’espace périvésical est développé et les uretères se trouvent en position postéro-latérale par rapport au ligament ombilical médial. Certains placent préalablement des stents urétéraux dans des uretères non dilatés pour faciliter leur identification. Chez l’homme, on veille à ne pas léser le canal déférent, qui passe au-dessus des uretères. Les interventions intravésicales, telles que la réimplantation urétérale trans-trigonale, sont réalisées par une incision de Pfannenstiel. Les approches laparoscopiques impliquent le positionnement classique des trocarts pour la chirurgie pelvienne, comprenant un trocart ombilical pour la caméra et des trocarts de travail infra-ombilicaux droit et gauche.
Urétéro-urétérostomie
L’urétéro-urétérostomie est une excellente solution en cas de pathologie isolée du pôle supérieur ou inférieur, mais pas des deux.67 En cas de reflux vésico-urétéral isolé du pôle inférieur, l’uretère inférieur peut être anastomosé à l’uretère supérieur en terminolatéral. Plus fréquemment, une urétéro-urétérostomie de l’uretère supérieur vers l’uretère inférieur est réalisée dans le contexte d’un uretère ectopique responsable d’incontinence urinaire ou d’obstruction. Les uretères du pôle supérieur obstrués par de petites urétérocèles intravésicales peuvent également être pris en charge par urétéro-urétérostomie; les urétérocèles volumineuses ou les urétérocèles ectopiques peuvent nécessiter une intervention intravésicale pour l’exérèse formelle de l’urétérocèle et la reconstruction du plancher vésical.68 L’urétéro-urétérostomie présente plusieurs avantages. Elle évite la dissection complexe autour du hile rénal requise lors d’une héminéphrectomie et évite la nécessité d’ouvrir la vessie ou de rétrécir des uretères dilatés, comme l’exige la réimplantation urétérale traditionnelle. En l’absence de dilatation urétérale, l’uretère doit être spatulé afin de permettre une anastomose largement perméable. Les taux de succès à long terme dépassent 90 % entre des mains expérimentées.69,70,71,72 Les risques comprennent le reflux urétéro-urétéral (« yo-yo »), les lésions de l’uretère receveur, la sténose anastomotique, la fuite d’urine et l’infection du moignon urétéral, tous rares. Une anastomose proximale avec exérèse du moignon urétéral distal peut diminuer l’infection du moignon urétéral et est facilement réalisable par laparoscopie.73,74 Si les uretères partagent une gaine commune, l’excision du moignon urétéral distal ne doit pas être poursuivie de manière agressive afin d’éviter d’endommager l’apport vasculaire partagé. Des stents, s’ils sont placés, peuvent soit traverser l’anastomose, soit rester dans l’uretère receveur.
Réimplantation urétérale
Le reflux vésico-urétéral isolé dans les systèmes duplex est traité comme dans les systèmes simples. Lorsqu’un reflux vésico-urétéral est présent en plus d’un uretère ectopique ou obstructif nécessitant une intervention, la réimplantation urétérale est traditionnellement la procédure de choix. Distalement, les uretères dupliqués sont souvent situés dans une gaine commune et partagent une vascularisation distale. Dans ce cas, les uretères doivent être mobilisés et réimplantés en bloc.75 Un uretère ectopique ne partage pas nécessairement la vascularisation avec l’uretère du pôle inférieur. Dans ce cas, les uretères peuvent être réimplantés de façon indépendante.76 Alternativement, on peut réaliser une urétéro-urétérostomie haute-vers-basse associée à une réimplantation de l’uretère inférieur.77,78
Les uretères peuvent être réimplantés par une approche intravésicale ou extravésicale, avec ou sans réduction urétérale. La réimplantation extravésicale bilatérale est évitée en raison du risque de lésion du plexus pelvien et de rétention urinaire. La réimplantation des uretères obstructifs ou ectopiques, la réduction urétérale et l’exérèse des urétérocèles associées nécessitent la désinsertion de l’uretère et l’ouverture de la muqueuse vésicale, et de nombreux chirurgiens privilégient une approche intravésicale dans ce contexte. Des approches vésicoscopiques de réimplantation urétérale ont été décrites, mais les résultats à long terme restent à rapporter et l’approche laparoscopique traditionnelle est extravésicale.79 Le taux de succès de la réimplantation sous gaine commune est supérieur à 95%, similaire à celui de la réimplantation d’un système unique.80,81
Excision de l’urétérocèle et reconstruction vésicale
Les urétérocèles non décompressées endoscopiquement, ou les grandes urétérocèles dont la musculature sous-jacente est anormale, sont parfois traitées par chirurgie ouverte. Cela peut inclure l’exérèse ou la marsupialisation de l’urétérocèle, la reconstruction du plancher vésical et/ou la reconstruction du col vésical.82 L’exérèse de l’urétérocèle est souvent réalisée au moment de la réimplantation urétérale. La muqueuse redondante est excisée en veillant à ne pas laisser un lambeau muqueux susceptible d’obstruer la vessie. Le défaut du détrusor peut être reconstruit afin d’assurer un soutien adéquat pour l’uretère réimplanté. Un reflux controlatéral peut en résulter, vraisemblablement dû à une distorsion du trigone, bien que la signification clinique en soit incertaine. Lorsque l’urétérocèle s’étend au-delà du col vésical, il existe un risque significatif d’incontinence urinaire d’effort et de dysfonction vésicale. Une dissection prudente est requise; cependant, même avec une technique méticuleuse, les résultats en termes de miction et de continence sont médiocres et seraient d’origine intrinsèque plutôt qu’acquise.68,83
Uretérostomie cutanée
Il s’agit d’une procédure de temporisation réalisée dans le contexte d’une infection des voies urinaires chez le jeune patient.16 Elle est indiquée pour l’uretère du pôle supérieur infecté et obstrué ou pour l’uretère du pôle inférieur refluxif avec des infections urinaires d’échappement sous prophylaxie antibiotique. L’abord chirurgical à ciel ouvert est similaire à une urétéro-urétérostomie. Les uretères pathologiques sont incisés ou sectionnés puis marsupialisés à l’incision cutanée inguinale. Chez le nourrisson, l’association de petites vessies et d’uretères dilatés ne permet pas la confection d’un tunnel urétéral adéquat, et la réimplantation est habituellement différée. La dilatation urétérale s’améliore souvent avec la dérivation, ce qui peut rendre inutile une réduction-calibrage de l’uretère lors de la réimplantation. La reconstruction définitive est réalisée lorsque le patient est âgé de 1 à 2 ans. À noter que l’urétérostomie de dérivation est une excellente option pour la prise en charge des urétérocèles lorsque le matériel endoscopique n’est pas disponible.
Approche des voies urinaires supérieures
La reconstruction des voies urinaires supérieures est indiquée lorsqu’il n’existe pas de pathologie des voies urinaires inférieures à traiter. Néanmoins, une approche par les voies urinaires inférieures est souvent envisagée en raison de sa relative facilité et de son succès.84,85
Héminéphrectomie
L’indication de l’héminéphrectomie supérieure est un pôle supérieur peu fonctionnel avec une incontinence urinaire associée ou une pathologie du pôle supérieur (p. ex., pyélonéphrite, calculs). L’uretère du pôle supérieur est sectionné et utilisé pour la traction. Les vaisseaux hilares du pôle supérieur sont ligaturés, et le parenchyme rénal non viable se délimite et est excisé. Une autre technique consiste à exciser le parenchyme du pôle supérieur, souvent peu vascularisé et facilement délimité par rapport au pôle inférieur sain, et à le suivre jusqu’aux vaisseaux hilares et à l’uretère du pôle supérieur, qui sont alors sectionnés. Cela simplifie la dissection hilaire mais expose à un risque de saignement. Le bord de section du parenchyme rénal est recouvert par le fascia de Gerota et la graisse périrénale. L’uretère redondant du pôle supérieur est retiré mais le moignon urétéral résiduel est laissé in situ. Le plus grand soin est apporté pour ne pas léser la vascularisation du parenchyme ou de l’uretère du pôle inférieur.
La perte de fonction du pôle inférieur est la complication la plus importante liée à l’héminéphrectomie supérieure, avec des taux rapportés pouvant atteindre neuf pour cent.84,86 Cela peut être dû à une lésion hilaire ou à une torsion postopératoire du rein restant, et est plus fréquent chez les enfants de moins de 1 an. Pour les reins complètement mobilisés, envisager une néphropexie afin de prévenir la torsion du reliquat rénal. Les complications supplémentaires comprennent l’hémorragie postopératoire (<5%), l’urinome (5–20%, plus fréquent dans les procédures laparoscopiques, rarement cliniquement significatif).87,88 Alors que l’héminéphrectomie supérieure était autrefois la procédure de choix pour le pôle supérieur non fonctionnel sans reflux du pôle inférieur, les pratiques évoluent vers l’urétéro-urétérostomie, qui est une intervention plus simple avec des taux de succès similaires et un risque moindre pour la fonction du pôle inférieur.84,85
L’héminéphrectomie du pôle inférieur est moins fréquente. Elle est réalisée en cas de pathologie cliniquement significative (p. ex., infection, obstruction symptomatique, calculs) dans un contexte d’hémi-rein inférieur non fonctionnel avec préservation du pôle supérieur. Cela survient secondairement à une obstruction de la jonction pyélo-urétérale (JPU) ou à un reflux vésico-urétéral (RVU) de haut grade. Cette intervention peut être plus difficile que l’héminéphrectomie du pôle supérieur, car le pôle inférieur s’imbrique dans le pôle supérieur, rendant la séparation difficile. Les complications et les résultats sont similaires à ceux de l’héminéphrectomie du pôle supérieur.89
Pyéloplastie, Pyélo-urétérostomie, Urétéro-urétérostomie proximale
Comme indiqué précédemment, l’urétéro-urétérostomie avec anastomose proximale présente certains avantages par rapport à une anastomose distale. Avec une approche laparoscopique, une incision de flanc est évitée et la morbidité supplémentaire est négligeable par rapport à une anastomose distale.73,74 Une obstruction de la JPU du pôle inférieur nécessite un abord des voies excrétrices supérieures. La technique particulière dépend de la configuration du système collecteur. En cas de duplication incomplète, l’uretère inférieur peut être court, empêchant une pyéloplastie traditionnelle. Une pyélo-urétérostomie est réalisée en créant une anastomose latéro-latérale ou termino-latérale entre le bassinet rénal du pôle inférieur obstrué et l’uretère du pôle supérieur.9,90 En cas de reflux concomitant du pôle inférieur, une anastomose termino-latérale avec drainage et ligature du moignon urétéral est préférable. En cas de duplication complète, la pyéloplastie traditionnelle est une alternative qui évite des risques pour le système de drainage supérieur.9 Les complications et les résultats sont similaires à ceux de l’urétéro-urétérostomie et de la pyéloplastie traditionnelle.
Anomalies de migration et de fusion
L’exploration d’un rein ectopique ou en fer à cheval non compliqué peut raisonnablement se limiter à l’échographie. En l’absence d’hydronéphrose et si l’enfant est asymptomatique, aucun bilan complémentaire n’est nécessaire. En présence d’une fosse rénale vide, une scintigraphie au DMSA peut localiser un tissu rénal ectopique.50 Des examens complémentaires sont indiqués en cas d’hydronéphrose ou d’antécédents d’infection documentée faisant suspecter un reflux vésico-urétéral. Il est important de souligner que la majorité des patients ne sont pas gênés par la position anormale de leur rein, et que l’intervention chirurgicale doit se limiter à corriger une pathologie associée, une obstruction ou un reflux. Lorsque la chirurgie est indiquée, les chirurgiens doivent anticiper une vascularisation rénale anormale.
Points clés
- Les anomalies de duplication et de migration sont fréquentes, et la plupart sont cliniquement insignifiantes.
- Les pathologies cliniquement significatives sont très variées. La prise en charge est axée sur le diagnostic, la prévention et le traitement de l’obstruction des voies urinaires, des infections, de l’atteinte de la fonction rénale et des troubles mictionnels.
- En cas de duplicité complète, l’uretère supérieur est sujet à une obstruction due à une urétérocèle ou à une implantation ectopique, tandis que l’uretère inférieur est sujet au reflux vésico-urétéral.
- La prise en charge des urétérocèles extravésicales est complexe, et des troubles mictionnels et de continence peuvent persister au long cours.
- Prendre en compte la fonction rénale des hémireins supérieur et inférieur et la présence d’un reflux vésico-urétéral lors de l’élaboration du plan chirurgical dans les systèmes duplex.
- Lorsque la chirurgie est indiquée en cas d’ectopie rénale, gardez à l’esprit que la vascularisation rénale sera aberrante.
Lectures recommandées
- Ross JH, Kay R. Ureteropelvic junction obstruction in anomalous kidneys. Urol Clin North Am 1998; 25 (2): 219–225. DOI: 10.1016/S0094-0143(05)70010-0.
- Le H-K, Chiang G. Long-term Management of Ureterocele in Duplex Collecting Systems: Reconstruction Implications. Curr Urol Rep 2018; 19 (2). DOI: 10.1007/s11934-018-0758-3.
- Stanasel I, Peters CA. Ectopic Ureter, Ureterocele, and Ureteral Anomalies. 12th ed., Philadelphia, PA: Elsevier Saunders; 2020.
- VanderBrink BA, Reddy PP. Anomalies of the Upper Urinary Tract. 12th ed., Philadelphia, PA: Elsevier Saunders; 2020, DOI: 10.1016/b978-1-4160-6911-9.00117-1.
Références
- Moore KL, Persaud MD, Torchia MG. Urogenital System. The Developing Human: Clinically Oriented Embryology. 11th ed. Philadelphia, PA: Elsevier; 2020. DOI: 10.5005/jp/books/10691_7.
- Tanagho EA. Embryologic basis for lower ureteral anomalies: A hypothesis. Urology 1976; 7 (5): 451–464. DOI: 10.1016/0090-4295(76)90179-5.
- Decter RM. Renal duplication and fusion anomalies. Pediatr Clin North Am 1997; 44 (5): 1323–1341. DOI: 10.1016/S0031-3955(05)70559-9.
- Williams H. Renal revision: from lobulation to duplication—what is normal? Arch Dis Child. Educ Pract 2007; 92 (5). DOI: 10.1136/adc.2007.126680.
- Kaplan WE, Nasrallah P, King LR. Reflux in complete duplication in children. J Urol 1978; 120 (2): 220–222. DOI: 10.1016/s0022-5347(17)57116-5.
- Whitaker J, Danks DM. A Study of the Inheritance of Duplication of the Kidneys and Ureters. J Urol 1966; 95 (2): 176–178. DOI: 10.1016/s0022-5347(17)63429-3.
- Atwell JD, Cook PL, Howell CJ. Familial incidence of bifid and double ureters. Arch Dis Child 1974; 49 (5): 390–393. DOI: 10.1136/adc.49.5.390.
- Joseph DB, Bauer SB, Colodny AH. Lower pole ureteropelvic junction obstruction and incomplete renal duplication. J Urol 1989; 141 (4): 896–899. DOI: 10.1016/s0022-5347(17)41044-5.
- Ross JH, Kay R. Ureteropelvic junction obstruction in anomalous kidneys. Urol Clin North Am 1998; 25 (2): 219–225. DOI: 10.1016/S0094-0143(05)70010-0.
- Weigert C. Ueber einige Bildungsfehler der Ureteren. Arch Für Pathol Anat Physiol Für Klin Med. 1877; 70 (4): 490–501. DOI: 10.1007/BF01935232.
- Meyer R. Zur Anatomie und Entwicklungsgeschichte der Ureterverdoppelung. Virchows Arch Path Anat 1907; 187: 408–434. DOI: 10.1007/BF01946114.
- Stanasel I, Peters CA. Ectopic Ureter, Ureterocele, and Ureteral Anomalies. 12th ed., Philadelphia, PA: Elsevier Saunders; 2020.
- Duicu C, Kiss E, Simu I. A Rare Case of Double-System With Ectopic Ureteral Openings Into Vagina. Front Pediatr 2018; 6 (176). DOI: 10.3389/fped.2018.00176.
- Gillenwater JY, Grayhack JT, Howards SS, editors. Adult and Pediatric Urology. 4th ed., Lippincott Williams & Wilkins; 2002, DOI: 10.1001/jama.1991.03460240115044.
- Plaire JC, Pope JCI, Kropp BP. Management of Ectopic Ureters: Experience With the Upper Tract Approach. J Urol 1997; 158 (3): 1245–1247. DOI: 10.1016/s0022-5347(01)64442-2.
- Coplen DE, Duckett JW. The Modern Approach to Ureteroceles. J Urol 1995; 153 (1): 166–171. DOI: 10.1097/00005392-199501000-00068.
- Chwalle R. The process of formation of cystic dilatation of the vesical end of the ureter and of diverticula at the ureteral ostium. Urol Cutan Rev 1927; 31: 499–504.
- Glassberg KI, Braren V, Duckett JW. Suggested Terminology for Duplex Systems, Ectopic Ureters and Ureteroceles. J Urol 1984; 132 (6): 1153–1154. DOI: 10.1016/S0022-5347(17)50072-5.
- Bolduc S, Upadhyay J, Restrepo R. The predictive value of diagnostic imaging for histological lesions of the upper poles in duplex systems with ureteroceles. BJU Int 2003; 91 (7): 678–682. DOI: 10.1046/j.1464-410x.2003.04247.x.
- Abrahamsson K, Hansson E, Hermansson G. Bladder dysfunction: an integral part of the ectopic ureterocele complex. J Urol 1998; 160 (4): 1468–1470. DOI: 10.1016/s0022-5347(01)62593-x.
- Fehrenbaker LG, Kelalis PP, Stickler GB. Vesicoureteral Reflux and Ureteral Duplication in Children. J Urol 1972; 107 (5): 862–864. DOI: 10.1016/S0022-5347(17)61160-1.
- Campbell MF. Renal Ectopy. J Urol 1930; 24 (2): 187–198. DOI: 10.1016/s0022-5347(17)72892-3.
- Yuksel A, Batukan C. Sonographic Findings of Fetuses with an Empty Renal Fossa and Normal Amniotic Fluid Volume. Fetal Diagn Ther 2004; 19 (6): 525–532. DOI: 10.1159/000080166.
- Sheih CP, Liu MB, Hung CS. Renal abnormalities in schoolchildren. Pediatrics 1989; 84 (6): 1086–1090. DOI: 10.1542/peds.84.6.1086.
- Mouriquand P, Panait N. Renal Fusions and Ectopia. Pediatric Surgery 2012 (12). DOI: 10.1016/b978-0-323-02842-4.50113-3.
- N’Guessen G, Douglas Stephens F. Congenital superior ectopic (thoracic) kidney. Urology 1984; 24 (3): 219–228. DOI: 10.1016/0090-4295(84)90346-7.
- Natsis K, Piagkou M, Skotsimara A. Horseshoe kidney: a review of anatomy and pathology. Surg Radiol Anat 2014; 36 (6): 517–526. DOI: 10.1007/s00276-013-1229-7.
- Kirkpatrick JJ, Leslie SW. Horseshoe Kidney. 2021. DOI: 10.53347/rid-18142.
- Dajani AM. Horseshoe kidney: a review of twenty-nine cases. Br J Urol 1966; 38 (4): 388–402. DOI: 10.1111/j.1464-410x.1966.tb09725.x.
- Khougali HS, Alawad OAMA, Farkas N. Bilateral pelvic kidneys with upper pole fusion and malrotation: a case report and review of the literature. J Med Case Reports 2021; 15 (1). DOI: 10.1186/s13256-021-02761-1.
- Guarino N, Tadini B, Camardi P. The incidence of associated urological abnormalities in children with renal ectopia. J Urol 2004; 172 (4, Supplement): 1757–1759. DOI: 10.1097/01.ju.0000138376.93343.74.
- Kramer SA, Kelalis PP. Ureteropelvic junction obstruction in children with renal ectopy. J Urol (Paris 1984; 90 (5): 331–336. DOI: 10.1016/s0094-0143(05)70009-4.
- Gleason PE, Kelalis PP, Husmann DA. Hydronephrosis in Renal Ectopia: Incidence, Etiology and Significance. J Urol 1994; 151 (6): 1660–1661. DOI: 10.1016/S0022-5347(17)35338-7.
- McDonald JH, McClellan DS. Crossed renal ectopia. Am J Surg 1957; 93 (6): 995–1002. DOI: 10.53347/rid-26773.
- Marshall FF, Freedman MT. Crossed Renal Ectopia. J Urol 1978; 119 (2): 188–191. DOI: 10.53347/rid-26773.
- Abeshouse BS, Bhisitkul I. Crossed Renal Ectopia With and Without Fusion. Urol Int 1959; 9 (2): 63–91. DOI: 10.1159/000277442.
- VanderBrink BA, Reddy PP. Anomalies of the Upper Urinary Tract. 12th ed., Philadelphia, PA: Elsevier Saunders; 2020, DOI: 10.1016/b978-1-4160-6911-9.00117-1.
- CMA B, JAE W, GMA B. Urological and Nephrological Findings of Renal Ectopia. J Urol 2010; 183 (4): 1574–1578. DOI: 10.1016/j.juro.2009.12.041.
- Glodny B, Petersen J, Hofmann KJ. Kidney fusion anomalies revisited: clinical and radiological analysis of 209 cases of crossed fused ectopia and horseshoe kidney. BJU Int 2009; 103 (2): 224–235. DOI: 10.1111/j.1464-410X.2008.07912.x.
- Cunningham BK, Khromykh A, Martinez AF. Analysis of Renal Anomalies in VACTERL Association. Birt Defects Res A Clin Mol Teratol 2014; 100 (10): 801–805. DOI: 10.1002/bdra.23302.
- Je B-K, Kim HK, Horn PS. Incidence and Spectrum of Renal Complications and Extrarenal Diseases and Syndromes in 380 Children and Young Adults With Horseshoe Kidney. Am J Roentgenol 2015; 205 (6): 1306–1314. DOI: 10.2214/AJR.15.14625.
- Creatsas G, Malhotra N, Malhotra J. Vaginal agenesis associated with renal ectopia. Adolesc Pediatr Gynecol 1990; 3 (2): 103–105. DOI: 10.1016/S0932-8610(12)80191-5.
- Afshar K, Papanikolaou F, Malek R. Vesicoureteral reflux and complete ureteral duplication. conservative or surgical management? J Urol 2005; 173 (5): 1725–1727. DOI: 10.1097/01.ju.0000154164.99648.ee.
- Bisset G, Strife J. The duplex collecting system in girls with urinary tract infection: prevalence and significance. Am J Roentgenol 1987; 148 (3): 497–500. DOI: 10.2214/ajr.148.3.497.
- Stokland E, Jodal U, Sixt R. Uncomplicated duplex kidney and DMSA scintigraphy in children with urinary tract infection. Pediatr Radiol 2007; 37 (8): 826–828. DOI: 10.1007/s00247-007-0518-x.
- Hanson GR, Gatti JM, Gittes GK. Diagnosis of ectopic ureter as a cause of urinary incontinence. J Pediatr Urol 2007; 3 (1): 53–57. DOI: 10.1016/j.jpurol.2005.06.009.
- Gao Z, Wu J, Lin C, Men C. Transperitoneal Laparoscopic Heminephrectomy in Duplex Kidney: Our Initial Experience. Urology 2011; 77 (1): 231–236. DOI: 10.1016/j.urology.2010.02.002.
- Connolly JO, Chan MMY, Neild GH. Congenital Anomalies of the Kidney and Urinary Tract. Comprehensive Clinical Nephrology. 6th ed. Elsevier;2019:50,607-625.e1; . DOI: 10.1007/978-3-319-29219-9.
- Vergani P, Ceruti P, Locatelli A. Accuracy of prenatal ultrasonographic diagnosis of duplex renal system. J Ultrasound Med 1999; 18 (7): 463–467. DOI: 10.7863/jum.1999.18.7.463.
- Privett JTJ, Jeans WD, Roylance J. The incidence and importance of renal duplication. Clin Radiol 1976; 27 (4): 521–530. DOI: 10.1016/s0009-9260(76)80121-3.
- Dickerson EC, Dillman S JR, E.A.. Pediatric MR Urography: Indications, Techniques, and Approach to Review. Radiogr Rev Publ Radiol Soc N Am Inc 2015; 35 (4): 1208–1230. DOI: 10.1148/rg.2015140223.
- Jones RA, Perez-Brayfield MR, Kirsch AJ. Renal transit time with MR urography in children. Radiology 2004; 233 (1): 41–50. DOI: 10.1148/radiol.2331031117.
- Chow JS, Benson CB, Lebowitz RL. The Clinical Significance of an Empty Renal Fossa on Prenatal Sonography. J Ultrasound Med 2005; 24 (8): 1049–1054. DOI: 10.7863/jum.2005.24.8.1049.
- Elmacı AM, Dönmez Mİ, Soran M. Is voiding cystourethrography necessary for evaluating unilateral ectopic pelvic kidney? Turk J Urol 2019; 45 (Suppl 1). DOI: 10.5152/tud.2019.72798.
- Visuri S, Jahnukainen T, Taskinen S. Prenatal complicated duplex collecting system and ureterocele - important risk factors for urinary tract infection. J Pediatr Surg 2018; 53 (4): 813–817. DOI: 10.1016/j.jpedsurg.2017.05.007.
- Bascietto F, Khalil A, Rizzo G. Prenatal imaging features and postnatal outcomes of isolated fetal duplex renal collecting system: A systematic review and meta-analysis. Prenat Diagn 2020; 40 (4): 424–431. DOI: 10.1002/pd.5622.
- Zielínski J. Avoidance of Vesicoureteral Reflux after Transurethral Ureteral Meatotomy for Ureterocele. J Urol 1962; 88 (3): 386–386. DOI: 10.1016/S0022-5347(17)64805-5.
- Meir DB, CJTDAE S, Rao P. Does the endoscopic technique of ureterocele incision matter? J Urol 2004; 172 (2): 684–686. DOI: 10.1097/01.ju.0000129228.92805.31.
- Palmer BW, Greger H, Mannas DB. Comparison of Endoscopic Ureterocele Decompression Techniques. Preliminary Experience—Is the Watering Can Puncture Superior? J Urol 2011; 186 (4S): 1700–1704. DOI: 10.1016/j.juro.2011.04.007.
- Jelloul L, Berger D, Frey P. Endoscopic management of ureteroceles in children. Eur Urol 1997; 32 (3): 321–326. DOI: 10.1159/000019704.
- Cooper CS, Passerini-Glazel G, Hutcheson JC. Long-term followup of endoscopic incision of ureteroceles: intravesical versus extravesical. J Urol 2000; 164(3. DOI: 10.1097/00005392-200009020-00045.
- Renzo DD, Ellsworth PI, Caldamone AA. Transurethral Puncture for Ureterocele—Which Factors Dictate Outcomes? J Urol 1620; 2010;184(4. DOI: 10.1016/j.juro.2010.04.023.
- Hensle TW, Reiley EA, Ritch C. The clinical utility and safety of the endoscopic treatment of vesicoureteral reflux in patients with duplex ureters. J Pediatr Urol 2010; 6 (1): 15–22. DOI: 10.1016/j.jpurol.2009.05.015.
- Lopes RI, Fernandez N, Koyle MA. Clinical Outcomes of the Upper Urinary Tract after Ureteral Clipping for Treatment of Low Functioning or Nonfunctioning Renal Moieties. J Urol 2018; 199 (2): 558–564. DOI: 10.1016/j.juro.2017.09.080.
- Lopes RI, Mello MF, Koyle MA. Ureteral clipping for the treatment of a non-functioning upper kidney moiety associated with a massive ureterocele: step-by-step description of a novel technique. J Pediatr Urol 2019; 15 (3): 284–285. DOI: 10.1016/j.jpurol.2019.03.005.
- Buchtel HA. Uretero-ureterostomy. J Urol 1965; 93 (2): 153–157. DOI: 10.1016/s0022-5347(17)63740-6.
- Le H-K, Chiang G. Long-term Management of Ureterocele in Duplex Collecting Systems: Reconstruction Implications. Curr Urol Rep 2018; 19 (2). DOI: 10.1007/s11934-018-0758-3.
- Bracci U, Miano L, Lauretti C. Ureteroureterostomy in Complete Ureteral Duplication. Eur Urol 1979; 5: 347–351. DOI: 10.1159/000473152.
- Huisman TK, Kaplan GW, Brock WA. Ipsilateral Ureteroureterostomy and Pyeloureterostomy: A Review of 15 Years of Experience With 25 Patients. J Urol 1987; 138 (5): 1207–1210. DOI: 10.1016/S0022-5347(17)43551-8.
- Grimsby GM, Merchant Z, Jacobs MA. Laparoscopic-Assisted Ureteroureterostomy for Duplication Anomalies in Children. J Endourol 2014; 28 (10): 1173–1177. DOI: 10.1089/end.2014.0113.
- Abdelhalim A, Chamberlin JD, Truong H. Ipsilateral ureteroureterostomy for ureteral duplication anomalies: predictors of adverse outcomes. J Pediatr Urol 2019; 15 (5). DOI: 10.1016/j.jpurol.2019.05.016.
- Lee YS, Hah YS, Kim M-J. Factors Associated with Complications of the Ureteral Stump After Proximal Ureteroureterostomy. J Urol 2012; 188 (5): 1890–1894. DOI: 10.1016/j.juro.2012.07.015.
- Ellison JS, Lendvay TS. Robot-assisted ureteroureterostomy in pediatric patients: current perspectives. Robot Surg Res Rev 2017; 4: 45–55. DOI: 10.2147/RSRR.S99536.
- Belman AB, Filmer RB, King LR. Surgical Management of Duplication of the Collecting System. J Urol 1974; 112 (3): 316–321. DOI: 10.1016/S0022-5347(17)59718-9.
- Marshall S. Reimplantation of the Dilated Ectopic Ureter of the Duplex System as a Separate Unit. J Urol 1986; 135 (3): 574–575. DOI: 10.1016/S0022-5347(17)45743-0.
- Amar AD, Egan RM, Das S. Ipsilateral Ureteroureterostomy Combined with Ureteral Reimplantation for Treatment of Disease in both Ureters in a Child with Complete Ureteral Duplication. J Urol 1981; 125 (4): 581–582. DOI: 10.1016/s0022-5347(17)55111-3.
- Lashley DB, McAleer IM, Kaplan GW. Ipsilateral ureteroureterostomy for the treatment of vesicoureteral reflux or obstruction associated with complete ureteral duplication. J Urol 2001; 165 (2): 552–554. DOI: 10.1097/00005392-200102000-00067.
- Kanojia R, Pandey A, Bawa M. Vesicoscopic common sheath cohen’s reimplant in duplex ureters. J Urol 2021; 206 (Supplement 3, V03-03). DOI: 10.1097/JU.0000000000001991.03.
- Ellsworth PI, Lim DJ, Walker RD. Common sheath reimplantation yields excellent results in the treatment of vesicoureteral reflux in duplicated collecting systems. J Urol 1996; 155 (4): 1407–1409. DOI: 10.1097/00005392-199604000-00090.
- Barrieras D, Lapointe S, Houle A-M. Is Common Sheath Extravesical Reimplantation an Effective Technique to Correct Reflux in Duplicated Collecting Systems? J Urol 2003; 170 (4 Part 2): 1545–1547. DOI: 10.1097/01.ju.0000084149.02826.64.
- Lewis JM, Cheng EY, Campbell JB. Complete Excision or Marsupialization of Ureteroceles: Does Choice of Surgical Approach Affect Outcome? J Urol 2008; 180 (4S): 1819–1823. DOI: 10.1016/j.juro.2008.04.078.
- Holmes NM, Coplen DE, Strand W. Is Bladder Dysfunction and Incontinence Associated with Ureteroceles Congenital or Acquired? J Urol 2002; 168 (2): 718–719. DOI: 10.1016/S0022-5347(05)64732-5.
- Michaud JE, Akhavan A. Upper Pole Heminephrectomy Versus Lower Pole Ureteroureterostomy for Ectopic Upper Pole Ureters. Curr Urol Rep 2017; 18 (3). DOI: 10.1007/s11934-017-0664-0.
- Sheth KR, White JT, Janzen N. Evaluating Outcomes of Differential Surgical Management of Nonfunctioning Upper Pole Renal Moieties in Duplex Collecting Systems. Urology 2019; 123: 198–203. DOI: 10.1016/j.urology.2018.06.028.
- Gundeti MS, Ransley PG, Duffy PG. Renal outcome following heminephrectomy for duplex kidney. J Urol 2005; 173 (5): 1743–1744. DOI: 10.1097/01.ju.0000154163.67420.4d.
- Wallis MC, Khoury AE, Lorenzo AJ. Outcome Analysis of Retroperitoneal Laparoscopic Heminephrectomy in Children. J Urol 2006; 175 (6): 2277–2282. DOI: 10.1016/S0022-5347(06)00338-7.
- You D, Bang JK, Shim M. Analysis of the late outcome of laparoscopic heminephrectomy in children with duplex kidneys. BJU Int 2010; 106 (4): 250–254. DOI: 10.1111/j.1464-410x.2009.09038.x.
- Singh RR, Wagener S, Chandran H. Laparoscopic management and outcomes in non-functioning moieties of duplex kidneys in children. J Pediatr Urol 2010; 6 (1): 66–69. DOI: 10.1016/j.jpurol.2009.04.005.
- Leclair M-D, Vidal I, Suply E. Retroperitoneal Laparoscopic Heminephrectomy in Duplex Kidney in Infants and Children: A 15-Year Experience. Eur Urol 2009; 56 (2): 385–391. DOI: 10.1016/j.eururo.2008.07.015.
- Lowe GJ, Canon SJ, Jayanthi VR. Laparoscopic reconstructive options for obstruction in children with duplex renal anomalies. BJU Int 2008; 101 (2): 227–230. DOI: 10.1111/j.1464-410X.2007.07106.x.
Dernière mise à jour: 2025-09-22 07:59