14: Hydronéphrose et obstruction de la jonction pyélo-urétérale
Ce chapitre prendra environ 28 minutes de lecture.
Introduction
L’hydronéphrose est définie comme une dilatation aseptique du bassinet rénal, avec ou sans dilatation des calices. Si elle survient avant la naissance, on parle d’hydronéphrose anténatale (ANH). La présence d’une hydronéphrose infectée désigne une pyonéphrose, tandis que la présence d’un uretère dilaté associée à un bassinet rénal dilaté est appelée hydro-urétéro-néphrose (HUN).
L’importance de l’ANH est attribuée au fait qu’il s’agit de l’anomalie des voies urinaires fœtales la plus fréquemment rencontrée à l’échographie.1 La plupart des ANH sont transitoires et se résolvent spontanément. Les autres causes pathologiques d’ANH peuvent être obstructives ou non obstructives. Les causes obstructives peuvent survenir à n’importe quel niveau des voies urinaires, mais la pathologie la plus fréquente est l’obstruction de la jonction pyélo-urétérale (UPJO). Les étiologies non obstructives comprennent le reflux vésico-urétéral (VUR), le méga-uretère non obstructif et non refluxant, le syndrome de Prune-Belly, etc.
De nombreux outils sont utilisés par les urologues pédiatriques pour évaluer la gravité de l’ANH. L’école nord-américaine s’appuie principalement sur le système de classification de la Society of Fetal Urology (SFU) tandis que la mesure de l’APRPD est privilégiée en Europe.2
UPJO est définie comme une altération du flux urinaire du bassinet rénal vers l’uretère, entraînant une dilatation secondaire du système pyélocaliciel. La présence d’un bassinet rénal dilaté avec un uretère non dilaté, mise en évidence par RBUS, fait suspecter une UPJO.
Ce chapitre abordera l’embryologie, l’épidémiologie, l’étiologie, le diagnostic, l’évaluation, les options thérapeutiques, le suivi et les complications de l’ANH et de l’UPJO. Les autres causes d’ANH seront abordées dans d’autres chapitres.
Embryologie
Les reins se développent à partir de trois structures séquentielles qui se chevauchent; le pronéphros, le mésonéphros et le métanéphros, qui dérivent tous d’une région du mésoderme intermédiaire appelée la crête urogénitale.3 Au cours de la quatrième semaine de gestation, le pronéphros apparaît au niveau de la région cervicale. Ensuite, des portions segmentées du mésoderme intermédiaire se connectent pour former le canal pronéphrique, qui s’étend de la région cervicale jusqu’à l’extrémité distale de l’embryon (cloaque). Le pronéphros est non fonctionnel et régresse entièrement à la fin de la quatrième semaine de gestation.
Par la suite, le mésonéphros émerge en position caudale par rapport au pronéphros et la persistance du canal pronéphrique induit la formation de tubules mésonéphriques à partir du mésoderme intermédiaire, lesquels s’ouvrent dans le canal pronéphrique, formant le canal mésonéphrique (de Wolff). Le bourgeon urétéral naît de la face postérieure du canal mésonéphrique.
Le métanéphros apparaît à la cinquième semaine du développement. Après cela, le bourgeon urétéral rejoint la coiffe métanéphrique. Le bourgeon urétéral donne naissance à la muqueuse de l’uretère, au bassinet rénal, aux calices majeurs et mineurs, et aux canaux collecteurs. Le mésenchyme entourant le bourgeon urétéral forme la lamina propria, la musculeuse et l’adventice de l’uretère et du bassinet rénal. Le bon développement de l’uretère et du bassinet rénal dépend d’une signalisation réciproque entre leurs composants mésenchymateux et épithéliaux. Une signalisation anormale entraîne un développement et une ramification inappropriés du bourgeon urétéral.La duplication urétérale complète résulte du développement de deux bourgeons urétéraux du même côté, tandis que la duplication urétérale incomplète résulte d’une bifurcation précoce du bourgeon urétéral. En cas de bifurcation tardive du bourgeon urétéral, il se forme un bassinet rénal bifide. La loi de Weigert-Meyer décrit la relation entre les deux uretères dans la duplication urétérale complète. L’uretère du pôle supérieur s’insère dans la vessie en position inféromédiale, et c’est le siège d’une obstruction par un urétérocèle ou un uretère ectopique. En revanche, l’uretère du pôle inférieur s’insère en position supérolatérale dans la vessie, le rendant sujet au VUR en raison du court tunnel intramural. De plus, il peut être affecté par une UPJO.
Finalement, la canalisation urétérale et la maturation de la paroi urétérale ont lieu à la fin de l’embryogenèse. Néanmoins, cette dernière se poursuit au-delà de la naissance et cela peut expliquer la résolution spontanée de nombreux cas diagnostiqués d’ANH. Le rein fœtal commence à produire de l’urine entre la cinquième et la neuvième semaine de gestation. L’urine représente environ 90 % du liquide amniotique, lequel est à son tour responsable de l’expansion des alvéoles pulmonaires. Par conséquent, l’oligoamnios est associé à une hypoplasie pulmonaire, qui se manifeste cliniquement par une détresse respiratoire. Le sinus urogénital donne naissance à la vessie et à l’urètre entre la 10e et la 12e semaine de grossesse.
Épidémiologie
ANH est l’anomalie la plus fréquente des voies urinaires détectée par échographie fœtale. Elle touche un à cinq pour cent de toutes les grossesses. Heureusement, jusqu’à 80% des cas sont transitoires et régressent spontanément. UPJO est la cause la plus fréquente d’ANH pathologique et est généralement traitée par une intervention chirurgicale. Elle touche les garçons deux fois plus que les filles et le côté gauche est atteint deux fois plus souvent que le côté droit. UPJO peut toucher les deux reins dans 10% à 30% des cas.
L’UPJO est généralement sporadique, mais six cas avec antécédents familiaux ont été rapportés dans la littérature.4 L’UPJO peut s’associer à d’autres anomalies urologiques (p. ex., VUR, rein multikystique dysplasique (MCDK), rein en fer à cheval, ou rein duplex où l’hémirein inférieur est le plus souvent le site atteint).
Étiologie/Pathogénie
La plupart des ANH sont transitoires et s’améliorent spontanément avec le temps. Les causes pathologiques qui ne se résolvent pas en période postnatale peuvent être dues à des causes obstructives ou non obstructives. Les causes obstructives comprennent : UPJO, mégauretère obstructif, urétérocèle, uretère ectopique, valvules urétrales postérieures (PUV), atrésie urétrale, ainsi qu’une vessie neuropathique. Les étiologies non obstructives comprennent : VUR, mégauretère non obstructif, non refluxif, syndrome de Prune-Belly.
L’obstruction s’accompagne d’une diminution du débit sanguin rénal (RBF), du débit de filtration glomérulaire (GFR) et de l’excrétion potassique, selon Josephson et al., et seule une infime proportion de ces lésions est atténuée par une intervention précoce.5
Causes de l’UPJO
La JPU primitive peut être due à des causes intrinsèques, extrinsèques ou intraluminales.6 L’obstruction intrinsèque est due à un segment apéristaltique résultant d’une musculature anormale ou d’un développement neurologique anormal. Il en résulte un écoulement urinaire inapproprié du bassinet vers l’uretère. Parmi les autres causes d’obstruction intrinsèque figurent un segment sténotique provoqué par un dépôt excessif de collagène et des plis urétéraux congénitaux.
L’obstruction extrinsèque est provoquée par un vaisseau croisé aberrant qui passe en avant de la jonction pyélo-urétérale (JPU). Ce type d’obstruction est généralement intermittente et se manifeste plus tard, à partir de l’âge de sept ans ou au-delà. L’obstruction intraluminale est due à un polype fibroépithélial. Cette pathologie peut toucher n’importe quel segment des voies urinaires, de la JPU jusqu’à l’urètre.7 L’obstruction de la JPU secondaire est due à une chirurgie antérieure, à un RVU, à un calcul enclavé et à une sténose post-inflammatoire.
Les anomalies associées à l’UPJO comprennent ; UPJO controlatérale (10-30 %), dysplasie rénale controlatérale, MCDK controlatéral, agénésie rénale unilatérale (5 %), duplicité du système collecteur où l’UPJO survient habituellement au niveau de l’hémirein inférieur, rein en fer à cheval, rein ectopique, VUR (20-40 %) et syndrome VACTERL.8,9
Pour éviter une élévation progressive de la pression intrapyélique, le pyélon se dilate pour s’y adapter, prévenant ainsi les lésions rénales. Néanmoins, une obstruction prolongée, avec défaillance des mécanismes compensateurs et perte de compliance, entraîne une augmentation de la pression intrarénale avec des lésions rénales subséquentes. Plus l’obstruction survient tôt au cours de la vie fœtale, plus les lésions rénales seront importantes. La crise de Dietl est une douleur abdominale intermittente résultant de la distension du système pyélocaliciel, et elle est habituellement causée par un vaisseau croisé provoquant une UPJO chez les enfants de plus de cinq ans.10
Évaluation et diagnostic
Le diagnostic de l’ANH repose sur la mesure de l’APRPD, qui est de cinq mm ou plus au deuxième trimestre et de sept mm ou plus au troisième.11 L’interprétation du RBUS fœtal implique les éléments suivants : sexe fœtal, indice de liquide amniotique (ILA), âge gestationnel, anomalies congénitales associées, hydronéphrose unilatérale ou bilatérale, degré d’hydronéphrose, APRPD, état parenchymateux sous la forme de l’épaisseur et de l’échogénicité parenchymateuses, dilatation urétérale, plénitude vésicale et cyclicité en plus de l’épaisseur de sa paroi, et dilatation urétrale (Tableau 1).
Tableau 1 Les dix questions à aborder pour l’évaluation de l’hydronéphrose anténatale.
| 10 questions | Question |
|---|---|
| 1 question liée au liquide amniotique | Index de liquide amniotique (AFI) |
| 3 questions liées au fœtus | Sexe masculin ou féminin |
| Âge gestationnel | |
| Autres anomalies congénitales | |
| 3 questions liées aux reins | Grade et latéralité de l’hydronéphrose |
| Dilatation de l’uretère supérieur | |
| Parenchyme rénal (épaisseur parenchymateuse et échogénicité) | |
| 3 questions liées au reste des voies urinaires | Dilatation de l’uretère inférieur |
| Vessie (réplétion vésicale et épaisseur de la paroi vésicale) | |
| Dilatation de l’urètre postérieur |
Une épaisseur de paroi vésicale supérieure à deux mm en vessie pleine définit une paroi vésicale épaissie, quel que soit l’âge gestationnel.12 L’impossibilité de visualiser la vessie à plusieurs reprises est un signe d’exstrophie vésicale. Dans les VUP, on peut observer une vessie pleine avec dilatation de l’urètre postérieur, donnant un “signe en trou de serrure”.
Au deuxième trimestre, l’ANH est classée en légère, modérée et sévère lorsque l’APRPD est de quatre à six mm, de sept à dix mm, et de plus de dix mm, respectivement. Au troisième trimestre, l’hydronéphrose prénatale est classée selon les mêmes grades que précédemment lorsque l’APRPD mesure sept à neuf mm, dix à 15 mm, et plus de 15 mm, respectivement (Tableau 2).11
Tableau 2 Catégories d’hydronéphrose anténatale.
| Degré | 2e trimestre | 3e trimestre | % d’HNA |
|---|---|---|---|
| léger | 4-7 mm | 7-9 mm | 56-88% |
| modéré | 7-10 mm | 9-15 mm | 10-30% |
| sévère | >10 mm | >15 mm | 2-13% |
Le nouveau-né doit être réévalué trois à sept jours après la naissance et pas avant afin d’éviter des résultats faussement négatifs causés par l’oligurie transitoire du nouveau-né, en particulier durant les 48 premières heures de vie. Néanmoins, RBUS est réalisé immédiatement après l’accouchement en cas d’hydronéphrose bilatérale de haut grade, de rein unique, d’oligoamnios, ou en cas de suspicion de PUV.
En Amérique du Nord, le système de classification de la SFU est utilisé pour classer l’hydronéphrose, tandis que l’APRPD est utilisée en Europe. La classification SFU de l’hydronéphrose est présentée dans le Tableau 3.13
Tableau 3 Système de classification de la SFU.
| Grade SFU | Descripteurs |
|---|---|
| Grade 0 | pas de dilatation, les parois calicielles sont accolées |
| Grade 1 (léger) | dilatation du bassinet rénal sans dilatation des calices (peut également survenir dans un bassinet extrarénal) |
| pas d’atrophie parenchymateuse | |
| Grade 2 (léger) | dilatation du bassinet rénal (légère) et des calices (le système pyélocaliciel est conservé) |
| pas d’atrophie parenchymateuse | |
| Grade 3 (modéré) | dilatation modérée du bassinet rénal et des calices |
| émoussement des fornix et aplatissement des papilles | |
| un amincissement cortical léger peut être observé | |
| Grade 4 (sévère) | dilatation majeure du bassinet rénal et des calices, qui apparaissent ballonnés |
| perte des limites entre le bassinet rénal et les calices | |
| atrophie rénale visible sous forme d’amincissement cortical |
Le désavantage du système de classification de la SFU est qu’il est quelque peu subjectif en l’absence d’utilisation des mesures de l’APRPD, ce qui rend difficile sa corrélation avec les mesures de l’ANH. Sur la base de l’APRPD, l’hydronéphrose est classée en légère, modérée et marquée, avec des valeurs d’APRPD de 7-10 mm, 10-15 mm et supérieures à 15 mm, respectivement.14 Le défaut de cette classification est qu’elle repose sur un seul élément pour graduer l’hydronéphrose et néglige les autres paramètres, tels que l’épaisseur parenchymateuse et la dilatation calicielle périphérique.
Par conséquent, une nouvelle classification de l’hydronéphrose a été proposée afin d’éviter les inconvénients des deux systèmes de classification précédents. Le système de classification de la dilatation des voies urinaires (UTD) repose sur six constatations à l’échographie réno-vésicale (RBUS) ; APRPD, dilatation calicielle avec distinction, en postnatal, entre dilatation calicielle centrale et périphérique, épaisseur du parenchyme rénal, aspect du parenchyme rénal, anomalies vésicales et anomalies urétérales. Ce système de classification distingue si les constatations à la RBUS étaient anténatales (normal, A1, A2, A3) ou postnatales (normal, P1, P2, P3).15
Si le RBUS est sans particularité, il doit être répété après quatre à six semaines. En cas de grade SFU 0 avec un APRPD inférieur à sept mm lors d’un RBUS réalisé entre la quatrième et la sixième semaine, aucun suivi supplémentaire n’est nécessaire. L’effet du grade d’hydronéphrose sur le taux de résolution a été étudié par.16
Si une hydronéphrose postnatale est détectée en présence d’une dilatation urétérale ou d’une suspicion de vessie anormale, une cystourétrographie mictionnelle (VCUG) devrait être demandée afin d’exclure un VUR, des PUV chez les garçons (Figure 1), une dysfonction vésicale neuropathique ou non neuropathique.
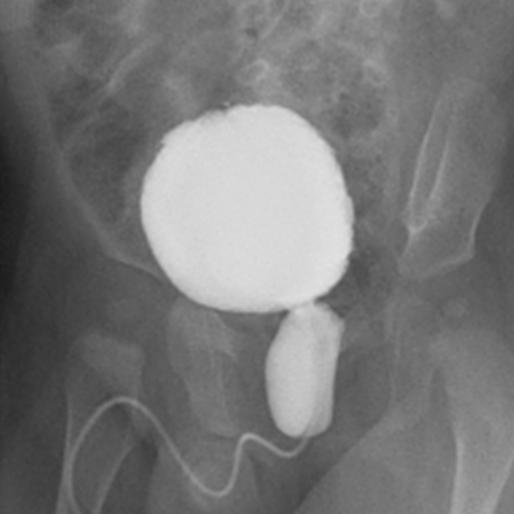
Figure 1 Urétrocystographie mictionnelle montrant l’aspect classique des valvules de l’urètre postérieur.
En présence d’une hydronéphrose postnatale de grade 1 à 2 selon la SFU ou d’un APRPD inférieur à 15 mm, sans dilatation urétérale ni anomalie vésicale chez un nourrisson asymptomatique, une RBUS devrait être réalisée tous les trois à six mois, puis tous les six à douze mois.17 La résolution spontanée de l’hydronéphrose est généralement attendue au cours des deux premières années de vie.
En revanche, une hydronéphrose SFU de grade 3 à 4 ou une APRPD de 15 mm ou plus indique un suivi plus rapproché. Dans une telle situation, la VCUG est nécessaire pour exclure VUR, PUV ou une pathologie vésicale. Si la VCUG est sans particularité, un rénogramme dynamique, en particulier au MAG3, est recommandé afin d’apprécier la fonction rénale différenciée et la présence d’une obstruction.
L’OJPU se manifeste soit en période prénatale, soit après la naissance. En période prénatale, l’OJPU est la cause la plus fréquente d’HNA pathologique 18. Après la naissance, le patient peut être asymptomatique avec une hydronéphrose découverte fortuitement, ou présenter une fièvre élevée due à un rein infecté et obstructé, ou des douleurs du flanc chez les enfants plus âgés. Chez les enfants de plus de cinq ans présentant une obstruction intermittente, un vaisseau croiseur aberrant doit être suspecté.
L’hématurie est une présentation peu fréquente et survient généralement après un traumatisme du flanc, car le rein hydronéphrotique est plus susceptible aux traumatismes que le rein normal. Une masse palpable au flanc est rarement rencontrée à l’ère de l’échographie.
Le RBUS seul peut fournir un diagnostic provisoire de la pathologie sous-jacente à l’origine de l’ANH. Une dilatation du bassinet rénal avec un uretère non dilaté indique une UPJO (Figure 2) tandis qu’un uretère dilaté peut être dû à un VUR ou à un mégauretère. Dans la MCDK, les kystes rénaux ne sont pas reliés entre eux et le parenchyme rénal n’est pas préservé, alors que les kystes rénaux sont habituellement bilatéraux et communicants avec un parenchyme rénal préservé. L’urétérocèle apparaît comme un kyste dans un kyste (la vessie), et elle est associée au pôle supérieur des systèmes rénaux dupliqués dans 80 % des cas, tandis que les 20 % restants sont des urétérocèles à système unique qui nécessitent une ponction pour la décompression du système. L’aspect en « trou de serrure » d’une vessie dilatée et de l’urètre postérieur chez les garçons est diagnostique de PUV.
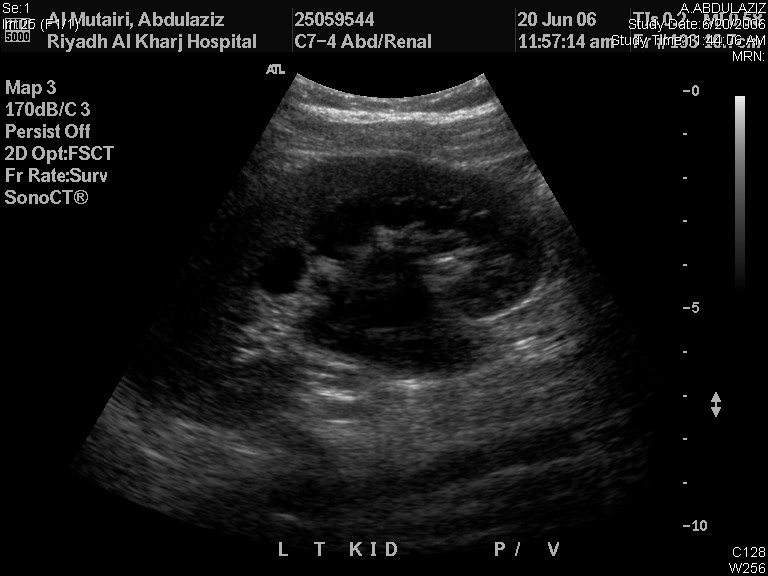
Figure 2 Échographie rénale et vésicale montrant une UPJO gauche
Le rôle de la scintigraphie rénale ne doit pas être négligé. Trois types de scintigraphie rénale sont utilisés : mercapto-acétyl triglycine (MAG3), acide diéthylènetriaminepentaacétique (DTPA) et acide dimercaptosuccinique (DMSA).18 Tous sont marqués au technétium-99 métastable (99mTc). Le MAG3 subit à la fois une excrétion tubulaire et glomérulaire. Le DTPA est uniquement filtré par les glomérules, c’est pourquoi il ne devrait pas être prescrit en cas d’insuffisance rénale. Le DMSA se fixe uniquement aux tubules rénaux proximaux. La demi‑vie (t1/2) du 99mTc est de six heures. De nombreux centres nord-américains disposent d’un accès limité à l’agent DMSA, ce qui restreint la possibilité de réaliser ce type d’examen de médecine nucléaire.
MAG3 et DTPA sont des examens dynamiques et fonctionnels, par opposition au DMSA. Ils fournissent des informations sur la fonction rénale relative et la présence d’une obstruction, en acquérant des images sériées au fil du temps évaluant la captation, l’excrétion et le drainage. Toutefois, le MAG3 est privilégié chez l’enfant. Le DMSA est une scintigraphie statique qui peut détecter non seulement la fonction rénale relative, mais aussi la présence de cicatrices rénales. La rénographie est réalisée de la quatrième à la sixième semaine afin de s’assurer que la maturation rénale a été atteinte.19
Si une scintigraphie rénale est réalisée avant la maturation rénale, l’examen peut montrer une activité corticale résiduelle élevée, retenant jusqu’à 50 % ou plus du pic. Le MAG3 ou le DTPA sont indiqués lorsque l’UPJO ou l’UVJ sont suspectés, tandis qu’un DMSA peut être réalisé en cas de VUR dans le cadre d’une approche top-down (Figure 3) Les rénogrammes comportent trois phases. La première est la phase vasculaire, qui reflète le flux sanguin rénal et dure jusqu’à dix secondes. La seconde est la phase parenchymateuse, qui correspond à la captation rénale et survient de la dixième seconde à la cinquième minute suivant l’injection de l’isotope. Enfin, vient la phase excrétrice, qui représente l’excrétion du radio-isotope dans le bassinet rénal.
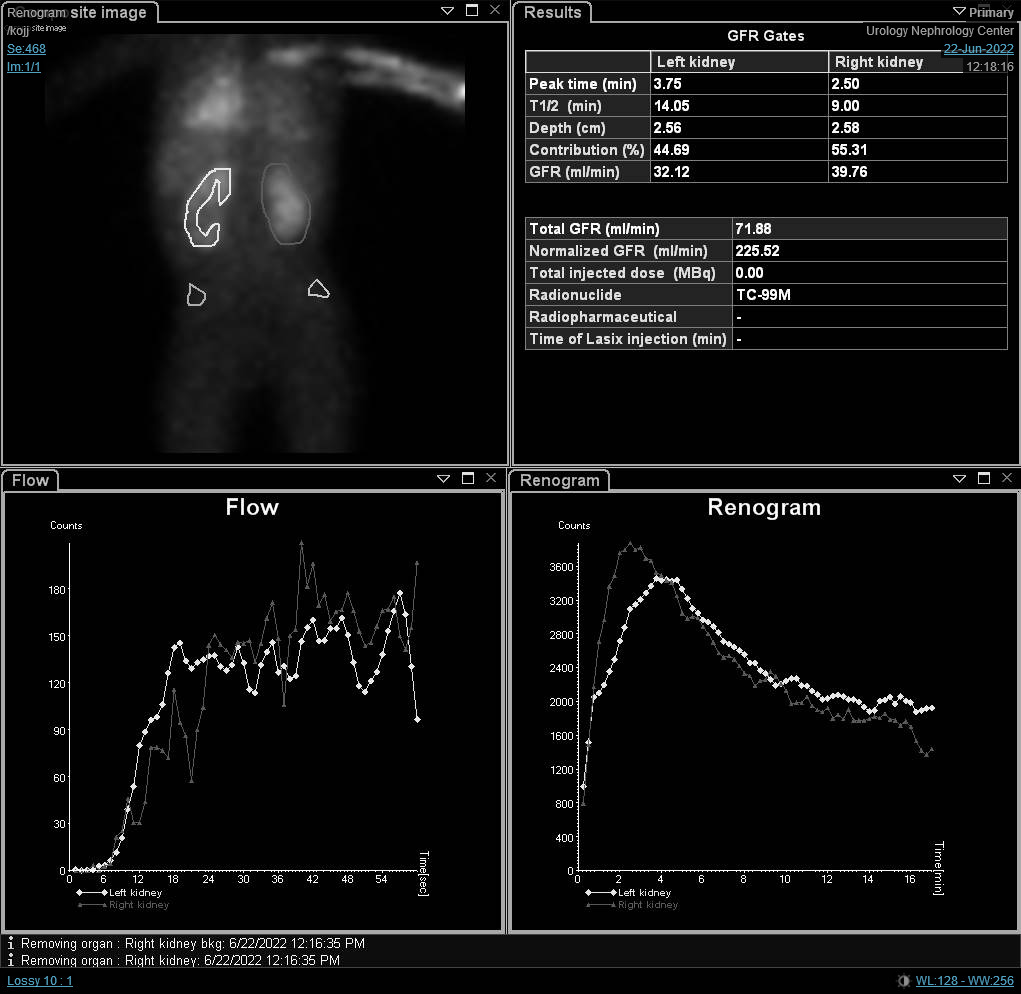
Figure 3 Scintigraphie rénale au DMSA montrant une diminution de la captation du radio-isotope, avec des cicatrices au rein gauche
Certaines précautions sont prises en compte avant la scintigraphie rénale, par exemple une hydratation adéquate, voire une perfusion intraveineuse de sérum physiologique à un débit de 10 mL/ kg avec un maintien de 4 mL/kg /heure et la pose d’une sonde urétrale pour vider la vessie afin d’éviter des résultats faussement positifs d’obstruction. Il n’y a pas de consensus concernant le moment de l’injection du diurétique. De manière routinière, il est injecté 20 minutes après l’isotope radioactif (F+20). Pour éviter la stase de l’isotope dans des systèmes pyélocaliciels dilatés, il est recommandé d’injecter le furosémide 15 minutes avant le produit radioactif (F-15). D’autres auteurs préconisent d’injecter le furosémide en même temps que l’isotope radioactif (F+0). La dose de furosémide (Lasix) est de 1 mg/kg au début de la petite enfance et de 0,5 mg/ kg par la suite, avec une dose maximale de 40 mg.
Bien que la fonction rénale différentielle soit le paramètre le plus important dans la scintigraphie rénale, les courbes du rénogramme et le t1/2 peuvent indiquer un diagnostic provisoire d’obstruction. O’Reilly a décrit quatre courbes pour le rénogramme dynamique ; la courbe de type I représentant une captation et une excrétion normales (courbe en cloche) (Figure 4), la courbe de type II représentant un profil obstructif sans réponse au diurétique (Figure 5) et Figure 6), la courbe de type IIIa qui s’élève initialement puis chute après l’injection de diurétique, la courbe de type IIIb qui s’élève initialement puis ne diminue pas et ne continue pas à s’élever (équivoque), et le type IV dans lequel une décompensation retardée survient 15 minutes après l’injection de furosémide.20
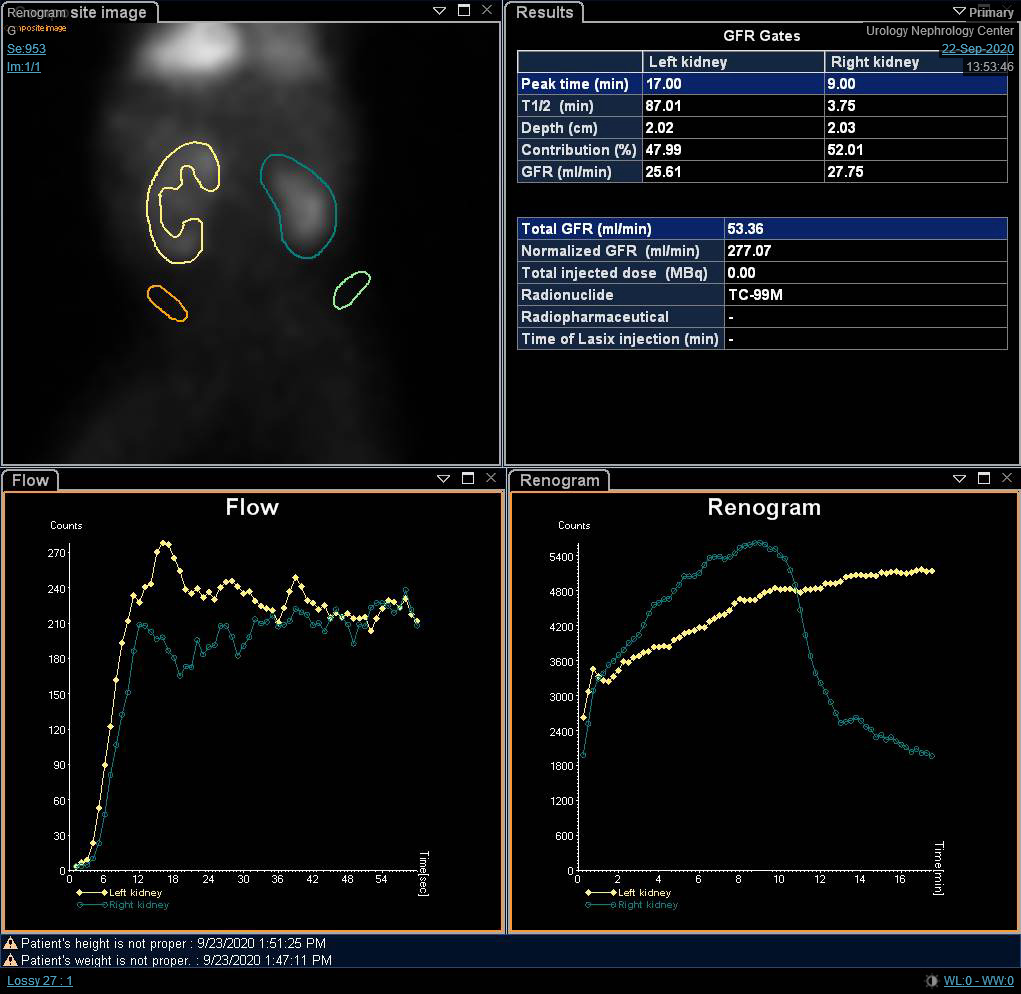
Figure 4 Scintigraphie au DTPA montrant une courbe en cloche non obstructive
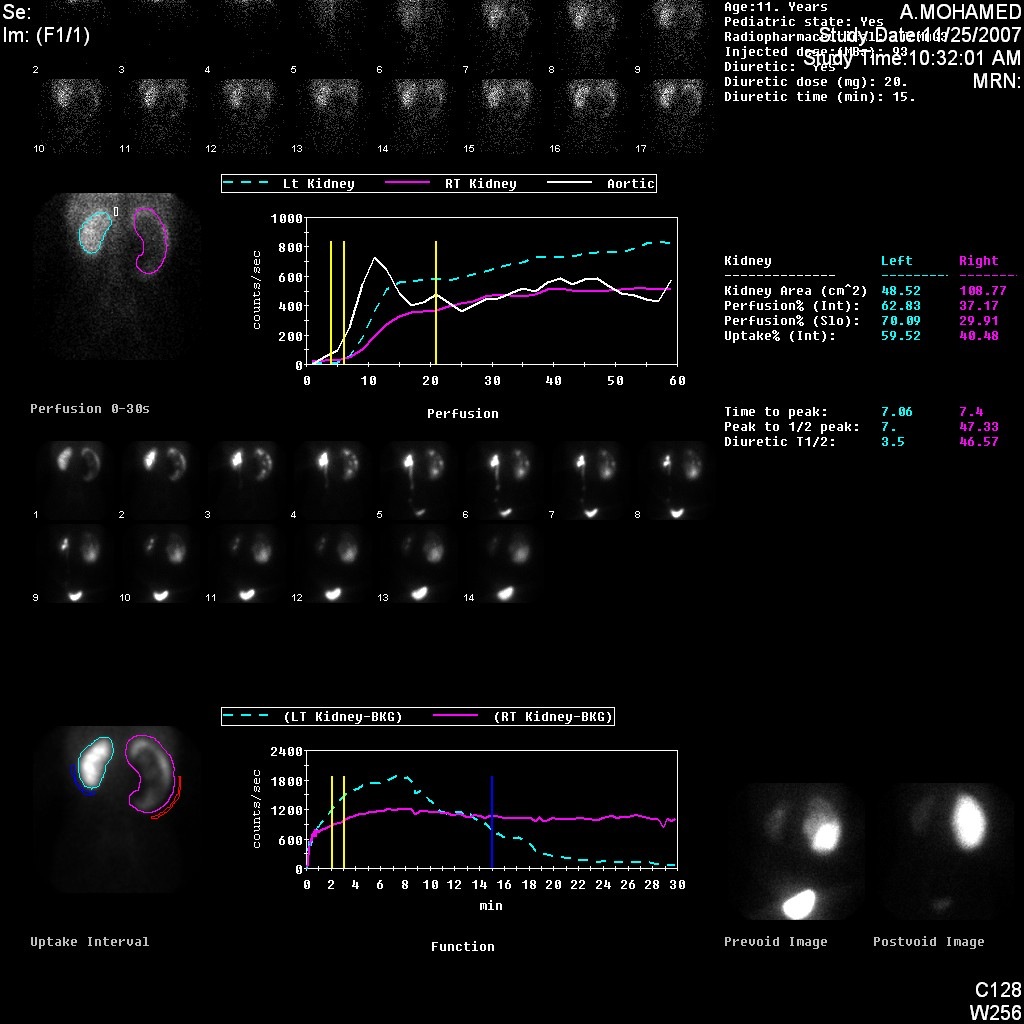
Figure 5 Scintigraphie rénale au DTPA mettant en évidence une courbe obstructive du rein gauche
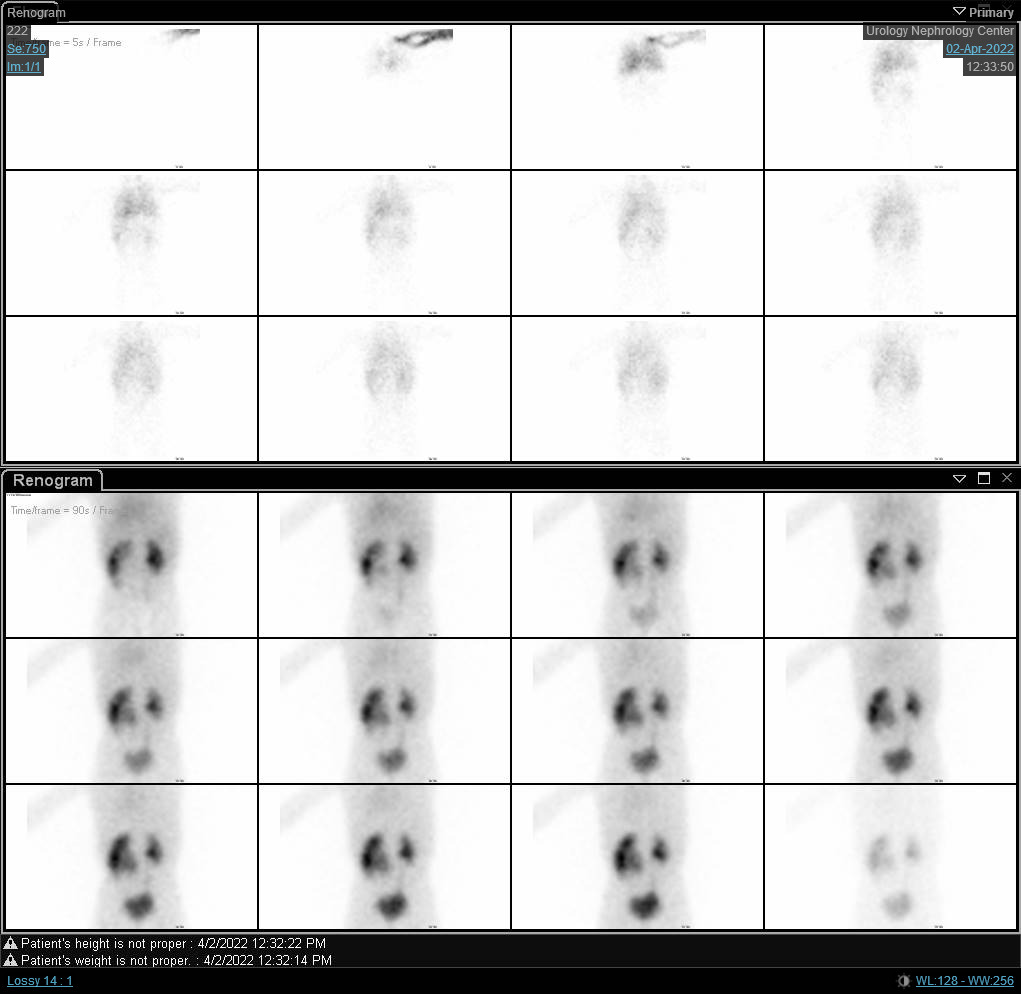
Figure 6 Scintigraphie rénale au DTPA montrant une courbe obstructive du rein droit avec t1/2 prolongé.
Un T1/2 inférieur à 10 minutes est normal, tandis qu’un t1/2 supérieur à 20 minutes indique une obstruction. Les valeurs intermédiaires sont considérées comme équivoques. Cependant, beaucoup déconseillent de se fier uniquement à la valeur de t1/2 pour déterminer s’il existe une obstruction, car la hauteur et la forme de la courbe, l’état d’hydratation du patient, le drainage de la vessie et la fonction rénale globale peuvent influencer cette valeur.
Pour confirmer le diagnostic d’UPJO, une RBUS est réalisée, suivie d’une scintigraphie rénale afin de fournir des informations à la fois structurelles et fonctionnelles (Figure 7) Dans les cas discutables, une urographie par résonance magnétique (MRU) peut être demandée. La VCUG n’est pas nécessaire tant que l’uretère n’est pas dilaté, tandis que l’urographie intraveineuse est obsolète en urologie pédiatrique moderne.
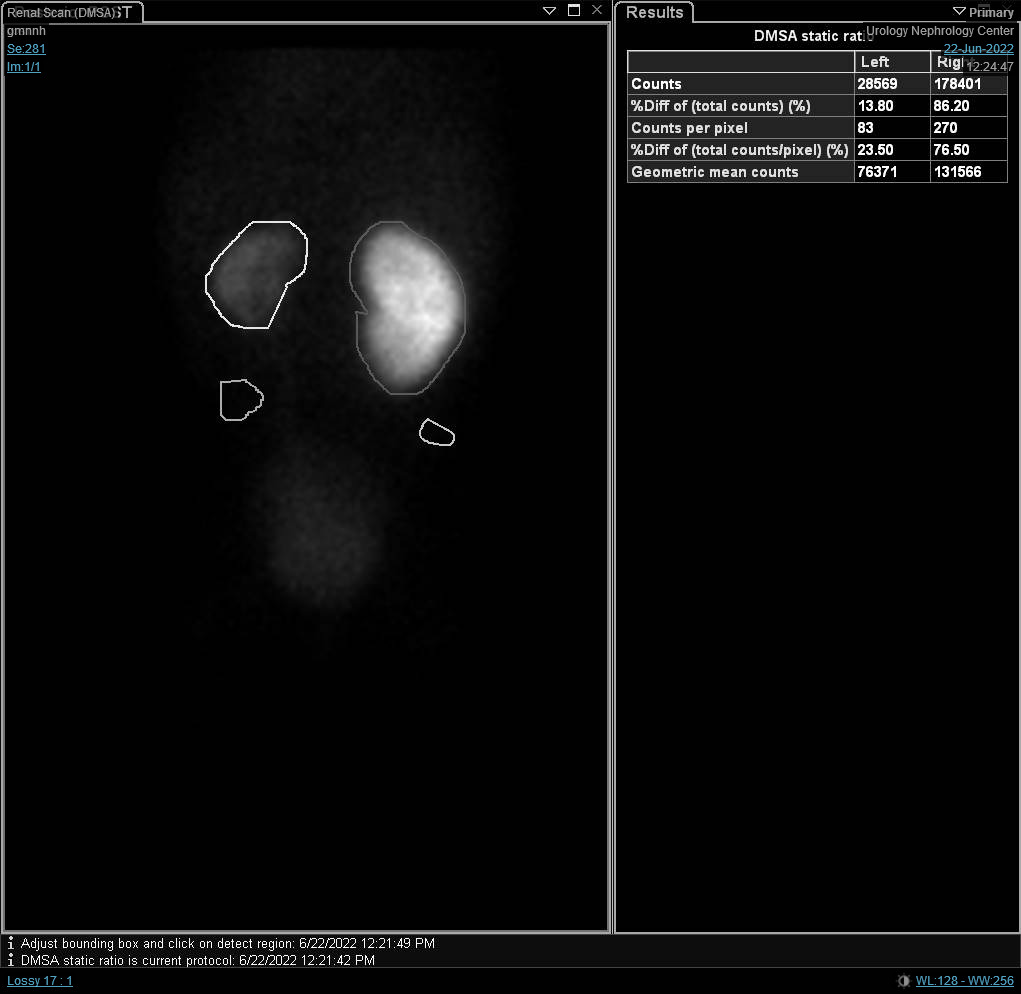
Figure 7 Scintigraphie au DTPA montrant un drainage retardé du rein gauche causé par une UPJO gauche
Au moyen du RBUS, un pelvis rénal dilaté avec un uretère non dilaté est observé. Comme mentionné précédemment, l’APRPD doit être mesuré et, s’il est supérieur à 30 mm, une scintigraphie rénale doit être prescrite, car l’incidence de la détérioration de la fonction rénale est élevée à ce degré d’hydronéphrose.
L’utilisation de l’échographie Doppler duplex pour suggérer une obstruction ne doit pas être négligée, bien que la précision de ces constatations ne soit pas très élevée. La présence de jets urétéraux de l’uretère vers la vessie exclut une obstruction urétérale. Un indice de résistance (RI) de 0,7 ou plus indique une obstruction. Il est mesuré en soustrayant la vitesse télédiastolique (EDV) de l’artère rénale de sa vitesse systolique maximale (PSV), puis en divisant le résultat par la PSV. La justification de l’utilisation du RI est que l’uropathie obstructive s’accompagne à terme d’une diminution du flux sanguin rénal. La cysto-urétrographie mictionnelle (VCUG) n’est pas demandée dans le contexte d’une obstruction de la jonction pyélo-urétérale (UPJO), sauf s’il existe une dilatation de l’extrémité distale de l’uretère dans les cas d’UPJO secondaire à un reflux vésico-urétéral (VUR).
Bien que la tomodensitométrie (TDM) avec injection de produit de contraste soit généralement évitée chez l’enfant en raison des risques liés aux rayonnements ionisants, elle peut être utilisée pour détecter la présence d’un vaisseau croisant en phase artérielle (cortico-médullaire). L’urographie intraveineuse (UIV) n’est plus recommandée en urologie pédiatrique moderne. Tous les examens avec produit de contraste doivent être évités, sauf si les tests de la fonction rénale sont dans les limites de la normale.
L’IRM peut être réalisée dans les cas équivoques où le RBUS n’est pas concluant. L’IRM dynamique avec gadolinium a suscité de l’intérêt ces dernières années en raison de sa capacité à fournir des informations non seulement sur le diagnostic anatomique mais aussi sur la fonction. Elle permet d’évaluer la fonction rénale différentielle en mesurant le volume du parenchyme rehaussé au moyen d’un logiciel spécialisé, utilisé par un physicien médical pour effectuer ce calcul. En outre, le calcul du temps de transit rénal, qui correspond à la différence de temps entre le rehaussement cortical et l’apparition de l’uretère, peut être utilisé pour confirmer l’obstruction.
Une urétéropyélographie rétrograde peut être utilisée en préopératoire pour confirmer le diagnostic dans les cas douteux ou si le chirurgien prévoit une lombotomie dorsale afin d’exclure une sténose urétérale concomitante. Enfin, certains marqueurs biochimiques ont été utilisés pour détecter des lésions tubulaires rénales dues à l’obstruction, par exemple la β2-microglobuline, la N-acétyl-β-D-glucosaminidase (NAG) et le facteur de croissance transformant bêta 1 (TGF-β1).
Options de traitement et leurs résultats
Prise en charge prénatale de l’HNA
Une intervention prénatale est rarement nécessaire de nos jours et elle n’est envisagée que chez ceux qui présentent une obstruction sévère des voies urinaires basses, p. ex., une hydronéphrose bilatérale de haut grade avec oligoamnios.21 En l’absence d’affections mettant en jeu le pronostic vital après la 20e semaine de gestation, la grossesse ne devrait pas être interrompue, et les plans d’accouchement ne devraient pas être influencés (p. ex., déclenchement précoce du travail).
Prise en charge postnatale de l’ANH
L’examen physique ne doit pas être négligé dans les cas d’ANH diagnostiquée. Par exemple ; une masse abdominale peut être palpée en cas d’UPJO ou de MCDK, tandis qu’un testicule non descendu et une musculature déficiente de la paroi abdominale antérieure sont retrouvés dans le syndrome de Prune- Belly, en plus d’une vessie palpable en cas de PUV.
La prophylaxie antibiotique continue (CAP) est recommandée en cas d’hydronéphrose de grade 3 et 4 selon la SFU ou d’un APRPD de 15 mm ou plus afin de réduire l’incidence des infections urinaires au cours des deux premières années de vie.17 Cependant, de nombreuses études sur l’ANH (en l’absence de reflux ou de mégauretère/hydrourétère) ne montrent aucun bénéfice de la CAP chez les patients présentant une hydronéphrose isolée de haut grade (grade 3-4).22
La CAP au cours des deux premiers mois comprend l’amoxicilline et le triméthoprime à la dose de 10 à 20 mg/kg une fois par jour et de 2 mg/kg une fois par jour, respectivement. Après cet âge, la nitrofurantoïne et le triméthoprime-sulfaméthoxazole (TMP/SMX) sont prescrits à la dose de mg/ kg/ jour. Une prescription précoce de nitrofurantoïne peut entraîner une anémie hémolytique ou un syndrome de détresse respiratoire, tandis que le sulfaméthoxazole au cours des deux premiers mois provoque un ictère nucléaire.
Les effets indésirables fréquents de la nitrofurantoïne comprennent des troubles gastro-intestinaux et des réactions cutanées. Les événements indésirables associés au TMP/SMX sont principalement imputables au sulfaméthoxazole, le plus souvent des réactions cutanées. L’exposition aux antibiotiques au cours de la première année de vie est associée à un risque accru de développer des maladies atopiques, notamment l’eczéma, l’asthme et des allergies ultérieurement.23 Cette observation est attribuée à l’hypothèse de l’hygiène, qui propose que grandir dans un environnement extrêmement hygiénique avec une exposition microbienne minimale pourrait majorer les réponses immunitaires atopiques. Un autre inconvénient de la CAP est le développement d’une résistance aux antibiotiques.
Le principal défi pour les urologues pédiatriques est de distinguer une UPJO qui va se résoudre spontanément de celle qui entraînera une dégradation de la fonction rénale. La première nécessite un suivi, tandis que la seconde requiert une intervention.
Les indications d’une intervention définitive comprennent la présence de symptômes (douleur, infection urinaire fébrile), un rein palpable, et un APRPD de plus de 40 mm.24 Les autres indications comprennent ; une hydronéphrose progressive au cours du suivi, une fonction rénale différenciée inférieure à 40 % et une détérioration de la fonction différenciée de 10 % ou plus.25 En cas d’UPJO symptomatique négligée avec une fonction rénale différenciée inférieure à 10 %, la néphrectomie est recommandée. Cependant, certains urologues pédiatres préfèrent un drainage précoce par sonde de néphrostomie ou par stent urétéral interne, puis une réévaluation.
La pyéloplastie d’Anderson-Hynes par résection-anastomose (AHDP) reste l’intervention de référence pour le traitement définitif de l’UPJO.17 Dans cette technique, le segment dyskinétique ou sténotique est excisé, l’uretère est spatulé en regard du pôle inférieur du rein, puis le bassinet est anastomosé à l’uretère spatulé sur un stent transanastomotique. En cas d’uretère à implantation haute, la plastie en Y-V de Foley était auparavant privilégiée, mais elle a été largement remplacée par l’AHDP. La pyéloplastie en Y-V de Foley peut être appropriée pour l’UPJO en cas de rein en fer à cheval.
La technique du hitch vasculaire conserve un rôle en urologie pédiatrique moderne car elle est moins exigeante et moins chronophage que l’AHDP. De plus, son taux de succès peut atteindre 90 % avec des taux de complications moindres (p. ex., fuite urinaire et sténose anastomotique). Elle consiste à élever le vaisseau croisant antérieurement, à distance de la JPU. Toutefois, une obstruction intrinsèque concomitante doit être exclue par un test diurétique afin d’éviter un échec technique.
Le patient est installé en décubitus latéral, avec le côté ciblé orienté vers le haut. L’incision est pratiquée en sous-costal antérieur (Figure 8) avec un abord extrapéritonéal. Après clivage ou section des muscles oblique externe, oblique interne et transverse de l’abdomen, avec rétraction médiale du péritoine et de la graisse extrapéritonéale (pararénale), les deux feuillets du fascia de Gerota sont ouverts. La JPU est identifiée et deux points de traction sont placés en amont et en aval de la JPU avant de la sectionner.
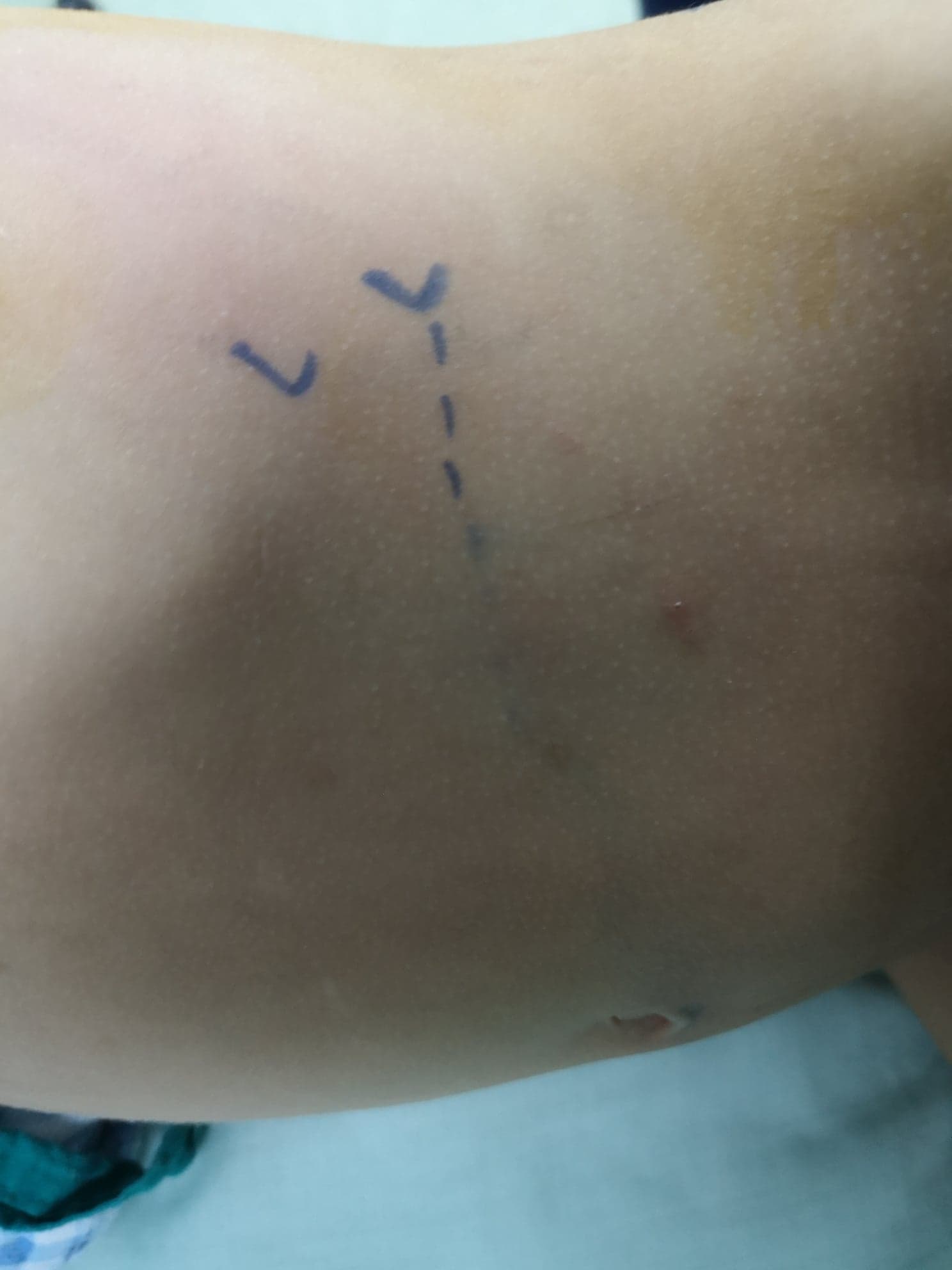
Figure 8 Incision lombaire antérieure en avant de l’extrémité de la dernière côte pour pyéloplastie ouverte à gauche
La JPU est sectionnée entre les deux points d’amarrage. La pyéloplastie de réduction n’est réalisée que dans les cas de redondance marquée du bassinet rénal, où l’excédent de bassinet est réséqué. À l’inverse, d’autres auteurs ont conclu que l’excision du bassinet rénal (pyéloplastie de réduction) n’est pas nécessaire dans la plupart des cas de pyéloplastie désarticulée.26 Ils ont constaté que les cas avec ou sans pyéloplastie de réduction avaient des résultats chirurgicaux similaires. L’étape suivante consiste à anastomoser les deux berges du bassinet rénal aux deux berges de l’uretère spatulé.
Le premier point à prendre est celui de l’angle, suivi de la ligne de suture postérieure, en insérant le stent transanastomotique et en complétant la ligne de suture antérieure. Les deux lambeaux restants du pyélon sont suturés l’un à l’autre. Les sutures utilisées sont du vicryl 6-0 (ou un autre fil monofilament résorbable), soit en continu, soit en points séparés. Au tout début de la courbe d’apprentissage, commencez par des points séparés jusqu’à la maîtrise de la technique.
Une autre voie pour la pyéloplastie ouverte, autre que la voie lombaire antérieure, est la lombotomie postérieure ou dorsale (DL) (Figure 9)27 C’est la plus ancienne voie d’abord utilisée pour accéder au rein et à l’uretère proximal. Cependant, elle n’est plus utilisée à grande échelle de nos jours, en particulier chez l’enfant. La DL peut être réalisée par l’une des incisions cutanées suivantes; incision verticale de Gil-Vernet le long du bord latéral du muscle sacro-épineux, incision verticale selon la modification de Lurz suivant le bord latéral du muscle carré des lombes, ou incision transversale suivant les lignes de Langer.
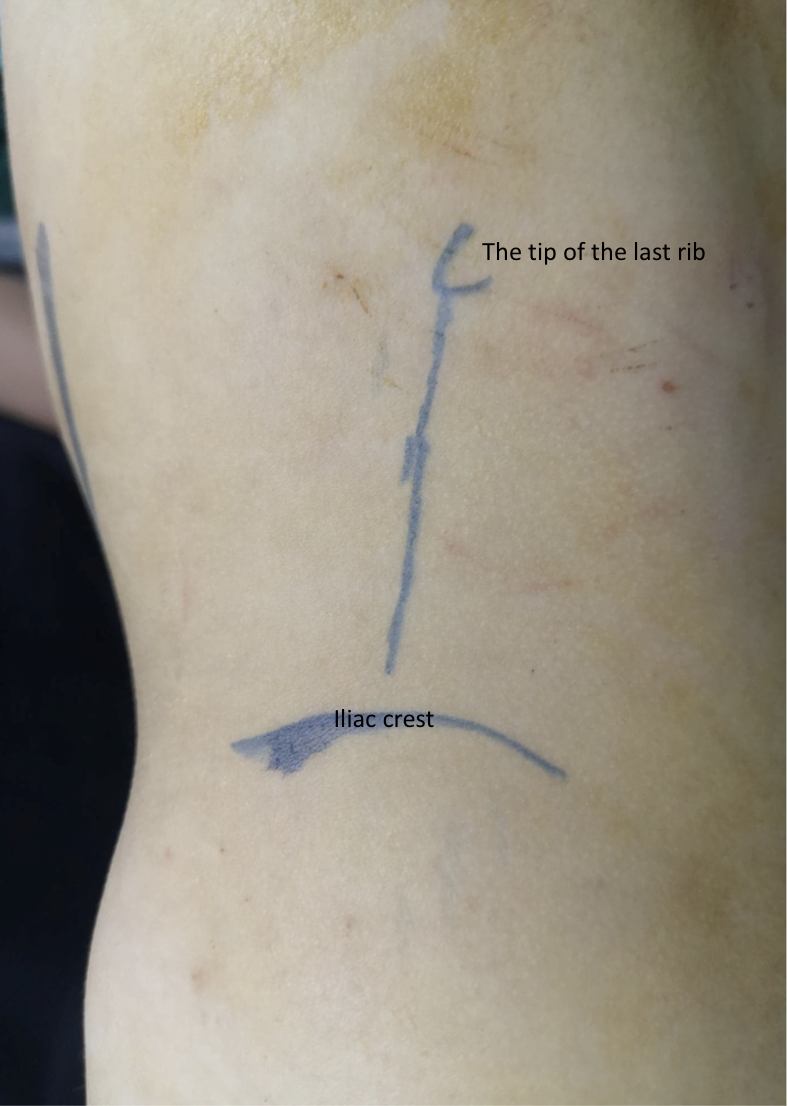
Figure 9 Incision de lombotomie dorsale pour pyéloplastie ouverte à gauche
Le principal avantage de la DL est l’accès facile au rétropéritoine au moyen de deux incisions simples sans section musculaire. Un rein hydronéphrotique volumineux n’est plus considéré comme une contre-indication à la DL, car les reins sont généralement plus mobiles chez l’enfant. Cependant, la DL doit être évitée en cas de malrotation ou de malposition rénale.
Bien que la pyéloplastie ouverte soit la technique de référence chez les sujets jeunes, avec un taux de succès de 95 %, les techniques laparoscopiques et assistées par robot affichent des taux de succès comparables.28 Les techniques mini-invasives présentent l’avantage d’une douleur moindre, d’un séjour hospitalier postopératoire plus court et de cicatrices minimes aux sites des trocarts. Néanmoins, elles nécessitent un équipement spécifique entraînant des coûts plus élevés, en plus d’une courbe d’apprentissage relativement plus longue. L’utilisation du système robotisé da Vinci® a rendu la suture intracorporelle plus facile qu’auparavant.
La pyéloplastie laparoscopique et assistée par robot peuvent être réalisées par voie transpéritonéale ou rétropéritonéale.28 La voie transpéritonéale est plus fréquemment utilisée en raison de repères anatomiques évidents et d’un espace de travail relativement large. Néanmoins, elle s’accompagne de davantage de complications que la voie rétropéritonéale, sous forme de lésions d’organes et d’occlusion intestinale. Afin de réduire le temps opératoire et la manipulation intestinale lors d’une pyéloplastie laparoscopique transpéritonéale, la voie trans-mésocolique est utilisée pour mobiliser directement la JPU gauche sans mobilisation colique.29
Lors de la pyéloplastie laparoscopique, au moins trois trocarts sont utilisés, un au niveau de l’ombilic par voie ouverte pour la caméra, et deux trocarts de travail. Le premier trocart de travail est sur la ligne sous-costale tandis que le second est sur la ligne spino-ombilicale, et il est préférable que les deux soient situés sur la ligne pararectale (Figure 10) Lors de la pyéloplastie robot-assistée, le trocart caméra est juste au-dessus de l’ombilic tandis que les deux trocarts de travail sont à mi-distance entre l’ombilic et l’épine iliaque antéro-supérieure, à un travers de doigt sous le rebord costal sur la ligne pararectale. Le trocart d’assistance est placé à mi-distance entre l’ombilic et le processus xiphoïde (Figure 11)
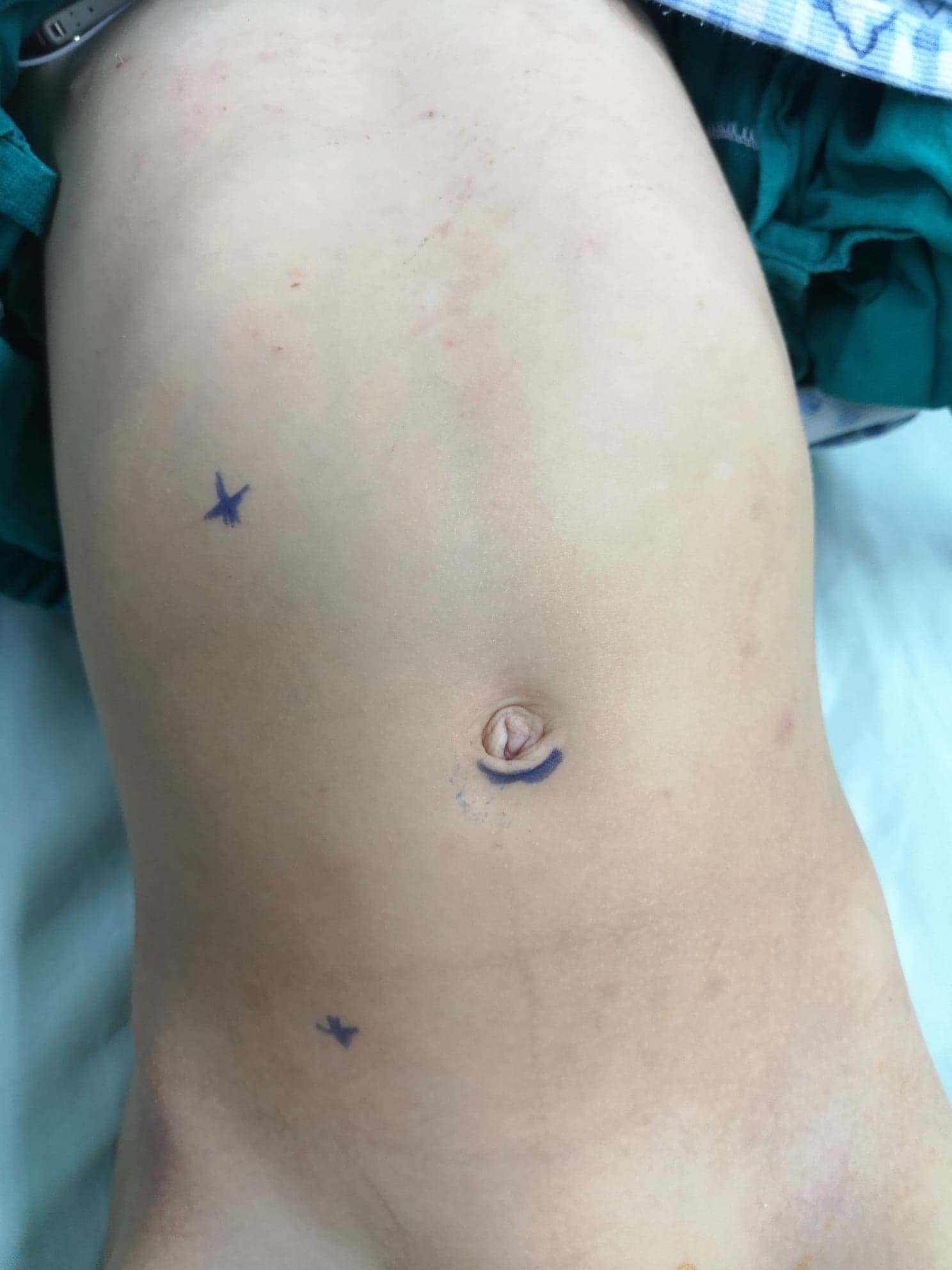
Figure 10 Répartition des trocarts pour une pyéloplastie d’Anderson-Hynes avec résection-anastomose par laparoscopie à droite
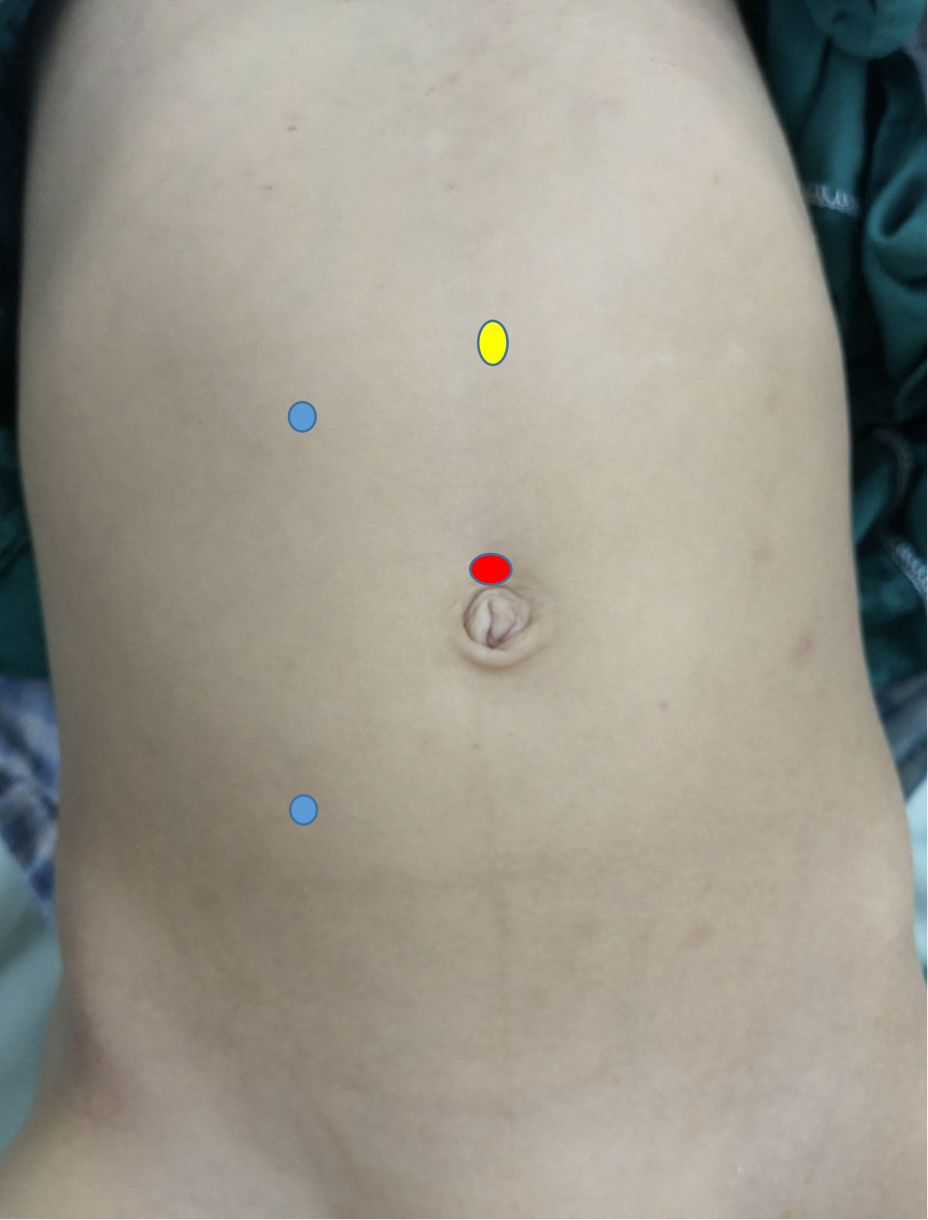
Figure 11 Disposition des trocarts pour une pyéloplastie robot-assistée à droite
Quelle que soit la voie d’abord utilisée, l’objectif principal de la pyéloplastie est d’obtenir une anastomose perméable, déclive, en entonnoir, étanche et sans tension entre l’uretère et le bassinet. Le stent transanastomotique peut être externe ou interne, ou absent.30
Le stent externe est extériorisé à travers le parenchyme rénal ou le bassinet et est habituellement laissé en place pendant dix à quatorze jours. Il est crucial de s’assurer qu’il y ait au moins un œillet dans le bassinet afin d’éviter l’obstruction du stent par l’uretère lui-même. De plus, évitez de laisser des œillets en dehors du système pyélo-caliciel de crainte d’une fuite urinaire postopératoire.
L’une des meilleures façons de confirmer que la boucle inférieure du stent en double queue de cochon (double J) a atteint la vessie est de remplir la vessie via une sonde urétrale préalablement fixée et de vérifier le reflux. Un autre conseil pour la mise en place est d’utiliser le stent de plus petit diamètre disponible et de le faire glisser sur un guide hydrophile. Cela présente moins de risques de se coincer à la jonction urétéro-vésicale et d’y provoquer une lésion, ce qui a été rapporté. Un stent interne est laissé en place pendant une à quatre semaines, puis retiré par cystoscopie. La nécessité d’une séance supplémentaire d’anesthésie est un inconvénient du stent interne. La pose d’un drain tubulaire n’est pas une pratique de routine, sauf dans les cas difficiles ou récidivants.
De nombreux chirurgiens préfèrent utiliser un stent externe, même dans les approches laparoscopiques et robot-assistées, afin d’éviter une seconde anesthésie générale pour le retrait du stent interne.31,32 La sonde pyélourétérale externalisée de Salle posée peropératoirement lors de la pyéloplastie est une autre alternative efficace au stenting interne, car son coût est inférieur à celui d’une seconde séance d’anesthésie générale.32
En cas de pelvis rénal redondant avec un défaut de long segment, un lambeau spiralé de Culp-DeWeerd ou un lambeau vertical de Scardino-Prince sont recommandés. Si le pelvis rénal est insuffisant pour réaliser un lambeau permettant de relier le pelvis rénal à l’uretère, l’urétérocalicostomie peut être une option. Lors d’une urétérocalicostomie, l’uretère est anastomosé au calice inférieur après amputation du pôle inférieur du rein.
L’endopyélotomie endoscopique est une option pour une sténose de court segment (moins de deux cm) dans un rein récupérable après exclusion de la présence d’un vaisseau croisant.33 Elle peut être réalisée pour des cas primaires ou récidivants par voie antégrade ou rétrograde en utilisant un couteau froid ou un laser à l’holmium. Elle présente des taux de succès plus faibles que l’AHDP (70 % vs 95 %, respectivement). Elle est contre-indiquée en cas d’infection urinaire active, de vaisseau croisant et de diathèse hémorragique. En cas d’échec de pyéloplastie, la pyéloplastie de reprise a des taux de succès plus élevés (95–99 %) par rapport à l’endopyélotomie endoscopique (39 %), en particulier chez les jeunes enfants et pour des segments de sténose de plus d’un centimètre.33
Complications
En l’absence de traitement, l’OJPU peut entraîner une détérioration de la fonction du rein atteint allant jusqu’à la perte complète de la fonction. L’hypertension artérielle secondaire est une complication peu fréquente. Les complications de la pyéloplastie sont soit précoces, soit tardives. Les complications précoces comprennent une fuite urinaire par la plaie ou le drain, avec ou sans collection, un stent externe non drainant, un stent interne déplacé, une hématurie, une fièvre et une infection de la plaie. Les complications tardives concernent un échec technique ou une resténose.34
La fuite urinaire est prise en charge par une dérivation urinaire sous forme de néphrostomie percutanée ou de pose rétrograde d’un stent urétéral interne. Elle peut parfois être attribuée à la présence d’orifices du stent en dehors du rein, entraînant une fuite secondaire dans le rétropéritoine. En cas de collection périnéphrique de taille importante, la mise en place d’un drain percutané est préconisée. Un stent externe non drainant peut être dû à un caillot sanguin obstruant le stent ou à l’absence d’orifices sur la portion du stent située dans le bassinet rénal, tandis que le reste des orifices de drainage est obstrué par l’uretère. La première cause est prise en charge par rinçage du stent, tandis que la seconde est traitée par retrait du stent.
L’hématurie est généralement prise en charge de façon conservatrice par une hydratation adéquate, avec ou sans recours à des agents hémostatiques, tandis que l’infection de plaie est traitée par un traitement antimicrobien guidé par les résultats de la culture, en plus de pansements fréquents de la plaie. En cas de fièvre, une obstruction persistante doit être exclue par RBUS, suivie d’antibiotiques intraveineux.
La prise en charge d’une pyéloplastie en échec dépend principalement de la fonction rénale différentielle. Chez un rein obstrué symptomatique et peu fonctionnel avec une fonction rénale différentielle inférieure à 10-15 %, une néphrectomie est envisagée. Pour un rein récupérable, une pyéloplastie de reprise ou parfois une phlébotomie endoscopique est réalisée. Le délai d’intervention est d’au moins trois mois après la chirurgie initiale.
Suivi recommandé
Dans les cas d’ANH unilatérale, un RBUS doit être réalisé une fois au troisième trimestre. Si l’ANH est bilatérale, le RBUS doit être réalisé mensuellement jusqu’à l’accouchement, en fonction de la présence de signes évocateurs d’une obstruction des voies urinaires basses, p. ex. hydronéphrose progressive, oligoamnios ou paroi vésicale épaissie.11
La prise en charge conservatrice des dilatations pyéliques asymptomatiques avec une fonction rénale différenciée supérieure à 40 % est généralement préconisée, car la majorité des cas se résolvent spontanément. L’hydronéphrose progressive ou une détérioration de la fonction rénale au cours de la surveillance constitue une indication reconnue d’une intervention définitive afin de prévenir des lésions ultérieures.
Il n’existe pas de consensus concernant le suivi après pyéloplastie et ce qui est publié dans la littérature relève soit de l’avis d’experts, soit d’expériences anecdotiques.35 Dans notre institut, le patient est réévalué cliniquement après deux semaines en cas de mise en place d’un stent externe ou après six semaines en cas de mise en place d’un stent interne. Trois mois après la chirurgie, une RBUS est demandée, et le grade de l’hydronéphrose et l’APRPD sont observés. S’il existe une amélioration des paramètres susmentionnés, le prochain suivi aura lieu un an après la chirurgie en utilisant la RBUS. En cas de RBUS inchangée, le prochain suivi aura lieu trois mois plus tard par RBUS. Si une hydronéphrose progressive est constatée ou si le patient est symptomatique, une scintigraphie au MAG3 doit être demandée.
Lectures recommandées
- Han HH, Ham WS, Kim JH, Hong CH, Choi YD, Han SW. Transmesocolic approach for left side laparoscopic pyeloplasty: Comparison with laterocolic approach in the initial learning period. Yonsei Medical Journal 2013; 54 (1): 197–203. DOI: 10.3349/ymj.2013.54.1.197.
- Jackson L, Woodward M, Coward RJ. The molecular biology of pelvi-ureteric junction obstruction. Pediatric Nephrology 2018; 33 (4): 553–571. DOI: 10.1007/s00467-017-3629-0.
- Gopal M, Peycelon M, Caldamone A, Chrzan R, El-Ghoneimi A, Olsen H. Management of ureteropelvic junction obstruction in children—a roundtable discussion. Journal of Pediatric Urology 2019; 15 (4): 322–329. DOI: 10.1016/j.jpurol.2019.05.010.
- Chertin B, Pollack A, Koulikov D, Rabinowitz R, Hain D, Hadas-Halpren I. Conservative treatment of ureteropelvic junction obstruction in children with antenatal diagnosis of hydronephrosis: lessons learned after 16 years of follow-up. European Urology 2006; 49 (4): 734–739. DOI: 10.1016/s0084-4071(08)70420-2.
- Värelä S, Omling E, Börjesson A, Salö M. Resolution of hydronephrosis after pyeloplasty in children. Journal of Pediatric Urology 2021; 17 (1): 1–7. DOI: 10.1016/j.jpurol.2020.10.031.
- Sarihan H, Comert HSY, İmamoğlu M, Basar D. Reverse tubularized pelvis flap method for the treatment of long segment ureteropelvic junction obstruction. Medical Principles and Practice 2020; 29 (2): 128–133. DOI: 10.1159/000502028.
Points clés
- Un bassinet rénal dilaté avec un uretère non dilaté à l’échographie rénale et vésicale est hautement évocateur d’une SJPU.
- Envisager une intervention dans l’un des scénarios suivants; SJPU symptomatique (sepsis, douleur importante ou formation de calculs) APRPD de plus de 5 centimètres Hydronéphrose progressive Détérioration de la fonction rénale de plus de 10 % sur des scintigraphies rénales sériées. Fonction rénale différentielle inférieure à 40 % avec t1/2 prolongé.
- Spatuler l’uretère contre le pôle inférieur du rein lors de la pyéloplastie d’Anderson-Hynes avec disjonction.
- Éviter la manipulation de l’uretère lors de la création de l’anastomose pyélo-urétérale.
- S’assurer que tous les pores externes du stent sont à l’intérieur du système pyélocaliciel afin d’éviter des fuites urinaires.
Références
- Oliveira EA, Oliveira MCL, Mak RH. Evaluation and management of hydronephrosis in the neonate. Current Opinion in Pediatrics 2016; 28 (2): 195–201. DOI: 10.1097/mop.0000000000000321.
- Onen A. An alternative grading system to refine the criteria for severity of hydronephrosis and optimal treatment guidelines in neonates with primary UPJ-type hydronephrosis. Journal of Pediatric Urology 2007; 3 (3): 200–205. DOI: 10.1016/j.jpurol.2006.08.002.
- Shapiro E. Clinical implications of genitourinary embryology. Current Opinion in Urology 2009; 19 (4): 427–433. DOI: 10.1097/mou.0b013e32832c90ff.
- Beksaç S, Balcı S, Yapıcı Z, Özyüncü Ö. Prenatally Diagnosed Ureteropelvic Junction Obstruction in Three Siblings of one Family: A Case Report. Gynecology Obstetrics & Reproductive Medicine 2008; 14 (3): 193–195.
- Josephson S. Antenatally detected, unilateral dilatation of the renal pelvis: a critical review. 1. Postnatal non-operative treatment 20 years on\–is it safe? Scandinavian Journal of Urology and Nephrology 2002; 36 (4): 243–250. DOI: 10.1080/003655902320248191.
- Krajewski W, Wojciechowska J, Dembowski J, Zdrojowy R, Szydełko T. Hydronephrosis in the course of ureteropelvic junction obstruction: An underestimated problem? Current opinions on the pathogenesis, diagnosis and treatment. Advances in Clinical and Experimental Medicine: Official Organ Wroclaw Medical University 2017; 26 (5): 857–864. DOI: 10.17219/acem/59509.
- Atwa AM, Abdelhalim A, Edwan M, Soltan M, Hashim A, Abdelhameed M. Holmium Laser En Bloc Resection of Urethral Polyps in Children: A Case Series. Journal of Endourology Case Reports 2020; 6 (4): 457–460. DOI: 10.1089/cren.2020.0099.
- Houat AP, Guimarães CT, Takahashi MS, Rodi GP, Gasparetto TP, Blasbalg R. Congenital anomalies of the upper urinary tract: a comprehensive review. Radiographics 2021; 41 (2): 462–486. DOI: 10.1148/rg.2021219009.
- Alagiri M, Polepalle SK. Dietlś crisis: an under-recognized clinical entity in the pediatric population. International Braz j Urol 2006; 32: 451–453. DOI: 10.1590/s1677-55382006000400012.
- Yalçınkaya F, Özçakar ZB. Management of antenatal hydronephrosis. Pediatric Nephrology 2020; 35 (12): 2231–2239. DOI: 10.1201/b13478-107.
- Has R, Sarac Sivrikoz T. Prenatal diagnosis and findings in ureteropelvic junction type hydronephrosis. Frontiers in Pediatrics 2020; 8 (492). DOI: 10.3389/fped.2020.00492.
- Hodhod A, Capolicchio J-P, Jednak R, El-Sherif E, El-Doray AE-A, El-Sherbiny M. Evaluation of urinary tract dilation classification system for grading postnatal hydronephrosis. The Journal of Urology 2016; 195 (3): 725–730. DOI: 10.1016/j.juro.2015.10.089.
- ElSheemy MS. Postnatal management of children with antenatal hydronephrosis. African Journal of Urology 2020; 26 (1): 1–14. DOI: 10.1186/s12301-020-00097-8.
- Chow JS, Koning JL, Back SJ, Nguyen HT, Phelps A, Darge K. Classification of pediatric urinary tract dilation: the new language. Pediatric Radiology 2017; 47 (9): 1109–1115. DOI: 10.1007/s00247-017-3883-0.
- Elmaci AM, Dönmez Mİ. Time to resolution of isolated antenatal hydronephrosis with anteroposterior diameter≤ 20 mm. European Journal of Pediatrics 2019; 178 (6): 823–828. DOI: 10.1007/s00431-019-03359-y.
- Engin MMN. Management of Infants Diagnosed with Antenatal Hydronephrosis and Determining the Need for Surgical Intervention. 2020. DOI: 10.33309/2639-9164.030202.
- Hashim H, Woodhouse CR. Ureteropelvic junction obstruction. European Urology Supplements 2012; 11 (2): 25–32. DOI: 10.1007/978-1-62703-206-3_4.
- Riccabona M. Assessment and management of newborn hydronephrosis. World Journal of Urology 2004; 22 (2): 73–78. DOI: 10.1007/s00345-004-0405-0.
- Taghavi R, Ariana K, Arab D. Diuresis renography for differentiation of upper urinary tract dilatation from obstruction F+ 20 and F-15 methods. 2007. DOI: 10.1016/j.urology.2007.06.721.
- Clayton DB, Brock JW. Current state of fetal intervention for lower urinary tract obstruction. Current Urology Reports 2018; 19 (1): 1–8. DOI: 10.1007/s11934-018-0760-9.
- Chamberlin JD, Braga LH, Davis-Dao CA, Herndon CA, Holzman SA, Herbst KW. Continuous antibiotic prophylaxis in isolated prenatal hydronephrosis. Journal of Pediatric Urology 2022. DOI: 10.1016/j.jpurol.2022.03.027.
- Ahmadizar F, Vijverberg SJ, Arets HG, Boer A, Lang JE, Garssen J. Early‐life antibiotic exposure increases the risk of developing allergic symptoms later in life: a meta‐analysis. Allergy 2018; 73 (5): 971–986. DOI: 10.1111/all.13332.
- Dhillon H. Prenatally diagnosed hydronephrosis: the Great Ormond street experience: Perinatal Urology. British Journal of Urology Supplement 1998; 81 (2): 39–44. DOI: 10.1046/j.1464-410x.1998.0810s2039.x.
- Hafez AT, McLorie G, Bägli D, Khoury A. Analysis of trends on serial ultrasound for high grade neonatal hydronephrosis. The Journal of Urology 2002; 168 (4 Part 1): 1518–1521. DOI: 10.1097/00005392-200210010-00072.
- Morsi HA, Mursi K, Abdelaziz AY, ElSheemy MS, Salah M, Eissa MA. Renal pelvis reduction during dismembered pyeloplasty: is it necessary? Journal of Pediatric Urology 2013; 9 (3): 303–306. DOI: 10.1016/j.jpurol.2012.03.002.
- Braga LH, Lorenzo AJ, Bägli DJ, Mahdi M, Salle JLP, Khoury AE. Comparison of flank, dorsal lumbotomy and laparoscopic approaches for dismembered pyeloplasty in children older than 3 years with ureteropelvic junction obstruction. The Journal of Urology 2010; 183 (1): 306–311. DOI: 10.1016/j.juro.2009.09.008.
- Başataç C, Boylu U, Önol FF, Gümüş E. Comparison of surgical and functional outcomes of open, laparoscopic and robotic pyeloplasty for the treatment of ureteropelvic junction obstruction. Turkish Journal of Urology 2014; 40 (1). DOI: 10.5152/tud.2014.06956.
- Han HH, Ham WS, Kim JH, Hong CH, Choi YD, Han SW. Transmesocolic approach for left side laparoscopic pyeloplasty: Comparison with laterocolic approach in the initial learning period. Yonsei Medical Journal 2013; 54 (1): 197–203. DOI: 10.3349/ymj.2013.54.1.197.
- Yiee JH, Baskin LS. Use of internal stent, external transanastomotic stent or no stent during pediatric pyeloplasty: a decision tree cost-effectiveness analysis. The Journal of Urology 2011; 185 (2): 673–681. DOI: 10.1016/j.juro.2010.09.118.
- Helmy T, Blanc T, Paye-Jaouen A, El-Ghoneimi A. Preliminary experience with external ureteropelvic stent: alternative to double-j stent in laparoscopic pyeloplasty in children. The Journal of Urology 2011; 185 (3): 1065–1070. DOI: 10.1016/j.juro.2010.10.056.
- Chu DI, Shrivastava D, Batavia JP, Bowen DK, Tong CC, Long CJ. Outcomes of externalized pyeloureteral versus internal ureteral stent in pediatric robotic-assisted laparoscopic pyeloplasty. Journal of Pediatric Urology 2018; 14 (5): 1–. DOI: 10.1016/j.jpurol.2018.04.012.
- Lucas JW, Ghiraldi E, Ellis J, Friedlander JI. Endoscopic management of ureteral strictures: an update. Current Urology Reports 2018; 19 (4): 1–7. DOI: 10.1007/s11934-018-0773-4.
- Khemchandani SI. Outcome analysis of pediatric pyeloplasty in varied presentation in developing countries. Urological Science 2019; 30 (6). DOI: 10.4103/uros.uros_31_19.
- Gopal M, Peycelon M, Caldamone A, Chrzan R, El-Ghoneimi A, Olsen H. Management of ureteropelvic junction obstruction in children—a roundtable discussion. Journal of Pediatric Urology 2019; 15 (4): 322–329. DOI: 10.1016/j.jpurol.2019.05.010.
- Freilich DA, Nguyen HT, Borer J, Nelson C, Passerotti CC. Concurrent management of bilateral ureteropelvic junction obstruction in children using robotic-assisted laparoscopic surgery. International Braz j Urol 2008; 34: 198–205. DOI: 10.1590/s1677-55382008000200010.
- Jackson L, Woodward M, Coward RJ. The molecular biology of pelvi-ureteric junction obstruction. Pediatric Nephrology 2018; 33 (4): 553–571. DOI: 10.1007/s00467-017-3629-0.
- Chertin B, Pollack A, Koulikov D, Rabinowitz R, Hain D, Hadas-Halpren I. Conservative treatment of ureteropelvic junction obstruction in children with antenatal diagnosis of hydronephrosis: lessons learned after 16 years of follow-up. European Urology 2006; 49 (4): 734–739. DOI: 10.1016/s0084-4071(08)70420-2.
- Värelä S, Omling E, Börjesson A, Salö M. Resolution of hydronephrosis after pyeloplasty in children. Journal of Pediatric Urology 2021; 17 (1): 1–7. DOI: 10.1016/j.jpurol.2020.10.031.
- Sarihan H, Comert HSY, İmamoğlu M, Basar D. Reverse tubularized pelvis flap method for the treatment of long segment ureteropelvic junction obstruction. Medical Principles and Practice 2020; 29 (2): 128–133. DOI: 10.1159/000502028.
Dernière mise à jour: 2025-09-22 07:59