09: Bases de l'endoscopie pédiatrique
Ce chapitre prendra environ 22 minutes de lecture.
Introduction
L’avènement de l’instrumentation endoscopique a révolutionné le domaine de l’urologie, en améliorant à la fois le potentiel diagnostique et thérapeutique des affections urologiques. Au cours des dernières décennies, les avancées technologiques ont permis la miniaturisation d’instruments urologiques destinés aux adultes pour une utilisation dans l’appareil génito-urinaire pédiatrique. La cysto-urétroscopie, l’urétéroscopie et la néphroscopie sont des outils indispensables pour l’urologue pédiatrique afin de diagnostiquer et de traiter des affections allant du reflux vésico-urétéral, de la lithiase rénale et des valves urétrales postérieures aux anomalies congénitales et aux traumatismes génito-urinaires. Des interventions chirurgicales autrefois ouvertes ont été transformées en procédures endoscopiques moins invasives, permettant une récupération plus rapide de nos patients.
Dans ce chapitre, nous discuterons du rôle de l’endoscopie des voies urinaires inférieures et supérieures chez le patient pédiatrique et fournirons un guide pour l’évaluation, le diagnostic et le traitement des affections nécessitant une endoscopie pédiatrique.
Histoire de l’endourologie
Avant l’arrivée des instruments endoscopiques, les interventions chirurgicales impliquant les orifices corporels se limitaient à l’utilisation de spéculums, de sondes et de couteaux.1 Le premier prototype endoscopique a été introduit par Phillip Bozzini en 1806. Le ‘lichtleiter’ ou ‘light conducter’ consistait en un long entonnoir placé dans une boîte recouverte de peau de requin et d’une bougie pour l’éclairage. Des miroirs inclinés à l’intérieur de la boîte dirigeaient la lumière dans le corps humain. Il était utilisé pour examiner le vagin, la vessie et le nasopharynx, mais n’a jamais été utilisé à l’intérieur d’un patient.1,2,3,4 En 1853, Antoine Desormeaux a introduit le premier cystoscope fonctionnel et est considéré comme le ‘père de la cystoscopie’.2,3,4 Les avancées technologiques comprenaient un endoscope plus petit, une lampe à pétrole et un miroir concave avec un trou central qui améliorait l’éclairage de l’appareil.2 Il est le premier connu à avoir utilisé son cystoscope primitif sur un patient pour l’excision d’un papillome urétral.4 Les principales complications comprenaient des brûlures thermiques associées à la source lumineuse au pétrole et un éclairage insuffisant.5 En 1877, l’urologue allemand Maximilian Nitze a utilisé un télescope miniaturisé avec une série de lentilles le long d’un tube creux pour grossir l’image, et un filament électrique en platine refroidi par eau à l’extrémité pour l’éclairage.6 Lorsque Thomas Edison a inventé l’ampoule en 1878, l’appareil de Nitze a été modifié par l’ajout d’une ampoule à l’extrémité du cystoscope.2,7 Le prisme d’Amici, développé en 1906, permettait aux images décalées de 90˚ d’apparaître dans la bonne orientation, et cette technologie a ensuite été intégrée à la conception du cystoscope.7
La découverte que le verre était un meilleur conducteur de la lumière que l’air a ouvert la voie aux conceptions à fibres optiques. Harold Hopkins a inventé le système à lentilles de tige en 1951 en regroupant et en disposant des fibres de verre de 0,1 mm de diamètre de manière coaxiale avec l’oculaire afin de transmettre des images.7 Le ‘fibroscope’ couplé à une source lumineuse externe a amélioré la transmission lumineuse > 80 fois, et le système a été breveté en 1959.7 Cette technologie a jeté les bases du cystoscope rigide moderne.
Outre les avancées endoscopiques, les systèmes de caméras se sont également améliorés au fil du temps. Avec la miniaturisation du matériel de caméras et l’invention d’un dispositif à transfert de charge, les images optiques obtenues à partir de l’endoscope sont converties en photons et en images numériques.3,8 Les images numériques peuvent désormais être affichées sur des moniteurs externes, une innovation qui a transformé la formation chirurgicale en urologie.
Urétrocystoscopie
Indications
La cystoscopie joue un rôle important dans le diagnostic et le traitement des pathologies de l’appareil génito-urinaire pédiatrique. En outre, les informations anatomiques obtenues grâce à la cysto-urétroscopie facilitent la planification des reconstructions génito-urinaires. Les indications courantes comprennent l’évaluation des anomalies congénitales de l’appareil génito-urinaire (complexe exstrophie vésicale–épispadias, anomalies cloaquales, valves urétrales postérieures, uretères ectopiques), de l’anatomie vaginale et des canaux urinaires, l’injection endoscopique pour le reflux vésico-urétéral et le traitement des calculs vésicaux.9 Pratiquement toutes les interventions sont réalisées sous anesthésie générale au bloc opératoire. Tableau 1 présente les indications courantes de la cysto-urétroscopie pédiatrique. Tableau 2 présente des interventions thérapeutiques courantes.
Tableau 1 Indications courantes de la cysto-urétroscopie pédiatrique.
| Diagnostic | Détails |
|---|---|
| Anomalies congénitales | Complexe exstrophie-épispadias |
| Anomalies cloacales | |
| Uretères ectopiques | |
| Vaginoscopie pour anomalies vaginales | |
| Pyélographies rétrogrades pour sténoses urétérales, obstruction de la JPU et de la JUV | |
| Malignité | Surveillance de l’augmentation gastrique |
| Évaluation d’une masse vésicale ou urétrale | |
| Évaluation des troubles de la miction : hématurie macroscopique, jet faible, incontinence urinaire | |
| CMG pour urodynamique peropératoire | |
| Évaluation d’une chirurgie reconstructrice antérieure | Procédures sur le col vésical |
| Conduits urinaires |
Tableau 2 Interventions thérapeutiques courantes en cystouréthroscopie.
| Traitement |
|---|
| Valves urétrales postérieures |
| Extraction de calcul vésical |
| Injection endoscopique pour RVU, incompétence sphinctérienne, incompétence du canal |
| Ponction d’urétérocèle |
| Mise en place d’un cathéter sus-pubien ou urétral |
Équipement
Les cystoscopes destinés aux enfants et aux adolescents existent en une variété de tailles, en modèles flexibles et rigides. La taille des instruments est exprimée en unité French (Fr), un diamètre de 1 Fr équivalant à 1/3 mm.10 Les composants d’un cystoscope rigide comprennent une optique, un pont, une gaine et un obturateur. Les optiques sont fabriquées avec des angles de tête allant de 0–120˚. Dans notre pratique, les optiques à 0˚ et 30˚ sont les plus courantes. Le pont relie l’optique à la gaine et offre 1–2 canaux de travail. Les tailles de gaines vont de 5 Fr jusqu’aux tailles adultes et comportent des orifices d’irrigation associés. L’obturateur peut être utilisé à la place de l’optique dans la gaine afin d’émousser l’extrémité de la gaine pour un passage à l’aveugle à travers l’urètre jusque dans la vessie. La cystoscopie rigide nécessite également une source lumineuse, une caméra endoscopique, un moniteur externe et un liquide d’irrigation. Les cystoscopes flexibles intègrent l’endoscope, la source lumineuse et la caméra, et disposent d’un seul canal de travail pour l’irrigation et le passage des instruments. Les extrémités des cystoscopes flexibles peuvent se défléchir jusqu’à 210˚, facilitant la maniabilité des dispositifs, et sont disponibles dans une variété de tailles.
Dans notre pratique, les cystoscopes rigides sont utilisés dans la plupart des cas et les cystoscopes flexibles sont réservés aux situations où l’installation en position de lithotomie est difficile ou pour la navigation dans des canaux cathétérisables tortueux.
Considérations préopératoires
Une analyse d’urine doit être effectuée avant toute instrumentation des voies urinaires, et une culture d’urine le cas échéant.11 La culture d’urine préopératoire et le traitement antibiotique, s’ils sont indiqués, sont particulièrement importants chez les patients dont les voies urinaires sont probablement colonisées, tels que les patients pratiquant un cathétérisme intermittent ou porteurs de sondes à demeure. En cas d’infection des voies urinaires, le patient doit être traité par des antibiotiques adaptés aux résultats de la culture et l’intervention reportée en raison du risque de bactériémie et de sepsis.
La déclaration de meilleures pratiques de l’AUA concernant les procédures urologiques et la prophylaxie antimicrobienne (2019) déconseille l’administration d’antibiotiques préprocéduraux pour la cystoscopie diagnostique de routine en l’absence de facteurs de risque spécifiques chez le patient, tels que l’immunodépression, la colonisation chronique du tractus génito-urinaire, des anomalies anatomiques prédisposant à la stase urinaire et un mauvais état nutritionnel.12 Il n’existe pas de directives claires spécifiquement pour l’instrumentation endourologique pédiatrique, mais nous utilisons ces lignes directrices pour orienter la prophylaxie antibiotique liée à la procédure. Un historique chirurgical détaillé, incluant la revue des comptes rendus opératoires, est essentiel avant l’endoscopie, en particulier en cas d’antécédents de reconstruction génito-urinaire.
Considérations chirurgicales
Avant l’induction de l’anesthésie, les instruments endoscopiques doivent être inspectés pour en vérifier l’exhaustivité, la compatibilité et le bon fonctionnement. Ceci est particulièrement important en endoscopie pédiatrique où divers calibres d’instruments et d’accessoires sont utilisés. Après l’induction de l’anesthésie générale et l’administration d’une prophylaxie antibiotique préprocédurale (lorsqu’indiquée), le patient est positionné en décubitus dorsal avec jambes fléchies et écartées (Figure 1). Chez les nourrissons, de petites serviettes roulées ou des rouleaux de gel peuvent être placés sous les genoux et les jambes fixées en place avec du ruban adhésif. Les enfants plus grands sont positionnés à l’aide d’étriers. Les organes génitaux et le périnée sont préparés avec une solution antiseptique contenant de la Bétadine, car les préparations à base d’alcool et de chlorhexidine peuvent léser les muqueuses. L’anatomie externe est examinée. Une sténose méatique légère peut être traitée par dilatation séquentielle à l’aide de bougies de McCrae, tandis qu’une sténose méatique sévère peut nécessiter une méatotomie formelle. Ensuite, un cystoscope lubrifié est introduit dans l’urètre et l’irrigation est mise en marche. Chez les patients de sexe masculin, le pénis est mis en tension et dirigé vers le haut. Cette position est optimale pour l’urétroscopie de l’urètre antérieur, puis la main du chirurgien est abaissée afin de permettre le passage dans l’urètre postérieur et la vessie. Une évaluation systématique de la vessie est réalisée, les interventions complémentaires nécessaires sont effectuées, et l’urètre est visualisé avec un afflux actif d’irrigation lors du retrait du cystoscope. À noter, l’inspection d’une vessie augmentée peut être difficile en raison des plis muqueux et de la production de mucus. L’irrigation permettant d’évacuer le mucus hors de la vessie et l’utilisation judicieuse de l’irrigation peuvent améliorer la visualisation. La distension excessive d’une vessie augmentée doit être évitée, car elle peut entraîner une perforation vésicale. Le cystoscope souple est introduit par voie urétrale de manière similaire à un cathéter urétral, et l’extrémité est défléchie selon les besoins pour la visualisation et l’inspection à l’entrée dans la vessie.
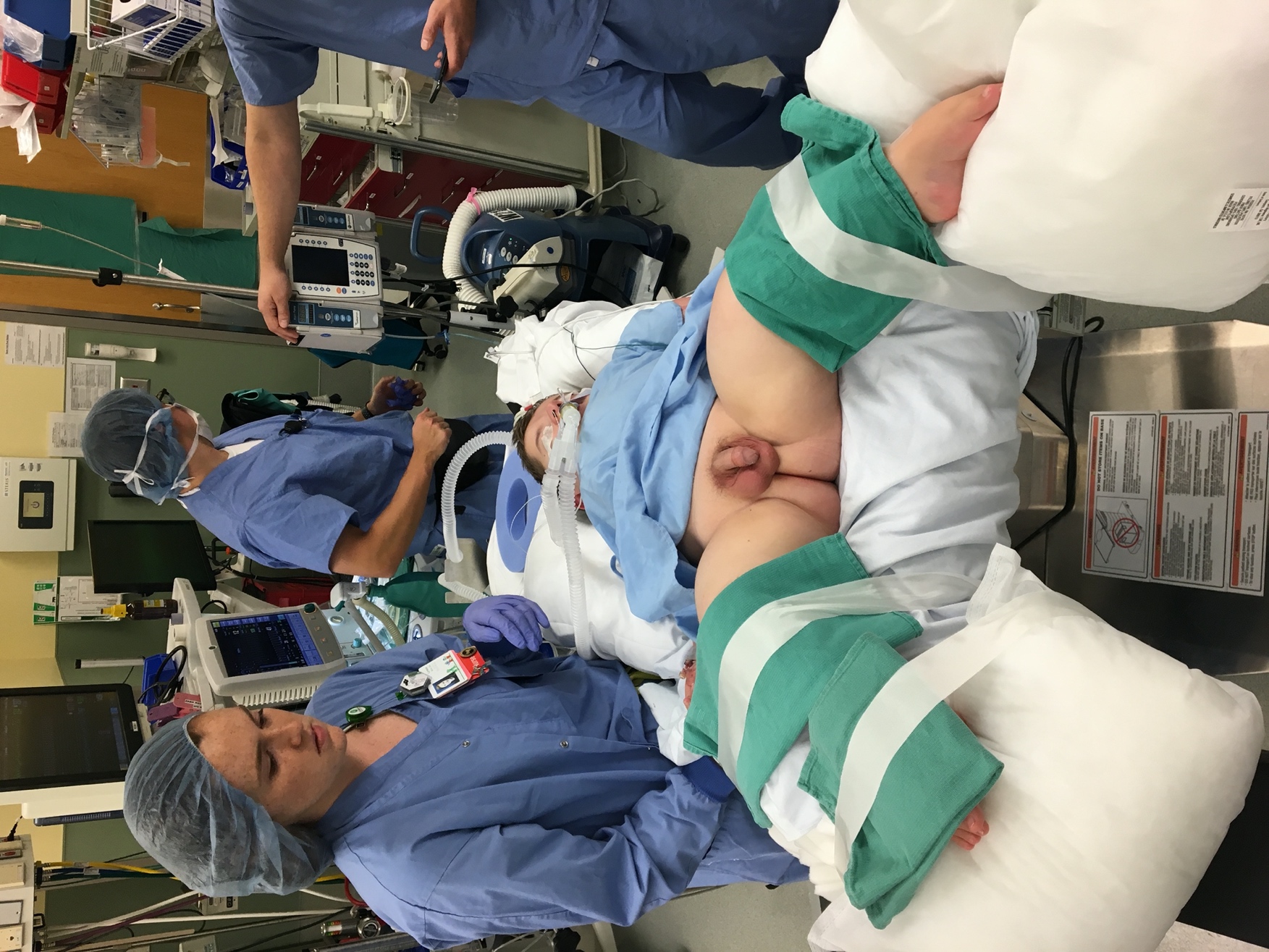
Figure 1 Lithotomie dorsale modifiée. Positionnement soigneux en lithotomie dorsale modifiée chez un patient atteint d’ostéogenèse imparfaite pour une extraction de calcul par urétéroscopie.
La cystoscopie peut également être réalisée via le trajet d’un cathéter sus-pubien, une vésicostomie ou un conduit cathétérisable, selon une technique similaire. Il est important de relever les détails opératoires (p. ex., type de segment intestinal utilisé, trajectoire du conduit, mécanisme de continence) avant l’endoscopie. Les conduits cathétérisables sont fragiles, et le cystoscope ne doit pas être avancé tant que la lumière n’est pas visualisée afin d’éviter une lésion ou une perforation du conduit.
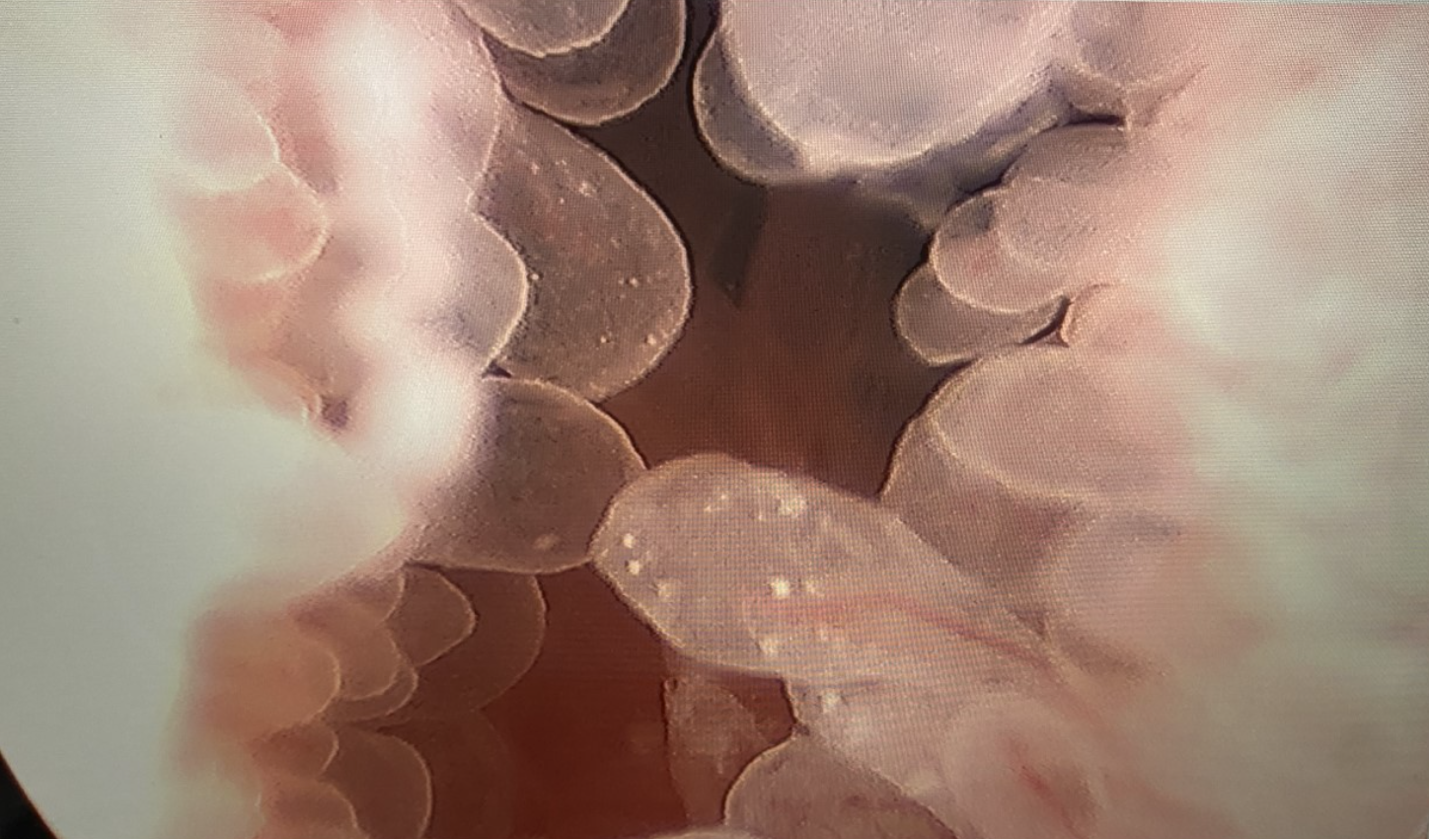
Figure 2 Cystoscopie avec résection transurétrale d’une tumeur vésicale. Résection transurétrale d’une masse papillaire du col vésical chez un adolescent de sexe masculin atteint de cystite éosinophilique.
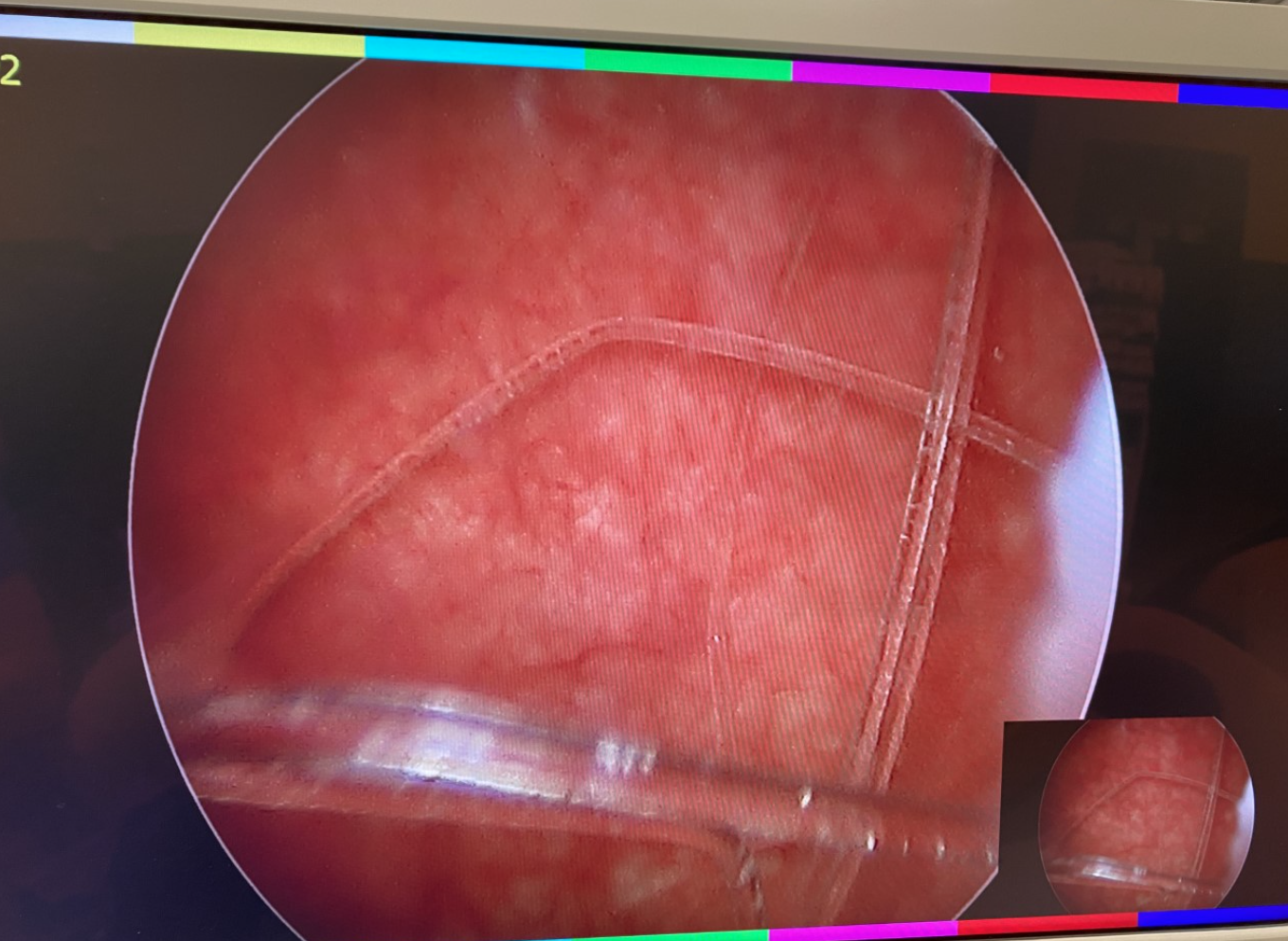
Figure 3 Corps étranger vésical. Cystoscopie avec extraction par panier d’un corps étranger vésical.
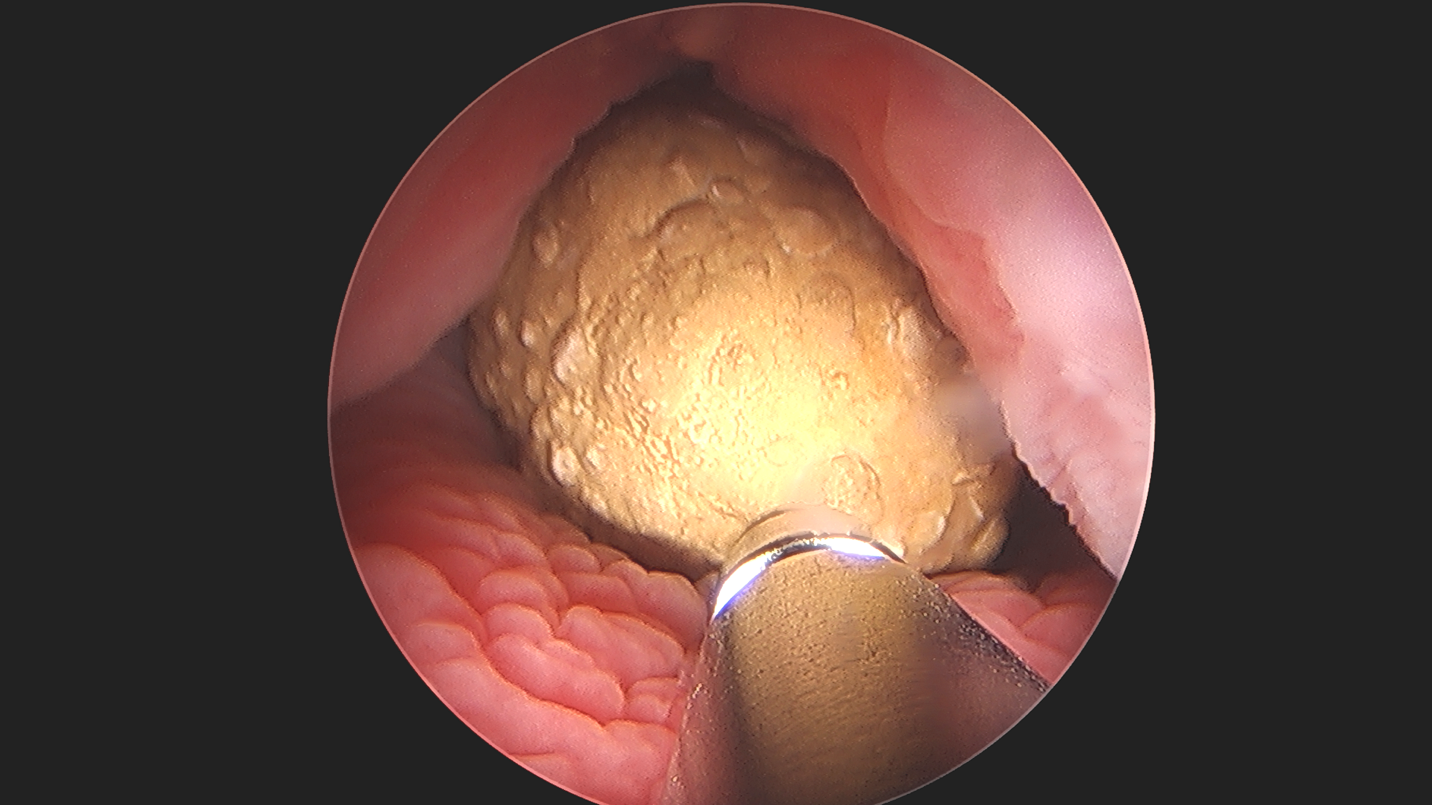
Figure 4 Cystolithotomie percutanée. Lithotripsie par ultrasons d’un gros calcul vésical dans une vessie augmentée, démontrant l’applicabilité et la polyvalence de l’endoscopie.
Complications
Les complications survenant après une cystouréthroscopie diagnostique sont rares et comprennent une bactériurie asymptomatique (5–8%), une infection urinaire symptomatique (2–5%) et une hématurie macroscopique.13
Soins postopératoires et suivi
La cysto-urétroscopie est généralement une intervention chirurgicale ambulatoire et entraîne un inconfort minime voire nul chez les patients. Sauf contre-indication, nous appliquons toujours des anesthésiques topiques à la fin de la cysto-urétroscopie (p. ex., gel de lidocaïne). Nous ne prescrivons pas d’antibiotiques postopératoires, sauf si le patient présente des facteurs de risque d’urosepsis et qu’un traitement endoscopique est réalisé.12 La prophylaxie antibiotique continue pour le reflux vésico-urétéral est poursuivie jusqu’à la consultation de suivi ambulatoire après l’injection endoscopique. La dysurie ou d’autres symptômes de stockage des voies urinaires basses sont traités par paracétamol ou anti-inflammatoires non stéroïdiens et anticholinergiques, si nécessaire. Le suivi est déterminé par le diagnostic du patient et l’intervention réalisée.
Urétéroscopie
Indications
L’urétéroscopie donne accès aux voies urinaires supérieures à des fins diagnostiques et thérapeutiques. L’amélioration des optiques et la miniaturisation des urétéroscopes permettent à des calculs urétéraux et rénaux auparavant traités par lithotritie extracorporelle par ondes de choc d’être pris en charge par voie urétéroscopique.14 Les recommandations 2016 de l’AUA/Endourology Society sur la prise en charge chirurgicale des calculs présentent l’urétéroscopie comme une option pour les patients pédiatriques ayant une charge lithiasique rénale totale ≤ 20 mm.15 Les indications supplémentaires comprennent l’incision au laser des sténoses urétérales courtes, l’endopyélotomie pour les obstructions récidivantes de la jonction pyélo-urétérale (dans des cas sélectionnés), et l’évaluation d’une hématurie macroscopique latéralisée et des défauts de remplissage urétéraux.
Équipement
Les urétéroscopes sont disponibles en modèles flexibles et semi-rigides, numériques et à fibres optiques, avec une variété de tailles allant de 4.5–11 Fr.16 Les urétéroscopes semi-rigides sont plus petits, car les fibres optiques sont incorporées dans l’endoscope; ils nécessitent une source lumineuse et une caméra externes. Deux canaux, l’un utilisé pour l’irrigation et l’autre pour le passage d’instruments, améliorent la visualisation. Les urétéroscopes semi-rigides sont utilisés dans l’uretère en aval des vaisseaux iliaques.17 Les microurétéroscopes, tels que l’urétéroscope semi-rigide Ultrathin 4.5 Fr (Richard Wolf, Knittlingen, Allemagne), réduisent les échecs d’accès dans les uretères pédiatriques de petit calibre.18 Les urétéroscopes flexibles intègrent un système optique, un mécanisme de déflexion et un canal opérateur. Les modèles numériques intègrent la source lumineuse et la caméra dans l’endoscope, tandis que les modèles à fibres optiques nécessitent une caméra et une source lumineuse externes. Une déflexion de l’extrémité distale jusqu’à 270˚ permet de naviguer dans des uretères tortueux ainsi que dans le bassinet et les calices rénaux.19 L’urétéroscope flexible est préféré pour une utilisation dans l’uretère en amont des vaisseaux iliaques ainsi que dans le bassinet et les calices rénaux. Le mécanisme de déflexion de l’urétéroscope flexible est délicat et peut s’endommager lors d’utilisations répétées. Son canal opérateur peut être endommagé par le passage d’instruments ou par des tirs laser involontaires à l’intérieur de l’endoscope, entraînant un dysfonctionnement de l’appareil.11 En conséquence, les urétéroscopes flexibles à usage unique gagnent en popularité car ils démontrent une efficacité similaire à celle des urétéroscopes flexibles conventionnels et peuvent offrir des économies de coûts.20 À l’heure actuelle, leur rôle chez le patient pédiatrique reste à élucider.
L’urétéroscopie doit être réalisée dans une salle d’endoscopie bien équipée, disposant de tout le matériel nécessaire, de la fluoroscopie et d’un personnel de bloc opératoire expérimenté. L’équipement de base nécessaire à l’urétéroscopie comprend des endoscopes (semi-rigides et flexibles), un laser à l’holmium et des fibres laser, des fils-guides, des cathéters urétéraux à extrémité ouverte, des cathéters à double lumière, des dilatateurs coaxiaux, des gaines d’accès urétérales, des paniers et des stents urétéraux. Une variété de tailles d’instruments à usage unique doit être disponible et adaptée à la taille de l’enfant.
Considérations préopératoires
Une culture d’urine doit être réalisée avant toute instrumentation des voies urinaires. En cas d’infection des voies urinaires ou de colonisation bactérienne chronique, le patient doit être traité par des antibiotiques ciblés selon la culture et l’intervention reportée en raison du risque de bactériémie et de sepsis.11 La déclaration de bonnes pratiques de l’AUA sur les procédures urologiques et la prophylaxie antimicrobienne en 2019 recommande une dose unique de TMP-SMX en périopératoire ou une céphalosporine de 1re ou 2e génération pour les procédures urétéroscopiques.12 Bien qu’il n’existe pas de recommandation spécifique pour les patients pédiatriques, notre pratique est d’utiliser la céfazoline avec ou sans gentamicine avant l’urétéroscopie.
Bien que l’objectif de l’urétéroscopie avec extraction de calculs soit d’obtenir l’élimination complète des calculs avec le moins d’interventions possible, plusieurs interventions peuvent être nécessaires pour traiter avec succès les calculs urétéraux ou rénaux chez l’enfant. Le petit calibre des uretères pédiatriques, en particulier chez les jeunes enfants, peut rendre l’accès urétéral direct difficile. En cas d’échec d’accès, la mise en place d’une endoprothèse urétérale assure une dilatation urétérale passive et peut augmenter la probabilité d’un accès réussi ultérieurement. Cependant, la mise en place systématique d’une endoprothèse avant la procédure n’est pas recommandée.15
Technique chirurgicale
Après l’induction de l’anesthésie générale et l’administration d’une prophylaxie antibiotique conforme aux recommandations, le patient est installé en position de lithotomie dorsale, comme discuté précédemment. On utilise un liquide d’irrigation au sérum physiologique isotonique chauffé à la température corporelle, compte tenu du risque d’absorption et d’hyponatrémie.11 Un cystoscope est utilisé pour obtenir l’accès urétéral, et une pyélographie rétrograde est réalisée afin de définir l’anatomie du système collecteur et de déterminer la localisation du calcul. Un guide de sécurité (0.025–0.038 inch) est mis en place. Un guide de travail peut également être mis en place à ce stade, ce qui permet le passage d’une gaine d’accès urétéral ou d’un urétéroscope flexible. L’urétéroscope est introduit dans l’orifice urétéral après hydrodilatation à l’aide d’une pompe d’irrigation manuelle et avancé jusqu’au calcul.21 Si l’urétéroscope ne passe pas, un stent urétéral est mis en place pour permettre une dilatation urétérale passive pendant 2–3 semaines avant de répéter l’urétroscopie. Alternativement, une dilatation urétérale active à l’aide d’un cathéter à double lumière de 8–10 Fr ou d’un dilatateur coaxial peut être employée, mais la dilatation au ballonnet de l’orifice urétéral doit être évitée en raison du risque de sténose urétérale.22 Si le calcul est trop volumineux pour une extraction en bloc au panier, un laser à l’holmium:YAG est utilisé pour traiter le calcul en mode fragmentation (énergie élevée, faible fréquence) ou poussiérage (énergie faible, fréquence élevée). Les gros fragments de calcul sont extraits au panier et envoyés pour analyse du calcul, et les fragments plus petits (< 1mm) sont laissés in situ pour une expulsion spontanée. Les gaines d’accès urétéral (9.5–14 Fr) doivent être utilisées pour les gros calculs urétéraux proximaux ou rénaux, car leur utilisation diminue les pressions intrarénales, facilite des passages multiples de l’urétéroscope et protège l’uretère des traumatismes.23 Cependant, l’utilisation d’une gaine d’accès urétéral n’est pas toujours faisable en raison du petit calibre des uretères pédiatriques. Après la lithotripsie, un stent urétéral peut être mis en place. La décision de poser un stent urétéral dépend du temps opératoire, de la charge lithiasique, de l’œdème urétéral et des traumatismes survenus pendant la procédure. Dans certains cas, les stents urétéraux sont posés avec un fil externe permettant un retrait sans seconde intervention. L’utilisation des rayons X pendant la procédure doit suivre le concept ALARA (aussi bas que raisonnablement possible), car les enfants atteints de néphrolithiase nécessitent souvent davantage d’imagerie ultérieurement.24 L’utilisation de rayons X intermittents et à faible dose, avec une distance peau–cible maximale, une fenêtre d’image étroite et l’évitement du grossissement, peut réduire l’exposition aux radiations liée à la procédure.25
Complications
Des séries contemporaines rapportent des taux globaux de complications de l’urétéroscopie allant de 0-14% chez les patients pédiatriques et comprennent l’infection des voies urinaires, l’hématurie, la colique néphrétique, l’hydronéphrose post-opératoire et les lésions urétérales.18,26,27,28 Les complications plus sévères (> Clavien 3) sont rares, avec une avulsion urétérale complète et un sepsis survenant chez <1% des patients.29 Un âge plus jeune peut être associé à un risque accru de complications après des procédures urétéroscopiques. Une revue systématique de 10 études (1,377 procédures) a montré un taux de complications plus élevé chez les enfants < 6 ans (24%) par rapport aux enfants > 6 ans (7.1%).28
Soins postopératoires et suivi
L’urétéroscopie est, dans la plupart des cas, une intervention chirurgicale ambulatoire. La douleur postopératoire est traitée par des anti-inflammatoires non stéroïdiens et l’utilisation d’antalgiques opioïdes est limitée. Un essai contrôlé randomisé en double aveugle récent chez des patients adultes a démontré la non-infériorité de 10 mg de kétorolac par rapport à 5 mg d’oxycodone pour le traitement de la douleur après urétéroscopie.30 Des anticholinergiques et des alpha-bloquants sont prescrits aux patients porteurs de stents urétéraux, car leur utilisation peut réduire les symptômes associés aux stents urétéraux.31,32 Une obstruction urétérale silencieuse après urétéroscopie peut survenir chez jusqu’à 3 % des patients. Par conséquent, nous réalisons une échographie rénale 4 semaines après l’urétéroscopie chez tous les patients.33
Néphroscopie
Indications
La néphroscopie percutanée avec néphrolithotomie constitue le traitement de référence des calculs rénaux volumineux et des calculs dans des reins présentant des anomalies anatomiques qui empêchent la lithotripsie extracorporelle par ondes de choc ou la chirurgie intrarénale rétrograde. Historiquement, des inquiétudes existaient quant au fait que l’utilisation d’instruments et de gaines de taille adulte (24–30 Fr) dans des reins pédiatriques entraînerait une atteinte du parenchyme rénal et augmenterait le risque de complications à court et à long terme.19 Cependant, avec l’amélioration des techniques et la miniaturisation des néphroscopes, la néphrolithotomie percutanée (PCNL) est considérée comme sûre et efficace chez les patients pédiatriques.34 Les recommandations 2016 de l’AUA/Endourology Society sur la prise en charge chirurgicale des calculs recommandent la PCNL comme option de traitement pour une charge lithiasique rénale totale de >20mm.15 Par ailleurs, la PCNL peut être utilisée pour traiter des calculs dans des diverticules caliciels, dans d’autres reins anatomiquement complexes, ou lorsque l’accès rétrograde n’est pas possible, comme en cas de dérivation urinaire.
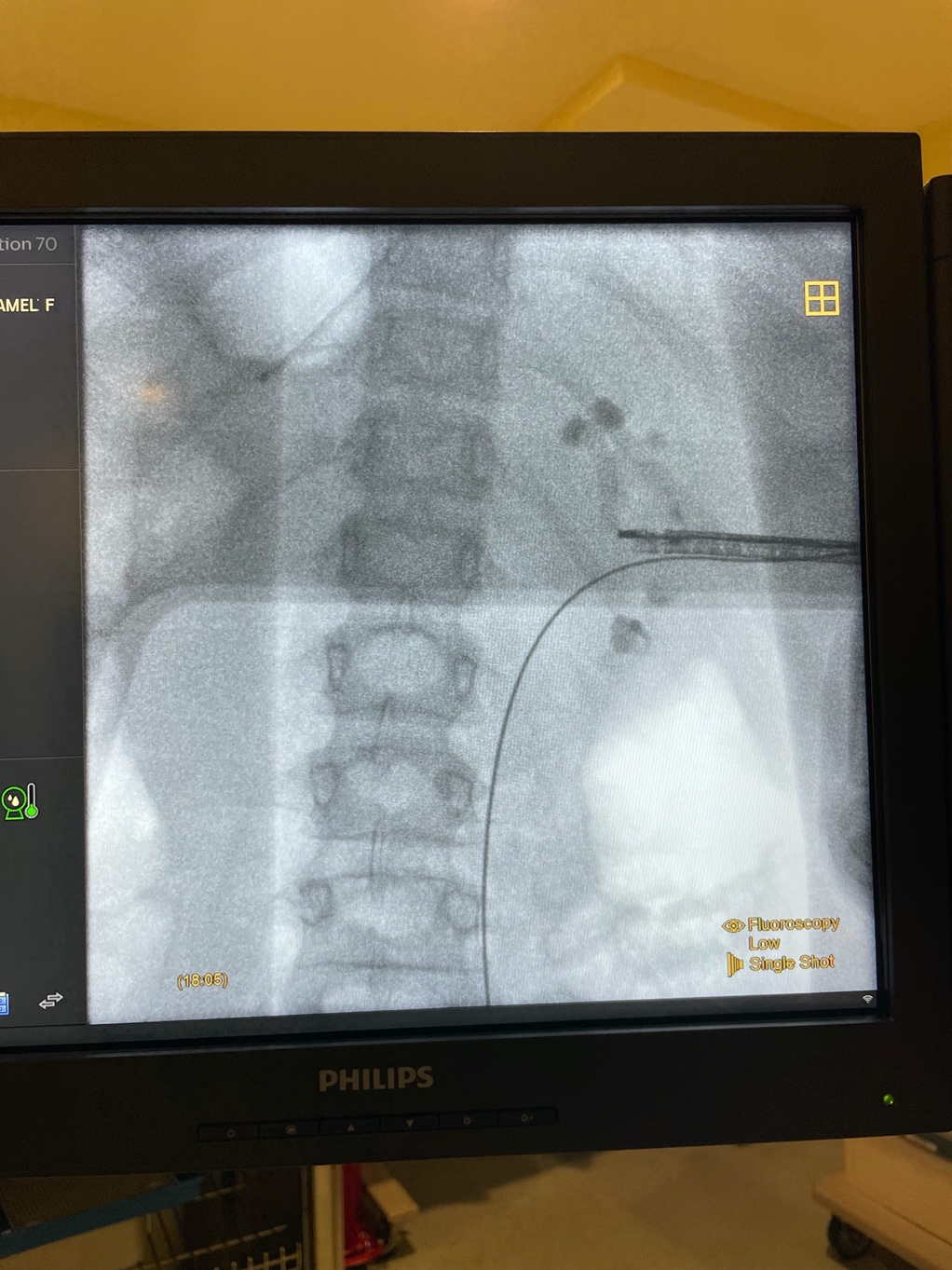
Figure 5 Néphroscopie rigide. Imagerie radiographique lors d’une PCNL de deuxième temps pour des calculs rénaux volumineux, utilisant un néphroscope rigide avec un abord médio-rénal.
Équipement
Les néphroscopes rigides permettent de visualiser le bassinet et les calices rénaux, sont disponibles en modèles à fibres optiques et numériques, et existent dans une variété de tailles (4.8–24 Fr).16 Le modèle à lentilles en tige à fibres optiques nécessite une caméra et une source lumineuse externes, tandis que le modèle numérique intègre l’endoscope, la source lumineuse et la caméra dans l’appareil.35 Un canal de travail permet l’introduction d’instruments et des ports d’entrée et de sortie permettent le remplissage et la vidange simultanés du système collecteur.
Les lithotriteurs intracorporels comprennent des modèles ultrasoniques, pneumatiques et combinés.35 Un système d’aspiration intégré de grand calibre élimine les fragments de calcul et la poussière pendant la lithotritie.
La PCNL standard implique l’utilisation d’une gaine d’Amplatz de 24–30 Fr et d’instruments de taille adulte. Étant donné la crainte que l’utilisation d’instruments de taille adulte puisse augmenter les taux de complications lors de PCNL pédiatriques, des techniques utilisant des instruments plus petits ont été développées. La mini-PCNL désigne l’utilisation de trajets de néphrostomie de 15–24 Fr, l’ultra-mini PCNL avec des trajets de 11–15 Fr et la micro-PCNL avec des trajets < 10 Fr.16 Les interventions doivent être réalisées au bloc opératoire, avec un personnel expérimenté, sous fluoroscopie, et un matériel approprié dans une variété de tailles. Les instruments nécessaires pour la PCNL comprennent des néphroscopes rigides et flexibles, des dilatateurs à ballon ou d’Amplatz, des gaines d’accès, un laser Holmium:YAG, un lithotripteur pneumatique ou ultrasonique, des fils-guides, des cathéters urétéraux, des cathéters à double lumière et des paniers.
Considérations préopératoires
Tous les patients envisagés pour une NLPC devraient bénéficier d’un scanner abdomino-pelvien à faible dose afin de déterminer la faisabilité et d’évaluer la charge lithiasique rénale totale.15 De plus, l’imagerie en coupes permet de déterminer le calice optimal pour l’accès, la proximité des organes de voisinage (côlon, plèvre, côtes) et les altérations de l’anatomie rénale.
Une culture d’urine préopératoire doit être réalisée et tous les patients présentant une infection des voies urinaires doivent être traités par des antibiotiques guidés par l’antibiogramme avant l’intervention. Il est important de noter qu’une culture des voies urinaires basses peut ne pas refléter les cultures du calcul ou de l’urine provenant des voies supérieures. La déclaration de bonnes pratiques 2019 de l’AUA concernant les procédures urologiques et la prophylaxie antimicrobienne recommande, sur la base de publications de haute qualité chez l’adulte, les options antibiotiques suivantes avant la PCNL : céphalosporine de 1re/2e génération, aminoside et métronidazole, aztréonam et métronidazole, aminoside et clindamycine ou aztréonam et clindamycine.12 La littérature concernant la prophylaxie antibiotique préopératoire avant la PCNL chez les patients pédiatriques est limitée. Une étude rétrospective portant sur 830 enfants âgés de < 12 ans a examiné le taux d’infection urinaire fébrile après la PCNL. Les céphalosporines de première, deuxième et troisième génération se sont révélées d’une efficacité comparable pour la prophylaxie chez les enfants < 12 ans subissant une PCNL.36 Dans notre pratique, nous utilisons la céfazoline et la gentamicine comme prophylaxie antibiotique avant la PCNL.
Considérations chirurgicales
Après l’induction d’une anesthésie générale et l’administration d’antibiotiques intraveineux, le patient est installé en décubitus ventral sur des rouleaux de gel. Un abord percutané dans le calice cible est réalisé sous guidage fluoroscopique ou échographique. À défaut, la radiologie interventionnelle peut obtenir un abord percutané sous guidage TDM en cas d’anatomie aberrante ou de dysraphisme spinal. Plusieurs abords peuvent être nécessaires pour le traitement de calculs coralliens partiels ou complets. Un fil-guide opérateur et un fil-guide de sécurité sont mis en place, la peau est incisée et le trajet est dilaté à l’aide d’un ballon ou de dilatateurs d’Amplatz, selon la préférence du chirurgien. Le choix du dilatateur et du calibre de la gaine dépend de l’âge du patient, de la morphologie, de l’anatomie, de la charge lithiasique et de la taille du néphroscope disponible. À noter que les reins pédiatriques sont plus mobiles que les reins adultes et peuvent s’éloigner lors de la dilatation ou de l’avancée de la gaine.37 La gaine est ensuite placée sur le dilatateur dans le système collecteur. Raccourcir la gaine peut améliorer la maniabilité. Un liquide isotonique réchauffé est utilisé compte tenu du risque d’hypothermie et d’hypervolémie. Le néphroscope rigide est avancé jusqu’au calcul et la fragmentation commence, à l’aide d’un laser Holmium:YAG ou d’un lithotripteur. Les fragments de calcul sont extraits et envoyés pour analyse lithiasique et culture. Un cystoscope ou un urétéroscope flexible est utilisé pour réaliser une néphroscopie flexible et les fragments résiduels de calcul sont extraits. Après la clairance de la charge lithiasique, une sonde de néphrostomie percutanée, un stent urétéral ou les deux peuvent être mis en place. Cette décision dépend de la complexité chirurgicale, de la charge lithiasique résiduelle, de la nécessité d’une procédure de second look et de la préférence du chirurgien.38 Nous recommandons de limiter la durée opératoire à 90 minutes, car des durées opératoires prolongées augmentent le risque d’infection urinaire fébrile postopératoire.36
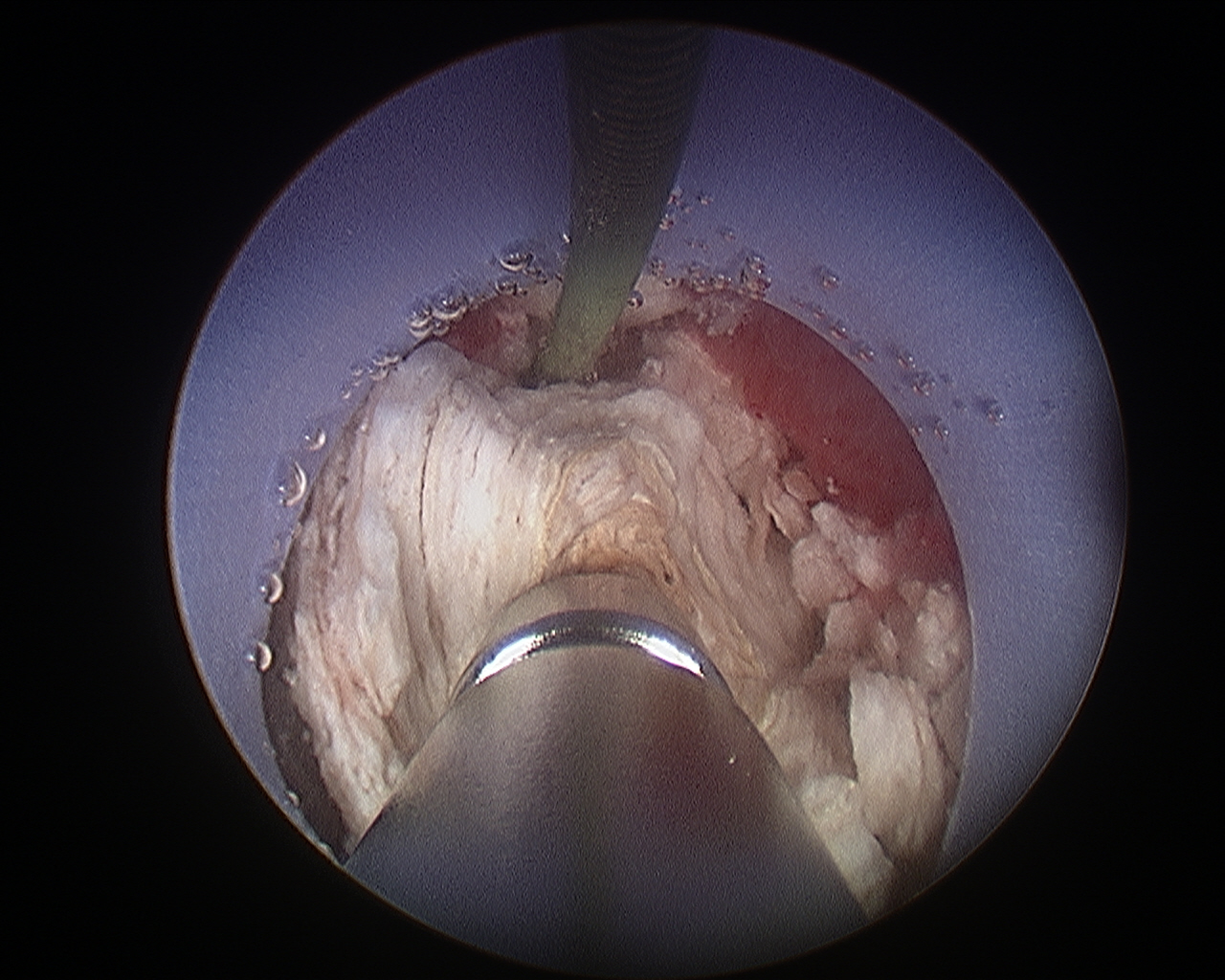
Figure 6 Néphrolithotomie percutanée. Lithotritie par ultrasons d’un volumineux calcul rénal pendant une néphrolithotomie percutanée.
Complications
Des séries contemporaines rapportent des taux de complications après NLPC pédiatrique de 11–40%.34,39 Les complications les plus fréquentes sont l’infection urinaire fébrile et le saignement nécessitant une transfusion.34,39 Les complications sévères telles que l’hémorragie massive, la fuite d’urine nécessitant un drainage, la lésion viscérale (côlon, plèvre), la lésion du bassinet rénal et l’hydrothorax sont rares, avec 84% des complications < grade III de Clavien.34,39 La taille du calcul, la complexité du cas et la durée opératoire sont associées aux taux de complications.34,40 Les NLPC ultra-mini et micro utilisant des trajets d’accès plus petits présentent des taux globaux de complications plus faibles (11.2%).41
Soins postopératoires et suivi
À la suite d’une PCNL, les patients sont hospitalisés pendant 2–5 jours. Les antibiotiques périopératoires sont poursuivis pendant 24 heures après l’intervention. Des examens biologiques sont réalisés pour rechercher des troubles électrolytiques et/ou une perte sanguine importante. Une imagerie postopératoire est effectuée pour évaluer la charge lithiasique résiduelle et planifier un traitement chirurgical supplémentaire. Si aucune PCNL de second regard n’est prévue et que l’hématurie macroscopique s’est résolue, la sonde de néphrostomie est retirée avant la sortie de l’hôpital. Des interventions supplémentaires sont fréquemment nécessaires pour obtenir une clairance lithiasique complète. Les taux d’absence de calcul après PCNL varient de 63–85,4 % et passent à 91,7–93,7 % avec des traitements ultérieurs (PCNL de second regard, lithotripsie extracorporelle par ondes de choc, chirurgie intrarénale rétrograde).34,42,43
Conclusions
Les avancées technologiques du matériel endoscopique ont transformé le domaine de l’urologie pédiatrique, en améliorant le potentiel diagnostique et thérapeutique. Des affections autrefois traitées par des procédures chirurgicales ouvertes sont désormais prises en charge par voie endoscopique. Alors que l’innovation des dispositifs progresse à un rythme exponentiel, des études prospectives de haute qualité devraient également être menées afin de préciser le rôle de cette nouvelle technologie dans l’arsenal thérapeutique de l’urologue pédiatrique.
Points clés
- La miniaturisation des instruments endoscopiques pour adultes et les améliorations technologiques ont conduit au développement de cystoscopes, urétéroscopes et néphroscopes pédiatriques
- Le choix du type et de la taille de l’endoscope doit être adapté à l’âge, à la taille, à l’habitus corporel et à l’anatomie particulière de l’enfant
- Une prophylaxie antibiotique préprocédurale systématique n’est pas recommandée pour la cystoscopie non compliquée, mais elle est indiquée pour l’instrumentation des voies urinaires supérieures
- Lors de la réalisation d’une endoscopie pédiatrique, il convient de suivre le principe ALARA afin de limiter l’exposition radiologique liée à la procédure
- L’élimination complète des calculs par urétéroscopie ou PCNL peut nécessiter plusieurs interventions compte tenu du faible calibre du système collecteur et de l’uretère pédiatriques
Ressources pour les patients
- https://www.urologyhealth.org/healthy-living/urologyhealth-extra/magazine-archives/summer-2020/kidney-stones-in-children
- https://pedsnet.org/pkids/
Lectures recommandées
- Tekgül S, Stein R, Bogaert G, Nijman RJM, Quaedackers J, Hoen L ’t, et al.. European Association of Urology and European Society for Paediatric Urology Guidelines on Paediatric Urinary Stone Disease. Eur Urol Focus 2021; 8 (3): 833–839. DOI: 10.1016/j.euf.2021.05.006.
- Kokorowski PJ, Chow JS, K S. Prospective Measurement of Patient Exposure to Radiation During Pediatric Ureteroscopy. Yearbook of Urology 2012; 2012 (4): 224–225. DOI: 10.1016/j.yuro.2012.07.025.
- Duty B, Conlin M. Principles of Urologic Endoscopy. In: Partin A, editor. Campbell-Walsh-Wein Urology. 12th ed. Philadelphia, PA: Elsevier; 2021. DOI: 10.1016/s0025-6196(12)60891-x.
Références
- REUTER MATTHIASA, REUTER HANSJ. The Development Of The Cystoscope. J Urol 1998; 59 (3): 638–640. DOI: 10.1016/S0022-5347(01)63691-7.
- Shah J. Endoscopy through the ages. BJU Int 2002; 89 (7): 645–652. DOI: 10.1046/j.1464-410x.2002.02726.x.
- Samplaski MK, Jones JS. Two centuries of cystoscopy: the development of imaging, instrumentation and synergistic technologies. BJU Int 2009; 103 (2): 154–158. DOI: 10.1111/j.1464-410x.2008.08244.x.
- Talwar HS. The journey of the “Lichtleiter”, the first ever cystoscope: An ode to Philipp Bozzini and his great invention. Eur Urol 1969; 81: S751. DOI: 10.1016/s0302-2838(22)00581-4.
- Nicholson P. Problems encountered by early endoscopists. Urology 1982; 19 (1): 114–119. DOI: 10.1016/0090-4295(82)90065-6.
- Herr HW. Max Nitze, the Cystoscope and Urology. J Urol 2006; 176 (4): 1313–1316. DOI: 10.1016/j.juro.2006.06.085.
- Sasian J. Harold H. Hopkins. Introduction to Aberrations in Optical Imaging Systems 1998; 2 (1): xvii–xviii. DOI: 10.1017/cbo9780511795183.
- Berci G, Paz-Partlow M. Electronic imaging in endoscopy. Surg Endosc 1988; 2 (4): 227–233. DOI: 10.1007/bf00705327.
- Gobbi D, Midrio P, Gamba P. Instrumentation for minimally invasive surgery in pediatric urology. Transl Pediatr 2015; 5 (4): 186–204. DOI: 10.21037/tp.2016.10.07.
- Osborn NK, Baron TH. The history of the “French” gauge. Gastrointest Endosc 2006; 63 (3): 461–462. DOI: 10.1016/j.gie.2005.11.019.
- Duty B, Conlin M. Principles of Urologic Endoscopy. In: Partin A, editor. Campbell-Walsh-Wein Urology. 12th ed. Philadelphia, PA: Elsevier; 2021. DOI: 10.1016/s0025-6196(12)60891-x.
- Lightner DJ, Wymer K, Sanchez J, Kavoussi L. Best Practice Statement on Urologic Procedures and Antimicrobial Prophylaxis. J Urol 2020; 203 (2): 351–356. DOI: 10.1097/ju.0000000000000509.
- TURAN HALE, BALCI UGUR, ERDINC FSEBNEM, TULEK NECLA, GERMIYANOGLU CANKON. Bacteriuria, pyuria and bacteremia frequency following outpatient cystoscopy. Int J Urol 2006; 13 (1): 25–28. DOI: 10.1111/j.1442-2042.2006.01219.x.
- Salerno A, Nappo SG, Matarazzo E, De Dominicis M, Caione P. Treatment of pediatric renal stones in a Western country: A changing pattern. J Pediatr Surg 2013; 48 (4): 835–839. DOI: 10.1016/j.jpedsurg.2012.09.058.
- Assimos D, Krambeck A, NL M. Faculty Opinions recommendation of Surgical management of stones: american urological association/endourological society guideline, PART I. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2016; 96 (4): 161–169. DOI: 10.3410/f.726388210.793519339.
- Silay MS. Recent Advances in the Surgical Treatment of Pediatric Stone Disease Management. European Urology Supplements 2017; 16 (8): 182–188. DOI: 10.1016/j.eursup.2017.07.002.
- Payne DA KJFX. Rigid and flexible ureteroscopes: technical features. In: Smith AD, Badlani GH, Preminger GM, Kavoussi LR, editors. Smith’s Textbook of Endourology. 3rd ed. West Sussex, UK: Wiley-Blackwell;2012:365-87; . DOI: 10.1002/9781444345148.ch34.
- Kucukdurmaz F, Efe E, Sahinkanat T, Amasyalı AS, Resim S. Ureteroscopy With Holmium:Yag Laser Lithotripsy for Ureteral Stones in Preschool Children: Analysis of the Factors Affecting the Complications and Success. Urology 2018; 111: 162–167. DOI: 10.1016/j.urology.2017.09.006.
- Tasian GE, Copelovitch LA. Management of pediatric kidney stone disease. In: Partin A, editor. Campbell-Walsh-Wein Urology. 12th ed. Philadelphia, PA: Elsevier; 2021. DOI: 10.1007/s11934-007-0067-8.
- Davis NF, Quinlan MR, Browne C, Bhatt NR, Manecksha RP, D’Arcy FT, et al.. Single-use flexible ureteropyeloscopy: a systematic review. World J Urol 2018; 36 (4): 529–536. DOI: 10.1007/s00345-017-2131-4.
- Soygur T, Zumrutbas AE, Gulpinar O, Suer E, Arikan N. Hydrodilation of the Ureteral Orifice in Children Renders Ureteroscopic Access Possible Without any Further Active Dilation. J Urol 2006; 176 (1): 285–287. DOI: 10.1016/s0022-5347(06)00580-5.
- MINEVICH EUGENE, DeFOOR WILLIAM, REDDY PRAMOD, NISHINAKA KAZUYUKI, WACKSMAN JEFFREY, SHELDON CURTIS, et al.. Ureteroscopy Is Safe And Effective In Prepubertal Children. J Urol 2005; 174 (1): 276–279. DOI: 10.1097/01.ju.0000161212.69078.e6.
- Auge BK, Pietrow PK, Lallas CD, Raj GV, Santa-Cruz RW, Preminger GM. Ureteral Access Sheath Provides Protection against Elevated Renal Pressures during Routine Flexible Ureteroscopic Stone Manipulation. J Endourol 2004; 18 (1): 33–36. DOI: 10.1089/089277904322836631.
- Kuhns LR, Oliver WJ, Christodoulou E, Goodsitt MM. The Predicted Increased Cancer Risk Associated With a Single Computed Tomography Examination for Calculus Detection in Pediatric Patients Compared With the Natural Cancer Incidence. Pediatr Emerg Care 2011; 27 (4): 345–350. DOI: 10.1097/pec.0b013e3182132016.
- Kokorowski PJ, Chow JS, K S. Prospective Measurement of Patient Exposure to Radiation During Pediatric Ureteroscopy. Yearbook of Urology 2012; 2012 (4): 224–225. DOI: 10.1016/j.yuro.2012.07.025.
- Tolga-Gulpinar M, Resorlu B, Atis G, Tepeler A, Ozyuvali E, Oztuna D, et al.. Safety and efficacy of retrograde intrarenal surgery in patients of different age groups. Actas Urol Esp (Engl Ed) 2015; 39 (6): 354–359. DOI: 10.1016/j.acuroe.2015.05.005.
- Dogan HS, Onal B, N S. Factors Affecting Complication Rates of Ureteroscopic Lithotripsy in Children: Results of Multi-Institutional Retrospective Analysis by Pediatric Stone Disease Study Group of Turkish Pediatric Urology Society. J Urol 2011; 186 (3): 1035–1040. DOI: 10.1016/j.juro.2011.04.097.
- Ishii H, Griffin S, Somani BK. Flexible ureteroscopy and lasertripsy (FURSL) for paediatric renal calculi: Results from a systematic review. J Pediatr Urol 2014; 11 (3): 164. DOI: 10.1016/j.jpurol.2015.01.010.
- De Coninck V, Keller EX, Somani B, Giusti G, Proietti S, Rodriguez-Socarras M, et al.. Complications of ureteroscopy: a complete overview. World J Urol 2020; 38 (9): 2147–2166. DOI: 10.1007/s00345-019-03012-1.
- Fedrigon D, Faris A, N K. SKOPE–Study of Ketorolac vs Opioid for Pain after Endoscopy: A Double-Blinded Randomized Control Trial in Patients Undergoing Ureteroscopy. Reply. J Urol 2021; 206 (6): 1529–1530. DOI: 10.1097/ju.0000000000002194.
- Zhou L, Cai X, Li H, Wang K-jie. Effects of \ensuremathα-Blockers, Antimuscarinics, or Combination Therapy in Relieving Ureteral Stent-Related Symptoms: A Meta-Analysis. J Endourol 2015; 29 (6): 650–656. DOI: 10.1089/end.2014.0715.
- Sivalingam S, Streeper NM, Sehgal PD, Sninsky BC, Best SL, Nakada SY. Does Combination Therapy with Tamsulosin and Tolterodine Improve Ureteral Stent Discomfort Compared with Tamsulosin Alone? A Double-Blind, Randomized, Controlled Trial. J Urol 2016; 195 (2): 385–390. DOI: 10.1016/j.juro.2015.08.104.
- Weizer AZ, Auge BK, Silverstein AD, Delvecchio FC, Brizuela RM, Dahm P, et al.. Routine Postoperative Imaging is Important After Ureteroscopic Stone Manipulation. J Urol 2002; 68 (2): 46–50. DOI: 10.1016/S0022-5347(05)64829-X.
- Goyal NK, Goel A, Sankhwar SN, Singh V, Singh BP, Sinha RJ, et al.. A critical appraisal of complications of percutaneous nephrolithotomy in paediatric patients using adult instruments. BJU Int 2014; 113 (5): 801–810. DOI: 10.1111/bju.12506.
- Canales BK, Pugh JW. New instrumentation in percutaneous nephrolithotomy. Indian J Urol 2010; 26 (3): 389. DOI: 10.4103/0970-1591.70579.
- Kaygısız O, Satar N, Güneş A, Doğan HS, Erözenci A, Özden E, et al.. Factors predicting postoperative febrile urinary tract infection following percutaneous nephrolithotomy in prepubertal children. J Pediatr Urol 2018; 14 (5): 448.e1–448.e7. DOI: 10.1016/j.jpurol.2018.04.010.
- Tekgül S, Stein R, Bogaert G, Nijman RJM, Quaedackers J, Hoen L ’t, et al.. European Association of Urology and European Society for Paediatric Urology Guidelines on Paediatric Urinary Stone Disease. Eur Urol Focus 2021; 8 (3): 833–839. DOI: 10.1016/j.euf.2021.05.006.
- Aghamir SMK, Salavati A, Aloosh M, Farahmand H, Meysamie A, Pourmand G. Feasibility of Totally Tubeless Percutaneous Nephrolithotomy Under the Age of 14 Years: A Randomized Clinical Trial. J Endourol 2012; 26 (6): 621–624. DOI: 10.1089/end.2011.0547.
- Hosseini MM, Irani D, Altofeyli A, Eslahi A, Basiratnia M, Haghpanah A, et al.. Outcome of Mini-Percutaneous Nephrolithotomy in Patients Under the Age of 18: An Experience With 112 Cases. Front Surg 2021; 8 (613812). DOI: 10.3389/fsurg.2021.613812.
- Nouralizadeh A, Basiri A, Javaherforooshzadeh A, Soltani MH, Tajali F. Experience of percutaneous nephrolithotomy using adult-size instruments in children less than 5 years old. J Pediatr Urol 2009; 5 (5): 351–354. DOI: 10.1016/j.jpurol.2008.12.009.
- Çitamak B, Dogan HS, Ceylan T, Hazir B, Bilen CY, Sahin A, et al.. A new simple scoring system for prediction of success and complication rates in pediatric percutaneous nephrolithotomy: stone-kidney size score. J Pediatr Urol 2019; 15 (1): 67.e1–67.e6. DOI: 10.1016/j.jpurol.2018.09.019.
- Baydilli N, Tosun H, Akınsal EC, Gölbaşı A, Yel S, Demirci D. Effectiveness and complications of mini-percutaneous nephrolithotomy in children: one center experience with 232 kidney units. Turk J Urol 2019; 46 (1): 69–75. DOI: 10.5152/tud.2019.19158.
- Jones P, Bennett G, Aboumarzouk OM, Griffin S, Somani BK. Role of Minimally Invasive Percutaneous Nephrolithotomy Techniques–Micro and Ultra-Mini PCNL (<15F) in the Pediatric Population: A Systematic Review. J Endourol 2017; 31 (9): 816–824. DOI: 10.1089/end.2017.0136.
- Xue W, Pacik D, Boellaard W, Breda A, Botoca M, Rassweiler J, et al.. Management of Single Large Nonstaghorn Renal Stones in the CROES PCNL Global Study. J Urol 2012; 187 (4): 1293–1297. DOI: 10.1016/j.juro.2011.11.113.
- Unsal A, Resorlu B, Kara C, Bozkurt OF, Ozyuvali E. Safety and Efficacy of Percutaneous Nephrolithotomy in Infants, Preschool Age, and Older Children With Different Sizes of Instruments. Urology 2010; 76 (1): 247–252. DOI: 10.1016/j.urology.2009.08.087.
Dernière mise à jour: 2025-09-22 08:00