08: Applications laparoscopiques et robotiques
Ce chapitre prendra environ 19 minutes de lecture.
Brève histoire des applications laparoscopiques et robotiques en urologie pédiatrique
La laparoscopie et la laparoscopie assistée par robot font partie de la chirurgie mini-invasive, qui est devenue de plus en plus populaire dans le monde. L’histoire de la laparoscopie remonte à 1805, lorsque Bozzini a mis au point le premier cystoscope. Le terme de laparoscopie (“laparothorakoskopie”) a été créé par le chirurgien suédois Hans Christian Jacobaeus en 1901. Il a rapporté 17 cas de laparoscopie et 2 thoracoscopies la même année.1 La laparoscopie des débuts présentait de nombreuses limites et suscitait davantage d’inquiétudes en raison de l’augmentation significative des taux de complications.
La technique vidéo s’est développée dans les années 1960, permettant aux chirurgiens d’observer le champ opératoire sur un moniteur. Le premier cas de technique laparoscopique en urologie pédiatrique concernait des testicules non palpables non descendus, rapporté en 1976.2 Au cours des années 1970 et 1980, la laparoscopie n’a été largement acceptée parmi les urologues pédiatriques que pour des indications diagnostiques. La phase suivante de la chirurgie laparoscopique opératoire est survenue dans les années 1990, lorsque des procédures laparoscopiques plus complexes ont commencé à émerger en s’inspirant de la pratique de la chirurgie adulte. En 1993, Kavoussi a décrit la première pyéloplastie laparoscopique chez une femme de 24 ans. Deux ans plus tard, Craig Peters a rapporté la première pyéloplastie laparoscopique dém emberée pour une obstruction de la jonction pyélo-urétérale droite chez un garçon.3 La pyéloplastie laparoscopique a significativement réduit la durée d’hospitalisation et amélioré le contrôle de la douleur postopératoire. Depuis lors, plusieurs entreprises, telles que Karl Storz Endocsopy et Richard Wolf, ont commencé à travailler avec des urologues pédiatriques pour développer et améliorer les instruments laparoscopiques.
Au cours des dernières décennies, la chirurgie laparoscopique est devenue une composante importante de la pratique urologique pédiatrique. Dans certains cas, elle a remplacé la chirurgie ouverte conventionnelle et, dans plusieurs cas, elle est reconnue comme l’approche de référence. La chirurgie laparoscopique obtient des résultats comparables, tout en réduisant les incisions chirurgicales aux sites de trocarts de 3 mm et 5 mm. Dans l’objectif d’absence de cicatrice, la chirurgie endoscopique transluminale par les orifices naturels (NOTES) et la chirurgie laparoscopique à orifice unique sont possibles et pratiquées dans certains centres.4
En 2000, la FDA a approuvé un système chirurgical robotisé nommé da Vinci Surgical System développé par Intuitive Surgical. Il est conçu pour faciliter la chirurgie cœlioscopique et est contrôlé par un chirurgien depuis une console au bloc opératoire. Il offre les avantages d’une vue 3D stable et agrandie, d’un filtrage des tremblements et d’une mise à l’échelle des mouvements pour une exposition et une suture intracorporelles précises. Au cours des deux dernières décennies, la chirurgie assistée par robot a été couramment utilisée en urologie, en gynécologie, en chirurgie générale et en chirurgie pédiatrique. Le système chirurgical da Vinci a évolué du modèle S de première génération vers le Si et, plus récemment, le Xi et le système SP à orifice unique.

Figure 1 L’évolution du système chirurgical da Vinci
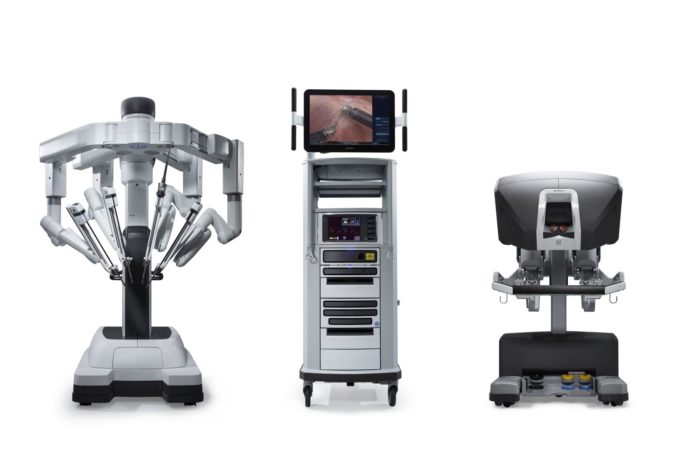
Figure 2 Système chirurgical da Vinci Xi
En 2001, Meininger a rapporté le premier cas de fundoplicature de Nissen assistée par robot chez un patient pédiatrique.5 Ce travail a stimulé les progrès de la chirurgie pédiatrique. La pyéloplastie laparoscopique assistée par robot (RALP) a été la première intervention réalisée avec la plateforme da Vinci dans le domaine de l’urologie pédiatrique, rapportée par Olsen et Jorgensen en 2004.6 En 2005, Atug a décrit son expérience de la RALP chez sept patients pédiatriques âgés de 6 à 15 ans.7 En 2006, Lee a comparé les résultats de la RALP et de la pyéloplastie ouverte (PO) en appariant 33 patients selon l’âge et le sexe.8 Ils ont constaté que la durée opératoire moyenne était de 219 minutes dans le groupe RALP, contre seulement 181 minutes dans le groupe de chirurgie ouverte. La durée opératoire de la RALP diminuait significativement après 15 cas. La cohorte RALP a montré une durée d’hospitalisation plus courte, une moindre consommation d’antalgiques, et le taux de succès était de 93,9 %.9 Étant donné le taux de succès élevé et le faible taux de complications de la RALP, certains urologues ont étendu cette approche aux nourrissons. Récemment, Andolfi a publié sa série de cas de RALP chez le nourrisson et a démontré que la RALP est une option de prise en charge attrayante de l’UPJO chez le nourrisson, car elle offre des résultats satisfaisants, une diminution de la durée d’hospitalisation et une amélioration du résultat esthétique.10 L’équipe de Higganbotham a même réalisé une orchidopexie laparoscopique assistée par robot chez un garçon atteint de cryptorchidie bilatérale.11
De nos jours, l’orchidopexie laparoscopique et la ligature haute laparoscopique du processus vaginal sont devenues des traitements de routine dans le monde entier. La chirurgie laparoscopique assistée par robot s’est également largement répandue aux États-Unis, en Europe et en Asie. De nombreuses autres entreprises ont tenté de développer des systèmes de robot chirurgical pour contester la domination de da Vinci Surgical Systems. Cela inclut le système chirurgical Senhance de TransEnterix, la Single Port Orifce Robotic Technology (SPORT) de Titan Medical, le Hinotori Surgical Robot System de Medicaroid, le REVO‑I Robotic Surgical System de Meere Company, le système chirurgical Edge d’Edge Medical Robotics, et ainsi de suite. Des dizaines de systèmes chirurgicaux robotisés sont encore en cours de développement.12 La demande de chirurgie assistée par robot continue d’augmenter. Les nouvelles technologies pourraient renforcer les efforts mini-invasifs et améliorer les capacités des systèmes déjà établis. Des études futures sont nécessaires pour évaluer plus avant les forces et les faiblesses de chaque dispositif et plateforme de chirurgie robotique au bloc opératoire.13
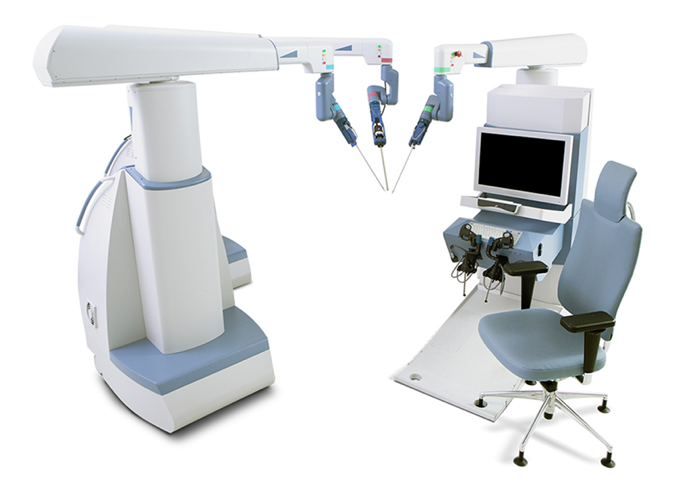
Figure 3 Système chirurgical Senhance
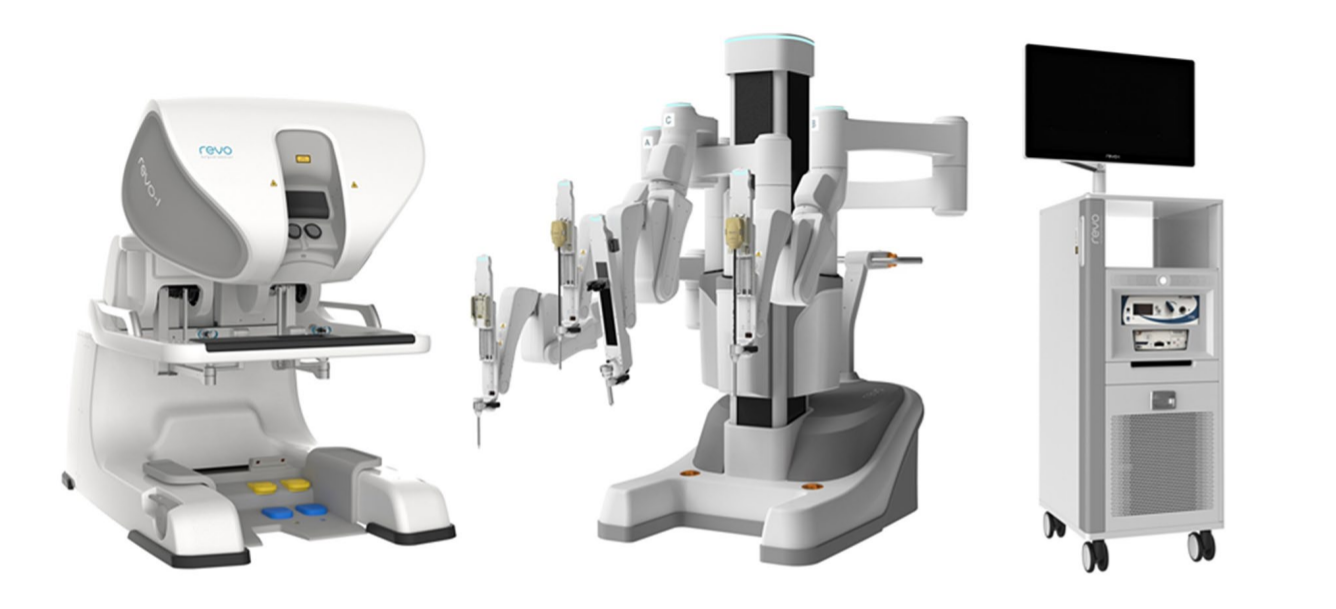
Figure 4 Système robotique REVO-I

Figure 5 Système robotique Hinotori
Instruments pour les applications laparoscopiques et robotiques
Instrumentation de la chirurgie urologique pédiatrique par laparoscopie
Équipement de pneumopéritoine
Le matériel de pneumopéritoine se compose d’un insufflateur de pneumopéritoine, d’une bouteille de CO2, d’une tubulure de sortie du gaz et d’instruments de ponction. L’insufflateur de pneumopéritoine peut réguler la pression de pneumopéritoine (6–10 mm Hg) et le débit de gaz. L’insufflateur de pneumopéritoine actuel peut ajuster automatiquement la pression intra-abdominale, insuffler rapidement le gaz et surveiller la consommation de CO2, et est équipé de dispositifs d’alarme en cas de pression de CO2 insuffisante dans la bouteille ou de dépassement de la plage de pression intra-abdominale préréglée, afin que le chirurgien puisse détecter rapidement tout problème, ce qui améliore la sécurité de l’intervention. Les insufflateurs de pneumopéritoine modernes (Figure 6) permettent : ① une circulation automatique pour filtrer les fumées afin d’assurer un champ opératoire clair ; ② une surveillance en temps réel de la pression de pneumopéritoine pour garantir une pression constante ; ③ certains équipements d’insufflation pour pneumopéritoine disposent d’un système de chauffage du gaz afin d’éviter la baisse de la température corporelle du patient. ④ Éliminer les émissions de fumée dans la salle d’opération, pour préserver la santé des chirurgiens et du personnel infirmier.

Figure 6 Appareil moderne de pneumopéritoine
Chariot électrique
Le chariot d’alimentation (Figure 7) regroupe le moniteur, l’insufflateur pour pneumopéritoine, le système de caméra, la source lumineuse et le bistouri électrique en un seul chariot, ce qui le rend facile à pousser et permet à l’opérateur d’en changer la position à tout moment.

Figure 7 Chariot d’alimentation électrique
Système optique
Actuellement, les laparoscopes utilisent principalement des systèmes optiques à lentilles en tige offrant une bonne transmission lumineuse, des images sans distorsion, une bonne planéité de l’image, des angles ultra-larges, une luminosité uniforme, une grande profondeur de champ et une forte sensation stéréoscopique. Le diamètre est de 5–10 mm, la longueur de travail est de 31 cm, et le champ de vision est de 0˚, 30˚ et 45˚ (Figure 8). Le laparoscope 30˚ d’un diamètre de 5 mm est le plus couramment utilisé en urologie pédiatrique, ce qui présente les avantages de modifier le champ de vision opératoire, de réduire les zones aveugles, de permettre l’observation de la même structure sous différents angles, de faciliter la formation d’une perception tridimensionnelle par le chirurgien et de réduire les interférences mutuelles entre le laparoscope et les instruments.
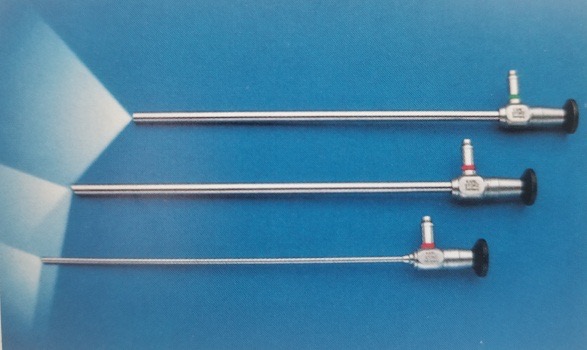
Figure 8 Le laparoscope à 0°, 30° et 45°.
Source de lumière froide et sonde à fibre optique
Une source de lumière froide (Figure 7) fournit des proportions égales de lumière aux longueurs d’onde rouge, bleue et verte pour créer une lumière blanche et constitue le type de lumière le plus couramment utilisé en chirurgie laparoscopique. De nombreux dispositifs utilisent actuellement une lampe au xénon (300 W) ou une lampe au xénon avec technologie LED, couplée à un réglage automatique de la luminosité, afin de fournir une source de lumière fiable pendant l’intervention. La durée de vie moyenne de la lampe peut atteindre 3 000 heures. Ce type de source lumineuse est économique, durable et efficace. La sonde à fibre optique de l’objectif (Figure 8) est composée d’un faisceau flexible de fibres guides de lumière assurant une transmission lumineuse de haute qualité. Celles-ci peuvent se rompre lors d’une déviation ou d’une flexion de l’objectif et nécessiter une réparation ou un remplacement.
Système de caméra
Le système de caméra laparoscopique (Figure 9) a évolué de la définition standard à la haute définition, puis à l’ultra-haute définition, et plus récemment aux systèmes de caméras 4K. Avec l’amélioration de la résolution, il peut offrir à l’opérateur des vues chirurgicales plus nettes. La technologie de laparoscope 3D est actuellement disponible, mais uniquement avec un diamètre de 10 mm, ce qui la rend moins courante en urologie pédiatrique.
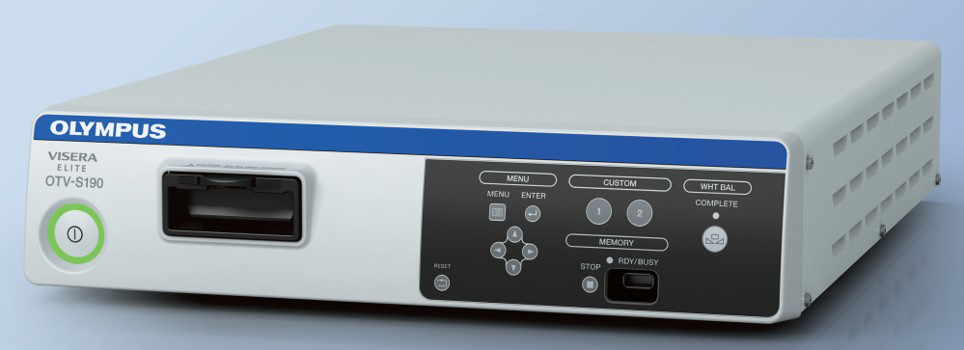
Figure 9 Système de caméra laparoscopique
Système d’électrochirurgie
Inclus Electrodebrider et système d’électrocoagulation, couteau ultrasonique (bistouri Harmonic), plateforme d’énergie et Ligasure. Ces dispositifs fournissent divers types d’énergie, notamment l’électrocautérisation monopolaire, l’électrocautérisation bipolaire, l’énergie ultrasonique, ainsi que des combinaisons pour aider les chirurgiens (Figure 10, Figure 11, Figure 12, et Figure 13).

Figure 10 Unité d’électrochirurgie

Figure 11 Bistouri ultrasonique

Figure 12 Plateforme d’énergie

Figure 13 Ligasure
Autres instruments
Les instruments couramment utilisés comprennent l’aiguille de Veress, le trocart, des applicateurs de clips Hem-o-Lok, des applicateurs de clips en titane, des pinces de préhension, des porte-aiguilles, des ciseaux, et d’autres encore (Figure 14, Figure 15, Figure 16).

Figure 14 Instruments usuels
Figure 15 Trocart

Figure 16 Aiguille de Veress

Figure 17 Applicateur de clips Hem-o-lok
Instrumentation de la chirurgie laparoscopique assistée par le robot Da Vinci
Le système chirurgical da Vinci se compose principalement de trois parties : la console du chirurgien, le système de bras robotisés au chevet (Patient Cart) et le système d’imagerie 3D (Vision Cart), comme le montre la Figure 18.
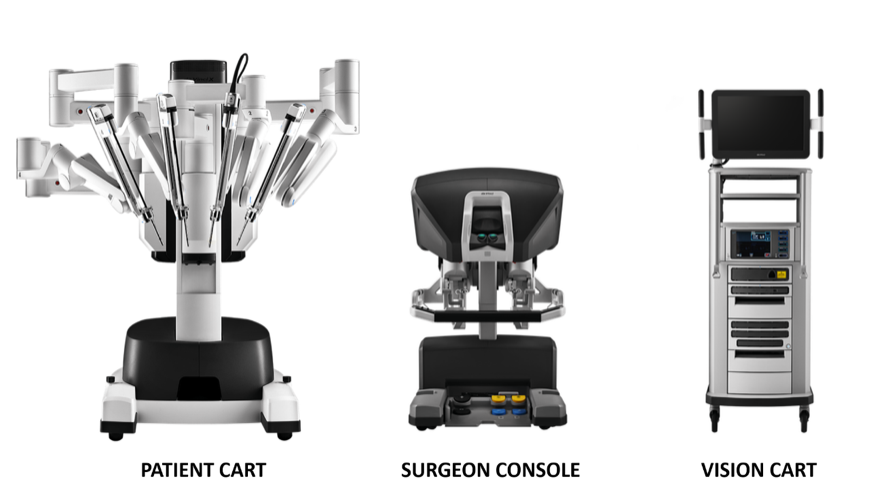
Figure 18 Trois composants qui constituent le système da Vinci
Console chirurgicale: Cette console peut être placée à l’extérieur de la porte de la zone stérile du bloc opératoire. Elle s’appuie principalement sur les mains et les pédales au pied du chirurgien pour contrôler le bras opératoire et l’endoscope 3D haute définition.
Système de bras robotisé au chevet du patient (chariot patient): Ce système constitue la partie opératoire du robot, qui assure principalement le support du bras d’instrumentation et du bras caméra. Il comprend généralement 2 à 3 bras opérateurs, chacun étant équipé de porte-aiguilles, de ciseaux, de pinces de préhension, etc. Les positions peuvent être interchangées selon les besoins peropératoires, et le nombre de bras mécaniques peut être augmenté ou réduit.
Système d’imagerie 3D (Vision Cart): Le système intègre un processeur central et un dispositif de traitement d’image, qui peut être raccordé aux équipements chirurgicaux auxiliaires (système d’insufflation), et fournit, au moyen de signaux à double canal, une image tridimensionnelle du champ opératoire, rendant la vision peropératoire plus proche de l’effet visuel à l’œil nu. Le chariot Vision comprend une paire de contrôleurs de caméra vidéo, une paire de sources lumineuses et des synchroniseurs des signaux vidéo pour l’œil gauche et l’œil droit. La caméra endoscopique comporte un double objectif, et les images recueillies par le double objectif forment une image 3D sous l’action du synchroniseur de signaux vidéo, ce qui aide le chirurgien à identifier les rapports tissulaires.
Les équipements couramment utilisés chez l’enfant pour le robot da Vinci comprennent les éléments suivants. Trocarts robotiques, consoles, chariot patient. Outre le canal de la caméra endoscopique, qui utilise un canal de travail d’un diamètre de 8 mm (Xi) ou 8,5 mm (Si), les autres canaux opérateurs utilisent des canaux de travail de 8 mm ou de 5 mm (Si). La canule spéciale du système robotique da Vinci est marquée, à l’extrémité intra-abdominale, d’un repère « deux fines et une épaisse ». La profondeur d’insertion à travers la paroi abdominale est plus faible que celle d’un laparoscope traditionnel.
Ensemble de bras robotique stérile à usage unique avec adaptateur. C’est le “pont” entre le bras robotique et l’instrument chirurgical.
Instruments chirurgicaux: Chaque instrument chirurgical est composé de trois parties : disque, tige et articulation du poignet. Les instruments chirurgicaux robotiques couramment utilisés en urologie pédiatrique sont répartis en instruments chirurgicaux de 8 mm et de 5mm, comprenant des ciseaux courbes unipolaires, des pinces atraumatiques, un grand porte-aiguille, des pinces bipolaires fenestrées, un couteau électrochirurgical à électrode, des ciseaux courbes chirurgicaux, un porte-aiguille et un bistouri harmonique (Xi). L’articulation EndoWrist des instruments permet un contrôle précis avec ±90 degrés d’articulation au niveau du poignet, la mise à l’échelle des mouvements et l’élimination des tremblements de la main. Les instruments laparoscopiques standard offrent quatre degrés de liberté sur deux axes (mouvement vers l’intérieur, vers l’extérieur, dans le sens des aiguilles d’une montre et dans le sens inverse des aiguilles d’une montre).
Positionnement du patient, mise en place des trocarts et accès initial
Chirurgie des voies urinaires supérieures
Pour la chirurgie laparoscopique des voies urinaires supérieures, nous choisissons habituellement le côté sain en décubitus dorsal incliné, avec le côté atteint calé de 45˚ à 60˚, aussi près que possible du bord du lit, à environ 1 cm.
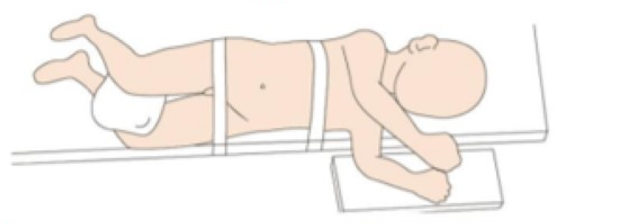
Figure 19 Position du patient pour la chirurgie laparoscopique des voies urinaires supérieures
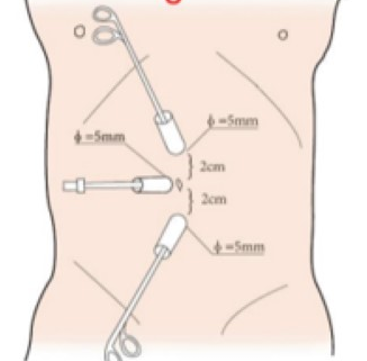
Figure 20 Position des trocarts pour laparoscopie des voies urinaires supérieures
Pour le choix de la position du patient lors d’une chirurgie laparoscopique robot-assistée des voies urinaires supérieures, nous suivons quatre règles : premièrement, le patient est installé en position rénale afin de dégager l’espace opératoire et d’éviter les interférences avec les bras du robot. Deuxièmement, le patient est placé près du bord de la table pour réduire la distance avec l’aide opératoire. Avec l’utilisation de la rotation de la table, nous privilégions un décubitus latéral à 80˚. Enfin, la gestion de la température en salle d’opération est très importante. Un système de réchauffement à air pulsé et des couvertures chauffantes doivent être utilisés pour la chirurgie chez le nourrisson.
Tous les trocarts ont été placés sous vision directe, y compris un trocart optique de 8,5 mm, un trocart de 8 mm et un trocart de 5 mm. Un ou deux trocarts d’assistance supplémentaires de 3 mm ont été placés à 3 cm latéralement du point médian de la ligne de Pfannenstiel, afin d’améliorer l’efficacité de la suture
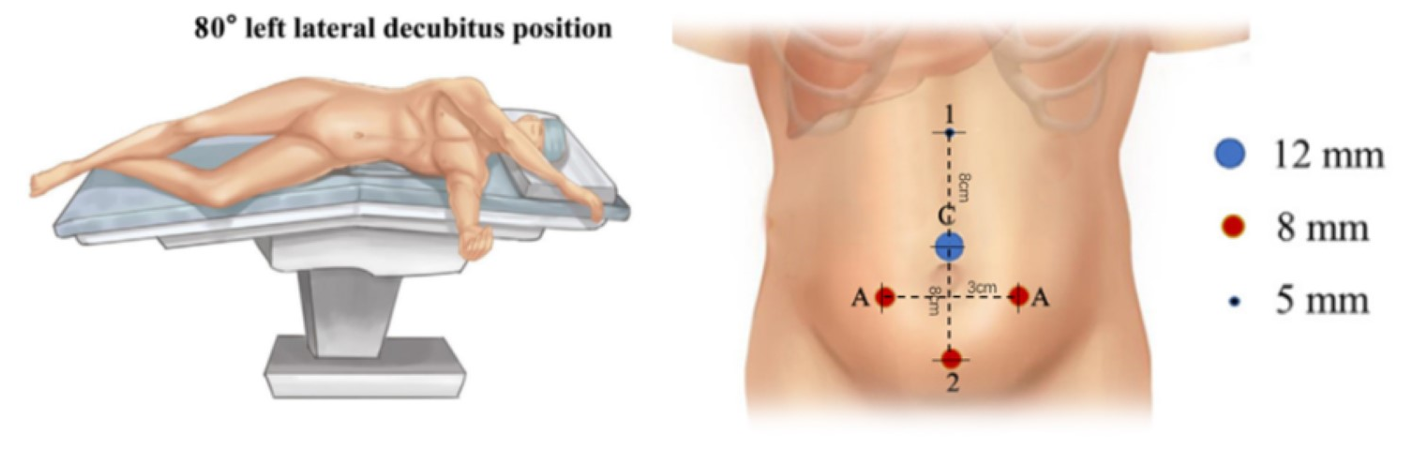
Figure 21 Position du patient et des trocarts pour une chirurgie laparoscopique robot-assistée des voies urinaires supérieures
Chirurgie du bas appareil urinaire
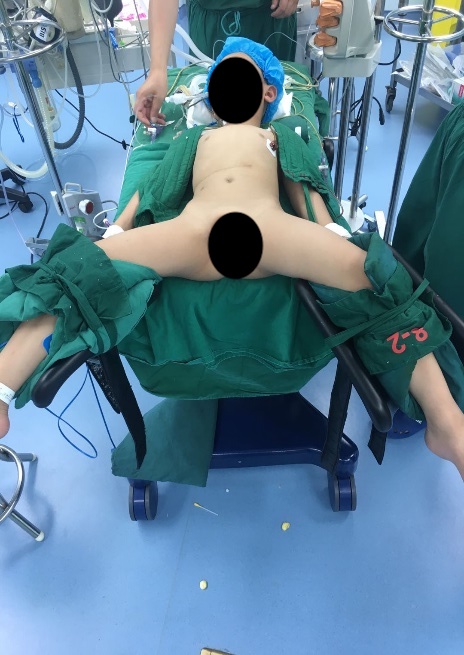
Figure 22 Position de lithotomie modifiée pour la chirurgie de l’appareil urinaire inférieur
Pour la chirurgie des voies urinaires inférieures, qu’elle soit cœlioscopique ou cœlioscopique assistée par robot, nous employons la position de lithotomie modifiée avec la tête en bas de 30–45˚. Des ports cœlioscopiques ou robotiques sont placés, y compris un trocart de caméra par l’ombilic, et deux trocarts supplémentaires placés au niveau ombilical avec une distance de 4–6 cm entre eux.
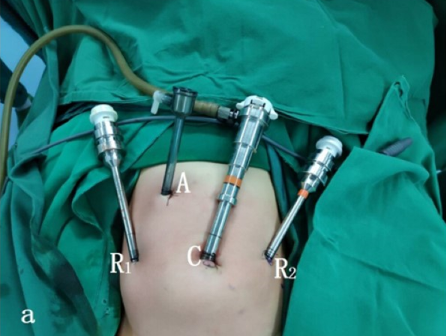
Figure 23 Position du trocart pour la chirurgie des voies urinaires basses
Applications des techniques laparoscopiques et robotiques
Pyéloplastie
Des données probantes bien établies ont démontré que la pyéloplastie laparoscopique ou la RALP présente non seulement des taux de succès équivalents à ceux de la pyéloplastie ouverte, mais offre également les avantages d’une invasivité minimale, d’un meilleur résultat esthétique, de douleurs postopératoires moindres, d’une durée d’hospitalisation réduite et d’un rétablissement précoce. La pyéloplastie démontée d’Anderson-Hynes constitue la référence pour toutes les approches.
Pyéloplastie laparoscopique
Pour la pyéloplastie laparoscopique, les voies transpéritonéale et rétropéritonéale permettent toutes deux d’obtenir une exposition opératoire satisfaisante. En revanche, en chirurgie assistée par robot, l’espace rétropéritonéal est trop exigu. Ainsi, nous décrivons les voies transpéritonéale et rétropéritonéale pour la pyéloplastie laparoscopique, et la voie transpéritonéale pour la pyéloplastie robot-assistée (RALP).
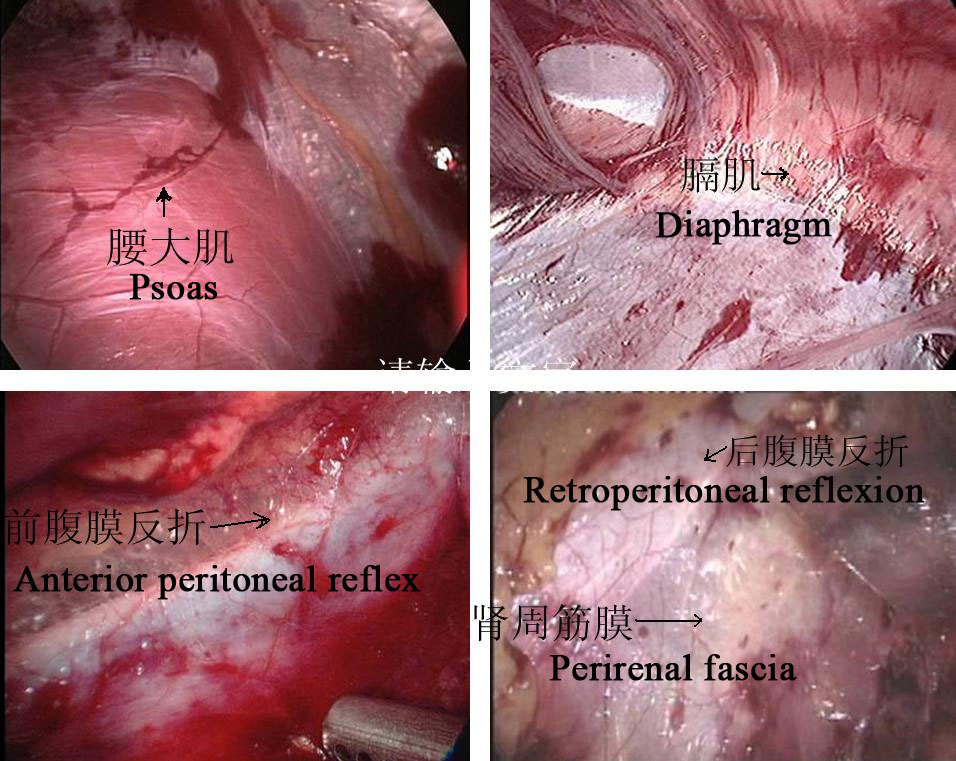
Figure 24 Repères anatomiques rétropéritonéaux
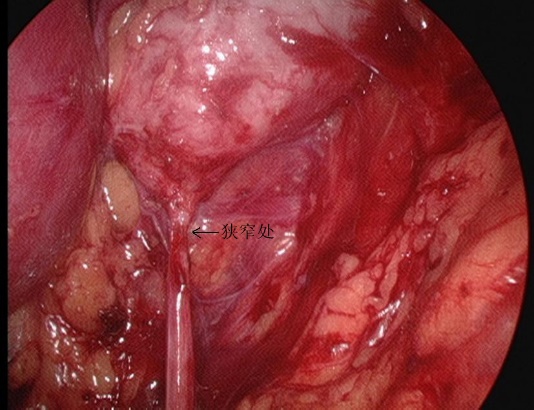
Figure 25 La partie sténosée de la JPU en vue rétropéritonéale
Approche rétropéritonéale
- Inciser longitudinalement la peau 1.5–2.0 cm sous l’extrémité de la 12e côte sur la ligne axillaire postérieure. La membrane tendineuse à l’origine du muscle transverse de l’abdomen et le fascia lombo-dorsal sont séparés par dissection mousse à l’aide de pinces vasculaires pour atteindre la région périrénale. Un ballon est placé après séparation mousse de l’espace périrénal au doigt index afin de créer l’espace opératoire rétropéritonéal, et la pression du pneumopéritoine est maintenue à 8–14 mmHg, avec une moyenne de 10 mm Hg.
- Le fascia périrénal a été incisé longitudinalement au bistouri ultrasonique pour exposer la face dorsale du pôle inférieur du rein, et le bassinet et l’uretère proximal ont été séparés pour révéler le siège et la cause de la sténose. Séparer la face dorsale des pôles moyen et inférieur du rein, libérer et exposer complètement le bassinet et l’uretère proximal, préciser l’UPJO.
- Inciser le bassinet. Conserver la partie médiale du bassinet incomplètement décollée et encore reliée à l’uretère, et fendre l’uretère longitudinalement jusqu’à dépasser la sténose de 1.0 à 2.0 cm.
- Suturer le lambeau du bassinet au point le plus déclive de l’uretère avec un fil résorbable 5-0.
- Section de l’uretère à environ 0.5 cm proximal du segment sténosé et achèvement de la section du bassinet pour retirer le segment sténosé de l’UPJ et une partie du bassinet dilaté.
- Suture séquentielle de la paroi postérieure de l’anastomose avec 1 point de verrouillage tous les 2 points
- Poursuite de la suture de l’ouverture du lambeau du bassinet excédentaire sans couper les fils
- Mise en place d’une sonde double J en ligne à travers l’anastomose.
- Suture intermittente de la paroi antérieure de l’anastomose.
- En présence d’une compression vasculaire ectopique, le vaisseau est placé en arrière du segment pyélo-urétéral pour plicature, la pression du pneumopéritoine est réduite, il est confirmé qu’il n’y a pas de saignement actif sur le champ opératoire, et un drain rétropéritonéal est laissé en place via une aiguille de trocart sur la crête iliaque pour fermer l’incision.
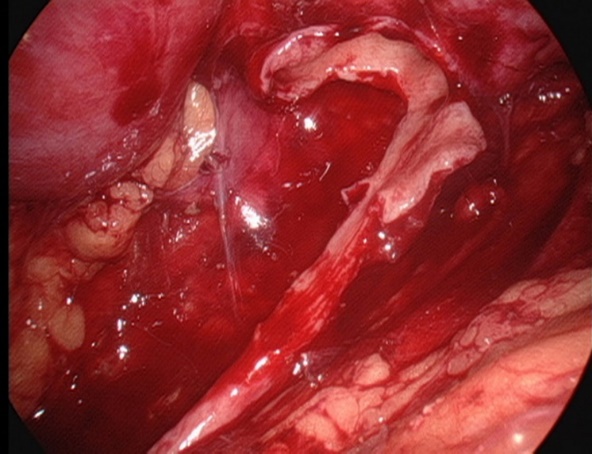
Figure 26 Conserver la portion médiale du pyélon partiellement détachée et toujours reliée à l’uretère
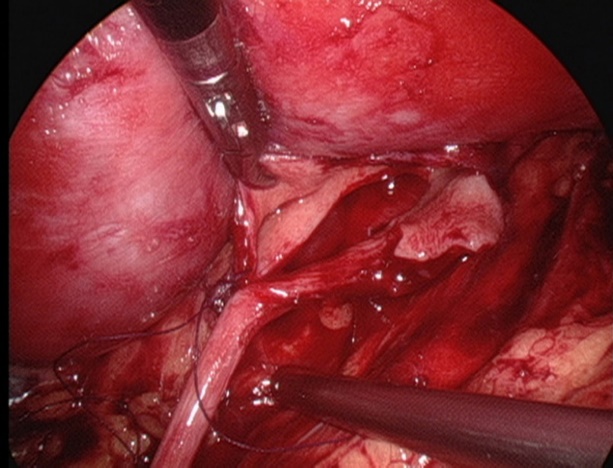
Figure 27 Suturer le point le plus déclive de l’uretère
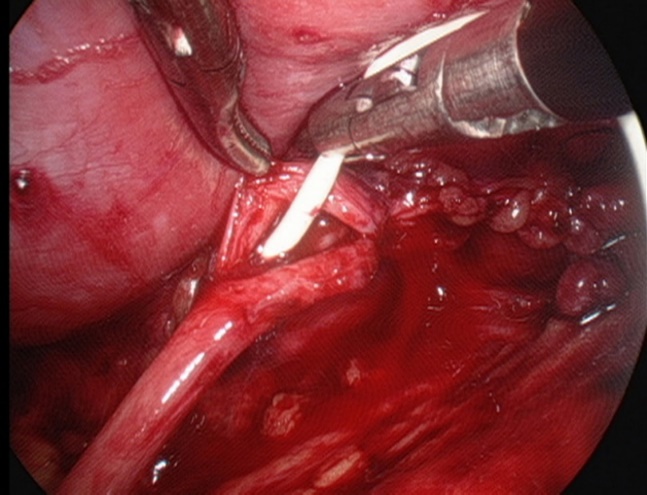
Figure 28 Mise en place d’une sonde double J
Approche transpéritonéale
- Après établissement d’un accès trocart normal, la pression pneumopéritonéale est maintenue à 8–14 mmHg, avec une moyenne de 10 mmHg.
- Ouvrir le péritoine latéral le long du bord latéral de la gouttière paracolique afin de libérer complètement le côlon, repousser le côlon médialement pour identifier la veine gonadique et l’uretère. Pour la pyéloplastie du côté gauche, ouvrir la zone avasculaire le long de l’espace mésentérique, et après avoir libéré la graisse périrénale, exposer le bassinet rénal et l’uretère proximal.
- Le bassinet rénal est complètement libéré des vaisseaux du hile à l’aide d’une traction vers le bas et d’un décollement émoussé. Puis libérer le bassinet dorsalement pour élargir le bassinet rénal et rechercher la présence de vaisseaux vagaux croisant la jonction pyélo-urétérale pour préciser le site de sténose.
- La corne supérieure du bassinet rénal est suspendue à la paroi abdominale avec un fil mousse 2-0. Puis inciser le bassinet rénal de l’arrière vers le bas puis vers le haut pour former une forme en entonnoir. Puis inciser l’uretère longitudinalement pour dépasser la sténose de 1 à 2 cm.
- Suturer le lambeau du bassinet rénal avec le point le plus déclive de l’uretère avec un fil résorbable 5-0.
- Sectionner l’uretère à environ 0,5 cm en aval du segment sténosé et compléter ensuite la section du bassinet rénal pour retirer le segment sténosé de la JPU et la portion de bassinet partiellement dilatée
- Suture séquentielle de la paroi postérieure de l’anastomose avec 1 point de verrouillage toutes les 2 sutures.
- Poursuivre la suture de l’ouverture du lambeau de bassinet excédentaire sans couper les fils.
- Mise en place d’une sonde double J.
- Suture continue de la paroi antérieure de l’anastomose, hémostase soigneuse et complète, et irrigation du champ opératoire avec du sérum physiologique tiède.
- Suture en points séparés du péritoine latéral ou de la brèche mésentérique.
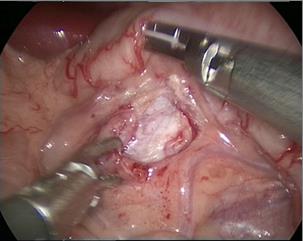
Figure 29 L’abord transmésentérique
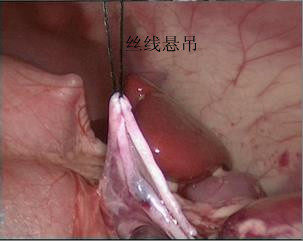
Figure 30 La corne supérieure du bassinet rénal est suspendue
Pyéloplastie laparoscopique robot-assistée
- Pour les cas du côté gauche, l’approche transmésentérique a été adoptée, le pyélon dilaté étant situé en dedans du côlon descendant. Pour les cas du côté droit, nous avons choisi l’approche par le sillon paracolique.
- Nous avons ensuite disséqué soigneusement l’uretère proximal et le pyélon tout en préservant la vascularisation urétérale.
- Le pyélon a été sectionné au-dessus du tissu obstructif, puis paré et stabilisé par un point de suspension percutané afin de faciliter l’anastomose.
- Après avoir spatulé l’uretère distal à la suite de l’excision du segment obstructif, nous avons suturé le point le plus déclive du segment urétéral apéristaltique et l’extrémité pyélique par un surjet continu de PDS-II 6-0.
- La paroi postérieure de l’uretère a ensuite été refermée par un surjet continu. Avant de commencer l’anastomose antérieure avec un second surjet continu de PDS-II 6-0, une sonde urétérale double J (COOK, USI-512, Irlande) a été mise en place en antégrade.
- Enfin, nous avons fermé le mésentère ou le péritoine avec un fil résorbable 5-0.
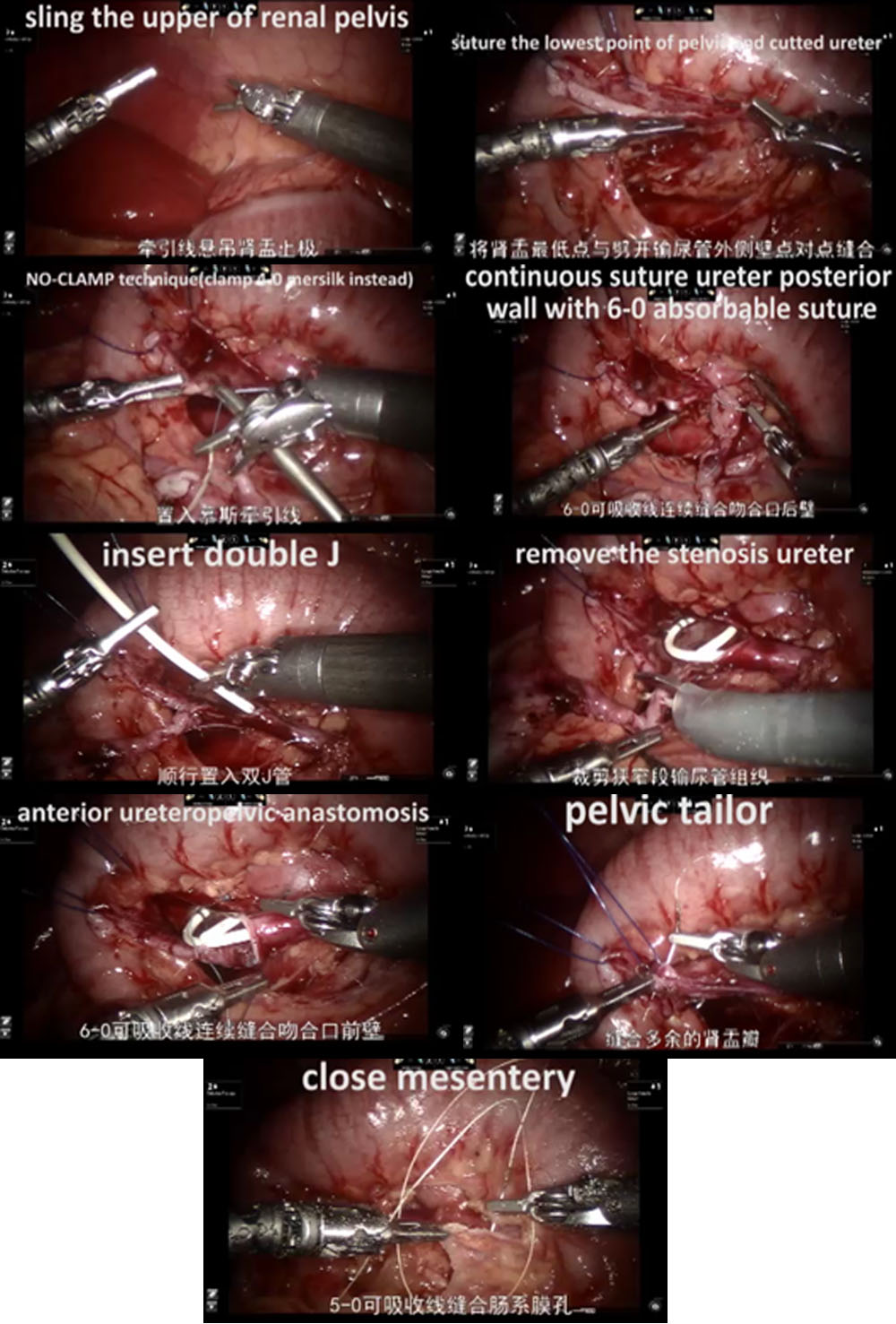
Figure 31 La procédure de RALP
Réimplantation urétérale
La réimplantation urétérale constitue le traitement de référence du reflux vésico-urétéral et de la sténose urétérale. Traditionnellement, cette intervention était réalisée par voie ouverte. De nombreuses techniques peuvent être utilisées : réimplantation intravésicale de Cohen, réimplantation transvésicale de Polino-Leadbetter, réimplantation extravésicale de Lich-Gregoir. Toutes ces techniques peuvent être réalisées par voie laparoscopique, par laparoscopie pneumovésicale ou par voie robotique. Nous présentons ici la procédure de réimplantation de Cohen par laparoscopie pneumovésicale (anastomose urétéro-vésicale avec tunnel vésical sous-muqueux transversal) et la réimplantation extravésicale de Lich-Gregoir.
Mise en place de la pneumovessie
- Le cystoscope a été introduit par l’urètre. Puis du gaz de CO2 a été injecté à travers le cystoscope jusqu’à ce que la vessie soit dilatée au niveau ombilical. Une traction de la vessie pleine a été réalisée percutanément sous contrôle cystoscopique. Le sommet de la vessie remplie a été fixé en position sous-ombilicale sur la ligne médiane de l’abdomen, la peau a été incisée au bord inférieur de la ligne de traction. Un trocart a été introduit par ponction immédiatement après la fixation de la traction. Un trocart opératoire de 3-5 mm a été placé respectivement du côté gauche et du côté droit. Le cystoscope a ensuite été retiré. Du gaz de CO2 a été injecté via le trocart ophtalmoscopique.
- Repérage des orifices urétéraux bilatéraux.
- Un point de traction est suturé au niveau de l’orifice urétéral du côté atteint. Inciser la muqueuse le long de l’orifice urétéral à l’aide d’une anse à crochet électrique. Libérer l’uretère du segment interne de la paroi vésicale au plus près à l’aide d’un bistouri électrique ou d’un bistouri ultrasonique. L’uretère libéré est tracté dans la vessie sur environ 5.0 cm jusqu’au segment dilaté de l’uretère pouvant être amené sans tension jusqu’au sommet de l’orifice urétéral controlatéral. Chez le patient de sexe masculin, il faut protéger le canal déférent lors de la libération de l’uretère.
- Pratiquer une petite ouverture à la jonction du segment distal dilaté de l’uretère et du segment sténosé pour drainer le liquide. Pour un diamètre urétéral supérieur à 12 mm, procéder à une plicature ou à une résection de l’uretère dilaté.
- Inciser la couche muqueuse à environ 2.0 cm au-dessus de l’orifice de l’uretère controlatéral. Séparer ensuite la couche sous-muqueuse avec des ciseaux ou des pinces vasculaires et réaliser un tunnel sous-muqueux jusqu’à l’orifice urétéral.
- Tracter l’uretère vers le côté opposé via le tunnel sous-muqueux, exciser le tissu lésionnel sténosé au niveau de l’orifice urétéral, et fixer l’ensemble de l’uretère à la muqueuse vésicale avec des sutures Vicryl 5-0 ou 6-0 par 6-8 points et 2 points avec la couche musculaire vésicale.
- Fermer l’orifice urétéral initial en suturant la couche musculaire vésicale avec la couche musculaire urétérale avec un fil de Vicryl 5-0
- Laisser une sonde double J à travers le trocart.
- Retirer chaque trocart, suturer le tissu sous-cutané et la peau.
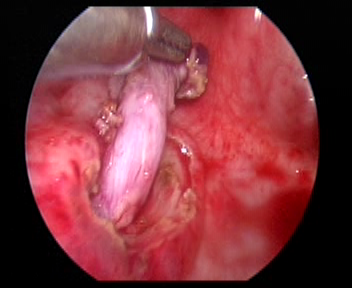
Figure 32 Libérer l’uretère
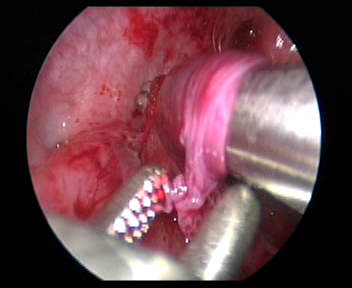
Figure 33 Réaliser un tunnel sous-muqueux jusqu’à l’orifice urétéral.
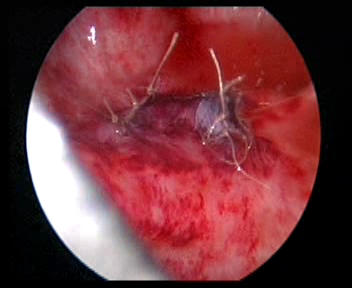
Figure 34 Fermer l’orifice urétéral d’origine
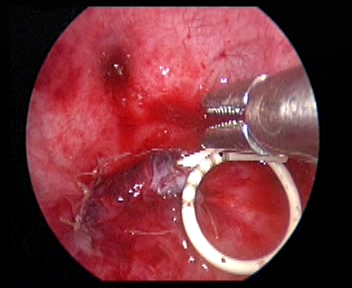
Figure 35 Laisser une sonde double J
Réimplantation selon Lich-Gregoir assistée par robot
- Ouvrir le péritoine latéral au niveau de l’artère iliaque externe pulsatile, repérer l’uretère qui croise l’artère iliaque externe, et libérer l’uretère autant que possible jusqu’à la jonction urétéro-vésicale afin d’exposer complètement la sténose urétérale.
- Remplir la vessie avec 60 ml de sérum physiologique pour la maintenir légèrement remplie. Une incision de 5 cm a été pratiquée dans la paroi postéro-latérale de la vessie. Inciser ensuite la vessie jusqu’à la sous-muqueuse vésicale.
- Détacher l’uretère au niveau de la jonction urétéro-vésicale, régulariser l’uretère distal à un calibre normal. Élargir la fente de la muqueuse vésicale à ce niveau. Puis suturer l’uretère régularisé à la fente de la muqueuse vésicale avec un fil résorbable 6/0 pour le fixer. Compléter l’anastomose de la paroi postérieure et laisser en place la sonde double J afin de poursuivre et compléter la paroi antérieure de l’anastomose (Pour les cas de reflux, placer la sonde double J avant l’intervention).
- Des sutures résorbables ont été utilisées pour fermer le péritoine au niveau de la paroi latérale de la vessie et le péritoine autour de l’uretère dans le segment pelvien. Le système robotique a été retiré, un drain a été mis en place, et l’incision cutanée a été suturée.
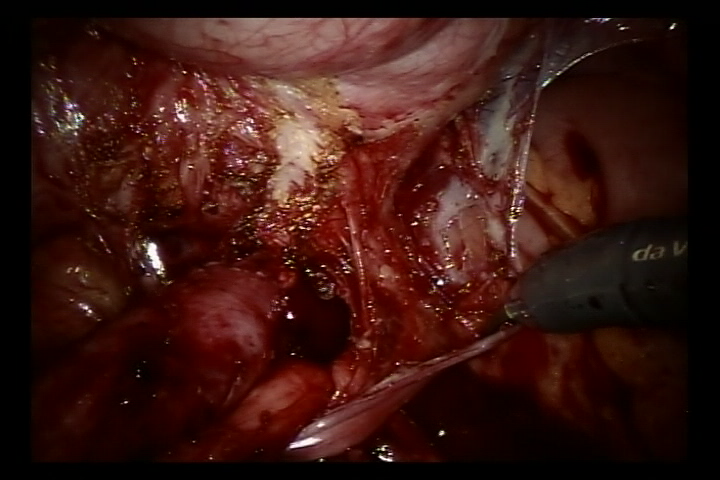
Figure 36 Libérer l’uretère
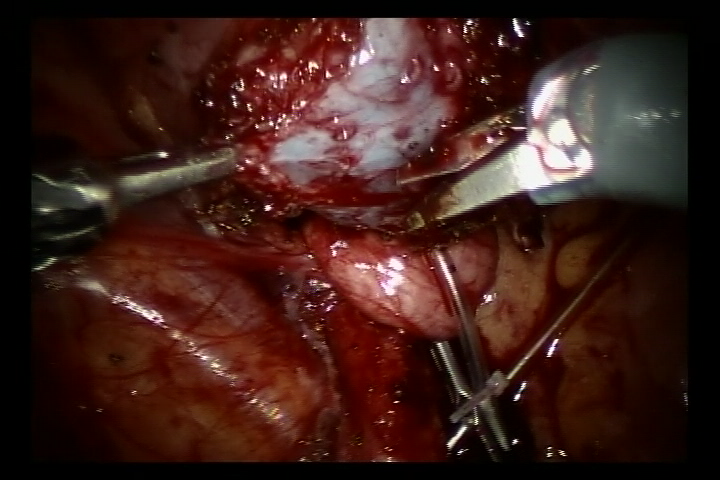
Figure 37 Inciser la vessie jusqu’à la sous-muqueuse vésicale
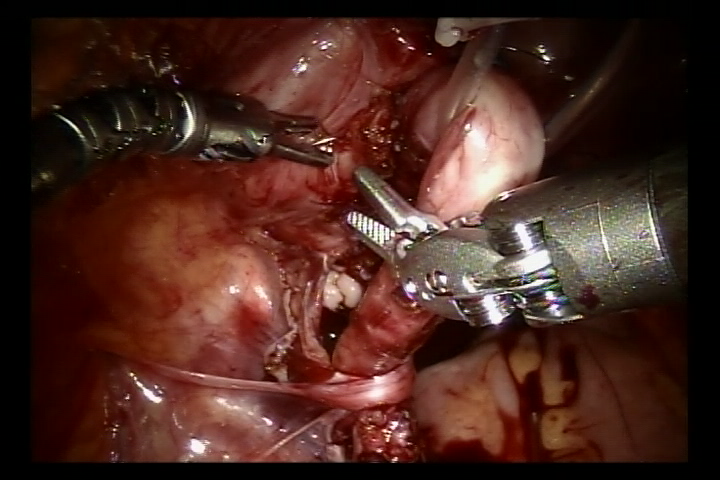
Figure 38 Suturer les deux côtés de la couche musculaire spongieuse afin de former un tunnel sous-muqueux
Rhabdomyosarcome de la vessie
Le rhabdomyosarcome (RMS) est le sarcome des tissus mous le plus fréquent chez l’enfant. Une cystectomie radicale ou partielle doit être réalisée pour retirer la tumeur. Nous présentons ici notre expérience de la cystectomie radicale assistée par robot avec reconstruction d’une néovessie orthotopique sigmoïdienne avec réimplantation urétérale bilatérale (technique de Politano-Leadbetter).
- Un trocart de 10 mm a été placé à environ 6 cm de la symphyse pubienne pour la caméra. Deux trocarts robotiques de 8 mm destinés aux bras robotiques #1and #2 ont été placés à 6 cm du trocart caméra sur la ligne médioclaviculaire, au-dessus de l’épine iliaque antéro-supérieure. Deux trocarts d’assistance de 5 mm ont été placés sur la ligne médioclaviculaire droite, juste sous le rebord costal.
- Après la résection radicale soigneuse et précise de la tumeur vésicale
-
et des ganglions lymphatiques pelviens périphériques, nous avons prélevé environ 20 cm de côlon sigmoïde et l’avons détubularisé en une forme sphérique afin de reconstruire la néovessie qui pourra à terme
- pouvait contenir environ 100 mL.
- Ensuite, nous avons réalisé une réimplantation antireflux bilatérale des uretères (technique de Politano-Leadbetter) par le tunnel sous-muqueux
- Enfin, nous avons extrait la pièce opératoire par l’incision de l’aine (ligne du bikini).
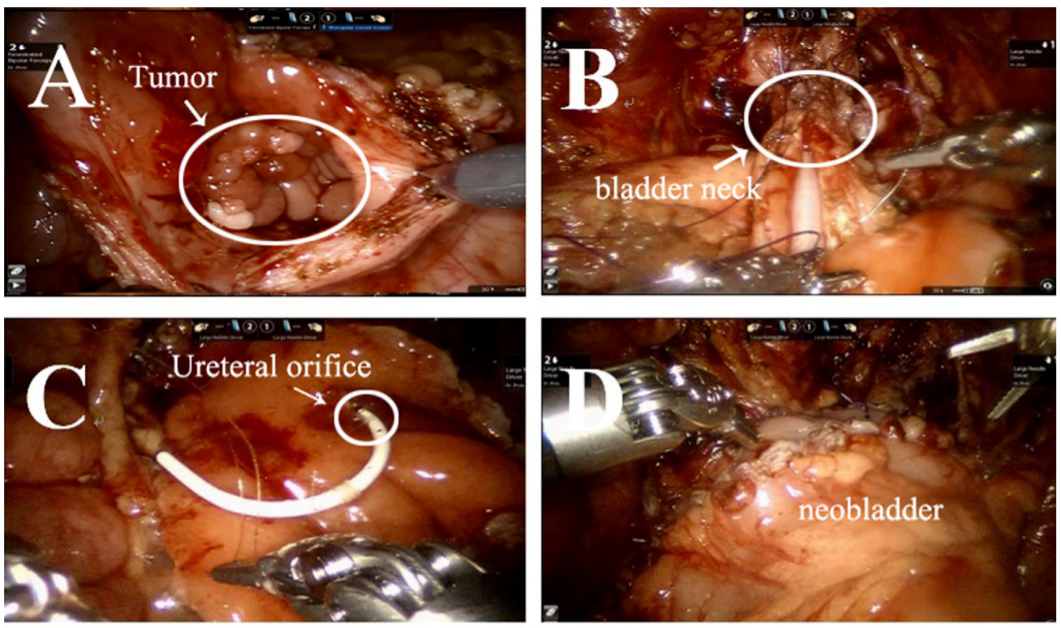
Figure 39 La procédure de cystectomie radicale avec reconstruction d’une néovessie orthotopique sigmoïdienne et réimplantation urétérale bilatérale
Autres applications
Nous avons également réalisé des laparoscopies robot-assistées pour des néphrectomies ou des chirurgies épargnant le néphron dans les tumeurs de Wilms, des résections de neuroblastome, des capsulotomies prostatiques et des reconstructions du canal déférent. Pour les cas d’hydronéphrose complexes, la technique de Yang-Monti et le remplacement urétéral par appendice ou par muqueuse buccale sont réalisés. Avec l’amélioration des instruments et des technologies, l’avenir de la chirurgie mini-invasive est prometteur.
Considérations
Pour la réimplantation, libérer l’uretère sur une longueur suffisante afin de réséquer adéquatement la lésion urétérale et d’assurer autant que possible une anastomose sans tension. En raison de l’absence de retour de force dans un système robot-assisté, un clampage excessif des tissus urétéraux doit être évité, et les tissus urétéraux environnants ainsi que leur vascularisation doivent être préservés. Nous devons veiller à maintenir des sutures symétriques lors de la réimplantation urétéro-vésicale afin de prévenir une torsion ou une angulation de l’uretère.
Si le diamètre de l’uretère dépasse 1,5 cm à vessie vide, il doit être rétréci, faute de quoi il est difficile d’établir une structure antireflux. La longueur du tunnel sous-muqueux de la vessie doit être d’environ 5 fois le diamètre de l’uretère afin de maintenir une pince relativement fixe comme support pour obtenir un effet antireflux satisfaisant.
Pour la pyéloplastie, le bassinet rénal doit être libéré plus largement, ce qui peut réduire la tension de l’anastomose, et l’uretère proximal doit être libéré le moins possible afin de minimiser le clampage direct de l’uretère par les instruments du système robotique et de préserver la vascularisation urétérale. Le premier point de suture est le plus important. Si le bassinet et l’uretère sont complètement séparés puis anastomosés, une déformation de l’uretère est susceptible de se produire. Par conséquent, l’orientation de l’axe rénal doit être déterminée avec précision en peropératoire. et le lambeau pyélique inférieur. Le point le plus déclive du bassinet rénal doit être anastomosé à la paroi latérale de l’uretère incisé longitudinalement.
Références
- WE. KJ. The evolution of laparoscopy and the revolution in surgery in the decade of the. 1990; 2 (4): 51.
- Cortesi N, Ferrari P, Zambarda E, Manenti A, Baldini A, Pignatti Morano F. Diagnosis of Bilateral Abdominal Cryptorchidism by Laparoscopy. Endoscopy 1976; 08 (01): 33–34. DOI: 10.1055/s-0028-1098372.
- Peters CA, Schlussel RN, Retik AB. Pediatric Laparoscopic Dismembered Pyeloplasty. J Urol 1995; 53 (6): 1962–1965. DOI: 10.1016/S0022-5347(01)67378-6.
- Blanco FC, Kane TD. Single-Port Laparoscopic Surgery in Children: Concept and Controversies of the New Technique. Minim Invasive Surg 2012; 2012 (232347): 1–5. DOI: 10.1155/2012/232347.
- Meininger DD, Byhahn C, Heller K, Gutt CN, Westphal K. Totally endoscopic Nissen fundoplication with a robotic system in a child. Surg Endosc 2001; 15 (11): 1360–1360. DOI: 10.1007/s00464-001-4200-3.
- OLSEN LH, JORGENSEN TM. Computer Assisted Pyeloplasty In Children: The Retroperitoneal Approach. J Urol 2004; 171 (6 Part 2): 2629–2631. DOI: 10.1097/01.ju.0000110655.38368.56.
- ATUG FATIH, WOODS MICHAEL, BURGESS SCOTTV, CASTLE ERIKP, THOMAS RAJU. Robotic Assisted Laparoscopic Pyeloplasty In Children. J Urol 2005; 174 (4 Part 1): 1440–1442. DOI: 10.1097/01.ju.0000173131.64558.c9.
- Lee RS, Retik AB, Borer JG, Peters CA. Pediatric Robot Assisted Laparoscopic Dismembered Pyeloplasty: Comparison With a Cohort of Open Surgery. Yearbook of Urology 2006; 2006 (2): 273–274. DOI: 10.1016/s0084-4071(08)70423-8.
- Hollis MV, Cho PS, Yu RN. Robot-Assisted Laparoscopic Pyeloplasty. Pediatric Robotic Urology 2015; 1: 109–121. DOI: 10.1007/978-1-60327-422-7_8.
- Andolfi C, Rodríguez VM, Galansky L, Gundeti MS. Infant Robot-assisted Laparoscopic Pyeloplasty: Outcomes at a Single Institution, and Tips for Safety and Success. Eur Urol 2021; 80 (5): 621–631. DOI: 10.1016/j.eururo.2021.06.019.
- Higganbotham C, Cook G, Rensing A. Bilateral Robot-Assisted Laparoscopic Orchiopexy for Undescended Testes. Urology 2021; 148 (314): 314. DOI: 10.1016/j.urology.2020.10.044.
- Rao PP. Robotic surgery: new robots and finally some real competition! World J Urol 2018; 36 (4): 537–541. DOI: 10.1007/s00345-018-2213-y.
- Peters BS, Armijo PR, Krause C, Choudhury SA, Oleynikov D. Review of emerging surgical robotic technology. Surg Endosc 2018; 32 (4): 1636–1655. DOI: 10.1007/s00464-018-6079-2.
Dernière mise à jour: 2025-09-22 07:59