6: Considérations relatives à l'anesthésie générale chez l'enfant
Ce chapitre prendra environ 31 minutes de lecture.
Introduction
Les procédures d’urologie pédiatrique couvrent un large éventail de types de patients, d’approches chirurgicales et un vaste spectre d’exigences et d’approches anesthésiques. Les plans anesthésiques peuvent varier, allant de l’anesthésie pour des interventions ambulatoires réalisées le jour même chez des patients en bonne santé présentant un problème urologique isolé, à des prises en charge plus impliquées et complexes.
L’anesthésie chez les patients médicalement complexes ou lorsque l’intervention chirurgicale comporte plusieurs étapes peut inclure une analgésie multimodale, diverses techniques de blocs anesthésiques neuraxiaux ou régionaux en plus de l’anesthésie générale et peut nécessiter une hospitalisation où des services de prise en charge de la douleur aiguë postopératoire peuvent être assurés. Les patients médicalement complexes peuvent bénéficier d’une visite à la clinique de préanesthésie ou d’optimisation préopératoire afin de s’assurer que toutes les informations de suivi sont à jour (p. ex., échocardiogramme et aval cardiologique chez les patients atteints de cardiopathie congénitale) et de permettre la réalisation en temps opportun de tout examen biologique ou d’imagerie nécessaire.
Une bonne communication préopératoire entre les équipes chirurgicale et anesthésique est idéale et peut comprendre tout besoin périopératoire particulier, l’admission postopératoire prévue ou des questions liées à la douleur.
Les parents ont peut-être consulté en ligne des informations sur l’anesthésie, ou ils peuvent avoir des questions à poser à l’urologue concernant les anesthésiques. On peut généralement rassurer ces parents en leur indiquant qu’ils s’entretiendront avec un professionnel de l’anesthésie le jour de l’intervention, ou en leur fournissant les coordonnées du groupe d’anesthésie pour toute question supplémentaire.
Évaluation préopératoire
Anxiolyse
L’anxiété préopératoire chez l’enfant peut entraîner une morbidité significative et des modifications du comportement postopératoires. Des données provenant des États-Unis et d’Europe ont montré que jusqu’à 54 % des patients présenteront une anxiété générale, des cauchemars, des pleurs nocturnes, une énurésie, une anxiété de séparation et des crises de colère pendant les 2 semaines suivant leur intervention chirurgicale. Certains enfants continuent de présenter des modifications comportementales inadaptées de 6 mois à 1 an après leur intervention. La qualité de leur expérience médicale est cruciale pour limiter les modifications comportementales postopératoires et diminuer l’anxiété lors des consultations ultérieures. Plusieurs méthodes sont disponibles pour aider à réduire l’anxiété préopératoire des patients et améliorer leur expérience périopératoire.1
Les agents pharmacologiques et les technologies de distraction peuvent tous deux être efficaces chez les enfants anxieux.2 L’anxiété de séparation débute vers l’âge d’un an. L’anxiété situationnelle atteint un pic chez l’enfant d’âge préscolaire. C’est pourquoi nous administrons un anxiolytique par voie orale (tel que du midazolam en solution buvable, 0.5–0.75 mg/kg) dans la salle d’attente préopératoire 15–30 minutes avant l’induction de l’anesthésie par inhalation afin d’optimiser le délai d’action du médicament. L’administration intranasale et intramusculaire d’agents pharmacologiques constituent d’autres options pour l’administration d’anxiolytiques.
Les enfants au développement normal sont généralement capables de rester assis pour la pose d’un cathéter intraveineux (IV) en salle d’attente préopératoire dans notre établissement après l’âge de 7 ans, il est donc plus habituel de proposer une induction IV aux enfants plus âgés, bien qu’une induction par inhalation puisse rester plus réalisable chez certains patients. Des spécialistes de l’accompagnement de l’enfant (personnes formées à distraire et à rassurer les enfants lors des visites médicales) sont disponibles pour enseigner des stratégies d’adaptation, proposer des jeux, décrire le processus d’induction et aider à la pose de l’IV. D’autres dispositifs peuvent être utilisés, comme de la lidocaïne tamponnée administrée par jet (crée une papule de peau insensibilisée grâce à de la lidocaïne sous pression, sans aiguille) à travers laquelle le cathéter IV peut être inséré, provoquant une douleur minimale. Des anesthésiques topiques peuvent également être appliqués sur la peau, si le temps le permet, pour réduire la douleur de la pose de l’IV.3
La présence parentale lors de l’induction peut également aider à réduire l’anxiété et à augmenter la satisfaction des parents. Certains parents peuvent préférer être présents quel que soit l’âge de leur enfant. Certaines populations de patients, comme ceux ayant un diagnostic de trouble du spectre de l’autisme, obtiennent parfois de meilleurs résultats lorsque des personnes familières, telles que les parents ou les soignants, sont présentes. Bien que la présence parentale lors de l’induction puisse être appropriée, des études ont montré que la prémédication pharmacologique pour traiter l’anxiété est supérieure à la présence parentale lors de l’induction. Un parent très anxieux ou présentant des comportements perturbateurs peut entraver le processus d’induction. En outre, la présence parentale lors de l’induction n’influence pas les modifications du comportement postopératoires, alors que le midazolam par voie orale a montré qu’il diminuait les manifestations comportementales négatives immédiates en postopératoire chez les jeunes enfants. La décision finale d’autoriser les parents à revenir au bloc opératoire doit être prise par l’équipe d’anesthésie après l’entretien préopératoire et la discussion du plan anesthésique. De manière générale, la présence parentale lors de l’induction a été déconseillée pendant la pandémie actuelle, sauf dans des circonstances très particulières.1
Affections aiguës
Maladies transmissibles
- Reporter les interventions programmées afin d’éviter de transmettre des maladies transmissibles à autrui.
- Varicelle : n’est plus contagieuse une fois que toutes les lésions cutanées sont croûtées.4,5
- Maladie mains-pieds-bouche : n’est plus contagieuse 3 semaines après la disparition de l’éruption.5,6
Infections respiratoires
Un dilemme fréquent en anesthésie pédiatrique consiste à déterminer s’il faut anesthésier un enfant bien portant ou un enfant malade. Certains agents pathogènes et l’hyperréactivité subséquente de la muqueuse des voies aériennes peuvent entraîner des complications lors de l’anesthésie. Après un rhume avec toux, ou une infection des voies aériennes supérieures (IVAS) non compliquée, la réactivité des voies aériennes peut demeurer élevée pendant plusieurs semaines. Notre politique est de reporter les interventions électives jusqu’à quatre semaines après la résolution complète des symptômes d’une IVAS, ou six semaines après les symptômes d’une infection des voies respiratoires inférieures (IVRI), telle qu’une infection à virus respiratoire syncytial (VRS), une grippe ou une pneumonie. Cela permet à la réactivité des voies aériennes de revenir à son niveau basal et réduit le risque de complications anesthésiques peropératoires telles que le bronchospasme, le laryngospasme, l’hypoxie et une admission postopératoire non planifiée.7,8
En général, les symptômes d’IVRS et d’IVRI sont identifiés lors de l’appel téléphonique de dépistage préopératoire et les cas peuvent être annulés avec suffisamment de temps pour combler le créneau dans le programme opératoire. Mais que faire du patient qui se présente actuellement pour son intervention en unité de préopératoire et qui a « tout » juste développé un nez qui coule, de la fièvre, une toux, ou un ensemble de nouveaux symptômes ? Certains aspects d’une IVRS, tels qu’un écoulement nasal verdâtre, des sifflements à l’auscultation pulmonaire, ou une fièvre dans les 48 heures, augmentent suffisamment le risque relatif d’événements des voies aériennes pour que l’annulation le jour de la chirurgie soit une décision facile.9 Cependant, la situation n’est pas toujours aussi tranchée, par exemple en présence d’une rhinorrhée claire isolée et d’une toux sèche occasionnelle. Le patient a peut-être déjà réalisé des examens préopératoires; les parents ont peut-être pris un jour de congé; l’enfant est peut-être à jeun de manière appropriée; et les annulations le jour de l’intervention sont contraignantes pour toutes les personnes impliquées. Dans notre pratique, nous évaluons chaque enfant au cas par cas, la sécurité étant notre objectif principal, en écartant des signes de maladie franche tels qu’une fièvre active, et en prenant en compte l’urgence de l’intervention chirurgicale ainsi que toute circonstance atténuante, par exemple lorsqu’un long trajet a été effectué, ou lorsque l’enfant est fréquemment malade au point qu’il peut être presque impossible de trouver une période de quatre semaines de convalescence sans symptômes, ou lorsque le congé professionnel parental pour s’occuper de l’enfant est limité, ce qui pourrait rendre la reprogrammation du cas particulièrement difficile. Nous associons également les parents au processus décisionnel, en les informant que, bien que le risque absolu global soit faible, l’anesthésie dans le contexte d’une infection des voies respiratoires supérieures active peut comporter plus de risques que chez un enfant en bonne santé. La stratification du risque selon le type et la durée des symptômes et selon les facteurs de risque du patient tels que l’exposition passive à la fumée, l’âge et l’asthme, est étayée par la littérature, avec des recommandations générales consistant à poursuivre en présence de symptômes légers chez les patients à faible risque et à reprogrammer en cas de symptômes significatifs chez ceux qui présentent un risque plus élevé.1
SRAS-CoV-2
Une étude de cohorte rétrospective menée dans un grand hôpital pédiatrique universitaire a révélé que chaque enfant ayant un test SARS-CoV-2 positif dans les 10 jours précédant une intervention présentait une incidence beaucoup plus élevée de complications respiratoires (11,8 % contre 1,0 %, IC à 95 % 1,6–19,8 %, p = 0,003) par rapport à des témoins appariés. Compte tenu du risque supplémentaire de transmission pour les autres patients à proximité et pour le personnel soignant, nous recommandons de dépister systématiquement le SARS-CoV-2 en préopératoire chez tous les patients et de reprogrammer les interventions programmées en cas de test COVID-19 nouvellement positif.10
Asthme
Les interventions chirurgicales programmées doivent être reportées jusqu’à ce que le traitement des patients dont le contrôle des symptômes est insuffisant ait été optimisé. Les interventions chez les patients présentant une exacerbation aiguë de l’asthme doivent être reportées pendant les 4 semaines suivant la résolution et le retour à l’état basal. Les patients doivent utiliser régulièrement leur traitement de fond de l’asthme dans les semaines et les jours précédant l’anesthésie.11,12
Comorbidités médicales
Selon la présentation clinique de l’affection (aiguë, subaiguë, chronique) et l’urgence d’une intervention chirurgicale, le patient d’urologie pédiatrique peut être en parfaite santé ou présenter un éventail de troubles hémodynamiques, de déséquilibres électrolytiques et de dysfonction d’organe.
Les patients présentant des comorbidités médicales complexes devraient être vus en consultation préopératoire afin de s’assurer que leurs affections médicales ont été contrôlées de manière optimale avant la chirurgie. Une orientation précoce vers la consultation préopératoire permet de disposer de suffisamment de temps pour initier efficacement un programme d’optimisation et pour gérer les risques modifiables. Les patients recevant un traitement d’entretien pour leurs affections médicales chroniques doivent poursuivre ces traitements pendant la période périopératoire.13,14
Recommandations de jeûne préopératoire
Il existe des lignes directrices visant à réduire le risque d’aspiration pulmonaire chez les patients recevant des médicaments qui diminuent les réflexes protecteurs des voies aériennes. La Société américaine des anesthésiologistes recommande un jeûne de 8 heures pour les aliments solides gras avant la chirurgie. Les recommandations de jeûne pour les repas légers, toute boisson non claire, le lait non maternel et la nutrition entérale artificielle sont de 6 heures. Le lait maternel doit être arrêté 4 heures avant l’anesthésie, et les liquides clairs 2 heures avant.15 La Société canadienne des anesthésiologistes a des lignes directrices similaires, mais la Société canadienne d’anesthésie pédiatrique encourage désormais les enfants à prendre des liquides clairs jusqu’à une heure avant la chirurgie.16 Les recommandations de jeûne de la Société européenne d’anesthésiologie interdisent les aliments solides 6 heures avant la chirurgie et encouragent les patients adultes à prendre des liquides clairs jusqu’à 2 heures et les patients pédiatriques à prendre des liquides clairs jusqu’à 1 heure avant la chirurgie.17
Des préoccupations ont été soulevées quant au fait que les recommandations concernant les liquides clairs pourraient être trop rigides et contribuer à de mauvais résultats. En raison de l’imprévisibilité des blocs opératoires, un jeûne de 2 heures pour les liquides clairs se traduit en réalité par une période de jeûne beaucoup plus longue. Un jeûne prolongé peut accroître l’inconfort et entraîner des effets physiologiques et métaboliques délétères. Il est également difficile de faire respecter les recommandations de jeûne chez les jeunes enfants. Les partisans de l’échographie gastrique ont suggéré que la mesure du contenu gastrique pourrait être plus fiable que les seules consignes de jeûne. Une échographie gastrique devrait être réalisée avant d’annuler ou de retarder une intervention en raison d’un non-respect du NPO.
Considérations anesthésiques
Anesthésie générale versus rachianesthésie
Réalisation de l’anesthésie rachidienne
La rachianesthésie est une bonne option anesthésique pour les patients subissant des interventions situées au-dessous de l’ombilic.18 Sur le plan technique, il n’existe pas de limite d’âge pour une rachianesthésie. Cependant, en dehors de la période néonatale et du nourrisson, une rachianesthésie isolée a peu de chances d’être possible sans anxiolytiques ou sédation, compte tenu du développement cognitif des patients et de leur incapacité à coopérer lors de la mise en place de la rachianesthésie et de l’intervention chirurgicale. Les anciens prématurés présentent souvent des antécédents d’apnée de la prématurité, de dysplasie bronchopulmonaire et de maladie pulmonaire chronique. Leur risque d’apnée postopératoire est en outre augmenté par rapport aux nourrissons nés à terme.19 Lorsque cela est possible, une rachianesthésie permettrait de réduire les risques potentiels associés à l’anesthésie générale, tels que la neurotoxicité, l’apnée et les événements cardiopulmonaires indésirables. La rachianesthésie doit être envisagée chez les patients pour lesquels l’anesthésie générale peut comporter un risque accru, par exemple en cas de dysmorphie faciale, de voie aérienne difficile, de dystrophie musculaire ou d’antécédents familiaux d’hyperthermie maligne.
Les modifications hémodynamiques secondaires à une sympathectomie induite par une anesthésie rachidienne ou péridurale, fréquentes chez l’adulte, ne sont pas observées chez les jeunes enfants. Les enfants ont un système nerveux sympathique relativement immature et dépendent moins du tonus vasomoteur pour maintenir la pression artérielle. En outre, ils présentent une capacitance veineuse des membres inférieurs plus faible et donc moins de stase veineuse.
Contre-indications à l’anesthésie rachidienne
La rachianesthésie est limitée aux interventions chirurgicales d’une durée de 90 minutes ou moins. Les enfants ont un volume de liquide céphalo-rachidien (LCR) plus important et un renouvellement du LCR plus rapide que les adultes. Compte tenu de cette différence, la rachianesthésie dure généralement plus longtemps chez les enfants plus âgés et les adultes que chez les nouveau-nés et les nourrissons. Une rachianesthésie en injection unique dure généralement 60 à 90 minutes et peut être prolongée jusqu’à 120 minutes si elle est associée à un bloc caudal.
Les contre-indications comprennent les coagulopathies, une infection systémique ou une infection locale au site de ponction, une hypovolémie non corrigée, le refus parental et un patient non coopératif. Les anomalies neurologiques telles que le spina bifida et l’hypertension intracrânienne constituent également des contre-indications à l’anesthésie rachidienne.
Complications
Les complications suivant la rachianesthésie comprennent une ponction traumatique entraînant un saignement, une douleur et des lésions des structures entourant le site de ponction. Avec des techniques d’asepsie rigoureuses, l’incidence des complications infectieuses graves telles que la méningite est très faible.20 Une insuffisance respiratoire et cardiovasculaire peut résulter d’une rachianesthésie haute. Des lésions neurologiques et une toxicité des anesthésiques locaux peuvent survenir respectivement en raison de l’injection d’une solution inappropriée ou d’une dose incorrecte d’anesthésique local. La céphalée post-ponction durale (CPPD) est une autre complication de la rachianesthésie. Cependant, l’incidence de la CPPD est inconnue chez les jeunes enfants, en raison de la difficulté à évaluer les céphalées dans cette population.
Considérations laparoscopiques et robotiques
Les approches urologiques robotiques et laparoscopiques sont de plus en plus fréquentes.21 Ces approches entraînent des modifications particulières de la ventilation, du retour veineux, de l’hémodynamique et de la perfusion des organes abdomino-pelviens pendant l’intervention. Une anesthésie générale avec intubation endotrachéale est nécessaire pour ce type d’intervention, car les patients éveillés ne tolèrent pas l’insufflation péritonéale. En outre, les interventions laparoscopiques nécessitent généralement une relaxation musculaire afin d’optimiser les conditions chirurgicales. Le pneumopéritoine contribue souvent à une oligurie ou une anurie réversibles, ainsi qu’à des modifications hémodynamiques et respiratoires similaires à celles observées lors de la laparoscopie chez l’adulte.
Tableau 1 Modifications physiologiques en réponse à la laparoscopie. CVP: pression veineuse centrale; CO: débit cardiaque; MAP: pression artérielle moyenne; SVR: résistance vasculaire systémique; FRC, capacité résiduelle fonctionnelle; TLV, volume pulmonaire total; VTE, thromboembolie veineuse. Source: Miller RD et al. Miller’s Anesthesia 7e. Ch: Anesthésie pour la chirurgie laparoscopique (ch. 68) pages 2185-2193.22
| Système organique | Intervention | Effets | Traitement |
|---|---|---|---|
| Cardiovasculaire | Position tête en bas | Augmentation de la CVP, augmentation du CO | Réduire l’inclinaison |
| Position tête en haut | Diminution de la CVP, de la MAP | Réduire l’inclinaison | |
| Insufflation | Réflexe barorécepteur → bradycardie réflexe ou asystolie | Réduire ou arrêter l’insufflation, traiter la fréquence cardiaque | |
| Augmentation de la SVR | Réduire l’inclinaison tête en haut, utiliser des vasodilatateurs, approfondir l’anesthésie | ||
| Respiratoire | Insufflation, positionnement tête en bas | Atélectasie → diminution de la FRC, du TLV, de la compliance pulmonaire → hypoxémie, hypercarbie | Augmenter les paramètres ventilatoires, diminuer les pressions d’insufflation, réduire l’inclinaison tête en bas |
| Neurologique | Positionnement tête en bas | Élévation des pressions cérébrale et intraoculaire chez les patients ayant une faible compliance intracrânienne | Réduire l’inclinaison vers le bas |
| Rénal | Insufflation | Oligurie, anurie | Typiquement réversible et transitoire une fois l’insufflation relâchée |
| Endocrinien | Insufflation | Augmentation des catécholamines, des hormones du stress | Approfondir l’anesthésie, traiter adéquatement les stimuli douloureux |
| Vasculaire | Positionnement (surtout en position de lithotomie) et insufflation | Stase veineuse dans les jambes → risque accru de TEV | Utilisation de dispositifs anti-TEV, changements périodiques de positionnement |
Anesthésie régionale
Injections épidurales uniques
L’anesthésie caudale est une technique bien établie avec un long historique de sécurité (Polaner et al—étude PRAN). Les bénéfices d’une anesthésie caudale comprennent une diminution des besoins en antalgiques peropératoires et postopératoires, une diminution de la réponse hormonale au stress et une augmentation de la satisfaction globale du patient et de ses parents.23
Les blocs caudaux consistent en l’injection d’un anesthésique local dans l’espace épidural, accessible par le hiatus sacré. Les repères osseux du hiatus sont généralement palpables chez les jeunes patients pédiatriques ou visualisés à l’échographie.
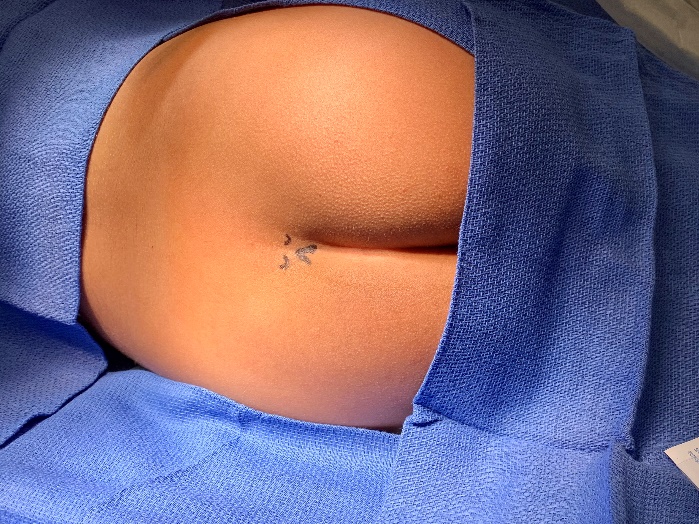
Figure 1 Approche anatomique du bloc caudal par palpation des repères osseux. Palpation des repères osseux lors de l’utilisation d’une approche anatomique. Anatomie externe : cornes sacrées et hiatus sacré.
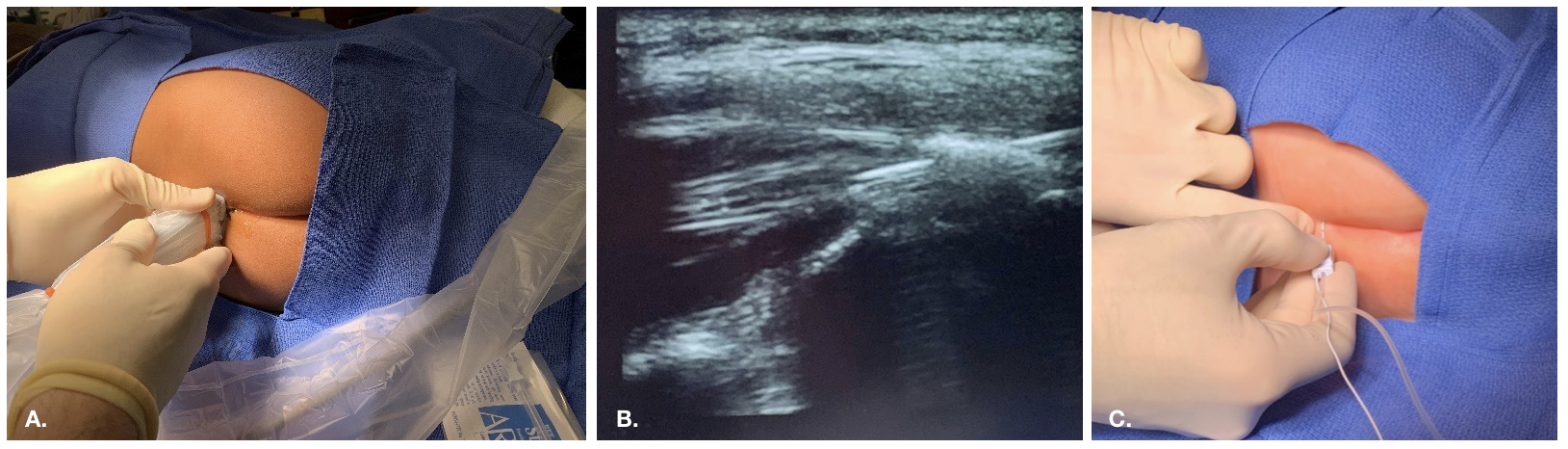
Figure 2 Approche échoguidée du bloc caudal
Figure 3 Mise en place épidurale guidée par fluoroscopie chez un patient présentant des modifications anatomiques et post-chirurgicales complexes
Contre-indications au bloc caudal
Les contre-indications comprennent le dysraphisme spinal (p. ex., syndrome de la moelle attachée), une infection au site d’injection ou un kyste pilonidal, le refus du patient et un risque (relatif) accru de saignement.
Les blocs caudaux, bien que généralement simples, non compliqués et efficaces, s’accompagnent d’un certain taux d’échec, même entre des mains expérimentées. L’échec survient le plus souvent en raison d’une localisation anatomique inappropriée de l’injectat (p. ex., sous-cutanée, intravasculaire), qui peut initialement passer inaperçue.
Complications du bloc caudal
Les risques comprennent l’hémorragie, l’infection, les lésions nerveuses, la ponction durale accidentelle et la céphalée post-ponction durale, la réaction allergique et la toxicité des anesthésiques locaux. L’événement indésirable le plus fréquent est l’impossibilité de réaliser un bloc ou l’échec du bloc.20
Limite d’âge
Bien que certains centres limitent les blocs caudaux aux populations non ambulantes (nourrissons), les blocs caudaux peuvent aussi être sûrs et efficaces chez des enfants plus âgés. Dans notre pratique pédiatrique, nous réalisons souvent des blocs caudaux chez des enfants plus âgés, en fonction de la morphologie, pour des interventions où un contrôle de la douleur de niveau sacré est souhaitable (p. ex., circoncision). Chez les enfants plus grands (plus de 50 kg) ou plus âgés, une épidurale lombaire monodose au niveau concerné est généralement simple, mais peut présenter une épargne sacrée en raison de la taille relativement importante des racines nerveuses sacrées, et est donc plus idéalement adaptée à une analgésie de niveau lombaire (p. ex., pour une incision de Pfannenstiel).2,24 Des études chez l’adulte suggèrent un taux d’injection intravasculaire accidentelle plus élevé que prévu lorsque l’on réalise une épidurographie caudale de confirmation.25 Des modifications anatomiques de la morphologie, l’ossification de la membrane sacrococcygienne et des changements de l’espace épidural peuvent également conduire à privilégier un point d’accès au niveau de la colonne lombaire ou thoracique pour les blocs neuraxiaux chez les enfants plus âgés et de plus grande taille ainsi que chez les adultes.
Taux de complications de l’hypospadias
La cure de l’hypospadias est une intervention urologique courante chez les jeunes garçons. Les rapports publiés se sont principalement intéressés à l’impact des techniques chirurgicales et de la gravité des anomalies sur l’incidence des complications chirurgicales. Ces dernières années, des rapports controversés ont été publiés concernant l’effet de la technique anesthésique sur le taux de complications postopératoires telles que la fistule uréthrocutanée ou la désunion glandulaire.
Dans une étude randomisée comparant l’efficacité du bloc pénien et de l’anesthésie caudale pour les réparations de l’hypospadias, Kundra et al ont noté incidemment une incidence accrue de fistule urétrocutanée chez les patients ayant reçu un bloc caudal.26 Il est important de noter le petit effectif de 54, et que les enfants de cette étude étaient âgés de 4 à 12 ans; un âge plus élevé que celui actuellement recommandé pour la réparation de l’hypospadias. Certaines études ont mis en évidence qu’un âge plus avancé du patient constitue un facteur de risque de complications.27,28 En outre, l’intervention a été réalisée à la fois par des chirurgiens urologues et des chirurgiens plasticiens, et les techniques opératoires étaient différentes dans le groupe bloc caudal par rapport au groupe bloc pénien.
Taicher et al., dans une revue des réparations primaires de l’hypospadias réalisées par un seul chirurgien entre 2001 et 2014, ont constaté que les complications étaient associées aux blocs caudaux, à l’hypospadias proximal, à une durée opératoire prolongée et aux premières années de pratique du chirurgien.29 Après ajustement des facteurs de confusion par une analyse de régression logistique multivariée, ils ont conclu que les blocs caudaux et l’hypospadias proximal demeuraient fortement associés aux complications postopératoires. Les auteurs ont toutefois noté l’utilisation systématique de lidocaïne avec adrénaline par leur chirurgien lors de toutes les interventions, sauf dans les cas glandulaires minimaux. Cependant, comme les informations sur l’utilisation de l’adrénaline sous-cutanée n’étaient pas saisies de manière constante dans leur base de données, ils ne peuvent pas dire si elle a joué un rôle dans leurs résultats.
Zaidi et al ont constaté que la localisation de l’orifice urétral (proximal >corps pénien distal) était fortement associée au développement d’une fistule uréthrocutanée. Contrairement à Taicher et al., leur analyse d’un sous-groupe ayant bénéficié d’une réparation tubulisée de l’orifice urétral distal n’a révélé aucune association entre la formation de fistule et l’utilisation de blocs caudaux, mais a trouvé une association entre la formation de fistule et l’utilisation d’adrénaline sous-cutanée.29,30 De même, Barga et al n’ont mis en évidence, après analyse multivariée, qu’une association entre l’hypospadias proximal et la formation de fistule.31
Une revue systématique et méta-analyse d’études observationnelles non randomisées n’a pas mis en évidence d’association entre les blocs caudaux et les complications postopératoires.32 L’avantage d’une méta-analyse est sa capacité à augmenter le nombre d’observations et donc la puissance statistique. Mais il faut garder à l’esprit que la méta-analyse est limitée par les biais et les limitations des données sources.
Les blocs caudaux, comparés au bloc du nerf pénien (PNB), étaient associés à un taux plus faible de reprise chirurgicale pour hypospadias, malgré des rapports antérieurs suggérant le contraire.33
Le mécanisme par lequel les blocs caudaux pourraient contribuer aux complications postopératoires reste incertain. Il a été émis l’hypothèse que la stase sanguine secondaire à la sympathicolyse entraîne une congestion pénienne, un œdème postopératoire et une mauvaise cicatrisation.26 D’autres soutiendraient qu’une augmentation du flux sanguin artériel secondaire au bloc caudal diminue l’ischémie tissulaire.33
Cathéter péridural
Pour les procédures douloureuses nécessitant une hospitalisation, ou chez certains patients pour lesquels une analgésie neuraxiale de plus longue durée est souhaitable, la mise en place d’un cathéter caudal ou péridural est avantageuse pour augmenter la durée du contrôle locorégional de la douleur. Dans notre établissement, beaucoup de nos patients seront “fast tracked” après une réparation programmée (p. ex., sortie au jour 1 postopératoire) telle qu’une réimplantation urétérale à ciel ouvert, et reçoivent plus fréquemment des blocs caudaux à injection unique avec un adjuvant pour prolonger le bloc. Les patients ayant des réparations plus complexes et nécessitant un séjour postopératoire plus long, ou ceux ayant des antécédents de difficultés de contrôle de la douleur, font l’objet d’une discussion entre le service d’urologie et l’équipe d’anesthésie-douleur aiguë avant la chirurgie et reçoivent des cathéters périduraux. Cela permet une perfusion continue d’anesthésique local en postopératoire. La perfusion péridurale peut être interrompue afin de déterminer si le patient est capable de gérer sa douleur avec un schéma oral avant la sortie. Si l’essai est concluant, le cathéter peut être retiré, généralement la veille de la sortie.
Blocs du tronc
Le bloc du nerf ilio-inguinal est une option pour les interventions inguino-scrotales unilatérales lorsque le bloc caudal n’est pas approprié en raison de l’âge, de difficultés anatomiques ou d’un refus du patient. La réalisation du bloc avant l’incision est préférable, car elle permettrait de réduire l’utilisation d’antalgiques intraveineux peropératoires. Cependant, l’infiltration d’un anesthésique local peut altérer les repères anatomiques pour le chirurgien.
Médicaments et adjuvants des blocs régionaux
Les anesthésiques locaux les plus couramment utilisés dans notre pratique d’anesthésie locorégionale pédiatrique sont la ropivacaïne et la bupivacaïne, tous deux utilisés à 0,125–0,25 %, et administrés le plus souvent à raison de 1 mL/kg pour obtenir un niveau d’analgésie sacré. En général, nous utilisons au minimum de l’adrénaline comme adjuvant, ce qui sert aussi à indiquer si une injection intravasculaire involontaire s’est produite. L’adrénaline utilisée en adjuvant, en cas d’injection intravasculaire, augmente la fréquence cardiaque du patient et provoque parfois des modifications de l’ECG lors d’une “dose d’épreuve” (c.-à-d. une petite quantité de l’anesthésique local contenant de l’adrénaline, injectée en premier, puis suivie d’une courte période d’attente afin de rechercher toute modification de l’ECG ou des paramètres vitaux).
Pour obtenir un niveau de blocage plus élevé, on peut utiliser un volume d’injectat supplémentaire en diluant la concentration d’anesthésique local (par exemple, 1 cc/kg d’anesthésique local plus 0.5 cc/kg de diluant tel qu’une solution de sérum physiologique sans conservateur).
Les adjuvants les plus couramment associés aux anesthésiques locaux dans notre pratique sont la clonidine (généralement 1 mcg/kg), le fentanyl (1 mcg/kg) et l’hydromorphone (5–10 mcg/kg). Une association entre l’utilisation d’opioïdes par voie caudale et une augmentation des nausées et vomissements postopératoires a été observée.34 Il n’existe pas de différence significative de durée d’action ni d’événements indésirables lors de l’utilisation de la clonidine par rapport à la morphine (sans conservateur) comme adjuvant. Ainsi, nous limitons l’utilisation d’un opioïde comme adjuvant (avec ou sans clonidine) aux patients qui présentent un risque plus faible de développer des nausées et vomissements postopératoires et qui sont susceptibles de bénéficier davantage d’une prolongation de la durée du bloc (p. ex., incision plus large, interventions plus douloureuses). La clonidine est généralement évitée dans la population néonatale en raison du risque d’apnée et de bradycardie.
L’utilisation de la dexmédétomidine comme adjuvant de l’anesthésie caudale a été associée à des scores de sédation plus élevés et à une incidence accrue de bradycardie.35
Analgésie multimodale
L’analgésie multimodale associe l’utilisation d’un bloc nerveux, d’opioïdes et d’antalgiques non opioïdes afin d’optimiser le contrôle de la douleur.
AINS
Malgré l’absence de preuves solides à grande échelle concernant son efficacité, le kétorolac est probablement sûr et est actuellement largement utilisé en période périopératoire.36 Le kétorolac est indiqué, pour un usage de courte durée uniquement, dans les affections douloureuses aiguës. Il n’est pas indiqué pour les douleurs légères et est contre-indiqué chez les patients présentant une maladie rénale avancée et chez ceux insuffisamment réanimés sur le plan volémique. L’utilisation à la dose efficace la plus faible (p. ex., 0,5 mg/kg IV ou moins) est associée à une analgésie équivalente à celle obtenue avec des doses plus élevées, mais avec des effets indésirables minimes. Le kétorolac doit également être évité chez les patients à haut risque hémorragique ou présentant une maladie ulcéreuse gastro-intestinale. Les pratiques des anesthésiologistes varient, mais la littérature récente suggère que son utilisation chez les nouveau-nés en bonne santé (âgés d’au moins 3 semaines et non prématurés) et chez les nourrissons n’est pas associée à une augmentation des effets indésirables.37,38
Paracétamol
L’acétaminophène est l’analgésique non opioïde le plus utilisé dans la population pédiatrique pour traiter les douleurs légères à modérées. Il est disponible sous diverses formulations et concentrations et peut être administré par voie orale, rectale et intraveineuse. La posologie varie selon la voie d’administration, l’âge du patient et la formulation intraveineuse disponible. L’acétaminophène présente un faible risque d’effets indésirables graves. L’hépatotoxicité est le principal effet indésirable grave et est le plus souvent associée à un surdosage, intentionnel ou non intentionnel.39 L’administration doit être évitée chez les patients présentant des vomissements prolongés, un jeûne prolongé, une déshydratation et une atteinte hépatique.40
Préoccupations postopératoires
NVPO
Un effet indésirable fréquent et potentiellement évitable de la chirurgie et de l’anesthésie est la survenue de nausées et vomissements postopératoires (NVPO). Les NVPO peuvent entraîner un inconfort important ainsi qu’une diminution de la satisfaction des patients.41 La thérapie combinée est plus efficace que la monothérapie. Les considérations anesthésiques visant à réduire le risque de NVPO comprennent l’anesthésie régionale et l’analgésie multimodale afin de réduire le recours aux opioïdes périopératoires, une hydratation préopératoire adéquate en minimisant les durées de jeûne, une hydratation peropératoire adéquate, l’évitement des anesthésiques volatils et un traitement prophylactique par des agents pharmacologiques.42,43
Table 2 Facteurs de risque de nausées et vomissements postopératoires chez les patients pédiatriques. Les facteurs de risque majeurs sont en gras et il a été démontré qu’ils s’additionnent.44
| Patient | Chirurgical | Anesthésique |
|---|---|---|
| Sexe féminin après la puberté | Chirurgie du strabisme | Utilisation d’agents volatils |
| Antécédents de NVPO ou de mal des transports | Interventions sur l’oreille | Utilisation de protoxyde d’azote |
| Âge > 3 ans | Amygdalectomie/adénoïdectomie | Utilisation d’opioïdes |
| Orchidopexie | Durée de l’anesthésie > 30 minutes | |
| Cure de hernie |
Tableau 3 Agents pharmacologiques pour la prophylaxie des nausées et vomissements postopératoires. L’ondansétron et la dexaméthasone sont les deux agents les plus couramment utilisés dans la population pédiatrique.42 Le patch transdermique de scopolamine n’est généralement pas utilisé chez les enfants de moins de 12 ans. Le British National Formulary for Children recommande l’utilisation d’un quart de patch de l’âge de 1 mois à 3 ans et d’un demi-patch de 3–10 ans. Le métoclopramide peut également provoquer une dyskinésie tardive.
| Médicament | Site d’action | Posologie | Effets indésirables |
|---|---|---|---|
| Ondansétron | Antagoniste de la sérotonine 5-HT3 | 0.1–0.15mg/kg IV (maximum 4 mg) | Allongement de l’intervalle QT |
| Dexaméthasone | Mal élucidé | 0.15 mg/kg IV | Syndrome de lyse tumorale |
| Scopolamine | Antagoniste de l’acétylcholine M-1 | 1.5 mg patch transdermique | Sécheresse buccale, troubles visuels, sédation |
| Aprépitant | Antagoniste de la neurokinine-1 | 1 mg/kg PO (maximum 40 mg) | Rare |
| Lorazépam | Agoniste du GABA | 0.05 mg/kg IV (maximum 2 mg) | Sédation |
| Diphénhydramine | Antagoniste de l’histamine H-1 | 1 mg/kg IV (maximum 50 mg) | Sédation |
| Métoclopramide | Antagoniste de la dopamine D-2 | 0.1–0.25 mg/kg IV (maximum 20 mg) | Allongement de l’intervalle QT |
Apnée
Il a été constaté que les anciens prématurés présentent un risque accru d’apnée postopératoire. Le risque d’apnée diminue chez les patients nés à un âge gestationnel plus avancé. Cote et al ont montré dans leur étude de référence que l’incidence de l’apnée est fortement liée à l’âge gestationnel et à l’âge post-conceptionnel, et que l’incidence globale est nettement diminuée après 43 semaines d’âge post-conceptionnel. Chez les patients nés à 35 semaines d’âge gestationnel, l’incidence de l’apnée diminue à moins de 5 % après 48 semaines d’âge post-conceptionnel et à moins de 1 % après 54 semaines d’âge post-conceptionnel. Chez ceux qui sont nés à 32 semaines, ils ont observé une diminution de l’incidence de l’apnée à moins de 5 % et à moins de 1 % après un âge post-conceptionnel de 50 semaines et 56 semaines, respectivement.19
L’anesthésie générale peut révéler des anomalies du contrôle ventilatoire et, par conséquent, une propension à l’apnée qui n’avait pas été auparavant observée chez un ancien prématuré ou même chez un nourrisson né à terme. L’anesthésie générale diminue le tonus musculaire, entraînant une obstruction des voies aériennes supérieures qui contribue à l’apnée; il est donc raisonnable de déduire que l’anesthésie rachidienne réduirait le risque d’apnée. Davidson et al ont également constaté que la prématurité était le facteur prédictif le plus fort de l’apnée. Ils ont observé, avec une anesthésie rachidienne en état d’éveil par rapport à l’anesthésie générale, une diminution des épisodes d’apnée dans les 30 premières minutes, une baisse du degré de désaturation et du niveau d’intervention nécessaires lors des épisodes d’apnée. Ils n’ont pas trouvé de différence dans l’incidence des apnées tardives (apnée survenant entre 30 minutes et 12 heures après l’anesthésie). Néanmoins, leur essai n’incluait pas les nourrissons nés extrêmement prématurés (avant 26 semaines de gestation) ni ceux présentant des comorbidités significatives. Il est possible que les bénéfices de l’anesthésie rachidienne sur l’apnée soient différents dans ces populations.45
Compte tenu de ce qui précède, les nourrissons devant subir des procédures nécessitant une anesthésie (sédation, anesthésie rachidienne et anesthésie générale) devraient être hospitalisés pour surveillance. L’hospitalisation devrait durer au moins 23 heures après l’anesthésie et inclure une oxymétrie de pouls continue. Les exigences en matière d’admission varient d’un établissement à l’autre. Notre établissement exige de façon prudente une hospitalisation post-anesthésique pour les nourrissons ayant des antécédents de prématurité (nés à < 37 semaines d’âge gestationnel) qui ont moins de 60 semaines d’âge post-conceptionnel. Pour les nourrissons nés à terme par ailleurs en bonne santé, l’admission après anesthésie n’est pas requise au-delà de 44 semaines d’âge post-conceptionnel. Les enfants présentant des comorbidités importantes doivent être évalués au cas par cas.
Complications inattendues
Les parents devraient toujours se préparer à d’éventuelles hospitalisations, en particulier chez les patients âgés de moins de 60 semaines d’âge post-conceptionnel. De plus, les patients présentant des symptômes respiratoires récents ou actuels, même légers, peuvent nécessiter une hospitalisation secondaire à une hyperréactivité des voies aériennes.
Mise à jour sur l’anesthésie pédiatrique et la neurotoxicité
Des préoccupations persistantes existent concernant la neurotoxicité induite par l’anesthésie dans le cerveau en développement. Comment mettre en balance les risques potentiels associés à l’anesthésie et le moment optimal des interventions chirurgicales ? Dans des modèles animaux, y compris chez les primates non humains, l’exposition à des agents anesthésiques généraux couramment utilisés, tels que des agents volatils halogénés, le propofol et la kétamine, entraîne un éventail de modifications morphologiques et fonctionnelles. Chez les animaux exposés, on a observé une mort cellulaire neuronale apoptotique, une mort gliale, une neurogenèse altérée et une formation axonale anormale. Chez certains, une exposition durant la petite enfance a été associée à des comportements altérés et à des atteintes de l’apprentissage et de la mémorisation persistant jusqu’au début de l’âge adulte. L’exposition semble dépendre de la dose, de la durée d’exposition et du sexe. Par rapport à leurs homologues femelles, les rongeurs mâles ont présenté une altération de l’apprentissage et de la mémoire contextuels malgré une mort neuronale comparable.46 Cependant, il est difficile de transposer les résultats des modèles animaux à l’être humain, car les doses utilisées dans ces études sont significativement plus élevées que celles généralement utilisées chez l’être humain.47
Il existe des données mitigées, provenant d’études de cohorte et rétrospectives, selon lesquelles les jeunes enfants exposés à l’anesthésie présentent un risque accru d’issues neurodéveloppementales défavorables. Certaines études ont suggéré une augmentation du risque de troubles du développement comportemental en cas d’expositions multiples, mais pas lors d’une exposition unique. DiMaggio et al ont réalisé une méta-analyse d’études sélectionnées publiées entre 2008 et 2012 et ont conclu que les résultats indiquaient un risque modeste, mais accru.48
O’Leary et al ont mené une étude de cohorte basée sur la population en Ontario, au Canada, en reliant des bases de données administratives provinciales de santé aux résultats de développement des enfants mesurés par l’Early Development Instrument (EDI). Les enfants ayant subi une chirurgie avant la passation de l’EDI (âge de 5 à 6 ans) ont été appariés à des enfants non exposés. Le critère de jugement principal était la vulnérabilité développementale précoce, définie comme tout domaine de l’EDI situé dans le décile inférieur de la population. Des analyses de sous-groupes ont été réalisées selon l’âge lors de la première chirurgie (moins de 2 ans et supérieur ou égal à 2 ans) et la fréquence des interventions chirurgicales. Les auteurs ont conclu que les enfants ayant subi une chirurgie avant l’âge de l’école primaire présentaient un risque accru de vulnérabilité développementale précoce, mais l’ampleur de la différence entre les enfants exposés et non exposés était faible. Un âge inférieur à 2 ans lors de la première exposition et des expositions multiples à la chirurgie n’étaient pas des facteurs de risque d’issues développementales défavorables.49
Une étude de population en Australie a également constaté que, parmi les enfants sans troubles neurodéveloppementaux préexistants connus, ceux exposés à une anesthésie générale avant l’âge de 4 ans présentaient des scores réduits en lecture et en numératie (mathématiques) en 3e année et étaient plus susceptibles d’être considérés comme à haut risque développemental (scores dans le 10e centile inférieur dans au moins deux domaines) à l’entrée scolaire. En restreignant à une seule anesthésie générale et à une seule hospitalisation, ils ont observé une atténuation de l’association avec un mauvais développement et des scores de lecture faibles, mais un mauvais résultat en numératie demeurait. Contrairement à O’Leary et al., ils ont trouvé une association entre le nombre d’expositions et de mauvais résultats développementaux.50
L’étude PANDA est une étude de cohorte appariée entre frères et sœurs qui a comparé les résultats neurodéveloppementaux de 105 enfants exposés à une anesthésie générale avant l’âge de 36 mois pour des cures de hernie inguinale et leurs frères et sœurs non exposés. Des tests neuropsychologiques ont été réalisés entre 8 et 15 ans. Leurs données n’ont montré aucune différence statistiquement significative entre les scores de QI d’enfants en bonne santé ayant eu une seule exposition anesthésique avant l’âge de 36 mois et ceux de leurs frères et sœurs en bonne santé non exposés.51 De même, l’étude de cohorte MASK n’a trouvé aucune preuve de différence dans les scores de tests entre les enfants ayant eu une seule anesthésie avant l’âge de 3 ans et ceux n’ayant eu aucune exposition à l’anesthésie. L’étude a cependant mis en évidence un risque accru de déficit de la vitesse de traitement et d’altération des performances motrices fines chez ceux ayant eu des anesthésies multiples. Les parents du groupe à expositions multiples ont rapporté davantage de problèmes liés aux fonctions exécutives, au comportement et à la lecture.52
L’étude « General Anesthesia Compared to Spinal Anesthesia » ou “GAS study” est un essai international, prospectif, multicentrique, randomisé et contrôlé évaluant l’issue neurodéveloppementale à 2 et 5 ans après une cure de hernie réalisée avant 60 semaines d’âge postmenstruel. Les nourrissons ont été stratifiés selon le centre et l’âge gestationnel à la naissance, puis répartis aléatoirement (1:1) pour recevoir soit une anesthésie locorégionale éveillée, soit une anesthésie générale au sévoflurane. Les nourrissons présentant des facteurs de risque préexistants de lésion neurologique ont été exclus. Les résultats ont montré qu’une exposition d’un peu moins d’une heure à une anesthésie générale au sévoflurane au cours de la petite enfance n’augmentait pas le risque d’issue neurodéveloppementale défavorable à l’âge de 2 ans.53 L’essai a de même montré des preuves d’équivalence du score de Quotient Intellectuel total de la Wechsler Preschool and Primary Scale of Intelligence, troisième édition (WPPSI-III), mesuré à l’âge de 5 ans, dans cette population d’étude majoritairement masculine.54
Sur la base des données disponibles, nous pouvons nous rassurer et rassurer les parents que, chez les jeunes enfants par ailleurs en bonne santé, une exposition unique et brève à l’anesthésie générale n’entraînera pas une altération du développement neurocognitif. Néanmoins, l’anesthésie générale n’est pas un processus totalement anodin. Il existe certaines données en faveur d’un effet délétère après des expositions répétées, mais les données restent limitées concernant les expositions prolongées et les sous-groupes vulnérables. La plupart des études animales ont constaté que des expositions plus longues (3 heures ou plus, pour les primates non humains 5 heures ou plus) sont plus susceptibles d’entraîner une neurotoxicité. Cependant, nous ne connaissons pas l’équivalence entre la durée d’exposition chez l’animal et celle chez l’humain.55 De plus, nous ne savons pas encore ce qui est le plus délétère : plusieurs expositions courtes ou une seule exposition prolongée. Pour autant, nous ne connaissons pas l’âge à partir duquel l’anesthésie générale ne représente plus une menace pour le développement neurocognitif d’un enfant. Pour les patients et les interventions appropriés, il peut être judicieux de proposer une technique anesthésique neuraxiale afin de limiter le nombre d’expositions potentielles à l’anesthésie générale. Si une anesthésie générale est nécessaire, une technique combinée d’anesthésie locorégionale et générale peut aider à réduire la quantité d’agents intraveineux et inhalés nécessaires pour maintenir un bon niveau d’anesthésie pendant l’intervention.
Conclusion
L’anesthésie pédiatrique est complexe, car nous prenons en charge une grande variété de patients présentant non seulement des comorbidités médicales diverses, mais aussi des stades de développement neurocognitif différents. Nous commençons seulement à comprendre les effets des anesthésiques sur la neuroinflammation, le stress périopératoire et le neurodéveloppement. À l’heure actuelle, nous disposons de données suggérant qu’une brève exposition unique à l’anesthésie générale chez des jeunes patients en bonne santé n’entraîne pas de conséquences neurocognitives défavorables. Il est difficile de déterminer si les issues défavorables observées chez les patients nécessitant des interventions prolongées et multiples sont imputables aux agents anesthésiques, aux modifications liées au stress induit par la chirurgie, ou s’il s’agit d’un marqueur de phénotypes prédisposés à la neurotoxicité. La réalité est probablement multifactorielle. Une bonne communication préopératoire entre les équipes d’urologie et d’anesthésie concernant les besoins spécifiques du patient et du cas permet d’assurer des soins optimaux et individualisés.
Points clés
- Les jeunes patients en bonne santé ayant une exposition unique et brève à l’anesthésie générale ne présentent pas un risque accru de troubles du développement neurocognitif.
- Un bloc caudal, péridural ou tronculaire assure une analgésie sûre et efficace pour les chirurgies urologiques ambulatoires
- Les patients qui nécessiteront une hospitalisation plus prolongée après des procédures douloureuses peuvent bénéficier d’un cathéter caudal ou péridural pour assurer une analgésie de plus longue durée
- La chirurgie laparoscopique et robotique induit des modifications physiologiques qui peuvent généralement être partiellement atténuées par l’équipe d’anesthésie
- Les enfants malades devraient être reprogrammés si les procédures sont électives, mais peuvent être évalués au cas par cas si les symptômes sont minimes
- Les enfants à risque d’apnée postopératoire devraient être hospitalisés pour surveillance
- Une bonne communication préopératoire entre les équipes d’urologie et d’anesthésie concernant les besoins spécifiques du patient et du cas conduit à des soins optimaux et individualisés
Références
- Davis PJ, Cladis F. Smith’s Anesthesia for Infants and Children. 2017; 9. DOI: 10.1213/00000539-199009000-00032.
- Sola C, Lefauconnier A, Bringuier S, Raux O, Capdevila X, Dadure C. Childhood preoperative anxiolysis: Is sedation and distraction better than either alone? A prospective randomized study. Paediatr Anaesth 2017; 27 (8): 827–834. DOI: 10.1111/pan.13180.
- Auerbach M, Tunik M, Mojica M. A Randomized, Double-blind Controlled Study of Jet Lidocaine Compared to Jet Placebo for Pain Relief in Children Undergoing Needle Insertion in the Emergency Department. Acad Emerg Med 2009; 16 (5): 388–393. DOI: 10.1111/j.1553-2712.2009.00401.x.
- Disease Control C for, Prevention. Chickenpox (Varicella). 2021. DOI: 10.1016/b978-1-4831-8407-4.50023-7.
- Kimberlin DW, Barnett ED, Lynfield R, Sawyer MH. Red book: report of the Committee on Infectious Diseases. vol. 2021, American Academy of Pediatrics; , DOI: 10.1111/j.1651-2227.2009.01642.x.
- Disease Control C for, Prevention. Hand, Foot, and Mouth Disease (HFMD). 2021. DOI: 10.3329/bjch.v40i2.31567.
- Mallory MD, Travers C, McCracken CE, Hertzog J, Cravero JP. Upper Respiratory Infections and Airway Adverse Events in Pediatric Procedural Sedation. Pediatrics 2017; 140 (1). DOI: 10.1542/peds.2017-0009.
- Lee LK, Bernardo MKL, Grogan TR, Elashoff DA, Ren WHP. Perioperative respiratory adverse event risk assessment in children with upper respiratory tract infection: Validation of the COLDS score. Paediatr Anaesth 2018; 28 (11): 1007–1014. DOI: 10.1111/pan.13491.
- Lema GF, Berhe YW, Gebrezgi AH, Getu AA. Evidence-based perioperative management of a child with upper respiratory tract infections (URTIs) undergoing elective surgery; A systematic review. Int J Surg Open 2018; 12: 17–24. DOI: 10.1016/j.ijso.2018.05.002.
- Saynhalath R, Alex G, Efune PN, Szmuk P, Zhu H, Sanford EL. Anesthetic Complications Associated With Severe Acute Respiratory Syndrome Coronavirus 2 in Pediatric Patients. Anesth Analg 2021; 133 (2): 483–490. DOI: 10.1213/ane.0000000000005606.
- Woods BD, Sladen RN. Perioperative considerations for the patient with asthma and bronchospasm. Br J Anaesth 2009; 103: i57–i65. DOI: 10.1093/bja/aep271.
- Dones F, Foresta G, Russotto V. Update on Perioperative Management of the Child with Asthma. Pediatr Rep 2012; 4 (2): e19. DOI: 10.4081/pr.2012.e19.
- Aronson S, Murray S, Martin G, Blitz J, Crittenden T, Lipkin ME, et al.. Roadmap for Transforming Preoperative Assessment to Preoperative Optimization. Anesth Analg 2020; 130 (4): 811–819. DOI: 10.1213/ane.0000000000004571.
- Shah NN, Vetter TR. Comprehensive Preoperative Assessment and Global Optimization. Anesthesiol Clin 2018; 36 (2): 259–280. DOI: 10.1016/j.anclin.2018.01.006.
- Practice Guidelines for Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration: Application to Healthy Patients Undergoing Elective Procedures. Anesthesiology 2017; 90 (3): 896–905. DOI: 10.1097/00000542-199903000-00034.
- Dobson G, Chow L, Flexman A. Practice Guidelines for Ophthalmic Anesthesia. Practice Guidelines in Anesthesia-2 2019; 6 (1): 175–175. DOI: 10.5005/jp/books/14207_19.
- Smith I, Kranke P, Murat I, Smith A, OʼSullivan G, Sreide E, et al.. Perioperative fasting in adults and children. Eur J Anaesthesiol 2011; 28 (8): 556–569. DOI: 10.1097/eja.0b013e3283495ba1.
- Dadure C, Sola C, Capdevila X. Preoperative nutrition through a prehabilitation program: A key component of transfusion limitation in paediatric scoliosis surgery. Anaesth Crit Care Pain Med 2015; 34 (6): 311–312. DOI: 10.1016/j.accpm.2015.12.004.
- Cote CJ, Zaslavsky A, Downes JJ, Kurth CD, Welborn LG, Warner LO, et al.. Postoperative Apnea in Former Preterm Infants After Inguinal Herniorrhaphy. Survey of Anesthesiology 1995; 40 (3): 163. DOI: 10.1097/00132586-199606000-00031.
- Polaner DM, Taenzer AH, Walker BJ. Faculty Opinions recommendation of Pediatric Regional Anesthesia Network (PRAN): a multi-institutional study of the use and incidence of complications of pediatric regional anesthesia. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2012; 15 (6): 353–1364. DOI: 10.3410/f.717968230.793467936.
- Sheth KR, Batavia JP, Bowen DK, Koh CJ, Srinivasan AK. Complications in Pediatric Urology Minimally Invasive Surgery. Minimally Invasive and Robotic-Assisted Surgery in Pediatric Urology 2018; 5 (4): 381–404. DOI: 10.1007/978-3-030-57219-8_26.
- Joris JL. Anesthesia for Laparoscopic Surgery. Miller’s Anesthesia. Churchill Livingstone, Philadelphia, 2185-2202. 2010.
- Cyna AM, Middleton P. Caudal epidural block versus other methods of postoperative pain relief for circumcision in boys. Cochrane Database Syst Rev 2008; 2008 (4). DOI: 10.1002/14651858.cd003005.pub2.
- Wiegele M, Marhofer P, Lönnqvist P-A. Caudal epidural blocks in paediatric patients: a review and practical considerations. Br J Anaesth 2019; 122 (4): 509–517. DOI: 10.1016/j.bja.2018.11.030.
- Fukazawa K, Matsuki Y, Ueno H, Hosokawa T, Hirose M. Risk factors related to accidental intravascular injection during caudal anesthesia. J Anesth 2014; 28 (6): 940–943. DOI: 10.1007/s00540-014-1840-8.
- Kundra P, Yuvaraj K, Agrawal K, Krishnappa S, Kumar LT. Surgical outcome in children undergoing hypospadias repair under caudal epidural vs penile block. Paediatr Anaesth 2012; 22 (7): 707–712. DOI: 10.1111/j.1460-9592.2011.03702.x.
- Yildiz T, Tahtali IN, Ates DC, Keles I, Ilce Z. Age of patient is a risk factor for urethrocutaneous fistula in hypospadias surgery. J Pediatr Urol 2013; 9 (6): 900–903. DOI: 10.1016/j.jpurol.2012.12.007.
- Zhang J, Zhu S, Zhang L, Fu W, Hu J, Zhang Z, et al.. The association between caudal block and urethroplasty complications of distal tubularized incised plate repair: experience from a South China National Children’s Medical Center. Transl Androl Urol 2021; 10 (5): 2084–2090. DOI: 10.21037/tau-21-355.
- Taicher BM, Routh JC, Eck JB, Ross SS, Wiener JS, Ross AK. The association between caudal anesthesia and increased risk of postoperative surgical complications in boys undergoing hypospadias repair: Comment on data sparsity. Paediatr Anaesth 2017; 27 (9): 974–974. DOI: 10.1111/pan.13207.
- Zaidi RH, Casanova NF, Haydar B, Voepel-Lewis T, Wan JH. Urethrocutaneous fistula following hypospadias repair: regional anesthesia and other factors. Paediatr Anaesth 2015; 25 (11): 1144–1150. DOI: 10.1111/pan.12719.
- Braga LH, Jegatheeswaran K, McGrath M, Easterbrook B, Rickard M, DeMaria J, et al.. Cause and Effect versus Confounding–Is There a True Association between Caudal Blocks and Tubularized Incised Plate Repair Complications? J Urol 2017; 197 (3 Part 2): 845–851. DOI: 10.1016/j.juro.2016.08.110.
- Zhu C, Wei R, Tong Y, Liu J, Song Z, Zhang S. Analgesic efficacy and impact of caudal block on surgical complications of hypospadias repair: a systematic review and meta-analysis. Reg Anesth Pain Med 2019; 44 (2): 259–267. DOI: 10.1136/rapm-2018-000022.
- Ngoo A, Borzi P, McBride CA, Patel B. Penile nerve block predicts higher revision surgery rate following distal hypospadias repair when compared with caudal epidural block: A consecutive cohort study. J Pediatr Urol 2020; 16 (4): 439.e1–439.e6. DOI: 10.1016/j.jpurol.2020.05.150.
- Goyal S, Sharma A, Goswami D, Kothari N, Goyal A, Vyas V, et al.. Clonidine and Morphine as Adjuvants for Caudal Anaesthesia in Children: A Systematic Review and Meta-Analysis of Randomised Controlled Trials. Turk J Anaesthesiol Reanim 2020; 48 (4): 265–272. DOI: 10.5152/tjar.2020.29863.
- Wang X-xue, Dai J, Dai L, Guo H-jing, Zhou A-guo, Pan D-bo. Caudal dexmedetomidine in pediatric caudal anesthesia. Medicine (Baltimore) 2020; 99 (31): e21397. DOI: 10.1097/md.0000000000021397.
- Rowe E, Cooper TE, McNicol ED. Ketorolac for postoperative pain in children. Cochrane Database Syst Rev 2018; 7:cd012294. DOI: 10.1002/14651858.cd012294.
- Aldrink JH, Ma M, Wang W, Caniano DA, Wispe J, Puthoff T. Safety of ketorolac in surgical neonates and infants 0 to 3 months old. J Pediatr Surg 2011; 46 (6): 1081–1085. DOI: 10.1016/j.jpedsurg.2011.03.031.
- Stone SB. Ketorolac in Postoperative Neonates and Infants: A Systematic Review. J Pediatr Pharmacol Ther 2021; 26 (3): 240–247. DOI: 10.5863/1551-6776-26.3.240.
- Anesthesia BBP. Non-Opioid Analgesic Agents. People’s Medical Publishing House; 2011, DOI: 10.1016/j.mpaic.2007.11.012.
- Drugs C on. Acetaminophen Toxicity in Children. Pediatrics 2001; 108 (4): 1020–1024. DOI: 10.1542/peds.108.4.1020.
- Chandrakantan A. Postoperative Nausea and Vomiting in Children. Case Studies in Pediatric Anesthesia 2014; 7 (3): 24–25. DOI: 10.1017/9781108668736.006.
- Urits I, Orhurhu V, Jones MR. Postoperative nausea and vomiting in paediatric strabismus surgery. Br J Anaesth 2020; 105 (4): 550–551. DOI: 10.1093/bja/aeq219.
- Gan TJ, Diemunsch P, Habib AS, Kovac A, Kranke P, Meyer TA, et al.. Consensus Guidelines for the Management of Postoperative Nausea and Vomiting. Anesth Analg 2014; 118 (1): 85–113. DOI: 10.1213/ane.0000000000000002.
- Eberhart LHJ, Geldner G, Kranke P. Development and validation of a risk score to predict the probability of postoperative vomiting in pediatric patients: the VPOP score. Paediatr Anaesth 2004; 25 (3): 330–330. DOI: 10.1111/pan.12596.
- Davidson AJ, Morton NS, Arnup SJ. Faculty Opinions recommendation of Apnea after Awake Regional and General Anesthesia in Infants: The General Anesthesia Compared to Spinal Anesthesia Study–Comparing Apnea and Neurodevelopmental Outcomes, a Randomized Controlled Trial. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2015; 23 (1): 8–54. DOI: 10.3410/f.725508900.793507986.
- Lee BH, Chan JT, Kraeva E, Peterson K, Sall JW. Isoflurane exposure in newborn rats induces long-term cognitive dysfunction in males but not females. Neuropharmacology 2014; 83: 9–17. DOI: 10.1016/j.neuropharm.2014.03.011.
- Vutskits L, Xie Z. Lasting impact of general anaesthesia on the brain: mechanisms and relevance. Nat Rev Neurosci 2016; 17 (11): 705–717. DOI: 10.1038/nrn.2016.128.
- DiMaggio C, Sun LS, Ing C, Li G. Pediatric Anesthesia and Neurodevelopmental Impairments. J Neurosurg Anesthesiol 2012; 24 (4): 376–381. DOI: 10.1097/ana.0b013e31826a038d.
- O’Leary JD, Janus M, Duku E, Wijeysundera DN, To T, Li P, et al.. A Population-based Study Evaluating the Association Between Surgery in Early Life and Child Development at Primary School Entry. Obstetric Anesthesia Digest 2016; 37 (2): 78–79. DOI: 10.1097/01.aoa.0000515748.52953.0b.
- Schneuer FJ, Bentley JP, Davidson AJ, Holland AJA, Badawi N, Martin AJ, et al.. The impact of general anesthesia on child development and school performance: a population-based study. Paediatr Anaesth 2018; 28 (6): 528–536. DOI: 10.1111/pan.13390.
- Sun LS, Li G, Miller TLK, Salorio C, Byrne MW, Bellinger DC, et al.. Association Between a Single General Anesthesia Exposure Before Age 36 Months and Neurocognitive Outcomes in Later Childhood. Jama 2016; 315 (21): 2312. DOI: 10.1001/jama.2016.6967.
- Warner DO, Zaccariello MJ, Katusic SK. Faculty Opinions recommendation of Neuropsychological and Behavioral Outcomes after Exposure of Young Children to Procedures Requiring General Anesthesia: The Mayo Anesthesia Safety in Kids (MASK) Study. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2018; 29 (1): 9–105. DOI: 10.3410/f.733078932.793559248.
- Davidson AJ, Disma N, Graaff JC de, Withington DE, Dorris L, Bell G, et al.. Neurodevelopmental outcome at 2 years of age after general anaesthesia and awake-regional anaesthesia in infancy (GAS): an international multicentre, randomised controlled trial. Lancet 2016; 387 (10015): 239–250. DOI: 10.1016/s0140-6736(15)00608-x.
- McCann ME, Graaff JC, Dorris L. Faculty Opinions recommendation of Neurodevelopmental outcome at 5 years of age after general anaesthesia or awake-regional anaesthesia in infancy (GAS): an international, multicentre, randomised, controlled equivalence trial. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2019; 93 (10172): 64–677. DOI: 10.3410/f.735131691.793559701.
- Creeley C, Dikranian K, Dissen G, Martin L, Olney J, Brambrink A. Propofol-induced apoptosis of neurones and oligodendrocytes in fetal and neonatal rhesus macaque brain. Br J Anaesth 2013; 110: i29–i38. DOI: 10.1093/bja/aet173.
Dernière mise à jour: 2025-09-22 07:59