5: Diagnostic prénatal et chirurgie anténatale
Ce chapitre prendra environ 25 minutes de lecture.
Introduction
Un bilan anatomique fœtal complet du deuxième trimestre est devenu la norme des soins prénataux. L’échographie prénatale détecte 84,4–97 % de toutes les malformations des voies urinaires fœtales et ces anomalies peuvent être détectées dès 12–14 semaines de gestation.1,2 Avant le dépistage anténatal systématique, les enfants symptomatiques présentant des anomalies urologiques étaient détectés après la naissance, se présentant avec des symptômes tels que l’urosepsis, la douleur, l’hématurie, une masse palpable ou un retard de croissance staturo-pondéral, nécessitant souvent une intervention chirurgicale. L’avènement de l’échographie prénatale systématique a fait évoluer le champ de la prise en charge urologique pédiatrique d’un modèle interventionnel/chirurgical vers un rôle de conseil anténatal.
L’hydronéphrose anténatale est observée dans 1–5% de toutes les grossesses et représente le diagnostic prénatal le plus fréquent.3 La majorité de ces patients présentent une dilatation légère du bassinet rénal qui se résout spontanément; cependant, l’hydronéphrose peut être secondaire à une obstruction des voies urinaires, qui peut ou non bénéficier d’une intervention prénatale. Ainsi, une connaissance approfondie de la physiopathologie des malformations potentielles des voies urinaires susceptibles d’être détectées lors du dépistage anténatal et de leurs manifestations prénatales possibles, ainsi que des interventions prénatales éventuelles, est requise.
Embryologie
Embryologie rénale
Les voies urinaires et génitales dérivent du mésoderme intermédiaire. À la quatrième semaine suivant la conception, le mésonéphros se forme à partir de deux renflements allongés de mésoderme. Ce système rudimentaire produit temporairement de l’urine entre 6 et 10 semaines de gestation, puis régresse. À 5–6 semaines de gestation, le bourgeon urétéral naît d’une évagination du canal mésonéphrique (de Wolff). Le bourgeon urétéral croît cranialement et pénètre dans le blastème métanéphrique à la semaine 7. Cela induit l’induction tissulaire du mésenchyme indifférencié, le transformant en néphrons fonctionnels du rein métanéphrique (Figure 1) L’interaction entre le bourgeon urétéral et le blastème métanéphrique est cruciale pour la formation de reins fonctionnels et, en l’absence de cet événement, il se produit une agénésie rénale.
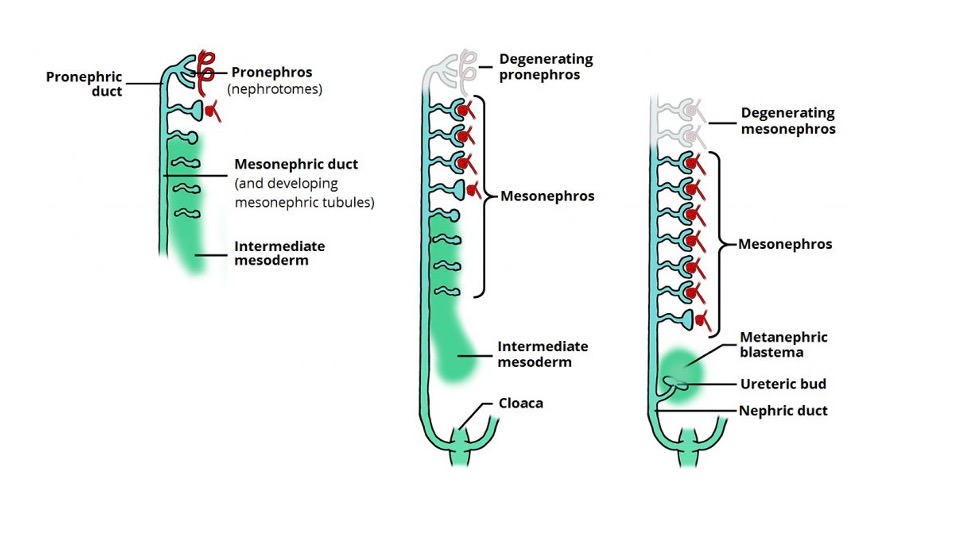
Figure 1 Le développement et la dégénérescence séquentiels du pronéphros et du mésonéphros, ainsi que l’induction du bourgeon urétéral et du blastème métanéphrogène aboutissant au développement du rein. Image tirée de Teach Me Anatomy.
Le cortex rénal et les néphrons se développent à partir du blastème métanéphrique, tandis que les tubules collecteurs, les canaux papillaires, les calices, le bassinet rénal et l’uretère dérivent du bourgeon urétérique. L’uretère forme un cordon tissulaire solide vers la sixième semaine de gestation et subit une canalisation, débutant au segment médio-urétéral et s’étendant dans les deux sens. La jonction pyélo-urétérale et la jonction urétéro-vésicale sont les derniers segments à se canaliser. La membrane qui se développe au cours de la canalisation, appelée membrane de Chwalla, peut contribuer à une hydronéphrose et à une urétéro-hydronéphrose transitoires/physiologiques en cas de retard de sa perforation.4 Au cours de la dixième semaine, les néphrons se raccordent au canal collecteur et la production d’urine commence. Si les néphrons et le système collecteur ne s’unissent pas correctement, un processus obstructif précoce peut survenir, pouvant entraîner le développement d’un rein dysplasique multikystique.5
Entre la 6e et la 9e semaine de gestation, les reins remontent jusqu’à leur localisation définitive dans la région lombaire. L’ectopie rénale survient lorsque les reins ne migrent pas, la région pelvienne étant la localisation ectopique la plus fréquente. En outre, la fusion des pôles inférieurs des reins peut aboutir à un rein en fer à cheval. Avec un rein en fer à cheval, l’ascension dans l’abdomen est limitée par l’artère mésentérique inférieure, entraînant sa localisation ectopique. Une vidéo illustrant le développement rénal prénatal normal est disponible (Vidéo 1).
Vidéo 1. Représentation du développement rénal prénatal normal.
À la dixième semaine de gestation, le néphron est mature et la production d’urine commence. Les reins sont capables d’éliminer le sodium et de concentrer l’urée entre la 12e et la 14e semaine de gestation et, après 18 semaines de vie intra-utérine, presque tout le liquide amniotique est de l’urine fœtale. Cette capacité des reins à produire de l’urine et à maintenir des volumes adéquats de liquide amniotique exerce une influence profonde sur la croissance et le développement du fœtus et joue un rôle clé dans le développement pulmonaire fœtal.
Embryologie de la vessie
Le développement de la paroi abdominale antérieure, de la vessie et du septum urorectal est également interdépendant. Entre la cinquième et la sixième semaine de gestation, le septum urorectal divise d’abord la cloaque en canal anorectal dorsal et en sinus urogénital ventral. Les anomalies de la membrane cloacale entraînent des malformations anorectales. Le sinus urogénital forme la vessie et l’urètre, et l’allantoïde est le précurseur embryonnaire du reliquat de l’ouraque.
Les canaux mésonéphriques (wolffiens) fusionnent avec le cloaque juste avant sa subdivision par le septum urorectal. L’abouchement des canaux mésonéphriques distingue le canal vésico-urétral céphalique du sinus urogénital caudal. Le canal vésico-urétral forme la vessie et l’urètre pelvien. La portion caudale du sinus urogénital forme l’urètre phallique chez le mâle et les vestibules urétral et vaginal chez la femelle. Ces divisions normales du cloaque sont illustrées dans (Figure 2) Une vidéo détaillée décrivant le développement normal de la vessie est disponible (Vidéo 2).
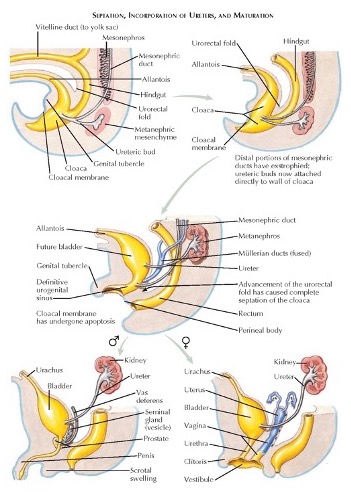
Figure 2 Division embryologique normale du cloaque et développement du système génito-urinaire.
Vidéo 2. Description du développement normal de la vessie.
La membrane cloacale définit à l’origine la paroi ventrale du septum urogénital. À mesure que la membrane régresse, au cours de la 6ᵉ semaine de gestation, les crêtes mésodermiques migrent vers la ligne médiane pour former la paroi ventrale définitive. L’exstrophie vésicale survient lorsque la membrane cloacale ne régresse pas et empêche la migration du mésoderme. L’exstrophie cloacale survient lorsque la membrane cloacale régresse avant que le septum urorectal ne se développe et que la vessie et l’intestin deviennent exposés.
Fonction rénale et liquide amniotique
Le pronostic des anomalies rénales est plus défavorable lorsque le volume de liquide amniotique est insuffisant. Ce pronostic plus défavorable s’explique par le fait que le liquide amniotique est vital pour le développement pulmonaire. Avant 16 semaines de gestation, l’amnios transporte activement les solutés et l’eau diffuse passivement à travers sa membrane. Initialement, pendant les premier et deuxième trimestres, les électrolytes et l’osmolarité de l’urine fœtale sont similaires à ceux du sang fœtal et maternel. Plus tard au cours de la gestation, à mesure que la fonction tubulaire mûrit et que le rein fœtal commence à réabsorber le sodium et le chlorure, l’urine et le liquide amniotique deviennent plus hypotoniques.6 Il en résulte une composition urinaire pauvre en électrolytes et riche en créatinine, très similaire à celle observée en période postnatale. Les reins ayant subi des lésions prénatales produisent une urine isotone, car ils ont perdu la capacité de réabsorber les électrolytes et les protéines.
Avant 16 semaines de gestation, la quantité de liquide amniotique peut être relativement normale, même en présence d’une fonction rénale altérée, puisque la majeure partie du liquide amniotique est produite par des sources extra-rénales. Après 16 semaines de gestation, les reins deviennent principalement responsables de la majeure partie du volume de liquide amniotique. Au troisième trimestre, la production urinaire fœtale horaire atteint 30–40 mL/heure et constitue environ 90 % du liquide amniotique.7
Le liquide amniotique est depuis longtemps reconnu comme jouant un rôle important dans le développement pulmonaire fœtal. Une diminution du volume de liquide amniotique entraîne des degrés variables d’hypoplasie pulmonaire. On ne sait pas clairement si le liquide amniotique joue uniquement un rôle mécanique dans le développement pulmonaire fœtal ou s’il apporte des facteurs de croissance d’origine rénale. Ce qui est clair, c’est son importance pour prévenir l’hypoplasie pulmonaire qui, lorsqu’elle est sévère, est mortelle. Le syndrome de Potter (hypoplasie pulmonaire sévère associée à une agénésie rénale bilatérale) est mortel et survient en cas d’anomalie rénale sévère ou d’obstruction urinaire, entraînant un oligoamnios sévère au début de la gestation.8
Épidémiologie
Les anomalies congénitales du rein et des voies urinaires9 surviennent dans 1/500 naissances vivantes et l’incidence de la mortalité néonatale liée aux CAKUT est d’environ 1/2000 naissances vivantes.9,10 L’hydronéphrose est l’anomalie urinaire prénatale la plus fréquente identifiée, survenant dans 1–5% de toutes les grossesses, le risque de toute pathologie postnatale augmentant avec le degré d’hydronéphrose (11,9% pour une forme légère, 45,1% pour une forme modérée et 88,3% pour une hydronéphrose sévère).11 La plupart des anomalies urologiques obstructives surviennent chez les sujets de sexe masculin, avec un ratio homme:femme de 4:1, avec une prédilection pour l’atteinte du rein gauche,12,13
Pathogénie
L’uropathie fœtale peut être due à des causes génétiques, telles que la polykystose rénale autosomique récessive, ou à des problèmes liés à la néphrogenèse et à l’obstruction des voies urinaires. Une néphrogenèse défectueuse peut entraîner une agénésie rénale ainsi qu’une dysplasie rénale. La dysplasie rénale peut résulter d’une interaction déficiente entre le bourgeon urétéral et le mésenchyme métanéphrique, de défauts intrinsèques de différenciation, ainsi que d’une obstruction. Les anomalies congénitales du rein et des voies urinaires comprennent l’agénésie rénale, le rein multikystique, la dysplasie rénale, les anomalies de duplication rénale, l’obstruction de la jonction pyélo-urétérale, les méga-uretères, les valves urétrales postérieures et le reflux vésico-urétéral. Les CAKUT s’accompagnent fréquemment d’une dysplasie rénale et une cause génétique possible a été envisagée, car des anomalies rénales ont été identifiées chez des apparentés proches de 10% des patients atteints de CAKUT.9,10 De nombreuses mutations génétiques, telles que des anomalies de la signalisation impliquant HNF1β, PAX2 et RET, ont été envisagées, mais aucun schéma clair d’hérédité n’a été identifié,14,15
Évaluation et diagnostic
Comme mentionné précédemment, l’échographie prénatale détecte 84,4–97 % de toutes les malformations des voies urinaires fœtales et ces anomalies peuvent être détectées dès 12–14 semaines de gestation.1,2 Bon nombre de ces anomalies peuvent être diagnostiquées par échographie, l’IRM fœtale apportant des précisions supplémentaires. En outre, de nombreuses affections génito-urinaires se chevauchent dans leur présentation à l’imagerie initiale.
Échographie prénatale
L’échographie prénatale est désormais régulièrement utilisée comme dépistage et surveillance de la croissance et du développement fœtaux au deuxième trimestre. La détection des anomalies urologiques avant la naissance est relativement sensible, avec jusqu’à 88 % des anomalies des voies urinaires diagnostiquées en période prénatale.16 Les reins ne sont généralement pas visibles à l’échographie avant la 15e semaine de gestation (Figure 3) Un diamètre antéro-postérieur du pelvis rénal (APRPD) inférieur à 4 mm entre les semaines 16–27 de gestation et inférieur à 7 mm à la semaine 28 ou au-delà est considéré comme relevant de la plage physiologique normale.17 Si les uretères ne sont pas dilatés, ils ne devraient pas être visibles à l’échographie prénatale. La vessie est généralement visible à 10 semaines de gestation, mais elle devrait être visualisée au plus tard à 12 semaines. Une paroi vésicale normale ne dépasse pas 3 mm d’épaisseur.2
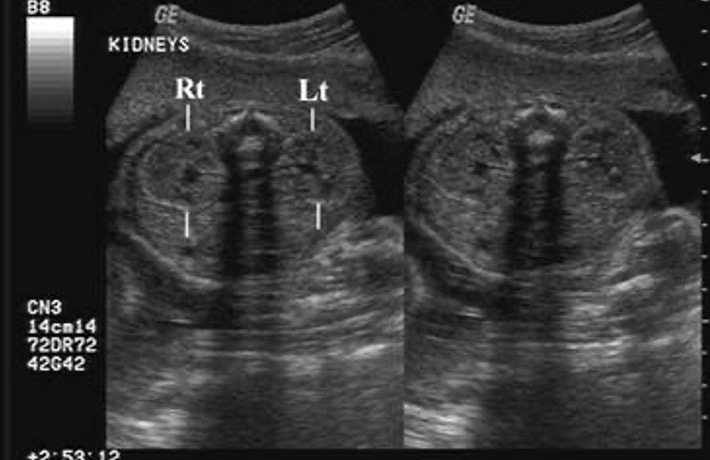
Figure 3 Échographie prénatale montrant des reins gauche et droit normaux.
IRM fœtale
L’IRM fœtale est couramment utilisée pour fournir des détails anatomiques plus précis sur les anomalies congénitales initialement détectées à l’échographie. Dans une étude, la sensibilité diagnostique globale était de 96 % pour l’IRM fœtale contre 58 % pour l’échographie.18 L’IRM fœtale fournit également des informations diagnostiques supplémentaires, en particulier pour l’évaluation de l’anatomie urétérale. Les avantages de l’IRM fœtale comprennent un meilleur contraste tissulaire et l’examen de la morphologie, ainsi que la capacité de détecter des anomalies supplémentaires et d’évaluer la fonction rénale fœtale.19 À mesure que l’imagerie fœtale se perfectionne, des techniques telles que la cystoscopie virtuelle 3D sont utilisées pour mieux préciser les anomalies urogénitales.20
À l’IRM, la vessie apparaît comme une structure ronde/ovoïde en hypersignal homogène et sa paroi doit être lisse et d’épaisseur uniforme. Les reins seront situés paraspinalement dans l’étage abdominal supérieur et se présentent comme des structures ovoïdes en signal intermédiaire sur une séquence pondérée T2. Ils doivent être examinés quant à leur taille, les modifications dysplasiques, la pyélectasie et l’urétérectasie.
Anomalies prénatales
Dilatation des voies urinaires supérieures
L’hydronéphrose est détectée dans 1–5% des échographies prénatales.21 La dilatation des voies urinaires supérieures doit être prise en compte avec d’autres constatations, telles que l’aspect du parenchyme rénal, le volume de liquide amniotique, la dilatation urétérale, ou l’aspect de la vessie fœtale et la dilatation urétrale.22,23 Les trois anomalies les plus fréquentes liées à la dilatation prénatale des voies urinaires supérieures sont les anomalies de la jonction pyélo-urétérale (JPU), les anomalies de la jonction urétéro-vésicale (JUV) et le reflux vésico-urétéral (RVU).
Systèmes de classification de l’hydronéphrose
Pour mieux préciser le degré d’hydronéphrose, différents systèmes de classification ont été élaborés. Les principaux systèmes utilisés pour l’hydronéphrose sont les systèmes de la Société d’urologie fœtale (SFU)24 et de dilatation des voies urinaires (UTD).25 L’APRPD a également été utilisé comme complément à ces systèmes de classification.26
Système de classification SFU
Dans le système SFU, la classification de l’hydronéphrose est fondée sur le degré de dilatation du bassinet rénal et des calices. (Figure 4) illustre le système de classification SFU. Il est important de noter que la classification SFU n’a pas été conçue à l’origine pour l’évaluation anténatale et qu’elle n’a pas été largement adoptée en dehors de l’urologie pédiatrique.
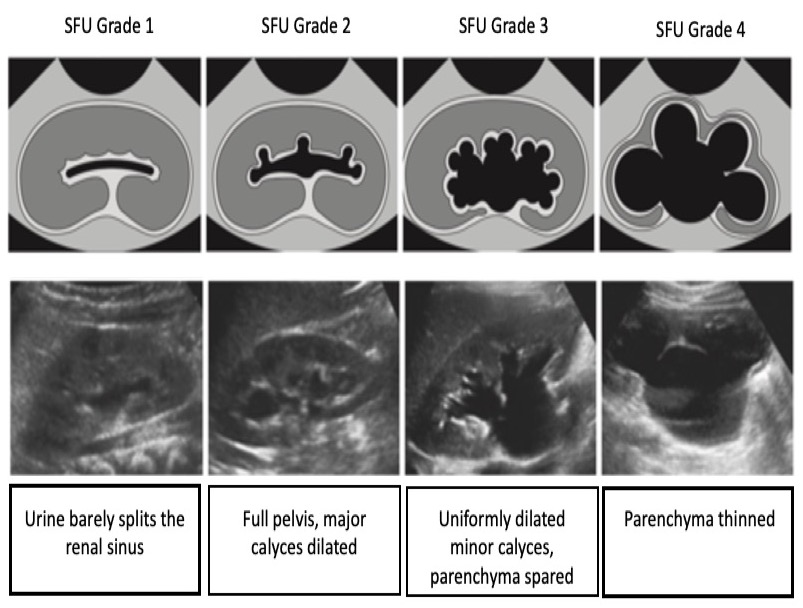
Figure 4 Système de classification de l’hydronéphrose selon la SFU.
Système de classification UTD de l’hydronéphrose
Ce système repose sur six catégories habituellement identifiées à l’échographie : diamètre antéro-postérieur du pelvis rénal (APRPD), dilatation des calices rénaux, épaisseur du parenchyme rénal, aspect du parenchyme rénal, anomalies vésicales et anomalies urétérales. Ce système de classification est également stratifié selon l’âge gestationnel. Pour l’hydronéphrose prénatale, l’hydronéphrose peut être classée UTD A1 : faible risque s’il existe une dilatation centrale ou calicielle, mais que tous les paramètres susmentionnés sont normaux. UTD A2–3 est utilisé s’il existe un risque accru d’uropathies postnatales. Ici, les groupes risque intermédiaire (A2) et haut risque (A3) sont regroupés en une seule catégorie (Figure 5)
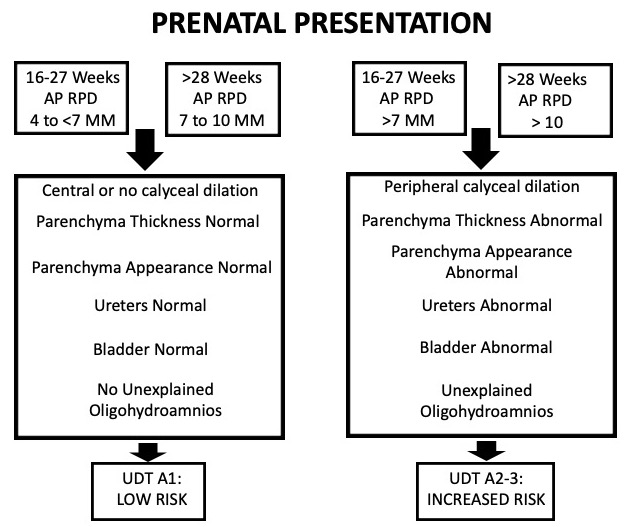
Figure 5 Tableau décrivant le système de classification UTD lorsque l’hydronéphrose se manifeste en période prénatale.
Hydronéphrose/Jonction pyélo-urétérale
Dans la plupart des cas d’hydronéphrose prénatale isolée, cette constatation évoque un processus transitoire et non pathologique.11 Une obstruction de la jonction pyélo-urétérale peut être évoquée selon le degré d’hydronéphrose. Le risque de toute pathologie postnatale augmente significativement en fonction de la sévérité de l’hydronéphrose prénatale. Le risque de pathologie postnatale pour une hydronéphrose prénatale légère, modérée et sévère a été rapporté à 11,9 %, 45,1 % et 88,3 %, respectivement.11 Une obstruction de la jonction urétéro-vésicale peut également être évoquée en présence d’une hydronéphrose et d’une dilatation urétérale.
La nécessité d’examens d’imagerie prénatale supplémentaires peut être fondée sur le diamètre antéropostérieur du bassinet. Dans une étude, aucun nourrisson présentant un APRPD au deuxième trimestre <7 mm n’a nécessité d’intervention postnatale et aucun n’a développé une insuffisance rénale.27 Une autre étude a suggéré qu’une dilatation du bassinet rénal de 15 mm constituait un seuil significatif pour suspecter une obstruction chez 80 % des fœtus, avec une sensibilité et une spécificité de 73 % et 82 %, respectivement.28 En outre, un seuil de 18 mm pour la dilatation du bassinet fœtal présentait un odds ratio diagnostique de 97.7 pour identifier les nourrissons nécessitant une pyéloplastie.29
Reflux vésico-urétéral
Dans le rapport de synthèse de 2010 du groupe d’experts sur les recommandations concernant le reflux vésico-urétéral pédiatrique, les auteurs ont noté que, parmi les 6 579 nourrissons présentant une hydronéphrose prénatale, un RVU était présent chez 4 756 (72 %).30 Malgré ces constatations, l’imagerie prénatale a une faible sensibilité pour détecter le RVU. Même si le diamètre du pelvis rénal (RPD) augmente à l’échographie prénatale, cette augmentation n’est pas prédictive de RVU.31,32 Une autre étude a montré que la modification de la forme/taille du pelvis rénal et de l’uretère à l’imagerie prénatale ne survenait que chez 17,2 % des fœtus chez lesquels un RVU a été diagnostiqué en postnatal, ce qui en fait un piètre prédicteur du reflux urinaire.32
Obstruction des voies urinaires basses
L’obstruction des voies urinaires basses regroupe un ensemble d’anomalies urogénitales responsables d’une obstruction urétrale. La présentation prénatale de ces affections est similaire et se manifeste généralement par une vessie distendue et une urétéro-hydronéphrose.
Identifier une LUTO est important en raison de son impact potentiel à long terme sur la fonction rénale ainsi que sur le développement pulmonaire prénatal, surtout en cas d’oligoamnios associé. Les caractéristiques échographiques et cliniques pouvant être prédictives d’une LUTO sont une méga-vessie sévère (définie par un volume vésical >35 mm3), une dilatation urétérale bilatérale, un oligoamnios/anhydramnios et un sexe fœtal masculin.33 L’IRM peut aider à évaluer le parenchyme rénal, la taille rénale, la quantité de liquide amniotique et le degré de distension urétérale et vésicale.34 En outre, la mesure de la surface parenchymateuse peut être corrélée à la fonction rénale postnatale, avec 8 cm2 ou plus au troisième trimestre, comme meilleur facteur prédictif du développement d’une maladie rénale terminale.35
Valvules urétrales postérieures
Les valves urétrales postérieures peuvent se manifester à l’échographie prénatale par une hydronéphrose, une hydrourétéronéphrose ou une mégavessie. Cependant, le signe échographique caractéristique des PUV est une vessie en trou de serrure avec une légère dilatation de l’urètre proximal (Figure 6) Les constatations échographiques prénatales les plus prédictives du diagnostic de PUV comprennent un urètre postérieur dilaté (le signe échographique le plus discriminant), un épaississement de la paroi vésicale et un anhydramnios.32
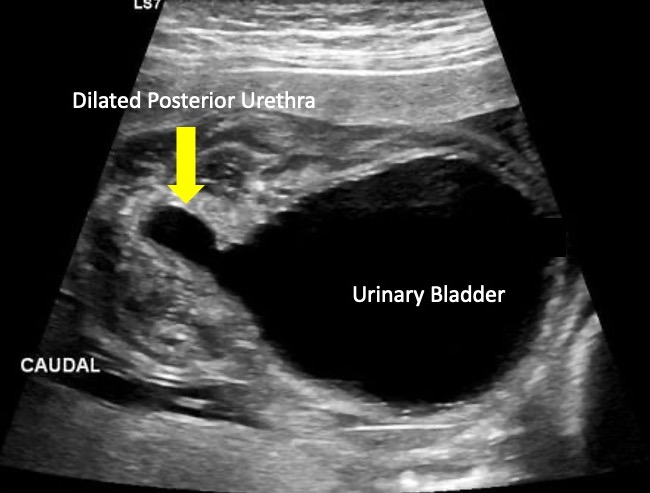
Figure 6 Image échographique montrant le signe en “trou de serrure” fréquemment observé dans les valves de l’urètre postérieur.
Syndrome prune-belly
Comme la sévérité du PBS est variable, son diagnostic anténatal est difficile. En général, les reins apparaissent hyperéchogènes et dysplasiques, avec une dilatation des uretères et un épaississement de la paroi vésicale. Un anhydramnios et des contenus abdominaux et thoraciques comprimés peuvent également être observés.36,37 Plus la suspicion de PBS survient précocement à l’imagerie prénatale, plus le pronostic est défavorable. L’IRM peut permettre de mieux préciser l’étendue des anomalies génito-urinaires, notamment une hypoplasie rénale, une dysplasie, une dilatation des uretères, une mégavessie, un urètre prostatique dilaté et une hypoplasie prostatique.34
Atrésie urétrale et anomalies urétrales antérieures
L’atrésie urétrale n’est qu’une affection parmi les anomalies urétrales antérieures, qui comprennent également les valves urétrales antérieures et le diverticule urétral. L’atrésie urétrale et les anomalies urétrales antérieures sont rares, mais peuvent être suspectées en présence d’une urétéro-hydronéphrose, d’une vessie dilatée et épaissie, d’oligoamnios, ainsi que d’un urètre dilaté à l’imagerie prénatale. La présence d’anomalies congénitales supplémentaires du rein et des voies urinaires augmente le risque de développer une maladie rénale chronique.38
Rein dysplasique multikystique
La maladie kystique rénale prénatale est difficile à identifier et à différencier en utilisant uniquement l’échographie. Souvent, il peut être difficile de distinguer un MCDK d’une obstruction sévère de la jonction pyélo-urétérale (UPJ) à l’échographie prénatale. L’IRM fœtale a été utilisée pour compléter les constatations initiales à l’échographie évoquant un MCDK. Classiquement, le rein est complètement remplacé par des kystes de tailles différentes qui ne communiquent pas (Figure 7) Un bassinet rénal normal n’est généralement pas visible, en raison de l’absence de développement de la ramification tubulaire et peut constituer un signe caractéristique de MCDK.39 Au-delà du MCDK, des kystes rénaux observés à l’imagerie prénatale peuvent également être évocateurs d’une dysplasie/maladie kystique rénale.
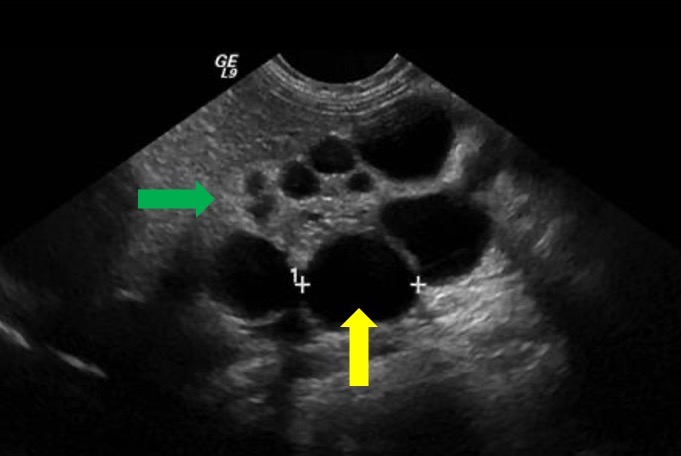
Figure 7 Image échographique montrant une MCDK. La flèche jaune indique un kyste rénal. La flèche verte indique un parenchyme rénal aminci et échogène évoquant une dysplasie rénale.
Anomalies de duplication
La précision diagnostique de l’échographie prénatale pour identifier les duplications isolées des voies excrétrices peut atteindre 90%.40 En cas de duplication urétérale, une urétérocèle peut être associée à l’hémisystème supérieur. Même si la plupart des anomalies de duplication peuvent être diagnostiquées par échographie (Figure 8), l’IRM peut être utile dans certains cas particuliers.41 Une étude a rapporté que chez les patients ayant un diagnostic prénatal de duplication isolée des voies excrétrices, l’urétérocèle et le méga-uretère étaient associés dans 70.7% et 36.6% des cas, respectivement.40
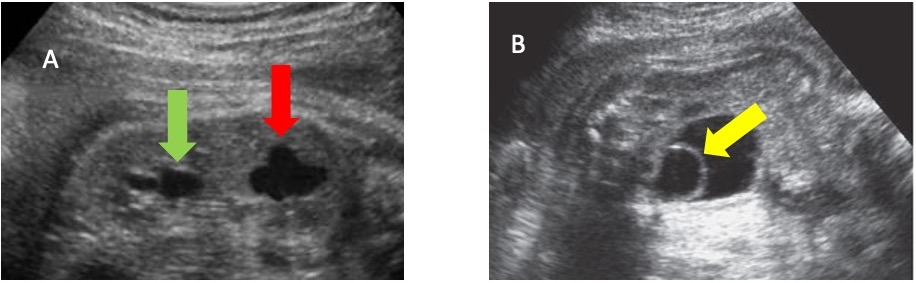
Figure 8 A. Image échographique montrant un rein duplex avec hydronéphrose du pôle inférieur (flèche verte) et du pôle supérieur (flèche rouge). B. Image échographique montrant la vessie avec une urétérocèle (flèche jaune) en son sein.
Exstrophie vésicale, Cloaque, Sinus urogénital
L’exstrophie vésicale et l’exstrophie cloacale peuvent également être visualisées à l’imagerie prénatale. La différenciation correcte entre l’exstrophie vésicale et l’exstrophie cloacale peut être réalisée en identifiant la localisation de l’insertion du cordon ombilical par rapport au défaut de la paroi abdominale (supérieure vs. médiane vs. inférieure), ce qui peut être réalisé soit par échographie fœtale, soit par IRM.42 Si le défaut de la paroi abdominale est visualisé en dessous du cordon sans vessie pleine, le diagnostic est probablement une exstrophie vésicale. En revanche, si le défaut se situe au niveau du cordon ou au-dessus, le diagnostic est plus probablement une omphalocèle.
L’exstrophie vésicale à l’IRM se présentera comme une masse de la paroi abdominale infra-ombilicale, avec une insertion basse du cordon ombilical. Comme les reins et les uretères devraient être normaux, la quantité de liquide amniotique sera normale. Un diastasis de la symphyse pubienne peut également être observé.
Les constatations échographiques prénatales évocatrices de malformations cloacales classiques comprennent un à deux kystes adjacents visibles dans le bassin fœtal féminin, une ascite transitoire, et une position haute du rectum avec dilatation proximale et amincissement distal émoussé ou en bec, ainsi qu’une hydronéphrose et une mégavessie. Les signes les plus spécifiques étayant le diagnostic de malformation cloacale sont un côlon dilaté rempli de liquide avec des entérolithes et la présence de méconium dans les voies urinaires. Des éléments supplémentaires à l’IRM fœtale évocateurs d’exstrophie cloacale comprennent l’absence de vessie avec un volume de liquide amniotique normal, un contour pelvien antérieur protubérant, l’absence de méconium dans l’intestin et un omphalocèle.43 L’IRM fœtale peut également contribuer à l’identification du nombre et de la localisation des orifices périnéaux.
En cas de sinus urogénital persistant, l’échographie fœtale peut montrer un hydrométrocolpos sous la forme d’une lésion oblongue, anéchoïque et cloisonnée située en arrière de la vessie fœtale.44 En IRM, un sinus urogénital se présentera avec un calibre normal du rectum et du côlon. Le signal du méconium sera également normal. L’orifice ano-périnéal sera en position physiologique. Il existera un canal urogénital commun avec un orifice au niveau du périnée, à l’emplacement où devrait se trouver l’urètre.45
Options de traitement
Du point de vue urologique, la plupart des interventions prénatales sont effectuées en cas d’obstruction des voies urinaires basses. Ces interventions sont réalisées pour lever l’obstruction, dans le but d’optimiser la fonction rénale et de normaliser la quantité de liquide amniotique afin de prévenir les lésions liées à l’oligoamnios.
Il existe actuellement deux interventions largement acceptées pour la LUTO prénatale : la pose d’un shunt vésico-amniotique et la cystoscopie fœtale. L’intervention fœtale vise principalement la décompression des voies urinaires supérieures afin de prévenir la poursuite des lésions du parenchyme rénal et de restaurer le volume de liquide amniotique nécessaire au développement pulmonaire. Avant d’envisager toute intervention prénatale, une évaluation est nécessaire pour apprécier le risque lié à l’intervention et doit débuter par deux vésicocentèses consécutives.46,47,48,49 En association avec l’aspect échographique des reins, le recours aux critères de Glick peut servir de facteur pronostique pour une intervention fœtale ultérieure, en complément d’une intervention thérapeutique (Tableau 1).50 Il convient de noter que cette évaluation pronostique n’est pas ajustée en fonction de l’âge fœtal et ne reflète pas nécessairement la fonction postnatale.48
Tableau 1 Critères pronostiques pour le fœtus atteint d’uropathie obstructive
| Fonction prédite | État du liquide amniotique au moment de la présentation initiale | Aspect échographique des reins | Urine fœtale – sodium (mEq/mL) | Urine fœtale – chlorure (mEq/mL) | Urine fœtale – osmolarité (mOsm) | Débit urinaire fœtal (mL/heure) |
|---|---|---|---|---|---|---|
| Mauvaise | Modérément à sévèrement diminué | Échogène à kystique | > 100 | > 90 | > 210 | < 2 |
| Bonne | Normal à modérément diminué | Normal à échogène | < 100 | < 90 | < 210 | > 2 |
Dérivation vésico-amniotique
La dérivation vésico-amniotique est réalisée sous anesthésie locale, sous guidage échographique bidimensionnel en temps réel.51,52 Selon une technique stérile, un cathéter vésico-amniotique est inséré percutanément, avec un positionnement optimal où l’extrémité distale du shunt se trouve dans la vessie fœtale et l’extrémité proximale dans la cavité amniotique (Figure 9)52 Les premiers modèles décrivent l’utilisation de cathéters pigtail à double extrémité, tandis que des études plus récentes ont exploré les cathéters à double panier comme modalité alternative. Des résultats variables ont été rapportés, avec des taux de survie allant de 41 % à 80 %, selon la sélection des patients,53,54 L’essai randomisé PLUTO le plus récent a rencontré des difficultés importantes de recrutement des patients, conduisant à l’arrêt prématuré de l’étude alors qu’il cherchait à apporter davantage de précisions sur l’utilité de la dérivation vésico-amniotique.52 Cette étude, ainsi que d’autres petites analyses rétrospectives et des données anecdotiques, a montré une amélioration de la survie périnatale,53,54,55 bien que les résultats à plus long terme demeurent incertains. Toutes les études soulignent la nécessité de mener d’autres études prospectives, randomisées contrôlées pour cette intervention.
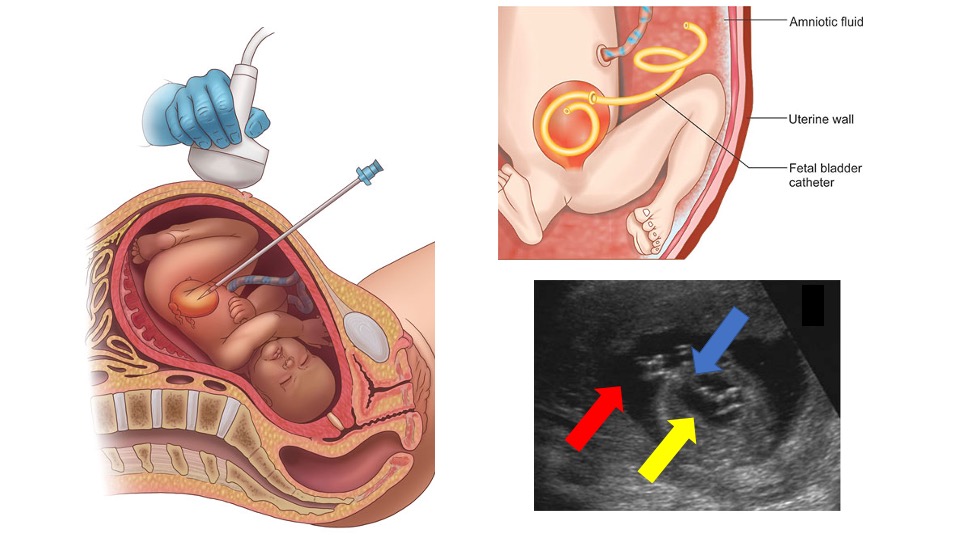
Figure 9 Représentation du guidage échographique pour la mise en place d’un shunt vésico-amniotique, de la position finale du shunt, et d’une échographie montrant le shunt (flèche bleue) au sein de la vessie (flèche jaune) et de la cavité amniotique (flèche rouge).
Cystoscopie
La cystoscopie fœtale in utero a été rapportée pour la première fois en 1995.56 Bien que techniquement plus complexe que la dérivation vésico-amniotique, cette intervention permet une visualisation directe, l’établissement d’un diagnostic spécifique et un traitement éventuel au moment du diagnostic. Un trocart plus grand que celui utilisé pour la dérivation vésico-amniotique est employé et un fœtoscope de 1.0–1.3 mm dans une gaine courbe offrant un champ de vision d’au moins 70° est utilisé.57 L’une des anomalies les plus fréquentes observées lors de la cystoscopie fœtale est la présence de valves urétrales postérieures (PUV). Si une structure membraneuse est observée en cystoscopie et que des PUV sont diagnostiquées, une fulguration au laser, une hydroablation ou une perforation au fil-guide peuvent être utilisées comme méthodes d’intervention immédiate (Figure 10)58 La sténose urétrale est un diagnostic cystoscopique peropératoire qui peut être traitée avec succès par la mise en place d’un stent urétral sur un fil-guide.57 Si, en revanche, une atrésie urétrale est diagnostiquée, la perforation de l’urètre n’est pas tentée, et un VAS est réalisé.59
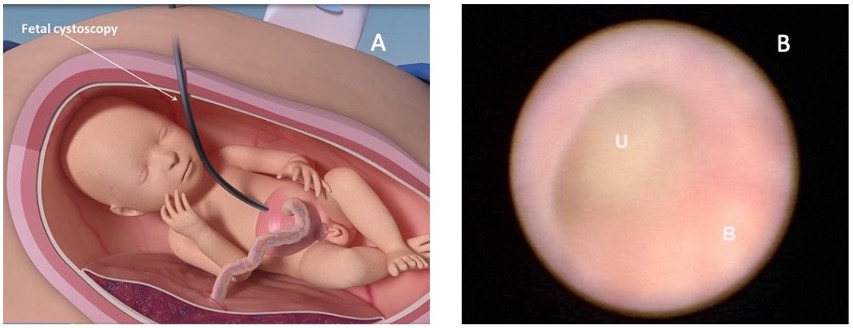
Figure 10 L’image A illustre la manière dont la cystoscopie fœtale est réalisée. L’image B montre une vue cystoscopique fœtale à l’intérieur de la vessie (B) et le point d’obstruction au niveau de l’urètre (U). Image tirée de : Prenatal regenerative fetoscopic interventions for congenital anomalies. SBRE 2020.
Une vidéo présentant une intervention fœtale pour LUTO est disponible (Vidéo 3). En outre, un podcast passant en revue les interventions prénatales pour LUTO est disponible.
Vidéo 3. Illustration d'une intervention fœtale pour LUTO.
Complications
Les interventions prénatales pour la LUTO ne sont pas dénuées de risques et de complications possibles. Un risque associé à la fois à la VAS et à la cystoscopie fœtale in utero est la rupture prématurée des membranes, pouvant entraîner un accouchement prématuré.60 Les complications de la dérivation vésico-amniotique comprennent un risque d’obstruction et de migration du shunt, pouvant tous deux entraîner le décès fœtal.55 Par ailleurs, des cas de malposition du shunt dans des organes intra-abdominaux environnants ont été rapportés.61 La cystoscopie fœtale avec ablation laser a été associée à un taux de fistule de 10 %, lequel variait de manière statistiquement significative selon l’âge gestationnel, l’utilisation de gaines courbes versus semi-courbes, le type et les réglages du laser, ainsi que l’expérience de l’opérateur.62
Conclusions
Les anomalies urologiques sont fréquemment détectées lors de l’examen anatomique fœtal complet de routine du deuxième trimestre. L’anomalie la plus fréquemment identifiée est l’hydronéphrose prénatale, généralement transitoire. Cependant, d’autres anomalies génito-urinaires détectées en période prénatale peuvent avoir un pronostic plus défavorable. En particulier, une obstruction des voies urinaires basses peut entraîner une morbidité et une mortalité fœtales importantes. Parfois, un traitement prénatal peut être indiqué pour tenter de préserver la fonction rénale et prévenir l’hypoplasie pulmonaire.
Points clés
- L’hydronéphrose anténatale est observée dans 1–5 % de toutes les grossesses et représente le diagnostic prénatal le plus fréquent.
- Le diamètre antéro-postérieur prénatal du bassinet rénal ( APRPD) inférieur à 4 mm entre les semaines 16–27 de gestation et inférieur à 7 mm à la semaine 28 ou au-delà de la gestation sont considérés comme relevant de la plage physiologique.
- De nombreuses affections et anomalies urogénitales sont détectées par l’imagerie prénatale. Beaucoup d’entre elles peuvent être diagnostiquées par échographie, l’IRM fœtale apportant une clarification accrue.
- Une obstruction des voies urinaires basses sans intervention peut entraîner une morbidité et une mortalité marquées chez le fœtus. Bien que plusieurs modalités thérapeutiques existent, des études à grande échelle sont nécessaires pour déterminer leur efficacité à préserver la fonction rénale et à prévenir l’hypoplasie pulmonaire.
Lectures recommandées
- Lee RS, Cendron M, Kinnamon DD, Nguyen HT. Antenatal Hydronephrosis as a Predictor of Postnatal Outcome: A Meta-analysis. Pediatrics 2006; 118 (2): 586–593. DOI: 10.1542/peds.2006-0120.
- Mallik M, Watson AR. Antenatally detected urinary tract abnormalities: more detection but less action. Pediatr Nephrol 2008; 23 (6): 897–904. DOI: 10.1007/s00467-008-0746-9.
- Fernbach SK, Maizels M, Conway JJ. Ultrasound grading of hydronephrosis: Introduction to the system used by the society for fetal urology. Pediatr Radiol 1993; 23 (6): 478–480. DOI: 10.1007/bf02012459.
- Nguyen HT, Benson CB, Bromley B, Campbell JB, Chow J, Coleman B, et al.. Faculty Opinions recommendation of Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2014; 0 (6): 82–98. DOI: 10.3410/f.725257762.793506733.
- Haeri S. Fetal Lower Urinary Tract Obstruction (LUTO): a practical review for providers. Matern Health Neonatol Perinatol 0AD; 1 (1). DOI: 10.1186/s40748-015-0026-1.
Références
- Bronshtein M, Yoffe N, Brandes JM, Blumenfeld Z. First and early second-trimester diagnosis of fetal urinary tract anomalies using transvaginal sonography. Prenat Diagn 1990; 10 (10): 653–666. DOI: 10.1002/pd.1970101005.
- Corteville JE, Gray DL, Crane JP. Congenital hydronephrosis: Correlation of fetal ultrasonographic findings with infant outcome. Am J Obstet Gynecol 1991; 165 (2): 384–388. DOI: 10.1016/0002-9378(91)90099-d.
- Mallik M, Watson AR. Antenatally detected urinary tract abnormalities: more detection but less action. Pediatr Nephrol 2008; 23 (6): 897–904. DOI: 10.1007/s00467-008-0746-9.
- Alcaraz A, Vinaixa F, Tejedo-Mateu A, Forés MM, Gotzens V, Mestres CA, et al.. Obstruction and Recanalization of the Ureter during Embryonic Development. J Urol 1991; 145 (2): 410–416. DOI: 10.1016/s0022-5347(17)38354-4.
- Saphier CJ, Gaddipati S, Applewhite LE, Berkowitz RL. Prenatal Diagnosis And Management Of Abnormalities In The Urologic System. Clin Perinatol 2000; 27 (4): 921–945. DOI: 10.1016/s0095-5108(05)70058-0.
- Glibert WM, Moore TR, Brace RA. Amniotic fluid volume dynamics. Fetal Matern Med Rev 1991; 3 (2): 89–104. DOI: 10.1017/s0965539500000486.
- Rabinowitz R, Peters MT, Vyas S, Campbell S, Nicolaides KH. Measurement of fetal urine production in normal pregnancy by real-time ultrasonography. Am J Obstet Gynecol 1989; 161 (5): 1264–1266. DOI: 10.1016/0002-9378(89)90679-0.
- Pitkin R. Potter EL. Bilateral absence of ureters and kidneys: a report of 50 cases. Obstet Gynecol 1965;25:3–12. Obstet Gynecol 0AD; 101 (6): 1159. DOI: 10.1016/s0029-7844(02)02394-3.
- Renkema KY, Winyard PJ, Skovorodkin IN, Levtchenko E, Hindryckx A, Jeanpierre C, et al.. Congenital anomalies of the kidney and urinary tract (CAKUT). Lijec Vjesn 2011; 144 (Supp 1): 843–851. DOI: 10.26800/lv-144-supl1-26.
- Hogan J, Dourthe M-E, Blondiaux E, Jouannic J-M, Garel C, Ulinski T. Renal outcome in children with antenatal diagnosis of severe CAKUT. Pediatr Nephrol 2012; 27 (3): 497–502. DOI: 10.1007/s00467-011-2068-6.
- Lee RS, Cendron M, Kinnamon DD, Nguyen HT. Antenatal Hydronephrosis as a Predictor of Postnatal Outcome: A Meta-analysis. Pediatrics 2006; 118 (2): 586–593. DOI: 10.1542/peds.2006-0120.
- Shih VE, Laframboise R, Mandell R, Pichette J. Neonatal form of the hyperornithinaemia, hyperammonaemia, and homocitrullinuria (HHH) syndrome and prenatal diagnosis. Prenat Diagn 0AD; 12 (9): 717–723. DOI: 10.1002/pd.1970120905.
- Harrison MR, Golbus MS, Filly RA, Nakayama DK, Callen PW, Lorimier AAde, et al.. Management of the fetus with congenital hydronephrosis. J Pediatr Surg 1982; 17 (6): 728–742. DOI: 10.1016/s0022-3468(82)80437-5.
- Paces-Fessy M, Fabre M, Lesaulnier C, Cereghini S. Hnf1b and Pax2 cooperate to control different pathways in kidney and ureter morphogenesis. Hum Mol Genet 2012; 21 (14): 3143–3155. DOI: 10.1093/hmg/dds141.
- Allison SJ. Ret signaling reveals insights into the pathogenesis of CAKUT. Nat Rev Nephrol 2012; 8 (8): 432–432. DOI: 10.1038/nrneph.2012.119.
- Clayton DB, Brock JW. Prenatal Ultrasound and Urological Anomalies. Pediatr Clin North Am 0AD; 59 (4): 739–756. DOI: 10.1016/j.pcl.2012.05.003.
- Grignon A, Filion R, Filiatrault D, Robitaille P, Homsy Y, Boutin H, et al.. Urinary tract dilatation in utero: classification and clinical applications. Radiology 1986; 160 (3): 645–647. DOI: 10.1148/radiology.160.3.3526402.
- Kajbafzadeh A-M, Payabvash S, Sadeghi Z, Elmi A, Jamal A, Hantoshzadeh Z, et al.. Comparison of magnetic resonance urography with ultrasound studies in detection of fetal urogenital anomalies. J Pediatr Urol 2008; 4 (1): 32–39. DOI: 10.1016/j.jpurol.2007.07.005.
- Chalouhi GE, Millischer A-É, Mahallati H, Siauve N, Melbourne A, Grevent D, et al.. The use of fetal MRI for renal and urogenital tract anomalies. Prenat Diagn 2020; 40 (1): 100–109. DOI: 10.1002/pd.5610.
- Werner H, Lopes J, Ribeiro G, Jésus NR, Santos GR, Alexandria HAF, et al.. Three-dimensional virtual cystoscopy: Noninvasive approach for the assessment of urinary tract in fetuses with lower urinary tract obstruction. Prenat Diagn 2020; 37 (13): 1350–1352. DOI: 10.1002/pd.5188.
- Swenson DW, Darge K, Ziniel SI, Chow JS. Characterizing upper urinary tract dilation on ultrasound: a survey of North American pediatric radiologists’ practices. Pediatr Radiol 2015; 45 (5): 686–694. DOI: 10.1007/s00247-014-3221-8.
- Mure P-Y, Mouriquand P. Upper urinary tract dilatation: Prenatal diagnosis, management and outcome. Semin Fetal Neonatal Med 2008; 13 (3): 152–163. DOI: 10.1016/j.siny.2007.09.010.
- Mouriquand PDE, Whitten M, Pracros J-P. Pathophysiology, diagnosis and management of prenatal upper tract dilatation. Prenat Diagn 2001; 21 (11): 942–951. DOI: 10.1002/pd.207.
- Fernbach SK, Maizels M, Conway JJ. Ultrasound grading of hydronephrosis: Introduction to the system used by the society for fetal urology. Pediatr Radiol 1993; 23 (6): 478–480. DOI: 10.1007/bf02012459.
- Nguyen HT, Benson CB, Bromley B, Campbell JB, Chow J, Coleman B, et al.. Faculty Opinions recommendation of Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2014; 0 (6): 82–98. DOI: 10.3410/f.725257762.793506733.
- Onen A. Grading of Hydronephrosis: An Ongoing Challenge. Front Pediatr 0AD; 8 (458). DOI: 10.3389/fped.2020.00458.
- Roo R de, Voskamp BJ, Kleinrouweler CE, Mol BW, Pajkrt E, Bouts AHM. Determination of threshold value for follow-up of isolated antenatal hydronephrosis detected in the second trimester. J Pediatr Urol 2017; 13 (6): 594–601. DOI: 10.1016/j.jpurol.2017.06.001.
- Coplen DE, Austin PF, Yan Y, Blanco VM, Dicke JM. The Magnitude of Fetal Renal Pelvic Dilatation can Identify Obstructive Postnatal Hydronephrosis, and Direct Postnatal Evaluation and Management. Yearbook of Urology 2006; 2007 (2): 237–238. DOI: 10.1016/s0084-4071(08)70187-8.
- Dias CS, Silva JM, Pereira AK, Marino VS, Silva LA, Coelho AM, et al.. Faculty Opinions recommendation of Diagnostic accuracy of renal pelvic dilatation for detecting surgically managed ureteropelvic junction obstruction. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2013; 90 (2): 61–66. DOI: 10.3410/f.718084698.793482695.
- Skoog SJ, Peters CA, Arant BS Jr., Copp HL, Elder JS, Hudson RG, et al.. Pediatric Vesicoureteral Reflux Guidelines Panel Summary Report: Clinical Practice Guidelines for Screening Siblings of Children With Vesicoureteral Reflux and Neonates/Infants With Prenatal Hydronephrosis. Yearbook of Urology 2010; 2011 (3): 205–207. DOI: 10.1016/j.yuro.2010.12.022.
- Dias CS, Bouzada MCF, Pereira AK, Barros PS, Chaves ACL, Amaro AP, et al.. Predictive Factors for Vesicoureteral Reflux and Prenatally Diagnosed Renal Pelvic Dilatation. J Urol 2009; 182 (5): 2440–2445. DOI: 10.1016/j.juro.2009.07.058.
- Chitrit Y, Bourdon M, Korb D, Grapin-Dagorno C, Joinau-Zoulovits F, Vuillard E, et al.. Posterior urethral valves and vesicoureteral reflux: can prenatal ultrasonography distinguish between these two conditions in male fetuses? Prenat Diagn 2016; 36 (9): 831–837. DOI: 10.1002/pd.4868.
- Fontanella F, Duin LK, Scheltema PN Adama van, Cohen-Overbeek TE, Pajkrt E, Bekker M, et al.. Prenatal diagnosis of LUTO: improving diagnostic accuracy. Ultrasound Obstet Gynecol 2018; 52 (6): 739–743. DOI: 10.1002/uog.18990.
- Chauvin NA, Epelman M, Victoria T, Johnson AM. Complex Genitourinary Abnormalities on Fetal MRI: Imaging Findings and Approach to Diagnosis. AJR Am J Roentgenol 2012; 199 (2): W222–w231. DOI: 10.2214/ajr.11.7761.
- Moscardi PRM, Katsoufis CP, Jahromi M, Blachman-Braun R, DeFreitas MJ, Kozakowski K, et al.. Re: Prenatal Renal Parenchymal Area as a Predictor of Early End-Stage Renal Disease in Children with Vesicoamniotic Shunting for Lower Urinary Tract Obstruction. J Urol 2018; 204 (5): 1083–1083. DOI: 10.1097/ju.0000000000001254.
- Alkhamis WH, Abdulghani SH, Altaki A. Challenging diagnosis of prune belly syndrome antenatally: a case report. J Med Case Rep 2019; 13 (1): 98. DOI: 10.1186/s13256-019-2120-x.
- Ome M, Wangnapi R, Hamura N, Umbers AJ, Siba P, Laman M, et al.. A case of ultrasound-guided prenatal diagnosis of prune belly syndrome in Papua New Guinea – implications for management. BMC Pediatr 0AD; 13 (1). DOI: 10.1186/1471-2431-13-70.
- Perlman S, Borovitz Y, Ben-Meir D, Hazan Y, Nagar R, Bardin R, et al.. Prenatal diagnosis and postnatal outcome of anterior urethral anomalies. Prenat Diagn 2020; 40 (2): 191–196. DOI: 10.1002/pd.5582.
- Meyers ML, Treece AL, Brown BP, Vemulakonda VM. Imaging of fetal cystic kidney disease: multicystic dysplastic kidney versus renal cystic dysplasia. Pediatr Radiol 2020; 50 (13): 1921–1933. DOI: 10.1007/s00247-020-04755-5.
- Bascietto F, Khalil A, Rizzo G, Makatsariya A, Buca D, Silvi C, et al.. Prenatal imaging features and postnatal outcomes of isolated fetal duplex renal collecting system: A systematic review and meta-analysis. Prenat Diagn 2020; 40 (4): 424–431. DOI: 10.1002/pd.5622.
- Sozubir S, Lorenzo AJ, Twickler DM, Baker LA, Ewalt DH. Prenatal diagnosis of a prolapsed ureterocele with magnetic resonance imaging. Urology 2003; 62 (1): 144. DOI: 10.1016/s0090-4295(03)00152-3.
- Weiss DA, Oliver ER, Borer JG, Kryger JV, Roth EB, Groth TW, et al.. Key anatomic findings on fetal ultrasound and MRI in the prenatal diagnosis of bladder and cloacal exstrophy. J Pediatr Urol 2020; 16 (5): 665–671. DOI: 10.1016/j.jpurol.2020.07.024.
- Clements MB, Chalmers DJ, Meyers ML, Vemulakonda VM. Prenatal Diagnosis of Cloacal Exstrophy: A Case Report and Review of the Literature. Urology 2014; 83 (5): 1162–1164. DOI: 10.1016/j.urology.2013.10.050.
- Giuliani M, Gui B, Laino M, Zecchi V, Rodolfino E, Ninivaggi V, et al.. Persistent Urogenital Sinus: Diagnostic Imaging for Clinical Management. What Does the Radiologist Need to Know? Am J Perinatol 2016; 33 (05): 425–432. DOI: 10.1055/s-0035-1565996.
- Capito C, Belarbi N, Paye Jaouen A, Leger J, Carel J-C, Oury J-F, et al.. Prenatal pelvic MRI: Additional clues for assessment of urogenital obstructive anomalies. J Pediatr Urol 2014; 10 (1): 162–166. DOI: 10.1016/j.jpurol.2013.07.020.
- Craparo FJ, Rustico M, Tassis B, Coviello D, Nicolini U. Fetal Serum \ensuremathβ2-Microglobulin Before and After Bladder Shunting: A 2-Step Approach to Evaluate Fetuses With Lower Urinary Tract Obstruction. J Urol 2007; 178 (6): 2576–2579. DOI: 10.1016/j.juro.2007.08.052.
- FISK NM, RONDEROS-DUMIT D, TANNIRANDORN Y, NICOLINI U, TALBERT D, RODECK CH. Normal amniotic pressure throughout gestation. Bjog 1992; 99 (1): 18–22. DOI: 10.1111/j.1471-0528.1992.tb14385.x.
- Nicolini U, Tannirandorn Y, Vaughan J, Fisk NM, Nicolaidis P, Rodeck CH. Further predictors of renal dysplasia in fetal obstructive uropathy: Bladder pressure and biochemistry of ‘fresh’ urine. Prenat Diagn 1991; 11 (3): 159–166. DOI: 10.1002/pd.1970110305.
- Johnson MP, Freedman AL. Fetal uropathy. Curr Opin Obstet Gynecol 1999. 0AD; 1 (2): 85–94. DOI: 10.1097/00001703-199904000-00011.
- Glick PL, Harrison MR, Golbus MS, Adzick NS, Filly RA, Callen PW, et al.. Management of the Fetus With Congenital Hydronephrosis II: Prognostic Criteria and Selection for Treatment. J Urol 1985; 135 (2): 444–445. DOI: 10.1016/s0022-5347(17)45673-4.
- Kilby MD, Morris RK. Fetal therapy for the treatment of congenital bladder neck obstruction. Nat Rev Urol 2014; 11 (7): 412–419. DOI: 10.1038/nrurol.2014.132.
- Morris RK, Malin GL, Quinlan-Jones E, Middleton LJ, Diwakar L, Hemming K, et al.. The Percutaneous shunting in Lower Urinary Tract Obstruction (PLUTO) study and randomised controlled trial: evaluation of the effectiveness, cost-effectiveness and acceptability of percutaneous vesicoamniotic shunting for lower urinary tract obstruction. Health Technol Assess 2013; 17 (59): –232. DOI: 10.3310/hta17590.
- Manning FA, Harrison MR, Rodeck C, International Fetal Medicine of the, Surgery Society M. Catheter Shunts for Fetal Hydronephrosis and Hydrocephalus. N Engl J Med 1986; 315 (5): 336–340. DOI: 10.1056/nejm198607313150532.
- Won H-S, Kim S-K, Shim J-Y, Ryang Lee P, Kim A. Vesicoamniotic shunting using a double-basket catheter appears effective in treating fetal bladder outlet obstruction. Acta Obstet Gynecol Scand 2006; 85 (7): 879–884. DOI: 10.1080/00016340500449923.
- Morris RK, Malin GL, Quinlan-Jones E, Middleton LJ, Hemming K, Burke D, et al.. Faculty of 1000 evaluation for Percutaneous vesicoamniotic shunting versus conservative management for fetal lower urinary tract obstruction (PLUTO): a randomised trial. F1000 - Post-Publication Peer Review of the Biomedical Literature 2013; 82 (9903): 496–506. DOI: 10.3410/f.718077679.793484579.
- Quintero RA, Johnson MP, Romero R, Cotton DB, Evans MI, Smith C, et al.. In-utero percutaneous cystoscopy in the management of fetal lower obstructive uropathy. Lancet 1995; 346 (8974): 537–540. DOI: 10.1016/s0140-6736(95)91381-5.
- Ruano R, Yoshizaki CT, Giron AM, Srougi M, Zugaib M. Cystoscopic placement of transurethral stent in a fetus with urethral stenosis. Ultrasound Obstet Gynecol 2014; 44 (2): 238–240. DOI: 10.1002/uog.13293.
- Haeri S. Fetal Lower Urinary Tract Obstruction (LUTO): a practical review for providers. Matern Health Neonatol Perinatol 0AD; 1 (1). DOI: 10.1186/s40748-015-0026-1.
- Ruano R, Sananes N, Sangi-Haghpeykar H, Hernandez-Ruano S, Moog R, Becmeur F, et al.. Fetal intervention for severe lower urinary tract obstruction: a multicenter case-control study comparing fetal cystoscopy with vesicoamniotic shunting. Ultrasound Obstet Gynecol 2015; 45 (4): 452–458. DOI: 10.1002/uog.14652.
- Crombleholme TM, Harrison MR, Langer JC, Longaker MT, Anderson RL, Slotnick NS, et al.. Early experience with open fetal surgery for congenital hydronephrosis. J Pediatr Surg 1988; 23 (12): 1114–1121. DOI: 10.1016/s0022-3468(88)80325-7.
- Mann S, Johnson MP, Wilson RD. Fetal thoracic and bladder shunts. Semin Fetal Neonatal Med 2010; 15 (1): 28–33. DOI: 10.1016/j.siny.2009.06.001.
- Sananes N, Favre R, Koh CJ, Zaloszyc A, Braun MC, Roth DR, et al.. Urological fistulas after fetal cystoscopic laser ablation of posterior urethral valves: surgical technical aspects. Ultrasound Obstet Gynecol 2015; 45 (2): 183–189. DOI: 10.1002/uog.13405.
Dernière mise à jour: 2025-09-22 07:59