1: Embryologie des voies urinaires
Ce chapitre prendra environ 22 minutes de lecture.
Introduction
Malgré les différences fonctionnelles entre les voies urinaires et l’appareil reproducteur, les origines embryologiques et le développement de ces systèmes sont intégrés entre eux. Les voies urinaires comprennent les reins, les uretères, la vessie et l’urètre. Ce système a pour fonction d’éliminer les déchets et de maintenir l’équilibre hydrique et électrolytique. Les reins produisent également des hormones qui régulent la pression artérielle, la production d’érythropoïétine et la synthèse de la vitamine D. L’appareil génital est constitué des gonades, des voies génitales et des organes génitaux externes. Ce système synthétise et reçoit des hormones nécessaires à la croissance et au développement, produit et transporte les spermatozoïdes et les ovocytes et, chez la femme, assure et soutient le développement fœtal.
Une compréhension du développement embryologique de l’appareil urogénital fournit une base pour comprendre la fonction anatomique et physiologique de ces organes ainsi que la physiopathologie des structures mal développées. Bien que l’embryologie relative à diverses affections urogénitales soit présentée en détail dans d’autres chapitres, l’objectif de ce chapitre est de fournir un aperçu de l’embryologie de l’appareil urogénital.
Dans cette vue d’ensemble, nous utilisons “masculin” pour désigner les organes génitaux internes et externes qui sont le plus souvent observés chez les personnes ayant le génotype 46,XY et “féminin” pour désigner les organes génitaux internes et externes qui sont le plus souvent observés chez les personnes ayant le génotype 46,XX.
Reins et voies urinaires supérieures
Le développement du rein et des voies urinaires supérieures progresse selon les stades proposés du pronéphros, du mésonéphros et du métanéphros (Figure 1) Le développement de chaque unité rénale donne finalement naissance au parenchyme rénal fonctionnel (composé d’environ 250 000 à 3 millions de néphrons1,2), et au système collecteur : calices mineurs et majeurs, bassinet rénal et uretère.
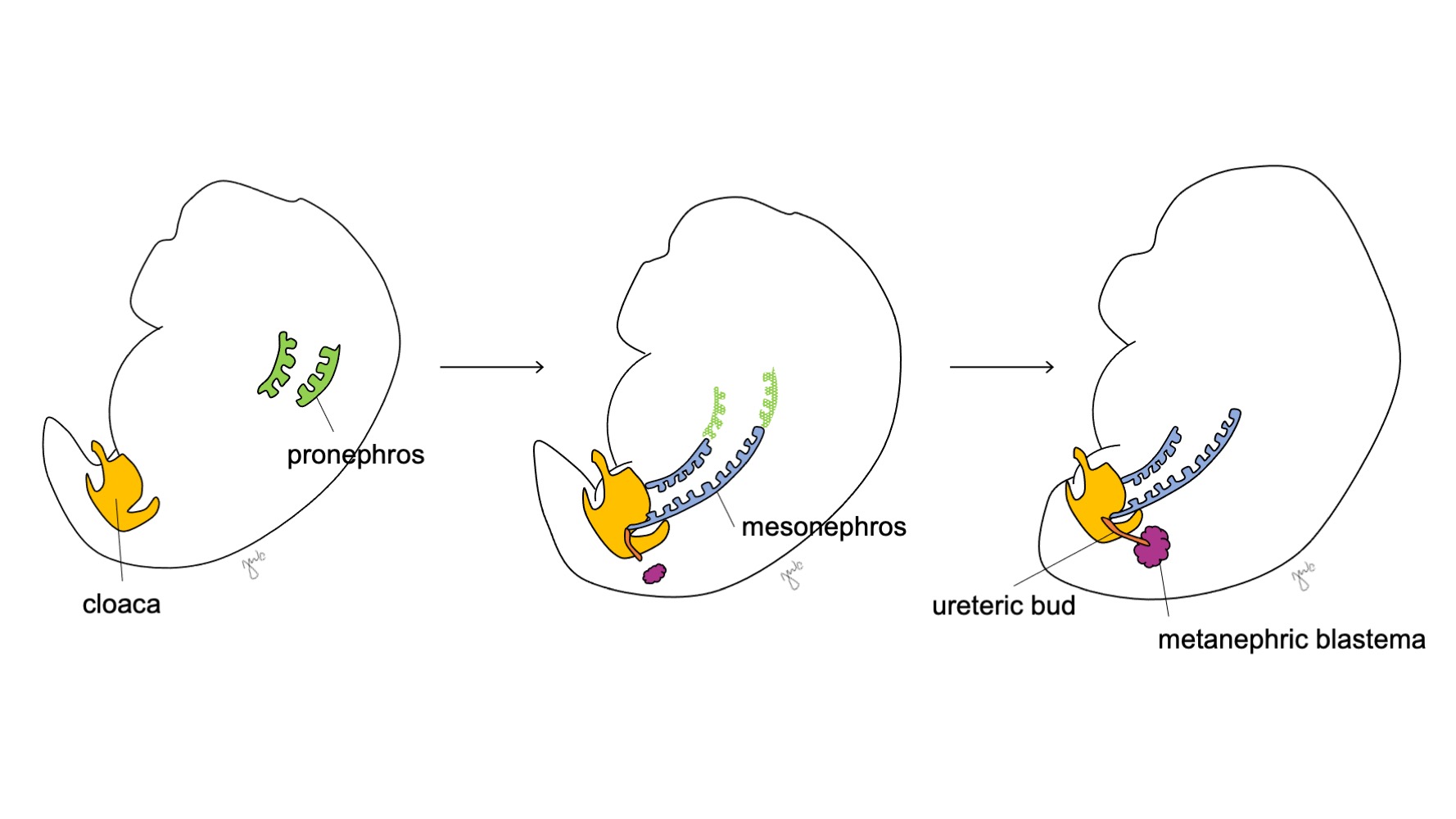
Figure 1 Stades de développement du rein et des voies urinaires supérieures. Le rein se développe en passant par le pronéphros à la 3e semaine (vert), le mésonéphros débutant à la 4e semaine (bleu), et le métanéphros débutant à la 5e semaine de gestation. À mesure que le mésonéphros s’attache à la cloaque, le bourgeon urétéral (orange) apparaît à proximité de cette jonction et fusionne avec le blastème métanéphrogène (bordeaux).
À la 3e semaine de gestation, le mésoderme intermédiaire dans les régions cervicales et thoraciques supérieures se condense pour former le pronéphros. Le pronéphros est une structure primitive et non fonctionnelle constituée de sphères tissulaires creuses et semble jouer un rôle transitoire dans le développement embryologique du rein. Les canaux pronéphriques s’étendent caudalement pour donner naissance aux canaux mésonéphriques et dégénèrent à la fin de la quatrième semaine de gestation. Selon le concept selon lequel l’ontogenèse récapitule la phylogenèse (c.-à-d. le développement embryologique progresse à travers des étapes de l’évolution des espèces), le rôle transitoire du pronéphros humain est proposé au regard de sa fonction dans le rein embryonnaire de divers cordés.3 Cependant, on sait peu de choses sur le pronéphros humain et des structures pronéphriques n’étaient pas détectables lors de l’évaluation d’embryons humains à 3-4 semaines de développement.3
Le mésonéphros apparaît au niveau des vertèbres thoraciques à environ 4 semaines de gestation.3 Vers la fin de la quatrième semaine, le mésonéphros s’étend caudalement pour s’attacher à la cloaque. Le mésonéphros fonctionne comme un rein primitif qui filtre le sang à travers des tubules. Bien que les tubules dégénèrent et que le mésonéphros rétrécisse par rapport à la taille de l’embryon en croissance, les canaux mésonéphriques (de Wolff) persistent bilatéralement et contribuent en outre au développement des voies urinaires (trigone vésical et uretères) et des voies génitales masculines (canal déférent, épididyme, vésicule séminale, appendice de l’épididyme).4
Après l’attachement du mésonéphros au cloaque, le bourgeon urétéral naît de la portion postérieure distale du canal mésonéphrique, près de sa jonction avec le cloaque, à la 5e semaine de gestation.3 Le blastème métanéphrogène apparaît simultanément comme une masse de tissu mésenchymateux agrégé issu du mésoderme intermédiaire. Ensemble, le bourgeon urétéral et le blastème métanéphrogène forment le métanéphros, qui constitue le stade final du développement du rein et des voies urinaires supérieures. Le blastème métanéphrogène et le bourgeon urétéral s’induisent mutuellement pour se développer : le blastème métanéphrogène encapsule et fusionne avec le bourgeon urétéral, et le bourgeon urétéral pénètre le blastème métanéphrogène et commence à se bifurquer. À mesure que le bourgeon urétéral s’allonge pour former l’uretère, il se bifurque pour former le bassinet et les grands calices, qui se ramifient ensuite pour former les petits calices, la pyramide rénale, et finalement les tubes collecteurs du néphron (Figure 2) Pendant ce temps, à mesure que le bourgeon urétéral s’allonge et se bifurque, le blastème métanéphrogène forme des structures du néphron (Figure 3) Le facteur de croissance de l’endothélium vasculaire 2 (VEGF-2) initie la vascularisation au niveau du blastème métanéphrogène.5 Des tubules excréteurs en forme de S acquièrent des capillaires pour former des glomérules, chacun étant enveloppé par une capsule de Bowman. Ces tubules excréteurs s’allongent pour former le tube contourné proximal, l’anse de Henle et le tube contourné distal. Le tube contourné distal s’unit au canal collecteur (issu du bourgeon urétéral) pour former le néphron.
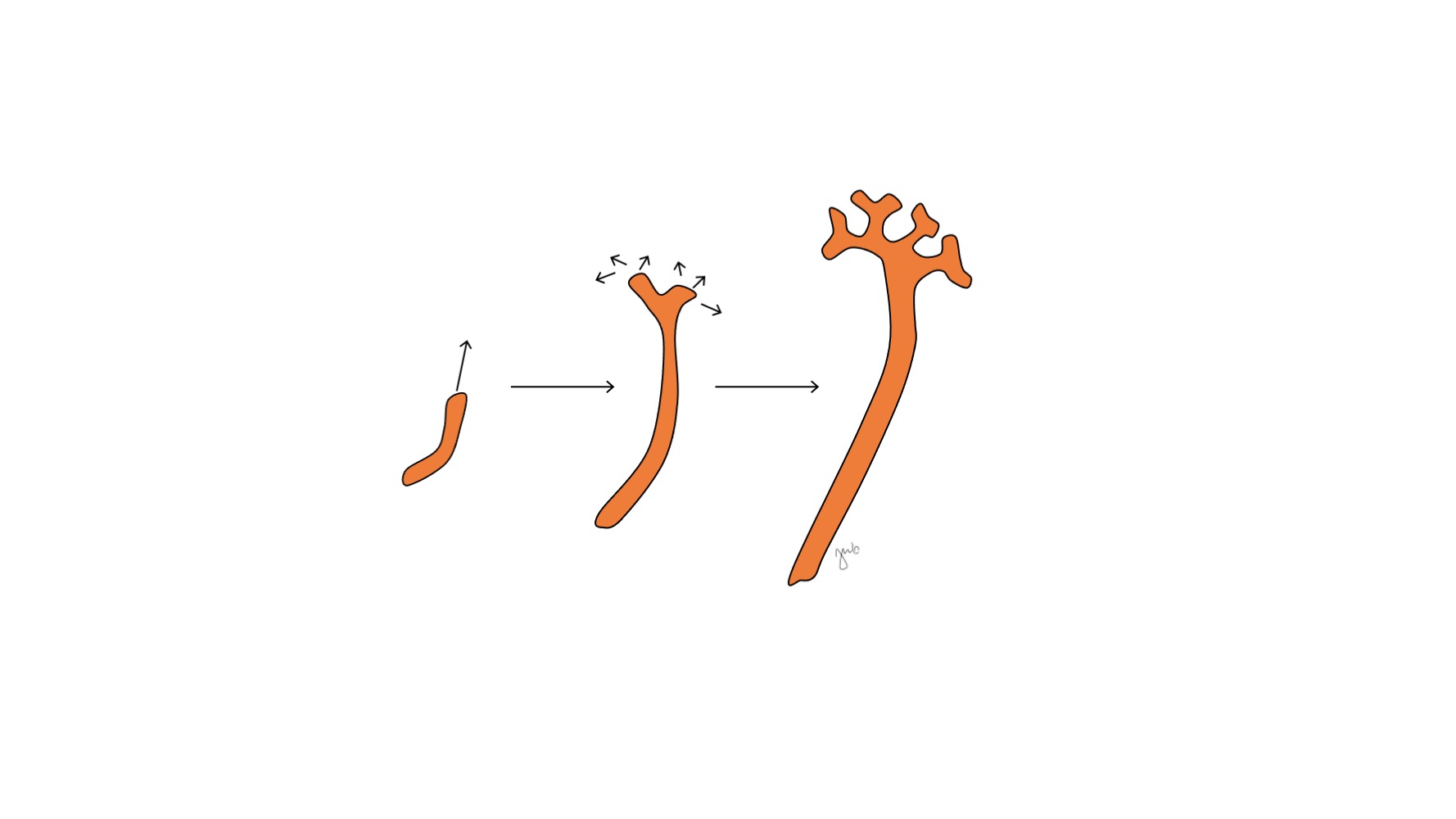
Figure 2 Bourgeon urétéral. Le bourgeon urétéral s’allonge et se ramifie pour former le pelvis rénal, les calices majeurs et mineurs, et le tube collecteur du néphron.
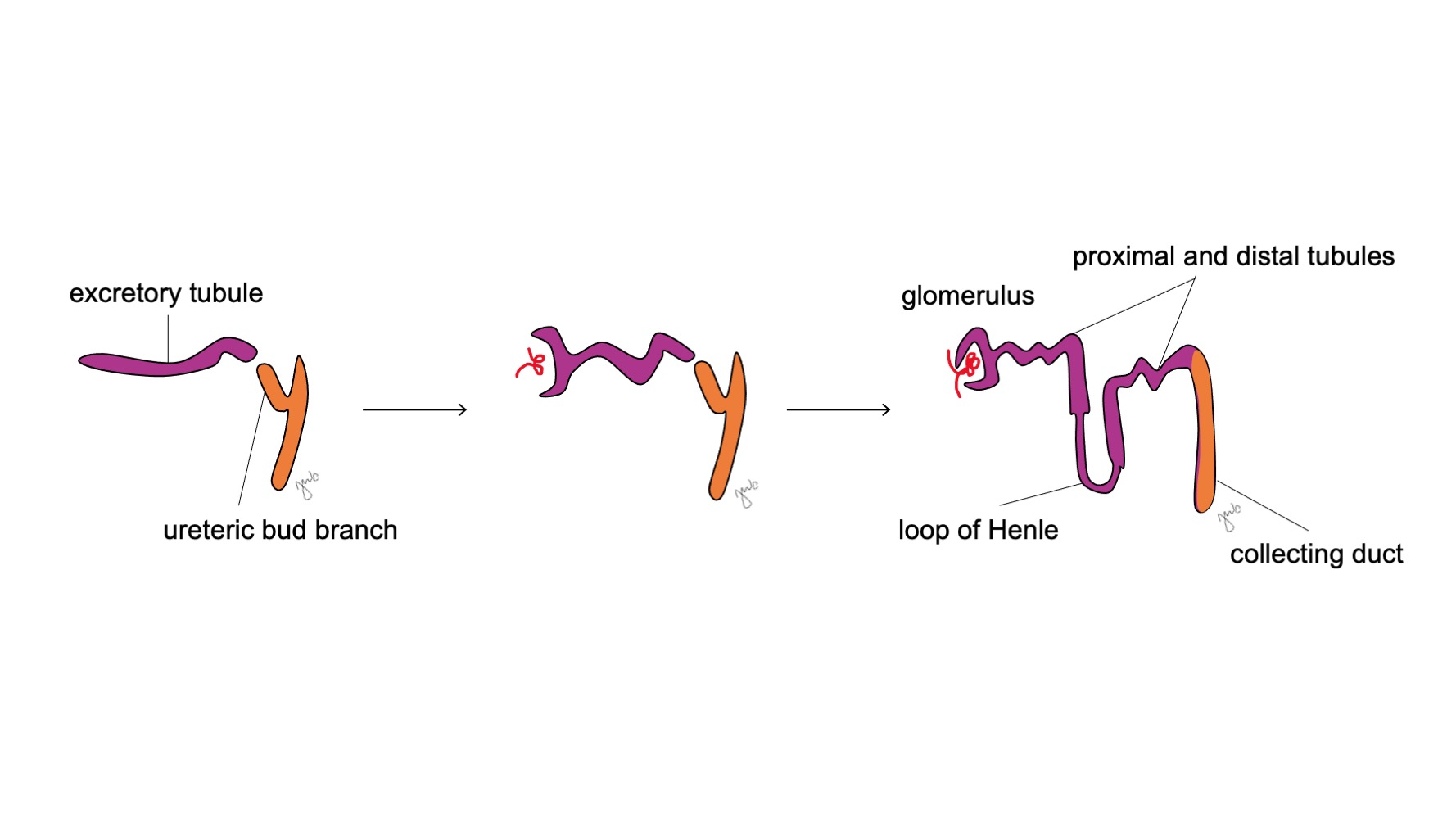
Figure 3 Développement du néphron. Des tubules excréteurs en S (violet ; issus du blastème métanéphrogène) acquièrent des capillaires pour former des glomérules, s’allongent pour former les tubules proximaux et distaux et les anses de Henle, et s’unissent aux canaux collecteurs issus du bourgeon urétéral (orange ; issus des canaux mésonéphriques) pour aboutir à la formation des néphrons.
Le bourgeon urétéral et le blastème métanéphrogène induisent réciproquement la croissance par divers facteurs et interactions moléculaires qui contribuent au développement du métanéphros. La protéine morphogénétique osseuse BMP-4 est exprimée dans le mésenchyme et remplit une double fonction consistant à inhiber le bourgeonnement urétéral et à promouvoir l’élongation urétérale.6 L’expression locale de l’antagoniste de la BMP, gremlin (grem1), permet l’initiation du bourgeonnement urétéral.6,7 Après l’initiation du bourgeonnement urétéral, la BMP-4 favorise ensuite l’élongation et semble participer à la promotion du développement du muscle lisse périurétéral.6,8 La BMP-7, issue du blastème métanéphrogène et du bourgeon urétéral, maintient et sensibilise les progéniteurs néphroniques à la signalisation du bourgeon urétéral.6 Le blastème métanéphrogène sécrète le facteur neurotrophique dérivé des cellules gliales (GDNF), qui induit également la ramification et l’élongation du bourgeon urétéral.9 La glycoprotéine WNT11 est exprimée à l’extrémité du bourgeon urétéral en ramification et contribue à maintenir l’expression de GDNF.10,11 Il existe une interaction réciproque entre WNT11, le GDNF et le récepteur tyrosine kinase RET dans le développement du métanéphros, car des mutations de WNT11 et de RET entraînent des anomalies de ramification et une hypoplasie rénale.11 Les ligands des facteurs de croissance des fibroblastes (FGF) et leurs récepteurs correspondants (FGFR) contribuent également à l’organisation du mésenchyme métanéphrogène, à l’induction du bourgeon urétéral, à la ramification du bourgeon urétéral et à la néphrogenèse.12 En outre, le contact direct avec le mésenchyme favorise également l’élongation du bourgeon urétéral et son patron de ramification.13
Le métanéphros se développe pour devenir le rein fonctionnel et correctement positionné sur le plan anatomique, avec une production urinaire précoce, l’ascension rénale et la revascularisation, ainsi que la rotation rénale. La production d’urine fœtale débute à 10-11 semaines de gestation et devient la composante prédominante du liquide amniotique.14 Les reins sont initialement très proches l’un de l’autre dans la région sacrée de l’embryon.15,16 À mesure que l’embryon croît longitudinalement, chaque rein remonte entre les semaines 6-9 depuis sa localisation pelvienne initiale jusqu’au rétropéritoine supérieur au niveau des régions thoracique inférieure et lombaire supérieure (Figure 4) Des vaisseaux sanguins transitoires se développent et régressent au fur et à mesure de la remontée des reins, jusqu’à ce qu’ils atteignent leur destination finale dans le rétropéritoine supérieur et que se développent les artères et veines rénales définitives. Les reins subissent une rotation de sorte que le bassinet rénal passe d’une orientation antérieure à une orientation médiale.16
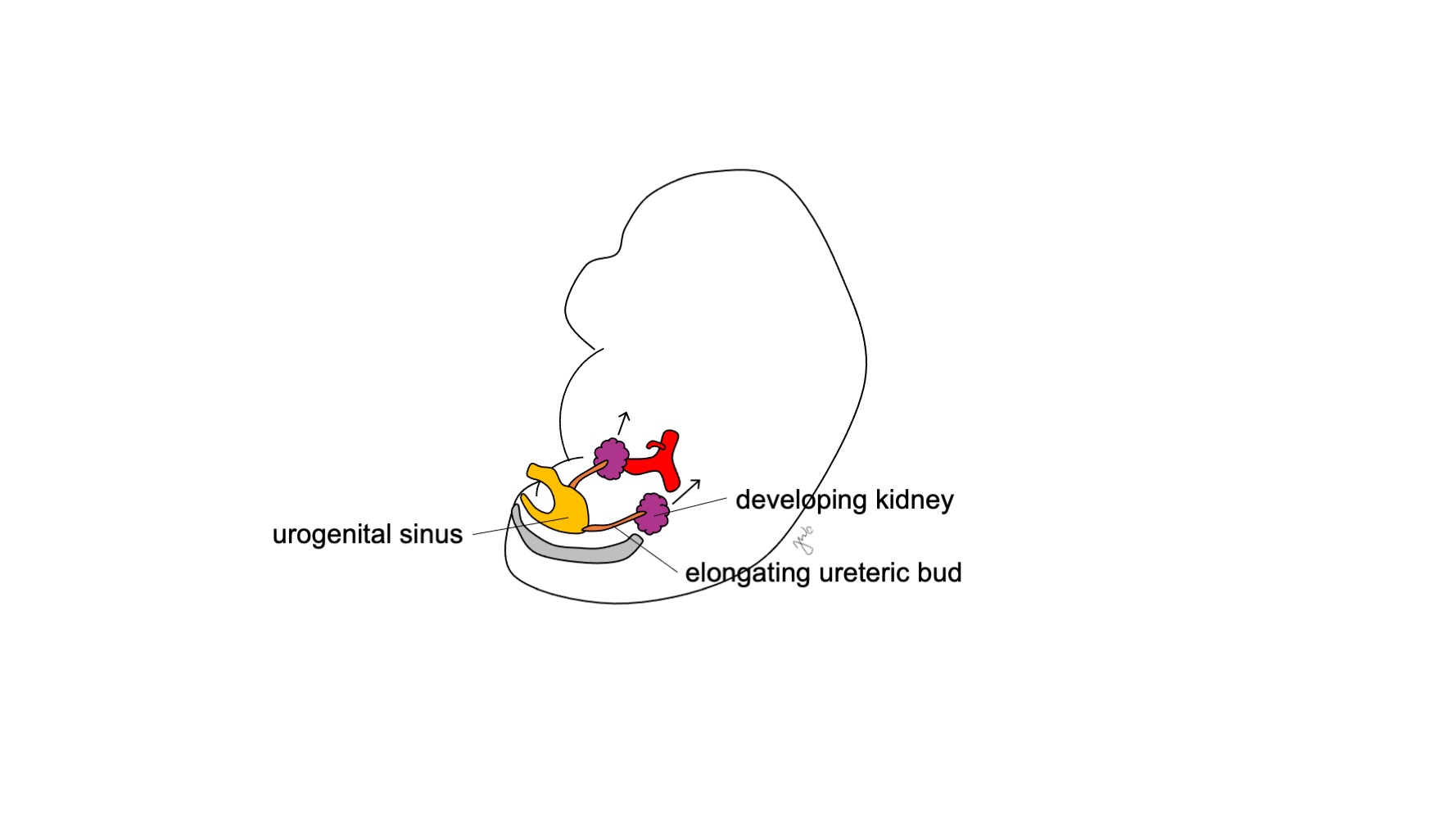
Figure 4 Ascension rénale. Le rein en développement remonte de sa localisation pelvienne vers le rétropéritoine supérieur.
Points clés
Le rein en développement et les voies urinaires supérieures se développent à travers les stades de pronéphros, mésonéphros et métanéphros. Le métanéphros est constitué du blastème métanéphrogène et du bourgeon urétéral, qui se développent respectivement en parenchyme rénal et en système collecteur. Le mésonéphros persiste et contribue au développement du trigone vésical, du système collecteur des voies urinaires supérieures et de l’appareil reproducteur masculin.
Bas appareil urinaire
Le cloaque agit comme une chambre commune pour les voies urogénitales et anorectales, car il est relié à l’allantoïde (sac vitellin) et à l’intestin postérieur. Il s’agit d’une combinaison d’ectoderme tapissée par de l’endoderme, qui s’ouvre par un orifice unique à l’extrémité caudale de l’embryon en développement. Alors que le mésonéphros s’attache au cloaque et que les voies urinaires supérieures se développent sous la forme du métanéphros, les voies urinaires inférieures se développent à partir du cloaque pour former la vessie et l’urètre.
Vers la 7e semaine de gestation, le septum urorectal se développe caudalement, séparant la cloaque en sinus urogénital antérieur et canal anorectal postérieur, et devient finalement le corps périnéal (Figure 5)17 Le sinus urogénital se subdivise ensuite crânialement et caudalement pour former respectivement la vessie et l’urètre.
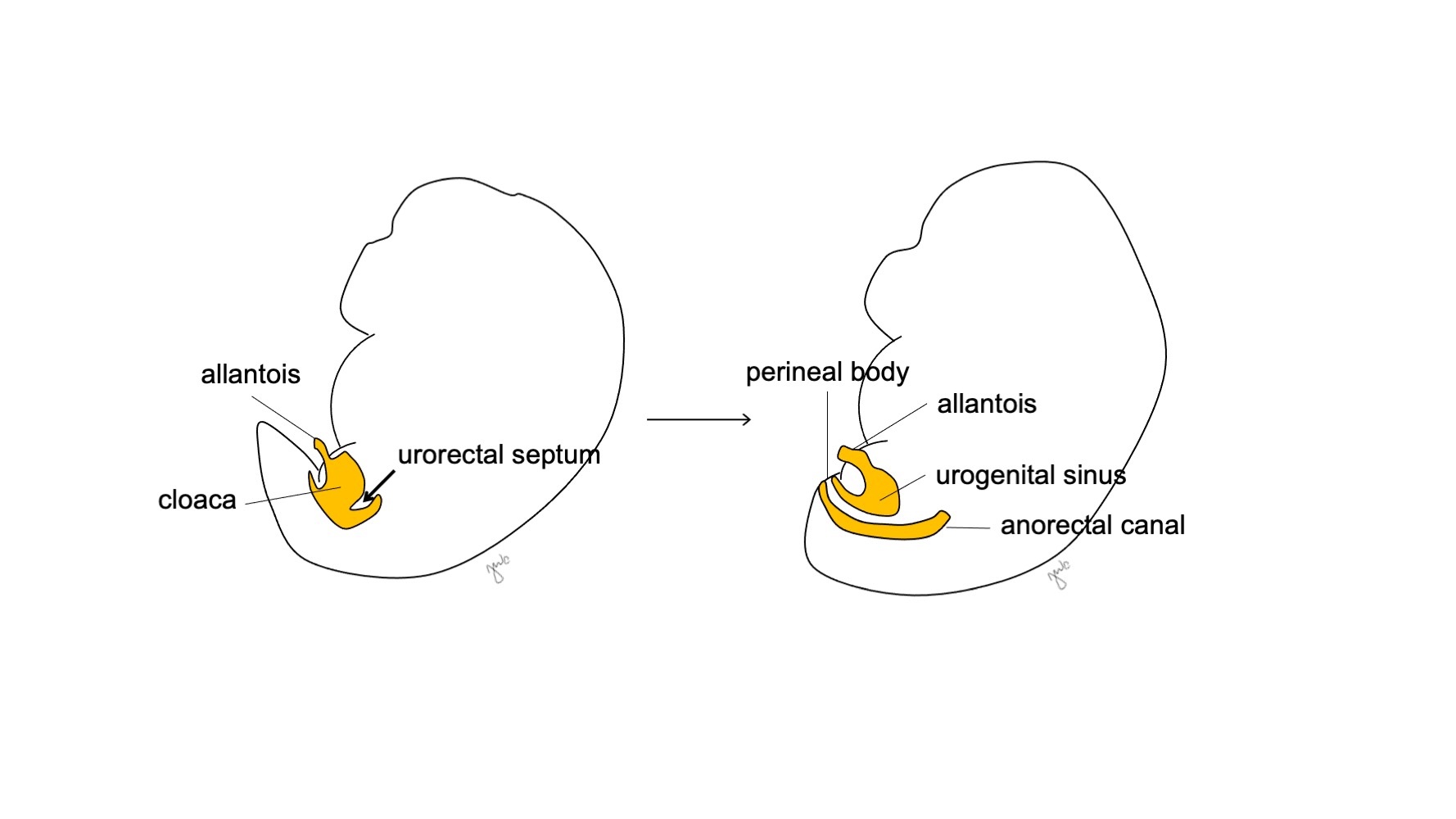
Figure 5 Division cloacale. Le septum urorectal divise le cloaque en sinus urogénital et en canal anorectal. Le septum urorectal se développe ensuite pour devenir le corps périnéal.
La portion crâniale du sinus urogénital s’agrandit et devient la vessie qui est initialement en continuité avec l’allantoïde (Figure 6) Alors que l’endoderme de l’ancien cloaque donne naissance au revêtement urothélial de la vessie.18 la différenciation du muscle lisse vésical repose sur des interactions mésenchymo-épithéliales.19 Le canal mésonéphrique qui était auparavant attaché au cloaque reste attaché à la vessie en développement; il régresse et est incorporé caudalement dans le trigone vésical et les orifices urétéraux. L’apoptose des canaux mésonéphriques induite par la vitamine A, les interactions entre la vessie et le muscle lisse urétéral, et des origines endodermiques sont d’autres mécanismes proposés contribuant au développement du trigone.20,21,22
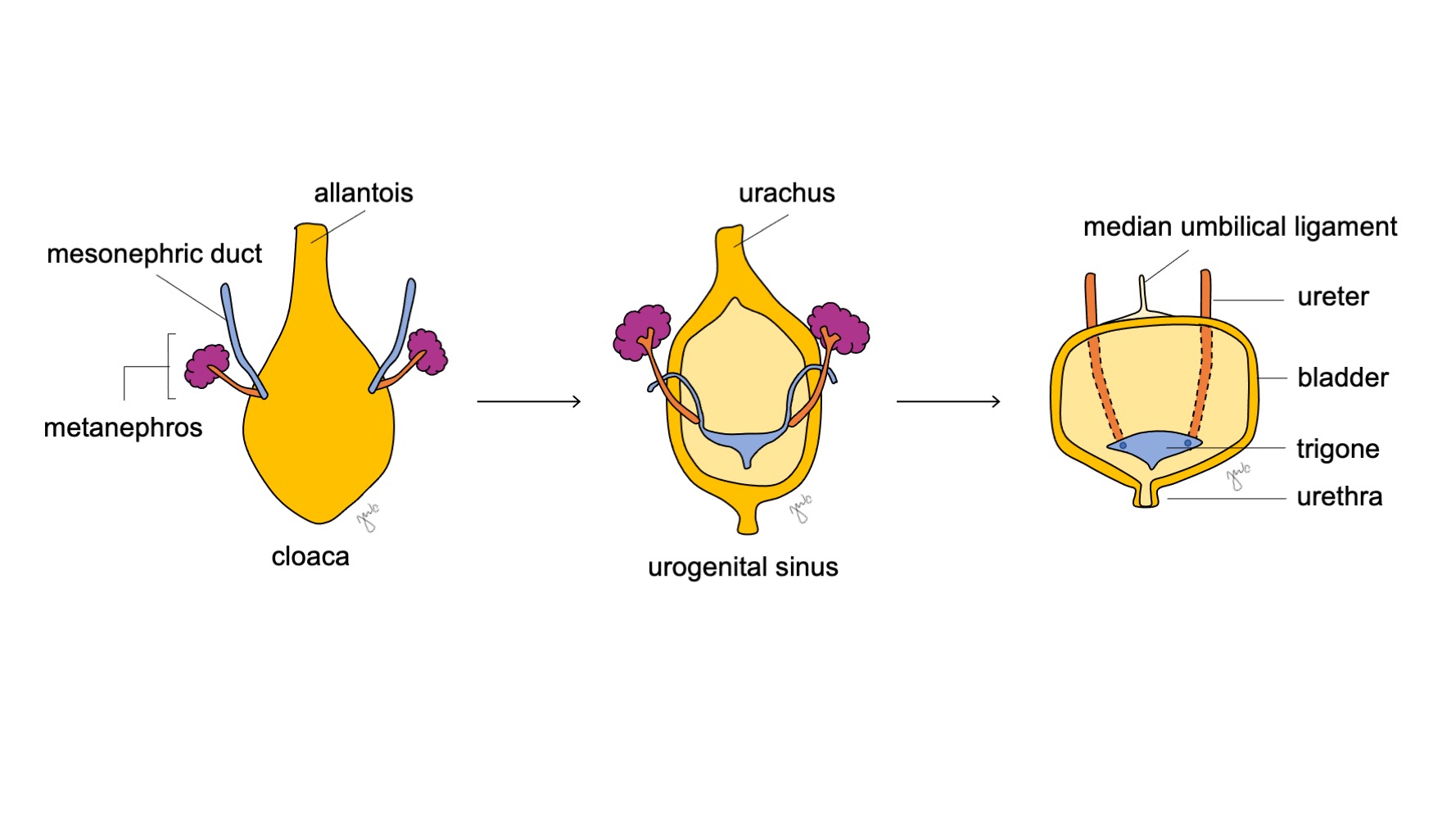
Figure 6 Développement de la vessie. La portion crâniale du sinus urogénital s’agrandit pour devenir la vessie. Le canal mésonéphrique (en bleu) régresse et est incorporé au trigone vésical et aux orifices urétéraux. Parallèlement, l’allantoïde involue et devient l’ouraque, qui se fibrose ensuite pour former le ligament ombilical médian.
Le reste des canaux mésonéphriques se développe ensuite pour former les voies génitales masculines (décrit dans la section gonades et voies génitales). Les dérivés des canaux mésonéphriques s’écartent davantage à mesure que l’embryon poursuit sa croissance : les orifices urétéraux migrent craniolatéralement tandis que les voies génitales masculines migrent caudalement et médialement. Un déplacement du bourgeon urétéral par rapport à la position du canal mésonéphrique peut influencer la localisation finale de l’orifice urétéral et le développement du rein correspondant.23,24 Un déplacement plus modéré peut aboutir à une position craniolatérale ou caudomédiale de l’orifice urétéral, tandis qu’un déplacement sévère peut entraîner un uretère ectopique s’abouchant en dehors de la vessie et/ou une dysplasie rénale.23,24
Au fur et à mesure que la vessie se développe, l’allantoïde involue et devient l’ouraque qui relie le dôme vésical à l’ombilic. Après la naissance, le reliquat ouraquien se fibrose davantage et devient le ligament ombilical médian.25
L’aspect inféro-caudal du sinus urogénital forme l’urètre prostatique et membraneux chez l’homme et l’urètre et le vestibule vaginal chez la femme.25 Comme pour la vessie, le revêtement urothélial de l’urètre dérive de l’endoderme.18 Chez l’homme, le sinus urogénital s’étend jusqu’au tubercule génital pour former l’urètre prostatique et membraneux, tandis que ses plis urogénitaux associés forment l’urètre pénien.18,26 Des ramifications et des bourgeonnements supplémentaires à partir de l’urètre prostatique forment les glandes prostatiques vers 9-10 semaines de gestation.27 Le stroma prostatique provient du mésenchyme et se développe sous l’influence des androgènes et de la signalisation paracrine impliquant de multiples facteurs, notamment FGF, sonic hedgehog (SHH), le facteur de transcription Nkx3.1, les gènes homeobox (HOX), les facteurs de transcription forkhead box (FOX), le facteur de transcription SRY-box (SOX-9), BMP et WNT.27,28,29,30,31 Bien que la testostérone puisse contribuer au développement prostatique, la dihydrotestostérone (DHT) a un effet beaucoup plus puissant sur la prostate.27 Le mésenchyme prostatique forme le tissu stromal et le muscle lisse entourant les glandes et les canaux prostatiques. Chez l’homme, les glandes bulbo-urétrales (de Cowper) se forment par bourgeonnement à partir de l’urètre. L’urètre pénien se forme lorsque la plaque urétrale se tubulise18,26 (abordé dans la section organes génitaux externes). Le développement de la portion glandulaire de l’urètre est actuellement débattu et pourrait résulter d’une tubulisation avec différenciation endodermique ultérieure en épithélium pavimenteux selon des études plus récentes.18,32,33
Chez la femme, le sinus urogénital forme l’urètre entier et la partie distale du vagin. Homologues des glandes prostatiques chez l’homme, la portion crâniale de l’urètre forme les glandes para-urétrales (de Skene). Homologues des glandes bulbo-urétrales (de Cowper) chez l’homme, les glandes de Bartholin se forment par bourgeonnement à partir de l’urètre.
Points clés
Le cloaque est initialement une cavité commune qui est divisée par le septum urorectal pour former le sinus urogénital et le canal anorectal. Le sinus urogénital s’agrandit ensuite crânialement pour former la vessie et contribue à la formation de l’urètre dans les deux sexes. L’allantoïde involue simultanément pour former l’ouraque, qui deviendra plus tard le ligament ombilical médian.
Gonades et voies génitales
Les gonades et les voies génitales internes des sexes masculin et féminin sont initialement indifférenciés. L’influence de facteurs génétiques et hormonaux détermine le développement, conduisant soit à la formation des testicules et des structures mésonéphriques (wolffiennes) associées, soit à la formation des ovaires et des structures paramésonéphriques (müllériennes) associées.
Au cours de la 5e semaine de gestation, la prolifération et la condensation de l’épithélium germinal et du mésenchyme forment la crête gonadique adjacente au mésonéphros. Cellules germinales primordiales sont intégrées à des amas d’épithélium appelés cordons sexuels. Les cordons sexuels s’invaginent dans le tissu mésenchymateux local et permettent la migration des cellules germinales primordiales à travers la cavité du sac vitellin jusqu’à la crête gonadique à 6 semaines.34 À mesure que les cellules germinales et les cordons sexuels se regroupent au niveau de la crête gonadique, les régions corticale et médullaire de la gonade se développent.35,36 Les facteurs WNT4 et SOX-9 sont exprimés au niveau des crêtes gonadiques et leur expression varie dans la détermination sexuelle humaine.37 La formation de la gonade est également régulée par des facteurs de transcription, dont Wilms tumor 1 (WT1), LIM homeobox 9 (LHX9) et steroidogenesis factor 1 (SF1).38
Les gonades indifférenciées sont bipotentielles (Figure 7) et les cellules germinales primordiales ont la capacité de se différencier en spermatogonies chez le mâle ou en oogonies chez la femelle jusqu’à la septième semaine de gestation.38 Les canaux mésonéphriques (de Wolff) et les canaux paramésonéphriques (de Müller) sont également bipotentiels à ce stade.
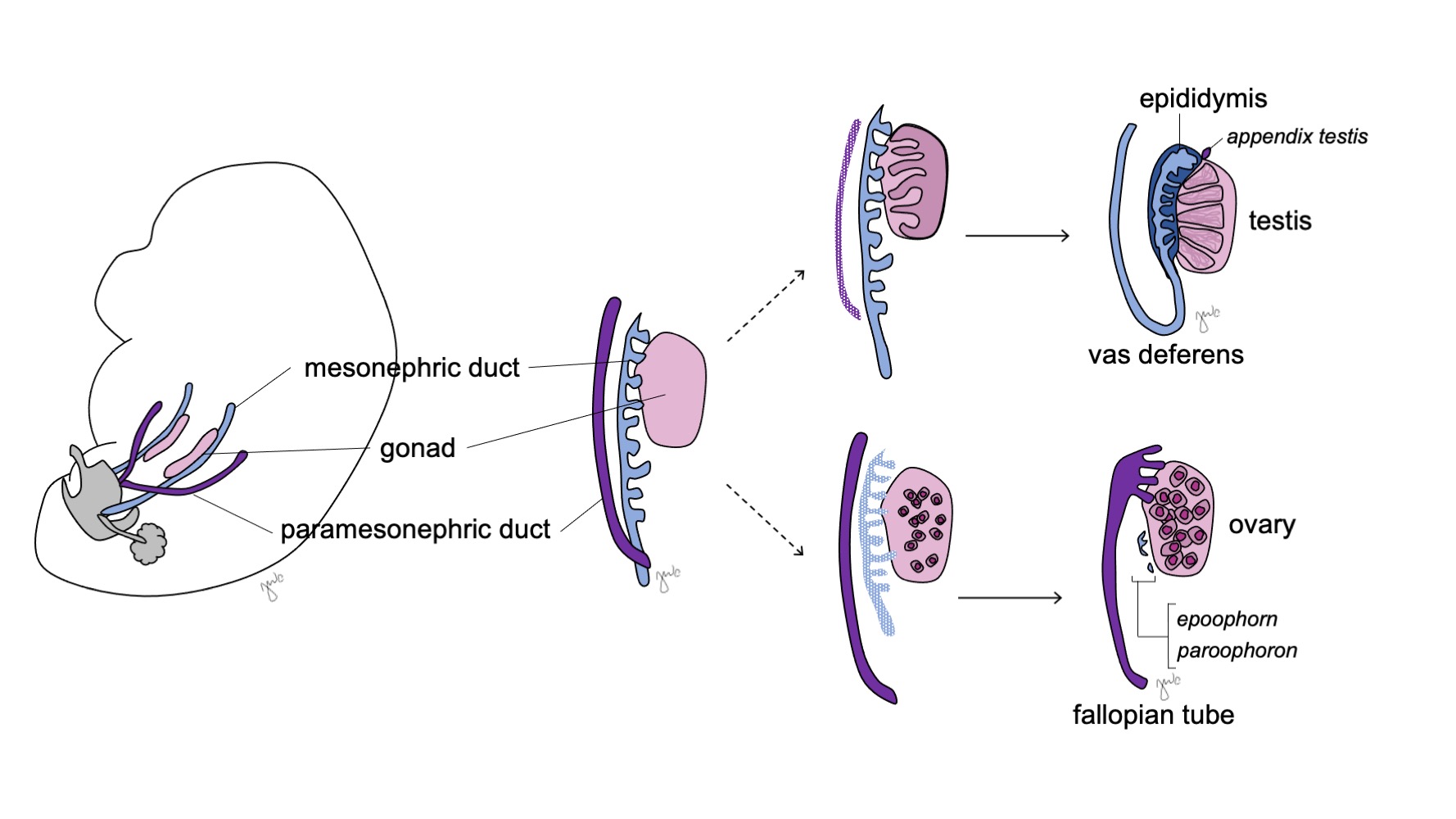
Figure 7 Différenciation gonadique. La gonade (rose) se différencie généralement soit en testicule avec les structures correspondantes du canal mésonéphrique (bleu), soit en ovaire avec les structures correspondantes du canal paramésonéphrique (violet).
La gonade masculine et le tractus reproducteur
Chez les mâles, la gonade indifférenciée devient le testicule et les canaux mésonéphriques (de Wolff) deviennent l’épididyme, l’appendice de l’épididyme, le canal déférent, la vésicule séminale et le canal éjaculateur.
Le gène SRY (sexe-déterminant région du Y-chromosome) (également connu sous le nom de facteur déterminant du testicule [TDF]) est situé sur le bras court du chromosome Y au locus Yp11.3 et initie la différenciation sexuelle masculine.39,40 La protéine SRY correspondante et les facteurs de transcription issus des gènes SOX-9, DAX-1, WT1 et SF1 influencent la différenciation gonadique,.% cite mcelreavey1995a vilain1998a –file 01-01 %} Il a été montré que SRY augmente l’expression de SOX-9 afin d’activer l’expression de SF1 et de favoriser la différenciation des cellules de Sertoli et de Leydig.37,41,42 Les cordons sexuels gonadiques primitifs s’organisent en rete testis et en cordons séminifères. Les cellules de Sertoli et les cellules de Leydig se développent entre les cordons séminifères et initient une production hormonale qui favorise la différenciation masculine (voir ci-dessous). La tunique albuginée encapsule ces cordons pour former le testicule. Les cordons séminifères finissent par développer une lumière et deviennent les tubules séminifères à la puberté.
Les cellules de Sertoli et de Leydig commencent ensuite la production hormonale testiculaire, ce qui entraîne une cascade de processus de masculinisation. Les cellules de Sertoli sécrètent le facteur inhibant müllérien (MIF) ou l’hormone anti-müllérienne (AMH) sous l’influence de SOX-9, SF1, WT1 et DAX1 ainsi que de l’hormone folliculo-stimulante (FSH).43 L’hormone anti-müllérienne provoque ensuite la dégénérescence des conduits paramésonéphriques (de Müller), dont les vestiges sont l’appendice du testicule et l’utricule prostatique.40,43,44 SOX-9 et SF1 interagissent pour augmenter l’effet de l’AMH et entraîner la régression müllérienne. Les cellules de Leydig répondent simultanément à l’hormone lutéinisante (LH) et à la gonadotrophine chorionique humaine (hCG), de structure analogue, pour initier la production de testostérone à 8–9 semaines. La testostérone induit la différenciation du canal mésonéphrique (Figure 8) en épididyme, appendice de l’épididyme, canal déférent, canal éjaculateur et vésicule séminale44 ainsi que la masculinisation des organes génitaux externes par conversion en DHT.
Au cours du développement, la descente testiculaire commence à la 10e semaine et dépend de la pression intra-abdominale, des influences hormonales et de la tension exercée par le gubernaculum.45 Lorsque le testicule pénètre dans l’orifice inguinal profond (interne) et que se constitue le canal inguinal, une couche de péritoine forme la tunique vaginale. Le testicule traverse le canal inguinal entre les semaines 20 et 28 et sort par l’orifice inguinal superficiel (externe) pour entrer dans le scrotum. Le muscle oblique externe, le muscle oblique interne et le fascia transversalis de la paroi abdominale antérieure constituent les couches scrotales correspondantes qui recouvrent le testicule, à savoir le fascia spermatique externe, le fascia et le muscle crémastériens, et le fascia spermatique interne.45
La gonade et le tractus reproducteur féminins
Chez la femme, la gonade indifférenciée se différencie en ovaire et le canal paramésonéphrique (de Müller) se développe pour former la trompe de Fallope, l’utérus, le col de l’utérus et la portion proximale du vagin.
Les ovaires se développent en l’absence du gène SRY chez les individus de génotype 46,XX ou chez ceux de génotype 46,XY présentant une perte du gène SRY.46 Le cortex ovarien prolifère et forme des cordons sexuels primaires qui s’étendent jusqu’à la médulla gonadique. À 4 mois, les cordons se divisent et forment des follicules primordiaux constitués d’ovogonies et de cellules folliculaires. Les ovogonies subissent des mitoses et les ovocytes primaires sont arrêtés en prophase I au moment de la naissance, constituant un réservoir de follicules pour la reproduction future.42 Comparativement à la descente testiculaire, les ovaires descendent dans la cavité pelvienne en un laps de temps plus court.45
Le développement gonadique féminin a auparavant été considéré comme le mécanisme “par défaut” qui survient en l’absence d’influence du gène SRY. Cependant, le développement ovarien ne semble pas être un simple processus passif. Il est activement favorisé par les influences génétiques et moléculaires de WNT4 et DAX-1.37,40,41,42 Ces deux gènes ont des effets anti-testiculaires et WNT4 a été considéré comme le “gène déterminant de l’ovaire”.37,40 WNT4 régule positivement l’expression de DAX-1 pour supprimer l’activité transcriptionnelle de SF1, inhiber la fonction de SOX-9 et, en fin de compte, favoriser le développement ovarien.41,42
Avant la différenciation sexuelle, les canaux paramésonéphriques (müllériens) apparaissent sous forme d’invaginations épithéliales latéralement aux canaux mésonéphriques (de Wolff).47 L’absence d’AMH tôt au cours du développement embryonnaire permet aux canaux paramésonéphriques (müllériens) de se développer en trompes de Fallope, utérus, col de l’utérus et vagin proximal (Figure 8).42,44,48 Les portions latérales de ces canaux forment les trompes de Fallope. Les portions médiales des canaux paramésonéphriques (müllériens) fusionnent sur la ligne médiane pour former l’utérus et l’extrémité distale des canaux fusionnés entre en contact avec le sinus urogénital pour unir les segments proximal et distal du vagin (Figure 9).44,47,49 Le mésenchyme environnant donne naissance à l’endomètre et au myomètre de l’utérus.48 Par homologie avec la dégénérescence des canaux paramésonéphriques (müllériens) en appendice testiculaire chez le mâle, les canaux mésonéphriques dégénèrent chez la femme pour former l’époophore, le paraoophore et le canal de Gartner, adjacents au vagin.44
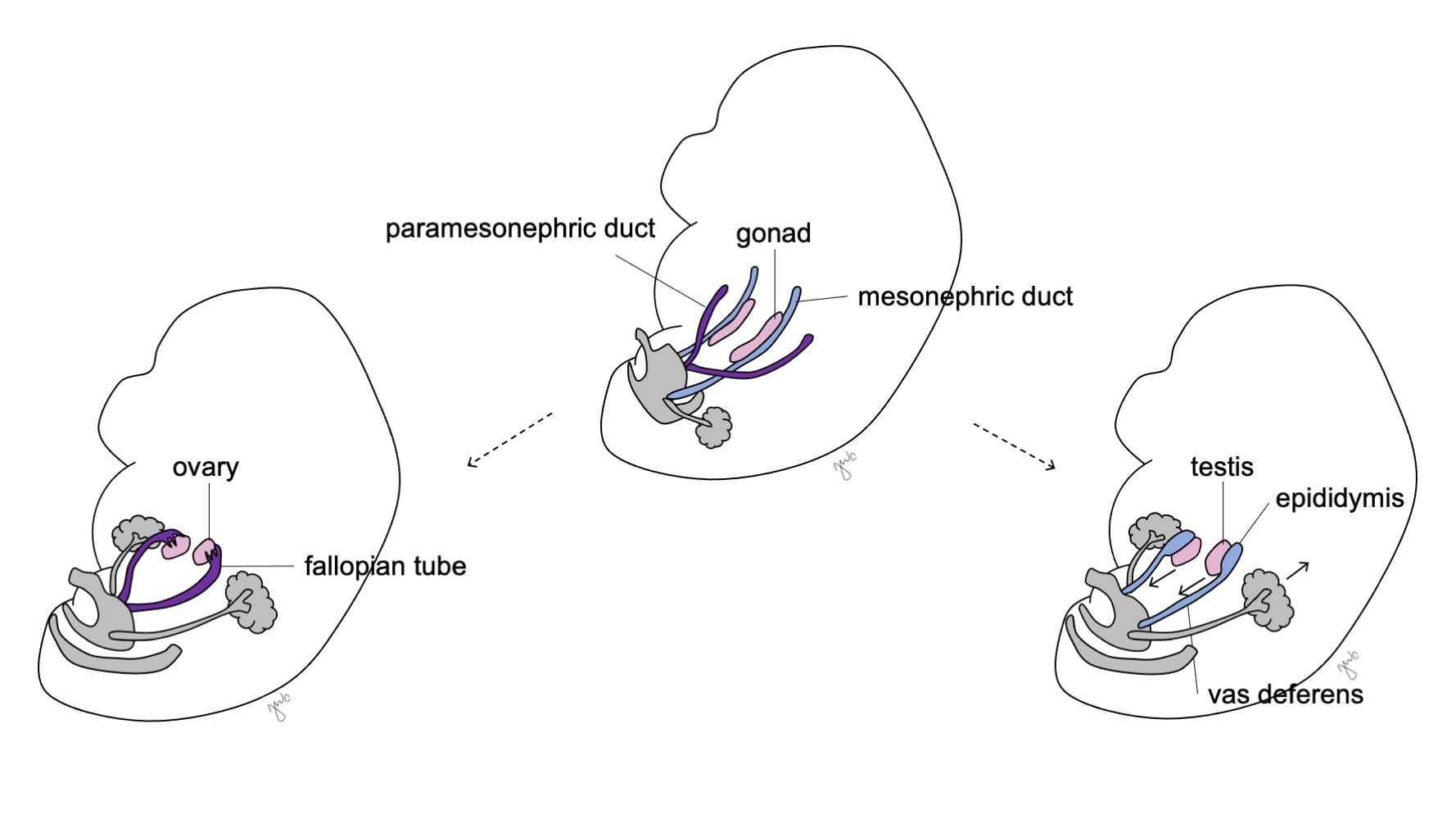
Figure 8 Différenciation des canaux mésonéphriques et paramésonéphriques. Chez le mâle, le canal mésonéphrique (en bleu) se différencie en épididyme, canal déférent, canal éjaculateur et vésicule séminale. Chez la femelle, le canal paramésonéphrique (en violet) se différencie en trompe utérine, utérus, col de l’utérus et portion proximale du vagin.
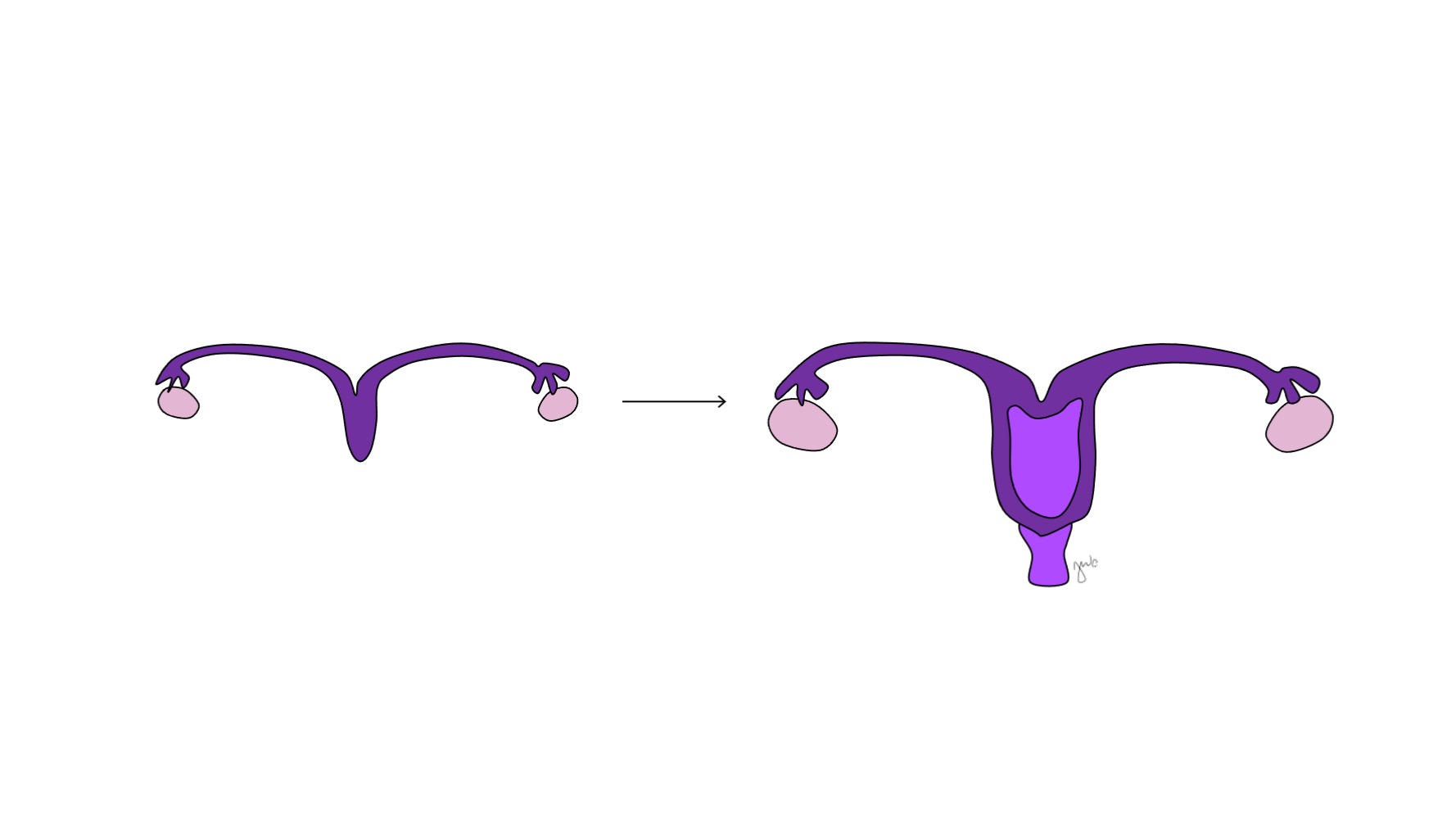
Figure 9 Fusion des canaux paramésonéphriques. Les faces médiales des canaux paramésonéphriques fusionnent sur la ligne médiane pour former l’utérus. L’extrémité distale de cet ensemble forme le col de l’utérus et le vagin proximal, qui se raccorde ensuite caudalement au sinus urogénital.
À l’instar du développement gonadique, le développement de l’appareil reproducteur féminin n’est pas non plus un mécanisme “par défaut” passif, car la signalisation WNT4 est essentielle au développement et à la différenciation des canaux de Müller, ainsi qu’à l’inhibition de la différenciation mâle.42,48 Les gènes Homeobox contribuent à l’alignement antéro-postérieur des structures paramésonéphriques (müllériennes).48 À l’instar des cellules de Sertoli du testicule, les cellules de la granulosa ovarienne finissent par sécréter l’AMH, mais elles le font plus tard au cours du développement fœtal, après que les structures paramésonéphriques (müllériennes) se sont développées.43
Points clés
La différenciation gonadique et canalaire est présentée dans le Tableau 1. La gonade indifférenciée et les cellules germinales primordiales peuvent se différencier en testicule avec des spermatogonies ou en ovaire avec des ovogonies. La sécrétion hormonale ultérieure par ces gonades oriente la différenciation du canal mésonéphrique (de Wolff) en épididyme, appendice de l’épididyme, canal déférent, canal éjaculateur et vésicule séminale, ou celle du canal paramésonéphrique (de Müller) en trompe utérine, utérus, col de l’utérus et vagin proximal.
Organes génitaux externes
Les organes génitaux externes sont initialement bipotentiels pour les deux sexes jusqu’à la septième semaine de gestation. Alors que la cloaque est en cours de séparation en sinus urogénital et canal anorectal (abordé précédemment dans la section voies urinaires basses), des replis se développent de part et d’autre de la cloaque. Après que le septum urorectal a achevé la division cloacale, les replis latéraux deviennent les replis urogénitaux et la portion antérieure des replis fusionne pour former le tubercule génital. Des bourrelets latéraux au tubercule génital forment les bourrelets labioscrotaux. Le tubercule génital, les replis urogénitaux et les bourrelets labioscrotaux (Figure 10) se différencient sous l’influence hormonale des gonades qui se développent concomitamment.
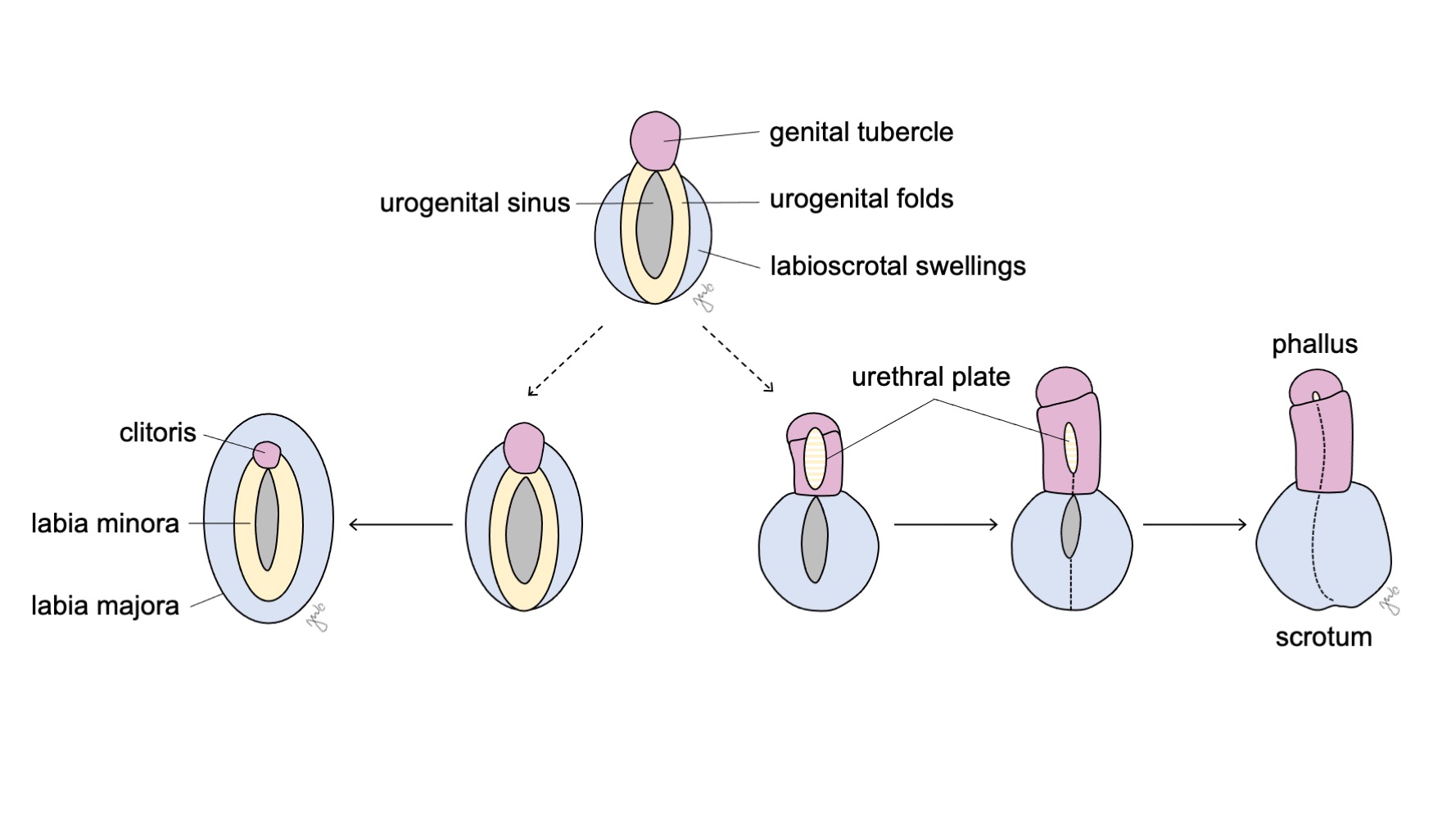
Figure 10 Différenciation des organes génitaux externes. Le tubercule génital (rose), les plis urogénitaux (jaune) et les renflements labioscrotaux (bleu) se différencient respectivement soit en clitoris, petites lèvres et grandes lèvres chez la femme, soit en phallus, plaque urétrale et scrotum chez l’homme.
Organes génitaux externes masculins
L’influence androgénique de la testostérone et de la dihydrotestostérone (DHT) provoque la masculinisation du sinus urogénital et des organes génitaux externes en un pénis et un scrotum (Figure 10).34,44
L’exposition aux androgènes entraîne l’allongement du tubercule génital à 8-12 semaines, avec une croissance linéaire ultérieure débutant à 14 semaines de gestation et la détection échographique de la structure phallique à partir de 18 semaines.34,50,51 SHH est exprimé dans le tubercule génital et l’épithélium de la plaque urétrale et peut faciliter l’influence des androgènes sur la formation pénienne et d’autres formes de masculinisation génitale.34,52 Les condensations mésenchymateuses péniennes forment les corps caverneux et spongieux.53 Une courbure ventrale du pénis a été identifiée chez les fœtus jusqu’à la 20e semaine de gestation, avec une résolution progressive au cours du reste de la gestation.54
Les replis urogénitaux fusionnent en ligne médiane pour former la plaque urétrale au cours du développement de l’urètre pénien. Un sillon au niveau de la ligne médiane de la plaque urétrale s’approfondit et les bords épithéliaux de la plaque fusionnent pour former un tube.33,55 La ligne de fusion épithéliale résultant de cette fusion est ensuite remodelée et remplacée par des cellules mésenchymateuses.55 Alors que l’urètre pénien proximal fusionne caudalement avec l’urètre prostatique issu du sinus urogénital, la tubulisation progresse distalement et ventralement. Comme discuté précédemment, le développement de l’urètre glandulaire est débattu. Alors que cet aspect de l’urètre était auparavant attribué à une invagination ectodermique à partir de l’extrémité du gland, des études plus récentes ont proposé que l’urètre glandulaire se forme par tubulisation avec une différenciation endodermique secondaire en épithélium pavimenteux.18,32,33 À mesure que le phallus s’allonge et que la plaque urétrale se tubulise, les bourrelets labioscrotaux fusionnent en ligne médiane au niveau du raphé médian pour former le scrotum.56
Organes génitaux externes féminins
Bien que l’absence d’androgènes évite la masculinisation, le développement des organes génitaux externes féminins n’est pas le processus « par défaut », car deux chromosomes X, le développement ovarien et les œstrogènes y contribuent. L’importance des influences génétiques, gonadiques et hormonales sur le développement peut être démontrée par des organes génitaux externes hypoplasiques chez des patientes atteintes du syndrome de Turner dépourvues d’un chromosome X ou dans des rapports de translocation du chromosome X.57,58
Le sinus urogénital et les organes génitaux externes se développent en clitoris, grandes et petites lèvres, et en partie inférieure du vagin à la fois sous l’influence des œstrogènes et en l’absence d’androgènes (Figure 10) Le tubercule génital régresse en l’absence d’androgènes et forme le clitoris. Le sinus urogénital (formé initialement après la division cloacale) donne naissance à l’ensemble de l’urètre féminin et au vagin distal. Le vagin distal fusionne crânialement avec les canaux paramésonéphriques. Les cellules centrales dégénèrent pour former la lumière vaginale et la paroi postérieure s’invagine pour former l’hymen. Les replis urogénitaux deviennent les petites lèvres, avec une fusion postérieure minimale pour former la fourchette postérieure. Les bourrelets labio-scrotaux restent non fusionnés chez la femme pour devenir les grandes lèvres.
Tableau 1 Différenciation et développement sexuels.
| Mâle | Femelle | |
|---|---|---|
| Gonades | ||
| Cellules germinales primordiales | Spermatogonies | Ovogonies |
| Cordons sexuels | Cordons séminifères | Follicules primordiaux |
| Canaux mésonéphriques (de Wolff) | Épididyme, appendice de l’épididyme, canal déférent, vésicule séminale, canal éjaculateur | Canal de Gartner, époophore, paraoophore |
| Canaux paramésonéphriques (de Müller) | Appendice du testicule, utricule prostatique | Trompe de Fallope, utérus, col de l’utérus, vagin proximal |
| Sinus urogénital | Vessie, urètre proximal, éventuellement l’urètre glandulaire distal | Vessie, urètre, vagin distal |
| Organes génitaux externes | ||
| Tubercule génital | Pénis | Clitoris |
| Plis urogénitaux | Plaque urétrale | Petites lèvres |
| Bourrelets labioscrotaux | Scrotum | Grandes lèvres |
Points clés
La différenciation des organes génitaux externes est également présentée dans Tableau 1. Le tubercule génital devient le phallus chez les sujets de sexe masculin et le clitoris chez les sujets de sexe féminin. Les plis urogénitaux deviennent la plaque urétrale chez les sujets de sexe masculin et les petites lèvres chez les sujets de sexe féminin. Les bourrelets labioscrotais se développent en scrotum chez les sujets de sexe masculin et en grandes lèvres chez les sujets de sexe féminin. Dans le cadre du développement des voies urinaires inférieures, le sinus urogénital forme l’urètre proximal et ses plis urogénitaux forment la plaque urétrale de l’urètre distal chez les sujets de sexe masculin. En revanche, le sinus urogénital forme l’ensemble de l’urètre chez les sujets de sexe féminin ainsi que le vagin distal.
Conclusion
Le développement des voies urinaires et reproductrices est intégré par leurs origines embryologiques et leurs interactions. Le rein en développement passe par les stades de pronéphros, mésonéphros et métanéphros. L’interaction entre le mésonéphros et le cloaque donne naissance au bourgeon urétéral et au blastème métanéphrique qui aboutiront finalement à la formation du rein et des voies urinaires supérieures. Le cloaque se divise simultanément, et le sinus urogénital antérieur se développe pour former la vessie et contribue à l’urètre masculin et féminin. Les gonades, les canaux mésonéphriques (de Wolff) et paramésonéphriques (de Müller), ainsi que les organes génitaux externes, ont le potentiel de se développer le long du spectre de la différenciation sexuelle mâle et femelle : des influences génétiques et hormonales déterminent respectivement la fonction gonadique et l’apparence phénotypique de l’embryon en développement. Diverses altérations des gènes, des interactions moléculaires ou des tissus en développement impliqués dans ces processus peuvent affecter à long terme l’anatomie et la fonction de leurs structures respectives.
Références
- Bertram JF, Douglas-Denton RN, Diouf B, Hughson MD, Hoy WE. Human nephron number: implications for health and disease. Pediatr Nephrol 2011; 26 (9): 1529–1533. DOI: 10.1007/s00467-011-1843-8.
- Tryggvason K, Kouvalainen K. Number of Nephrons in Normal Human Kidneys and Kidneys of Patients with the Congenital Nephrotic Syndrome. Nephron 1975; 15 (1): 62–68. DOI: 10.1159/000180493.
- Bakker BS de, Hoff MJB van den, Vize PD, Oostra RJ. The Pronephros; a Fresh Perspective. Integr Comp Biol 2019; 59 (1): 29–47. DOI: 10.1093/icb/icz001.
- Ludwig KS, Landmann L. Early development of the human mesonephros. Anat Embryol (Berl) 2005; 209 (6): 439–447. DOI: 10.1007/s00429-005-0460-3.
- Nagata M. Glomerulogenesis and the role of endothelium. Curr Opin Nephrol Hypertens 2018; 27 (3): 159–164. DOI: 10.1097/mnh.0000000000000402.
- Nishinakamura R, Sakaguchi M. BMP signaling and its modifiers in kidney development. Pediatr Nephrol 2014; 29 (4): 681–686. DOI: 10.1007/s00467-013-2671-9.
- Michos O, Panman L, Vintersten K, Beier K, Zeller R, Zuniga A. Gremlin-mediated BMP antagonism induces the epithelial-mesenchymal feedback signaling controlling metanephric kidney and limb organogenesis. Development 2004; 131 (14): 3401–3410. DOI: 10.1242/dev.01251.
- Wang GJ, Brenner-Anantharam A, Vaughan ED, Herzlinger D. Antagonism of BMP4 Signaling Disrupts Smooth Muscle Investment of the Ureter and Ureteropelvic Junction. J Urol 2009; 181 (1): 401–407. DOI: 10.1016/j.juro.2008.08.117.
- Sajithlal G, Zou D, Silvius D, Xu P-X. Eya1 acts as a critical regulator for specifying the metanephric mesenchyme. Dev Biol 2005; 284 (2): 323–336. DOI: 10.1016/j.ydbio.2005.05.029.
- Yu J, McMahon AP, Valerius MT. Recent genetic studies of mouse kidney development. Curr Opin Genet Dev 2004; 14 (5): 550–557. DOI: 10.1016/j.gde.2004.07.009.
- Majumdar A, Vainio S, Kispert A, McMahon J, McMahon AP. Wnt11andRet/Gdnfpathways cooperate in regulating ureteric branching during metanephric kidney development. Development 2003; 130 (14): 3175–3185. DOI: 10.1242/dev.00520.
- Walker KA, Sims-Lucas S, Bates CM. Fibroblast growth factor receptor signaling in kidney and lower urinary tract development. Pediatr Nephrol 2016; 31 (6): 885–895. DOI: 10.1007/s00467-015-3151-1.
- Qiao J, Sakurai H, Nigam SK. Branching morphogenesis independent of mesenchymal–epithelial contact in the developing kidney. Proc Natl Acad Sci U S A 1999; 96 (13): 7330–7335. DOI: 10.1073/pnas.96.13.7330.
- Underwood MA, Gilbert WM, Sherman MP. Amniotic Fluid: Not Just Fetal Urine Anymore. J Perinatol 2005; 25 (5): 341–348. DOI: 10.1038/sj.jp.7211290.
- Taghavi K, Kirkpatrick J, Mirjalili SA. The horseshoe kidney: Surgical anatomy and embryology. J Pediatr Urol 2016; 12 (5): 275–280. DOI: 10.1016/j.jpurol.2016.04.033.
- Friedland GW, De Vries P. Renal ectopia and fusion. Urology 1975; 5 (5): 698–706. DOI: 10.1016/0090-4295(75)90137-5.
- Kruepunga N, Hikspoors JP, Mekonen HK, Mommen GM, Meemon K, Weerachatyanukul W, et al.. Faculty Opinions recommendation of The development of the cloaca in the human embryo. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2018; 33 (6): 24–39. DOI: 10.3410/f.734193252.793568763.
- Seifert AW, Harfe BD, Cohn MJ. Cell lineage analysis demonstrates an endodermal origin of the distal urethra and perineum. Dev Biol 2008; 318 (1): 143–152. DOI: 10.1016/j.ydbio.2008.03.017.
- Baskin LS, Hayward SW, Young P, Cunha GR. Role of Mesenchymal-Epithelial Interactions in Normal Bladder Development. J Urol 1996; 56 (5): 1820–1827. DOI: 10.1097/00005392-199611000-00101.
- Batourina E, Tsai S, Lambert S, Sprenkle P, Viana R, Dutta S, et al.. Faculty Opinions recommendation of Apoptosis induced by vitamin A signaling is crucial for connecting the ureters to the bladder. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2005; 7 (10): 082–089. DOI: 10.3410/f.1029077.343528.
- Viana R, Batourina E, Huang H, Dressler GR, Kobayashi A, Behringer RR, et al.. The development of the bladder trigone, the center of the anti-reflux mechanism. Development 2007; 134 (20): 3763–3769. DOI: 10.1242/dev.011270.
- Tanaka ST, Ishii K, Demarco RT, Pope JC, Brock JW, Hayward SW. Endodermal Origin of Bladder Trigone Inferred From Mesenchymal-Epithelial Interaction. J Urol 2010; 183 (1): 386–391. DOI: 10.1016/j.juro.2009.08.107.
- Mackie GG, Stephens FD. Duplex Kidneys: A Correlation of Renal Dysplasia with Position of the Ureteral Orifice. J Urol 1975; 114 (2): 274–280. DOI: 10.1016/s0022-5347(17)67007-1.
- Wen JG, Frøkiaer J, Zhao JB, Ringgaard S, Jørgensen TM, Djurhuus JC. Severe partial ureteric obstruction in newborn rats can produce renal dysplasia. BJU Int 1981; 89 (7): 740–745. DOI: 10.1046/j.1464-410x.2002.02747.x.
- Parada Villavicencio C, Adam SZ, Nikolaidis P, Yaghmai V, Miller FH. Imaging of the Urachus: Anomalies, Complications, and Mimics. Radiographics 2016; 36 (7): 2049–2063. DOI: 10.1148/rg.2016160062.
- Krishnan A, Souza A de, Konijeti R, Baskin LS. The Anatomy and Embryology of Posterior Urethral Valves. J Urol 2006; 175 (4): 1214–1220. DOI: 10.1016/s0022-5347(05)00642-7.
- Cunha GR, Vezina CM, Isaacson D, Ricke WA, Timms BG, Cao M, et al.. A comparison of prostatic development in xenografts of human fetal prostate and human female fetal proximal urethra grown in dihydrotestosterone-treated hosts. Differentiation 2018; 115 (24-45): 37–52. DOI: 10.1016/j.diff.2020.06.001.
- Thomson AA. Role of androgens and fibroblast growth factors in prostatic development. Reproduction 2001; 21 (2): 187–195. DOI: 10.1530/rep.0.1210187.
- LASNITZKI ILSE, MIZUNO TAKEO. Prostatic Induction: Interaction Of Epithelium And Mesenchyme From Normal Wild-type Mice And Androgen-insensitive Mice With Testicular Feminization. J Endocrinol 1980; 85 (3): 423–np. DOI: 10.1677/joe.0.0850423.
- Meeks JJ, Schaeffer EM. Genetic Regulation of Prostate Development. J Androl 2011; 32 (3): 210–217. DOI: 10.2164/jandrol.110.011577.
- Marker PC, Donjacour AA, Dahiya R, Cunha GR. Hormonal, cellular, and molecular control of prostatic development. Dev Biol 2003; 253 (2): 165–174. DOI: 10.1016/s0012-1606(02)00031-3.
- Kurzrock EA, Baskin LS, Cunha GR. Ontogeny of the male urethra: Theory of endodermal differentiation. Differentiation 1999; 64 (2): 115–122. DOI: 10.1046/j.1432-0436.1999.6420115.x.
- Hadidi AT, Roessler J, Coerdt W. Development of the human male urethra: A histochemical study on human embryos. J Pediatr Surg 2014; 49 (7): 1146–1152. DOI: 10.1016/j.jpedsurg.2014.01.009.
- Blaschko SD, Cunha GR, Baskin LS. Molecular mechanisms of external genitalia development. Differentiation 2012; 84 (3): 261–268. DOI: 10.1016/j.diff.2012.06.003.
- Satoh M. Histogenesis and organogenesis of the gonads in human embryos. Med Electron Microsc 1991; 27 (3-4): 254–256. DOI: 10.1007/bf02349668.
- McKay DG, Hertig AT, Adams EC, Danziger S. Histochemical observations on the germ cells of human embryos. Anat Rec 1953; 117 (2): 201–219. DOI: 10.1002/ar.1091170206.
- Hanley NA, Hagan DM, Clement-Jones M, Ball SG, Strachan T, Salas-Cortés L, et al.. SRY, SOX9, and DAX1 expression patterns during human sex determination and gonadal development. Mech Dev 2000; 91 (1-2): 403–407. DOI: 10.1016/s0925-4773(99)00307-x.
- Yao HH-C. The pathway to femaleness: current knowledge on embryonic development of the ovary. Mol Cell Endocrinol 2005; 230 (1-2): 87–93. DOI: 10.1016/j.mce.2004.11.003.
- Berta P, Hawkins JB, Sinclair AH, Taylor A, Griffiths BL, Goodfellow PN, et al.. Genetic evidence equating SRY and the testis-determining factor. Nature 1990; 348 (6300): 448–450. DOI: 10.1038/348448a0.
- Rey RA, Grinspon RP. Normal male sexual differentiation and aetiology of disorders of sex development. Best Pract Res Clin Endocrinol Metab 2011; 25 (2): 221–238. DOI: 10.1016/j.beem.2010.08.013.
- McElreavey K, Barbaux S, Ion A, Fellous M. The genetic basis of murine and human sex determination: a review. Heredity (Edinb) 1995; 75 (6): 599–611. DOI: 10.1038/hdy.1995.179.
- Vilain E, McCabe ERB. Mammalian Sex Determination: From Gonads to Brain. Mol Genet Metab 1998; 65 (2): 74–84. DOI: 10.1006/mgme.1998.2749.
- Sinisi AA, Pasquali D, Notaro A, Bellastella A. Sexual Differentiation. Encyclopedic Dictionary of Genetics, Genomics and Proteomics 2003; 26 (3 Suppl): 473–494. DOI: 10.1002/0471684228.egp11478.
- Biason-Lauber A, Chaboissier M-C. Ovarian development and disease: The known and the unexpected. Semin Cell Dev Biol 2015; 45 (59-67): 59–67. DOI: 10.1016/j.semcdb.2015.10.021.
- Rey R, Lukas-Croisier C, Lasala C, Bedecarrás P. AMH/MIS: what we know already about the gene, the protein and its regulation. Mol Cell Endocrinol 2003; 211 (1-2): 21–31. DOI: 10.1016/j.mce.2003.09.007.
- Sajjad Y. Development of the genital ducts and external genitalia in the early human embryo. J Obstet Gynaecol Res 2010; 36 (5): 929–937. DOI: 10.1111/j.1447-0756.2010.01272.x.
- Barteczko KJ, Jacob MI, Jacob MI. Development, Shape and Fate of Gubernaculum Hunteri and Processus Vaginalis Peritonei - Own Phases of Testicular Descent. Adv Anat Embryol Cell Biol 2000; 156:iii-x: 17–72. DOI: 10.1007/978-3-642-58353-7_4.
- Hawkins JR, Taylor A, Berta P, Levilliers J, Auwera B Van der, Goodfellow PN. Mutational analysis of SRY: nonsense and missense mutations in XY sex reversal. Hum Genet 1992; 88 (4): 471–474. DOI: 10.1007/bf00215684.
- Spencer TE, Dunlap KA, Filant J. Comparative developmental biology of the uterus: Insights into mechanisms and developmental disruption. Mol Cell Endocrinol 2012; 354 (1-2): 34–53. DOI: 10.1016/j.mce.2011.09.035.
- Kobayashi A, Behringer RR. Developmental genetics of the female reproductive tract in mammals. Nat Rev Genet 2003; 4 (12): 969–980. DOI: 10.1038/nrg1225.
- Cunha GR. The dual origin of vaginal epithelium. Am J Anat 1975; 143 (3): 387–392. DOI: 10.1002/aja.1001430309.
- Feldman KW, Smith DW. Fetal phallic growth and penile standards for newborn male infants. J Pediatr 1975; 86 (3): 395–398. DOI: 10.1016/s0022-3476(75)80969-3.
- Zalel Y, Pinhas-Hamiel O, Lipitz S, Mashiach S, Achiron R. The development of the fetal penis-anin uterosonographic evaluation. Ultrasound Obstet Gynecol 2001; 17 (2): 129–131. DOI: 10.1046/j.1469-0705.2001.00216.x.
- Miyagawa S, Matsumaru D, Murashima A, Omori A, Satoh Y, Haraguchi R, et al.. The Role of Sonic Hedgehog-Gli2 Pathway in the Masculinization of External Genitalia. Endocrinology 2011; 152 (7): 2894–2903. DOI: 10.1210/en.2011-0263.
- BASKIN LS, LEE YT, CUNHA GR. Neuroanatomical ontogeny of the human fetal penis. BJU Int 1997; 79 (4): 628–640. DOI: 10.1046/j.1464-410x.1997.00119.x.
- Kaplan GW, Lamm DL. Embryogenesis of Chordee. J Urol 1975; 114 (5): 769–772. DOI: 10.1016/s0022-5347(17)67140-4.
- Baskin L, Erol A, Jegatheesan P, Li Y, Liu W, Cunha G. Urethral seam formation and hypospadias. Cell Tissue Res 2001; 305 (3): 379–387. DOI: 10.1007/s004410000345.
- Kluth D, Fiegel HC, Geyer C, Metzger R. Embryology of the distal urethra and external genitals. Semin Pediatr Surg 2011; 20 (3): 176–187. DOI: 10.1053/j.sempedsurg.2011.03.003.
- Omar HA, Hummel M, Jones EA, Perkins KC. Hypoplastic external genitalia in association with X;autosome chromosome translocation. J Pediatr Adolesc Gynecol 1999; 12 (3): 161–164. DOI: 10.1016/s1038-3188(99)00011-x.
- Ferguson-Smith MA. Karyotype-phenotype Correlations in Gonadal Dysgenesis and Their Bearing on the Pathogenesis of Malformations. J Med Genet 1965; 2 (2): 142–155. DOI: 10.1136/jmg.2.2.142.
Dernière mise à jour: 2025-09-21 21:31