44: Tumores testiculares y paratesticulares en niños
Este capítulo durará aproximadamente 23 minutos para leer.
Introducción
Los tumores testiculares y paratesticulares son poco frecuentes en los niños. Pueden ser primarios o secundarios, benignos o malignos. Este capítulo ofrece una visión general del espectro de lesiones que se observan clínicamente en los niños. Las lesiones intratesticulares se consideran, para fines clínicos, en dos grupos etarios pediátricos:
- El niño prepuberal
- El adolescente y el adulto joven (AYA)
En cualquiera de estos grupos etarios, los tumores testiculares tienen características propias a considerar, que repercuten en el manejo y el pronóstico. Se puede planificar la cirugía de preservación testicular (TSS) para la mayoría de las lesiones testiculares benignas prepuberales; mientras que la mayoría de los tumores AYA se sospechan malignos desde el inicio, y la orquiectomía radical es el tratamiento quirúrgico estándar para la neoplasia maligna primaria intratesticular o paratesticular.
Embriología
El testículo fetal se desarrolla a partir de la gónada mesodérmica indiferenciada después de 6 semanas. En un feto masculino, el conducto de Müller involuciona en respuesta a la AMH secretada por el testículo en desarrollo. El sistema de Wolff se desarrolla en respuesta a la testosterona secretada por el testículo en desarrollo. Las células de Leydig productoras de testosterona surgen del mesodermo gonadal y se encuentran en el intersticio del testículo maduro. Los cordones sexuales estromales mesodérmicos se desarrollan en túbulos seminíferos y las células epiteliales de sostén dan lugar a las células de Sertoli. Las células somáticas del testículo derivan del mesodermo de la cresta gonadal, pero las células germinales primordiales se originan del epiblasto/saco vitelino después de alrededor de 8 días de desarrollo embrionario, y migran a la cresta gonadal, asentándose en estrecha proximidad al mesodermo gonadal.1
La derivación de células de distintos orígenes embriológicos dentro del testículo en desarrollo subyace a la miríada de posibles tumores, con comportamientos diferentes, que pueden presentarse en el testículo pediátrico.
Epidemiología
Los tumores testiculares en niños representan el 1-2% de todos los tumores pediátricos sólidos.2 La incidencia se estima en 0.5-2 por 100,000 niños.3 En la población pediátrica, existe un pico de incidencia en la adolescencia, con un pico menor en menores de 3 años de edad.4
Ahora está muy claro que la mayoría de los tumores intratesticulares en niños prepuberales son benignos. Se informa que el 60-70% de los tumores intratesticulares prepuberales son benignos.5,6 El 75% de los tumores intratesticulares en AYA pospuberales son malignos.7 El tumor benigno más frecuente en el grupo de edad prepuberal es el teratoma, con una edad mediana de presentación de 13 meses.8 Los tumores del saco vitelino son el tumor testicular maligno más frecuente en el grupo de edad prepuberal, con una edad mediana de presentación de alrededor de 16 meses.9 Estos dos tumores de origen en células germinales constituyen una gran proporción del pico temprano de incidencia de tumores testiculares en menores de 3 años.
El cáncer testicular más frecuente en el grupo AYA es el tumor de células germinales mixto.10 El seminoma puro es infrecuente en AYA. A diferencia de los niños prepuberales, que predominantemente presentan tumores puros del saco vitelino, los tumores de células germinales en AYA son no seminomatosos y, por lo general, de histología mixta, incluyendo al carcinoma embrionario como el subtipo histológico más común.10 El teratoma que se presenta en AYA suele ser maligno, a diferencia de lo que ocurre en los niños prepuberales.7
Patogénesis y descripción general de los tipos de tumores testiculares y paratesticulares en niños
Los tumores testiculares primarios pueden originarse a partir de células germinales (Tumores de células germinales, GCTs) o de células estromales (Tumores del cordón sexual/estromales) del testículo. Los GCTs son mucho más frecuentes que los tumores estromales .
Los TCG se clasifican según la clasificación de la Organización Mundial de la Salud de 2016 - ya sea derivados de neoplasia de células germinales in situ (derivados de GCNIS), que en su mayoría se presentan en la pospubertad; o no derivados de neoplasia de células germinales in situ (no derivados de GCNIS), que en su mayoría se presentan en el periodo prepuberal.11
El grupo de TCG no derivados de GCNIS incluye los tumores del saco vitelino prepuberales, el teratoma de tipo prepuberal, incluidos los quistes dermoides y epidermoides, y el tumor espermatocítico (que ocurre principalmente en adultos). El carcinoma in situ o la neoplasia de células germinales intratubular es casi inexistente en el grupo etario prepuberal, a diferencia de en AYA y en adultos de mayor edad.12,13
El grupo de TCG derivado de GCNIS incluye el teratoma de tipo pospuberal, el tumor del saco vitelino, el carcinoma embrionario, tumores trofoblásticos, incluidos el coriocarcinoma, todos los cuales pueden presentarse en el grupo AYA; y el seminoma, que es más frecuente en adultos mayores.
Los tumores testiculares de los cordones sexuales y del estroma son raros en niños. Los tumores de células de Leydig son casi siempre benignos en los niños prepuberales.14,15 Los tumores de células de la granulosa juveniles suelen ser benignos en el grupo prepuberal.16 Los tumores de células de Sertoli son en su mayoría benignos, pero pueden ser malignos en alrededor del 10%, especialmente en los niños de mayor edad.17 Los tumores de células de Sertoli pueden asociarse a síndromes como el síndrome de Carney y el síndrome de Peutz-Jeghers.
El gonadoblastoma es una neoplasia maligna única de la gónada en la infancia. Las células del gonadoblastoma comprenden tanto las células estromales como las germinales de la gónada. El gonadoblastoma casi siempre se presenta en el contexto de diferencias o variaciones del desarrollo sexual.18
Anomalías del desarrollo raras del testículo, como la displasia de la rete testis, pueden presentarse como una masa del testículo prepuberal. La displasia de la rete testis se asocia casi siempre con agenesia renal ipsilateral.19 Los quistes testiculares simples y los quistes epididimarios también pueden presentarse en la infancia como masas testiculares o escrotales.
Los tumores paratesticulares en la infancia pueden ser benignos o malignos. Los tumores paratesticulares benignos son poco frecuentes e incluyen lesiones como hemangioma, leiomioma y lipoma.2 Los tumores paratesticulares malignos incluyen el rabdomiosarcoma, que es la neoplasia paratesticular más frecuente en niños.2 y el raro tumor neuroectodérmico melanótico del lactante, que es en su mayoría benigno, pero puede mostrar comportamiento maligno.20
Debe recordarse que el testículo en la infancia es una localización frecuente de neoplasias malignas metastásicas o infiltrativas, como la leucemia o el linfoma metastásicos.7
Aunque la criptorquidia es un factor de riesgo conocido de malignidad testicular, la mayoría de los tumores testiculares en la infancia descritos no están asociados con la criptorquidia. La criptorquidia se asocia con un riesgo aumentado de malignidad pospuberal, bilateralmente, de 2 a 5 veces el de la población general.21 Este riesgo parece reducirse mediante la orquidopexia realizada tempranamente en la infancia.22 El tipo de malignidad que ocurre con mayor frecuencia en la criptorquidia no corregida o operada tardíamente es el seminoma.23
La microlitiasis testicular, generalmente detectada de forma incidental en la ecografía en niños, no se ha demostrado que esté asociada con un aumento del riesgo de tumores testiculares en la infancia. La microlitiasis testicular puede estar asociada con un mayor riesgo de malignidad testicular en la vida adulta, especialmente si se asocia con otros factores de riesgo como la criptorquidia. Por lo tanto, se aconseja el autoexamen testicular pospuberal para facilitar la detección precoz.24
Evaluación y diagnóstico
La forma más frecuente de presentación de un tumor testicular o paratesticular es una masa escrotal indolora, observada por el niño o su cuidador. A veces, puede estar presente un hidrocele reactivo. La tumefacción escrotal puede motivar evaluación y estudios diagnósticos, y en ocasiones la masa puede detectarse de forma incidental tras una consulta por traumatismo, o en una ecografía (USS). Puede haber pocas otras características clínicas distintivas si se palpa un bulto escrotal. Sin embargo, los tumores de células de Leydig pueden asociarse con signos de pubertad precoz, y el 10% de los tumores de células de Sertoli también pueden presentarse con signos de pubertad precoz.25
La USS del escroto y del testículo es una investigación inicial muy útil. Usualmente proporciona una clara indicación de la localización y el tamaño de la masa, si es sólida o quística, si es difusa o bien delimitada, si es intratesticular o paratesticular, su vascularidad y si es unifocal o multifocal. Algunas lesiones prepuberales tienen características en la USS, como las capas en ‘piel de cebolla’ de un quiste epidérmico (Figura 1), el aspecto lobulado de un quiste dermoide (Figura 2) y el aspecto quístico característico de la displasia de la rete testis (Figura 3).26 Los teratomas pueden tener un aspecto abigarrado quístico/sólido (Figura 4). Las lesiones benignas tienden a mostrar baja vascularidad en la USS. Las lesiones malignas suelen ser hipoecoicas, sólidas y homogéneas en la USS.
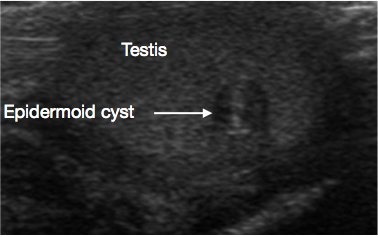
Figura 1 Ecografía de quiste epidermoide testicular, aspecto en capas de cebolla (Flecha)
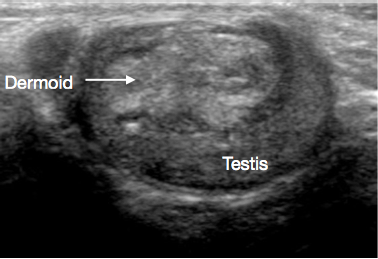
Figura 2 Ecografía de quiste dermoide testicular, quiste lobulado lleno de detritos
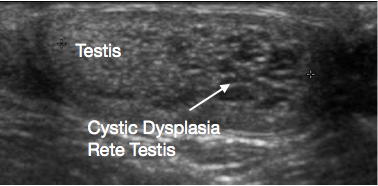
Figura 3 Ecografía de displasia quística de la rete testis, testículo a la izquierda y displasia quística a la derecha de la imagen
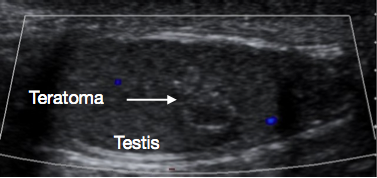
Figura 4 Ecografía de teratoma testicular prepuberal, aspecto heterogéneo
Los marcadores tumorales séricos pueden ser útiles para distinguir entre lesiones benignas y malignas. En los tumores testiculares, la alfa-fetoproteína (AFP), la gonadotropina coriónica humana beta (BHCG) y la lactato deshidrogenasa (LDH) son los marcadores más utilizados. La BHCG no suele ser útil en la evaluación de tumores prepuberales, ya que el coriocarcinoma y el carcinoma embrionario, que pueden secretar BHCG, casi nunca se observan en este grupo etario.7,27 Sin embargo, la BHCG es muy importante en el grupo AYA pospuberal, donde estas lesiones pueden presentarse. La AFP es el marcador más importante en el grupo etario prepuberal, ya que se eleva de forma marcada en casi todos los tumores del saco vitelino, comúnmente vistos en este grupo.9 El teratoma puede presentar una elevación leve de la AFP, pero no se han reportado niveles de AFP por encima de 100ng/mL en el teratoma prepuberal.9 Esta diferencia marcada en los niveles de AFP entre el teratoma benigno y el tumor maligno del saco vitelino también ayuda a planificar la TSS frente a una orquiectomía radical. Debe tenerse en cuenta, al interpretar los niveles de AFP, que los lactantes de hasta 8 meses de edad pueden tener niveles séricos de AFP naturalmente elevados.28
Las características clínicas, las características por imagen de la lesión y los niveles séricos de marcadores tumorales ayudarán a guiar el manejo ulterior. Si se sospecha que la lesión es maligna, sería importante realizar una TC abdominopélvica y torácica para estadificación a fin de evaluar la diseminación locorregional y las metástasis. El 20% de los tumores del saco vitelino prepuberales presentan metástasis pulmonares al momento de la presentación.29
Una lesión con características clínicas y ecográficas de un tumor benigno, y sin elevación de los niveles séricos de marcadores tumorales, no suele requerir TC de estadificación antes de la resección.
Resumen de los tumores testiculares en niños prepuberales
Tabla 1 Tumores testiculares y paratesticulares en la infancia
| Clasificación | Tipo | Subtipo | Benigno | Mayormente benigno, puede ser maligno | Maligno |
|---|---|---|---|---|---|
| Tumores testiculares/gonadales primarios | Tumores testiculares prepuberales | GCT - no derivado de GCNIS | Teratoma prepuberal | Tumor del saco vitelino | |
| Quiste epidermoide | |||||
| Quiste dermoide | |||||
| Tumores de cordón sexual / estromales | Tumor de células de la granulosa juvenil | Tumor de células de Leydig | |||
| Tumor de células de Sertoli | |||||
| Anomalías del desarrollo y quistes simples | Displasia quística del rete testis | ||||
| Quiste testicular | |||||
| Quiste epididimario | |||||
| Tumores testiculares en adolescentes y adultos jóvenes (AYA) | GCT - derivado de GCNIS | Teratoma pospuberal | |||
| Carcinoma embrionario | |||||
| Tumor de células del saco vitelino | |||||
| Coriocarcinoma | |||||
| GCT mixtos | |||||
| Seminoma | |||||
| Tumor gonadal en diferencias del desarrollo sexual (DSD) | Gonadoblastoma | ||||
| Metástasis/infiltración testicular secundaria | Leucemia p. ej., leucemia linfoblástica aguda | ||||
| Linfoma p. ej., linfoma de Burkitt | |||||
| Tumores paratesticulares | Hemangioma | Tumor neuroectodérmico melanótico de la infancia | Rabdomiosarcoma paratesticular | ||
| Leiomioma | |||||
| Lipoma | |||||
GCT=Tumor de células germinales, GCNIS=Neoplasia de células germinales in situ
Tumores testiculares/ gonadales primarios
Tumores de células germinales testiculares benignos (no derivados de GCNIS)
Teratoma
Estos son casi siempre benignos cuando se presentan en la etapa prepuberal.8 La edad mediana de presentación es de 13 meses.2 A menudo presentan un aspecto heterogéneo en la ecografía (Figura 4) porque los teratomas pueden tener elementos de cualquiera o de todas las tres capas germinales embrionarias - endodermo, mesodermo y ectodermo. En este grupo etario, los teratomas suelen contener elementos maduros, con elementos inmaduros descritos ocasionalmente. Incluso con elementos inmaduros, la evolución tras la TSS suele ser buena en este grupo etario.30 La TSS suele ser factible para el teratoma prepuberal y, tras una extirpación satisfactoria y la confirmación histológica de su naturaleza benigna, por lo general no se requiere seguimiento adicional.27
Quiste epidermoide
Se trata de quistes benignos de origen ectodérmico, revestidos por un epitelio que produce queratina. El quiste presenta un aspecto laminar característico en ‘piel de cebolla’ en la USS (Figura 1).11 Se enuclean con facilidad, por lo que la TSS es el estándar de atención. No se requiere vigilancia rutinaria a largo plazo tras la exéresis, pero se han reportado recidivas poco frecuentes.26
Quiste dermoide
Los quistes dermoides comprenden elementos de tipo cutáneo, incluidos apéndices como folículos pilosos y glándulas sebáceas. Son benignos. En la USS a menudo se observan lesiones quísticas de pared gruesa y contorno liso con detritos ecogénicos avasculares (Figura 2).31,32 La TSS es el estándar de atención, y la vigilancia de rutina tras la extirpación no suele ser necesaria.27
Tumores malignos de células germinales testiculares (no derivados de GCNIS)
Tumor del saco vitelino
Esta es la neoplasia intratesticular más frecuente en el niño prepuberal. La edad habitual de presentación corresponde al pico temprano por debajo de los 3 años, con una mediana de 16 meses de edad.9 Los tumores suelen ser sólidos y homogéneos por lo general en la ecografía. La AFP sérica está marcadamente elevada. El 80% de los tumores del saco vitelino prepuberales son estadio 1 al momento de la presentación.33 El 20% presentan metástasis pulmonares en la presentación.2 Si se sospecha un tumor del saco vitelino, debe realizarse una TC de tórax, abdomen y pelvis para estadificación, y planificarse una orquidectomía radical. La disección radical de ganglios linfáticos (RLND) no se realiza de forma rutinaria para el tumor del saco vitelino prepuberal, ya que la diseminación hematógena sin diseminación locorregional es común en el tumor del saco vitelino; lo cual la RLND, con su riesgo significativo de morbilidad, no abordará.34
En la enfermedad confirmada en estadio 1, con normalización del AFP sérico tras la cirugía, la quimioterapia por lo general no es necesaria. Las tasas de recurrencia son alrededor del 20% . Por lo tanto, se aconseja un seguimiento oncológico posquirúrgico regular con monitorización de los niveles de AFP y estudios de imagen como la RM, y las tasas de rescate tras el tratamiento de la recurrencia son excelentes.2,35 Para la enfermedad en estadio clínico 2 con afectación ganglionar, y para la enfermedad metastásica, la quimioterapia está indicada en la mayoría de los protocolos. La quimioterapia basada en platino es altamente eficaz para el tumor del saco vitelino. La RLND se reserva para enfermedad locorregional residual o recurrente.2,33
Tumores de los cordones sexuales y del estroma testicular
Tumores de células de la granulosa juveniles
Estos tumores, generalmente benignos, suelen presentarse en lactantes y son los tumores testiculares neonatales más frecuentes. Histológicamente, están compuestos por láminas de células tipo granulosa, a menudo con cambios quísticos.16,36 La TSS suele ser exitosa y curativa; no se han reportado recurrencias, y la vigilancia a largo plazo tras la escisión no suele ser necesaria.27
Tumores de células de Leydig
En los niños, los tumores de células de Leydig suelen ser benignos, aunque pueden ser malignos en adultos. Los tumores de células de Leydig suelen presentarse en niños de alrededor de 5-10 años de edad.14,15 La mayoría se presenta como una masa testicular indolora. Sin embargo, los tumores de células de Leydig pueden presentarse con pubertad precoz debido a la producción de testosterona . Además, el 10-15% de los niños con tumores de células de Leydig puede tener signos de feminización, como ginecomastia, debido a la secreción de estradiol.2 El aspecto intraoperatorio de los tumores de células de Leydig es el de nódulos amarillos homogéneos. En niños prepuberales, se recomienda la TSS, ya que los tumores de células de Leydig son casi siempre benignos en este grupo etario. Si la pubertad precoz es una característica asociada, se aconseja la evaluación por endocrinología y el seguimiento. Los cambios puberales no se revierten tras la extirpación del tumor, dado que el eje hormonal puberal se ha activado.2
Tumores de células de Sertoli
Estos se presentan a una edad temprana, con una mediana de 6 meses, aunque pueden ocurrir a cualquier edad prepuberal. Un tercio se asocia con síndromes como Peutz-Jeghers o el síndrome de Carney. El 10% presenta manifestaciones de pubertad precoz porque son hormonalmente activos; o incluso ginecomastia, debido a la secreción tumoral de aromatasa, lo que produce la conversión de androstenediona a estrona.37 En su mayoría son benignos, pero pueden ser malignos en niños mayores. Por lo tanto, una TC de estadificación preoperatoria sería prudente, especialmente en niños mayores de 5 años. Las guías actuales recomiendan considerar TSS para los tumores de células de Sertoli en niños.27
Anomalías del desarrollo y quistes
La displasia quística de la rete testis es una anomalía del desarrollo poco frecuente que se presenta como un bulto testicular. Casi siempre se asocia con agenesia renal ipsilateral. La ecografía muestra que la lesión es quística, por lo general en el polo superior del testículo, con compresión del tejido testicular normal adyacente (Figura 3). Tradicionalmente se recomendaba TSS para la lesión. Se han reportado tasas significativas de recurrencia tras la TSS. Dada la apariencia característica en la ecografía y la anomalía renal ipsilateral asociada, su naturaleza benigna y los informes cada vez más numerosos de regresión de la lesión con el tiempo, ahora se sugiere un manejo conservador con preservación testicular y vigilancia. Puede considerarse una biopsia de la lesión si existe alguna duda sobre el diagnóstico antes del manejo conservador.38,39
Los quistes epididimarios simples y los quistes intratesticulares pueden presentarse en la infancia. En ocasiones son sintomáticos. Por lo general son susceptibles de enucleación o destechamiento si se requiere.
Resumen de los tumores testiculares en AYA
Los tumores testiculares en AYA suelen ser malignos y, por lo general, GCTs, principalmente derivados de GCNIS. Los GCTs testiculares comprenden el 14% de las neoplasias en adolescentes y son el tumor sólido más frecuente en este grupo etario .
Histológicamente, en su mayoría tienden a ser carcinomas embrionarios, con componentes mixtos de TCG no seminomatosos. A menudo se presentan con enfermedad metastásica y tienen una tasa de recaída más alta. La evaluación de sospecha de malignidad incluye imagen con ecografía, marcadores tumorales - AFP, BHCG y LDH, y TC de estadificación de tórax, abdomen y pelvis.10 El teratoma pospuberal también deriva de GCNIS, a diferencia de su contraparte prepuberal. Las metástasis ocurren en el 22-37% de los teratomas en AYA.40 También debe señalarse que los tumores testiculares malignos en AYA no necesariamente presentan marcadores tumorales elevados.41
El estándar de atención para una sospecha de malignidad testicular en AYA es la orquiectomía radical por vía inguinal. Para la enfermedad localizada, la orquiectomía radical suele ser curativa. Los AYAs que tienen enfermedad en estadio clínico 1 tras la orquiectomía, por lo general se someten a vigilancia activa para la detección de recurrencia; el 20-30% presentarán recurrencia clínica, y la supervivencia con quimioterapia de rescate es excelente.10 Este enfoque conservador limita el sobretratamiento de la mayoría con enfermedad en estadio clínico 1, y limita la exposición a los efectos secundarios de la quimioterapia basada en platino, dirigiendo el tratamiento a quienes presentan enfermedad recurrente demostrable. Los tumores >4cm, la invasión linfovascular y un componente creciente de carcinoma embrionario se asocian con un mayor riesgo de enfermedad metastásica.42
Los AYAs con enfermedad en estadio clínico II y III suelen recibir quimioterapia. La RLND se usa de manera selectiva en quienes presentan enfermedad residual o una masa posquimioterapia, a pesar de que los marcadores tumorales sean negativos, ya que la lesión residual puede ser un teratoma, por lo general menos sensible a la quimioterapia.10
Resumen de los tumores paratesticulares en niños
La TSS con escisión focal de la lesión suele considerarse para lesiones paratesticulares benignas poco frecuentes, como el lipoma.
El tumor neuroectodérmico melanótico de la infancia es un tumor raro que afecta la región epididimaria y paratesticular.20 Suele ser benigno, pero diferenciarlo histológicamente de los tumores malignos de células pequeñas redondas azules en la biopsia puede ser un desafío. Al ser típicamente benigno, la orquidectomía suele ser curativa; pero el 10% puede mostrar comportamiento maligno con recidiva y/o metástasis. Tras la cirugía, se aconseja la vigilancia de seguimiento con estudios de imagen de sección transversal como la resonancia magnética.2
El rabdomiosarcoma paratesticular es la neoplasia maligna paratesticular más frecuente en la infancia. Representa el 5% de todas las neoplasias malignas intrascrotales y el 40% de todas las neoplasias malignas paratesticulares.43 Existe un pico bimodal de incidencia, uno en el grupo AYA y otro en lactantes menores de 6 meses de edad. El tumor se origina a partir de los elementos mesenquimatosos de los tejidos paratesticulares. La presentación suele ser con una masa escrotal indolora, y una proporción significativa presenta enfermedad metastásica al diagnóstico. La ecografía suele mostrar una lesión paratesticular sólida (Figura 5). Se requiere TC de estadificación de abdomen, pelvis y tórax para evaluar la diseminación locorregional y metastásica. Los marcadores tumorales suelen ser negativos.
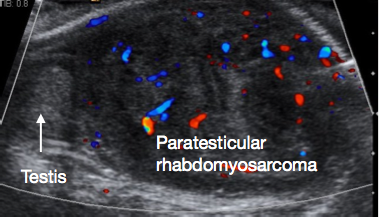
Figura 5 Ecografía de rabdomiosarcoma paratesticular, testículo normal a la izquierda de la imagen, gran masa paratesticular a la derecha de la imagen
Se ha publicado recientemente una declaración de consenso del Children’s Oncology Group (COG), el European paediatric Soft tissue sarcoma Study Group (EpSSG) y la Cooperative Weichteilsarkom Studiengruppe (CWS) sobre el manejo quirúrgico del rabdomiosarcoma paratesticular.44 La orquidectomía radical con resección en bloque del tumor, el testículo y el cordón espermático hasta el anillo inguinal interno constituye el manejo quirúrgico actualmente recomendado del rabdomiosarcoma paratesticular. La vía escrotal para la resección está contraindicada, ya que dificulta el control proximal a nivel del anillo inguinal interno; también debe evitarse la biopsia transescrotal, ya que aumenta el riesgo de derrame tumoral.
La mayoría de los rabdomiosarcomas paratesticulares en la infancia son de histología embrionaria. Si la lesión es embrionaria, en los niños mayores de 10 años se recomienda la evaluación de los ganglios linfáticos retroperitoneales en cualquier estadio clínico; pero en los varones menores de 10 años, la evaluación de los ganglios linfáticos retroperitoneales solo se realiza si hay evidencia de diseminación local o de ganglios aumentados de tamaño. Si en las imágenes hay ganglios aumentados y no se realiza evaluación ganglionar, la recomendación es tratar con quimioterapia como si los ganglios estuvieran afectados.44
Para el rabdomiosarcoma de histología alveolar, se recomienda la evaluación de los ganglios linfáticos retroperitoneales en todos los pacientes, independientemente de los hallazgos de imagen. Si los ganglios son positivos, están indicadas la quimioterapia y la radioterapia.44
Los resultados tras el tratamiento del rabdomiosarcoma paratesticular son mejores en el grupo prepuberal que en el grupo AYA. Existe una supervivencia libre de fracaso del 90% en el grupo de edad prepuberal frente al 63% en adolescentes.45
Metástasis o neoplasia maligna infiltrante en los testículos en la infancia
Los testículos son un sitio frecuente de infiltración en la leucemia y el linfoma - como la leucemia linfoblástica aguda, el linfoma folicular o el linfoma de Burkitt en niños. La presentación suele ser un aumento significativo del tamaño testicular, de forma unilateral o bilateral. Los hallazgos ecográficos suelen mostrar un testículo aumentado de tamaño, difusamente hipoecoico y con hipervascularidad.46
TSS y orquiectomía radical
Las guías clínicas ahora recomiendan firmemente la TSS para los tumores testiculares prepuberales que se sospecha firmemente que son benignos en el estudio diagnóstico.27 La TSS se realiza por vía inguinal. El pinzamiento atraumático de los vasos del cordón espermático antes de la movilización y la disección testicular se considera una técnica oncológica estándar y permite minimizar el sangrado y optimizar la visualización de la disección en el órgano prepuberal, habitualmente pequeño. (Figura 6).
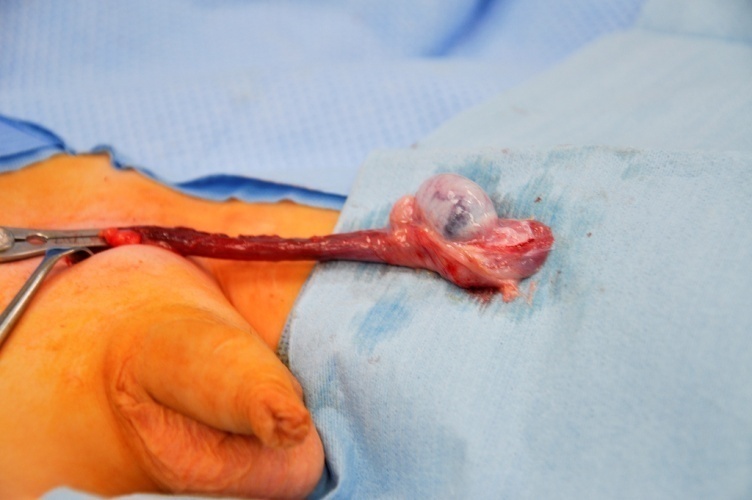
Figura 6 TSS - Pinza vascular atraumática en el cordón espermático, tumor de células de Leydig en el polo inferior del testículo
La evaluación mediante sección congelada es útil para ayudar a confirmar que la lesión es benigna y que los márgenes están libres. En muchos centros con experiencia, la sección congelada no se realiza de forma rutinaria actualmente en lesiones prepuberales negativas para marcadores tumorales con características clínicas y ecográficas benignas.41 Si existe duda o sospecha de malignidad a pesar de los pasos de la TSS, entonces se abandona la TSS y se realiza una orquidectomía radical. Si la TSS se realiza con éxito, la túnica albugínea se cierra con sutura tras la resección de la lesión y el testículo se recoloca en el escroto.
En todos los niños con sospecha clínica de malignidad testicular y paratesticular, debe realizarse una estadificación preoperatoria de la extensión locorregional y metastásica. El estándar de atención para las lesiones malignas es la orquiectomía radical, realizada por vía inguinal y con pinzamiento vascular antes de la movilización del testículo y de la lesión. El cordón espermático debe ligarse y resecarse a nivel del anillo inguinal interno. Para las lesiones paratesticulares, el tumor debe resecarse en bloque junto con el testículo y el cordón espermático; si hay invasión de la piel escrotal, la piel escrotal afectada debe resecarse también en bloque junto con la lesión.44
Estadificación clínica de los tumores malignos
El Children’s Oncology Group (COG) utiliza un sistema de estadificación clínica por estadios I–IV para las neoplasias malignas testiculares prepuberales (Tabla 2). El estadio I es esencialmente enfermedad localizada en el testículo en el momento de la resección.
Tabla 2 Estadificación del Children’s Oncology Group para tumores testiculares
| Estadio | Descripción |
|---|---|
| I | Limitado al testículo, completamente resecado mediante orquidectomía inguinal alta; sin evidencia clínica, radiográfica ni histológica de enfermedad más allá de los testículos |
| Los pacientes con marcadores tumorales normales o desconocidos al diagnóstico deben tener una RPLND ipsilateral negativa para confirmar la enfermedad estadio I si las imágenes demuestran GL >2 cm | |
| Los pacientes que han sido sometidos a orquidectomía escrotal con ligadura alta del cordón son estadio I” | |
| II | “Biopsia transescrotal; enfermedad microscópica en el escroto o alta en el cordón espermático (<5 cm del extremo proximal) |
| Falta de normalización o de descenso de los marcadores tumorales con una vida media apropiada” | |
| III | Biopsia transescrotal; enfermedad microscópica en el escroto o alta en el cordón espermático (<5 cm del extremo proximal) |
| GL >4 cm por TC o 2–4 cm con confirmación por biopsia” | |
| IV | Metástasis a distancia, incluido el hígado |
| III | Afectación de ganglios linfáticos retroperitoneales, pero sin afectación visceral ni extraabdominal |
La Comisión Conjunta Estadounidense sobre el Cáncer (AJCC) generalmente utiliza el sistema Tumor (T), Ganglios (N) y Metástasis (M) con una designación S para marcadores tumorales posquirúrgicos (Tabla 3).
Tabla 3 Estadificación AJCC
| T-Tumor primario | N-Ganglios linfáticos regionales | M-Metástasis a distancia | S-Marcadores tumorales séricos |
|---|---|---|---|
| pT0 – sin evidencia de tumor primario | cN0 – sin metástasis en ganglios linfáticos regionales | M0 – sin metástasis a distancia | S0 – niveles de marcadores dentro de los límites normales |
| pTis – neoplasia intratubular de células germinales (carcinoma in situ) | pN0 – sin metástasis en ganglios linfáticos regionales | M1 – metástasis a distancia | S1 - LDH < 1.5 X N y hCG (mIU/mL) <5000 y AFP (ng/mL) <1000 |
| pT1 – tumor limitado al testículo y al epidídimo sin ILV; el tumor puede invadir la túnica albugínea, pero no la túnica vaginal | cN1 – metástasis con una masa ganglionar≤ 2 cm o múltiples ganglios, ninguno>2 cm | M1a – metástasis ganglionar no regional o pulmonar | S2 LDH 1.5–10 X N o hCG (mIU/mL) 5000–50,000 o AFP (ng/mL) 1000–10,000 |
| pT2 – tumor limitado al testículo y al epidídimo con ILV, o tumor que se extiende a través de la túnica albugínea con compromiso de la túnica vaginal | pN1 – metástasis con una masa ganglionar≤2 cm y ≤5 ganglios positivos, ninguno >2 cm | M1b – metástasis a distancia en sitios distintos de los ganglios no regionales y del pulmón | S3 LDH >10 x N o hCG (mIU/mL) >50,000 o AFP (ng/mL) >10,000 |
| pT3 – el tumor invade el cordón espermático con o sin ILV | cN2 – metástasis con una masa ganglionar 2–5 cm o múltiples ganglios, cualquiera>2 cm pero no >5 cm | ||
| pT4 –tumor invade el escroto con o sin ILV | pN2 – metástasis con una masa ganglionar 2–5 cm, o >5 ganglios positivos, ninguno >5 cm, o evidencia de extensión tumoral extranodal | ||
| cN3 – metástasis con una masa ganglionar >5 cm | |||
| pN3 – metástasis con una masa ganglionar>5 cm |
AFP: alfa-fetoproteína; hCG : beta gonadotropina coriónica humana; LDH: lactato deshidrogenasa; LN: ganglio linfático; LVI: invasión linfovascular; N: normal; c: clínico; p: patológico; T: tumor primario; N: ganglios linfáticos regionales; M: metástasis; S: marcadores tumorales séricos.
Los ahora superados Estudios Intergrupales de Rabdomiosarcoma (IRS) establecieron tanto un sistema de ‘agrupación’ basado en la resecabilidad quirúrgica como un sistema de estadificación TNM modificado por el IRS para el rabdomiosarcoma paratesticular.
Complicaciones del tratamiento
Tanto la TSS como la orquiectomía radical son procedimientos asociados a una buena recuperación, con pequeños riesgos asociados de sangrado con hematoma escrotal, infección y recurrencia de la lesión. La atrofia testicular es rara tras la TSS.41
En los últimos años, el manejo de los tumores testiculares y paratesticulares pediátricos se ha centrado en reducir los riesgos y los efectos negativos a largo plazo de la quimioterapia y la radioterapia, mediante la estratificación del riesgo tumoral y ofreciendo tratamiento adicional únicamente a los niños que cumplen los criterios requeridos. En la actualidad, a la mayoría de los niños con enfermedad en estadio I se les ofrecerá vigilancia activa tras la resección del tumor, y solo aquellos con enfermedad recurrente demostrada requerirán quimioterapia.
Los efectos adversos de la quimioterapia, como la nefrotoxicidad por cisplatino y la neuropatía periférica, así como la fibrosis pulmonar después de bleomicina, están bien descritos.
Los efectos adversos a largo plazo de la quimioterapia y la radioterapia incluyen alteración de la fertilidad y neoplasias malignas secundarias.
Seguimiento y vigilancia sugeridos después del tratamiento
Las lesiones benignas confirmadas con márgenes libres, como el teratoma prepuberal, por lo general no requieren vigilancia rutinaria a largo plazo después de la TSS. Sin embargo, las guías clínicas sugieren un seguimiento posquirúrgico inicial con ecografía cada 3-6 meses durante el primer año posoperatorio.27
Todos los niños con neoplasia maligna testicular o paratesticular requieren un seguimiento y vigilancia adecuados durante varios años, según los protocolos oncológicos. Esto tiene como objetivo mantener una vigilancia activa de la recurrencia de la enfermedad y controlar los efectos a largo plazo tras la cirugía y el tratamiento con quimioterapia y/o radioterapia.
Puntos clave
- La mayoría de los tumores testiculares prepuberales son benignos
- La mayoría de los tumores testiculares prepuberales malignos son tumores del saco vitelino puros
- Los tumores testiculares de los cordones sexuales / estromales son raros en la infancia y en gran medida tienden a ser benignos
- La mayoría de los tumores testiculares en AYA son malignos
- El rabdomiosarcoma paratesticular es la malignidad paratesticular más frecuente en los niños, pero sigue siendo raro
Conclusiones
La mayoría de los tumores testiculares prepuberales son benignos. La TSS se puede considerar de forma segura y se recomienda para tumores testiculares prepuberales con características clínicas y ecográficas de una lesión benigna, y marcadores tumorales negativos.
La mayoría de los tumores testiculares malignos prepuberales son tumores del saco vitelino puros. La AFP está marcadamente elevada en la mayoría de los tumores del saco vitelino. Tras el estudio de estadificación con TC, el tratamiento consiste en orquiectomía radical. La mayoría presenta enfermedad en estadio I localizada en el testículo y la cirugía es curativa. La quimioterapia se reserva para los niños con enfermedad en estadio II o superior, o para aquellos con estadio I que presentan recurrencia tras la cirugía.
La mayoría de los tumores testiculares en AYA son malignos. Tienden a ser carcinomas embrionarios y tumores de células germinales mixtos.
Los tumores testiculares del estroma del cordón sexual son raros en la infancia y, en su mayoría, tienden a ser benignos y aptos para TSS.
El rabdomiosarcoma paratesticular es la neoplasia maligna paratesticular más frecuente en los niños. Tras una estadificación y un estudio adecuados, el tratamiento suele ser la orquiectomía radical en bloque con la masa tumoral paratesticular, mediante abordaje inguinal. Si la lesión es de tipo embrionario en la histología, se recomienda la evaluación de los ganglios linfáticos retroperitoneales para los niños mayores de 10 años, independientemente del estadio; y para los varones menores de 10 años que presenten evidencia de enfermedad locorregional o recidiva ganglionar. Si la lesión es de tipo alveolar en la histología, se recomienda la evaluación de los ganglios linfáticos retroperitoneales para todos, independientemente de los hallazgos de imagen.
Referencias
- Silber S. Testis Development, Embryology, and Anatomy. 2018. In: Fundamentals of Male Infertility \[Internet\]. Springer; , DOI: 10.1007/978-3-319-76523-5_1.
- Ahmed HU, Arya M, Muneer A, Mushtaq I, Sebire NJ. Testicular and paratesticular tumours in the prepubertal population. Lancet Oncol 2010; 11 (5): 476–483. DOI: 10.1016/s1470-2045(10)70012-7.
- Coppes MJ, Rackley R, Kay R. Primary testicular and paratesticular tumors of childhood. Med Pediatr Oncol 1994; 22 (5): 329–340. DOI: 10.1002/mpo.2950220506.
- Schneider DT, Calaminus G, Koch S, Teske C, Schmidt P, Haas RJ. Epidemiologic analysis of 1,442 children and adolescents registered in the German germ cell tumor protocols. Pediatr Blood Cancer 2004; 42 (2): 169–175. DOI: 10.1002/pbc.10321.
- Nerli RB, Ajay G, Shivangouda P, Pravin P, Reddy M, Pujar VC. Prepubertal testicular tumors: our 10 years experience. Indian J Cancer 2010; 47 (3): 292–295. DOI: 10.4103/0019-509x.64730.
- Woo LL, Ross JH. Partial orchiectomy vs. radical orchiectomy for pediatric testis tumors. Transl Androl Urol 2020; 9 (5): 2400–2407. DOI: 10.21037/tau-19-815.
- Jarvis H, Cost NG, Saltzman AF. Testicular tumors in the pediatric patient. Semin Pediatr Surg 2021; 30 (4). DOI: 10.1016/j.sempedsurg.2021.151079.
- Grady RW, Ross JH, Kay R. Epidemiological features of testicular teratoma in a prepubertal population. J Urol 1997; 158 (3 Pt 2): 1191–1192. DOI: 10.1097/00005392-199709000-00129.
- Ross JH, Rybicki L, Kay R. Clinical behavior and a contemporary management algorithm for prepubertal testis tumors: a summary of the Prepubertal Testis Tumor Registry. J Urol 2002; 168 (4 Pt 2): 8–9. DOI: 10.1097/00005392-200210020-00004.
- Saltzman AF, Cost NG. Adolescent and Young Adult Testicular Germ Cell Tumors: Special Considerations. Adv Urol 2018; 2018 (2375176). DOI: 10.1155/2018/2375176.
- Williamson D SR, B M-G, C A, F E, L U, T.M.. The World Health Organization 2016 classification of testicular germ cell tumours: a review and update from the International Society of Urological Pathology Testis Consultation Panel. Histopathology 2017; 70: 335–346. DOI: 10.1111/his.13102.
- Renedo DE, Trainer TD. Intratubular germ cell neoplasia (ITGCN) with p53 and PCNA expression and adjacent mature teratoma in an infant testis. An immunohistochemical and morphologic study with a review of the literature. Am J Surg Pathol 1994; 18 (9): 947–952. DOI: 10.1097/00000478-199409000-00010.
- Hawkins E, Heifetz SA, Giller R, Cushing B. The prepubertal testis (prenatal and postnatal): its relationship to intratubular germ cell neoplasia: a combined Pediatric Oncology Group and Childrenś Cancer Study Group. Hum Pathol 1997; 28 (4): 404–410. DOI: 10.1016/s0046-8177(97)90027-7.
- Agarwal PK, Palmer JS. Testicular and paratesticular neoplasms in prepubertal males. J Urol 2006; 176 (3): 875–881. DOI: 10.1016/j.juro.2006.04.021.
- Luckie TM, Danzig M, Zhou S, Wu H, Cost NG, Karaviti L. A Multicenter Retrospective Review of Pediatric Leydig Cell Tumor of the Testis. J Pediatr Hematol Oncol 2019; 41 (1): 74–76. DOI: 10.1097/mph.0000000000001124.
- Grogg JB, Schneider K, Bode PK, Kranzbuhler B, Eberli D, Sulser T. Risk factors and treatment outcomes of 239 patients with testicular granulosa cell tumors: a systematic review of published case series data. J Cancer Res Clin Oncol 2020; 146 (11): 2829–2841. DOI: 10.1007/s00432-020-03326-3.
- Talon I, Moog R, Kauffmann I, Grandadam S, Becmeur F. Sertoli cell tumor of the testis in children: reevaluation of a rarely encountered tumor. J Pediatr Hematol Oncol 2005; 27 (9): 491–494.
- Chung JM, Lee SD. Overview of pediatric testicular tumors in Korea. Korean J Urol 2014; 55 (12): 789–796. DOI: 10.4111/kju.2014.55.12.789.
- Ulbright TM, Young RH. Testicular and paratesticular tumors and tumor-like lesions in the first 2 decades. Semin Diagn Pathol 2014; 31 (5): 323–381. DOI: 10.1053/j.semdp.2014.07.003.
- Calabrese F, Danieli D, Valente M. Melanotic neuroectodermal tumor of the epididymis in infancy: case report and review of the literature. Urology 1995; 46 (3): 415–418. DOI: 10.1016/s0090-4295(99)80234-9.
- Pettersson A, Richiardi L, Nordenskjold A, Kaijser M, Akre O. Age at surgery for undescended testis and risk of testicular cancer. N Engl J Med 2007; 356 (18): 1835–1841. DOI: 10.1016/j.urolonc.2007.08.002.
- Schneuer FJ, Milne E, Jamieson SE, Pereira G, Hansen M, Barker A. Association between male genital anomalies and adult male reproductive disorders: a population-based data linkage study spanning more than 40 years. Lancet Child Adolesc Health 2018; 2 (10): 736–743. DOI: 10.1016/s2352-4642(18)30254-2.
- Wood HM, Elder JS. Cryptorchidism and testicular cancer: separating fact from fiction. J Urol 2009; 181 (2): 452–461. DOI: 10.1016/s0084-4071(09)79277-2.
- LAt H, NR B, C R, HS D, RJM N, J Q. The prognostic value of testicular microlithiasis as an incidental finding for the risk of testicular malignancy in children and the adult population: A systematic review. On Behalf of the EAU Pediatric Urology Guidelines Panel Epub Ahead of Print Journal of Pediatric Urology 2021. DOI: 10.1016/j.jpurol.2021.06.013.
- Thomas JC, Ross JH, Kay R. Stromal testis tumors in children: a report from the prepubertal testis tumor registry. J Urol 2001; 166 (6): 2338–2340. DOI: 10.1016/s0022-5347(05)65583-8.
- Friend J, Barker A, Khosa J, Samnakay N. Benign scrotal masses in children - some new lessons learned. J Pediatr Surg 2016; 51 (10): 1737–1742. DOI: 10.1016/j.jpedsurg.2016.07.016.
- Stein R, Quaedackers J, Bhat NR, Dogan HS, Nijman RJM, Rawashdeh YF. EAU-ESPU pediatric urology guidelines on testicular tumors in prepubertal boys. J Pediatr Urol 2021; 17 (4): 529–533. DOI: 10.1016/j.jpurol.2021.06.006.
- Wu JT, Book L, Sudar K. Serum alpha fetoprotein (AFP) levels in normal infants. Pediatr Res 1981; 15 (1): 50–52. DOI: 10.1203/00006450-198101000-00012.
- Haas RJ, Schmidt P, Gobel U, Harms D. Testicular germ cell tumors, an update. Results of the German cooperative studies 1982-1997. Klin Padiatr 1999; 211 (4): 300–304.
- A DB, GC M, R P, P H, FG H-C, JW O. Influence of tumor site and histology on long-term survival in 193 children with extracranial germ cell tumors. Eur J Pediatr Surg 2008; 18 (1): 1–6. DOI: 10.1055/s-2007-989399.
- Ulbright TM, Srigley JR. Dermoid cyst of the testis: a study of five postpubertal cases, including a pilomatrixoma-like variant, with evidence supporting its separate classification from mature testicular teratoma. Am J Surg Pathol 2001; 25 (6): 788–793.
- P GA, LM HF, M JG, C SF, D SA, S NL. \[Mature cystic teratoma of the testis (dermoid cyst. Case Report and Literature Review\] Arch Esp Urol 2009; 62 (9): 747–751.
- Grady RW. Current management of prepubertal yolk sac tumors of the testis. Urol Clin North Am 2000; 27 (3): 503–508. DOI: 10.1016/s0094-0143(05)70097-5.
- Grady RW, Ross JH, Kay R. Patterns of metastatic spread in prepubertal yolk sac tumor of the testis. J Urol 1995; 153 (4): 1259–1261. DOI: 10.1097/00005392-199504000-00068.
- Ye YL, Zheng FF, Chen D, Zhang J, Liu ZW, Qin ZK. Relapse in children with clinical stage I testicular yolk sac tumors after initial orchiectomy. Pediatr Surg Int 2019; 35 (3): 383–389. DOI: 10.1007/s00383-018-04426-5.
- Kao CS, Cornejo KM, Ulbright TM, Young RH. Juvenile granulosa cell tumors of the testis: a clinicopathologic study of 70 cases with emphasis on its wide morphologic spectrum. Am J Surg Pathol 2015; 39 (9): 1159–1169. DOI: 10.1016/j.juro.2016.07.011.
- Dursun F, Su Dur SM, Sahin C, Kirmizibekmez H, Karabulut MH, Yoruk A. A Rare Cause of Prepubertal Gynecomastia: Sertoli Cell Tumor. Case Rep Pediatr 2015; 2015 (439239). DOI: 10.1155/2015/439239.
- Gelas T, Margain Deslandes L, Mestrallet G, Pracros JP, Mouriquand P. Spontaneous regression of suspected cystic dysplasia of the rete testis in three neonates. J Pediatr Urol 2016; 12 (6): 1–4. DOI: 10.1016/j.jpurol.2016.05.032.
- Helman T, Epelman M, Ellsworth P. Cystic Dysplasia of the Rete Testis: Does Pathophysiology Guide Management? Urology 2020; 141: 150–153. DOI: 10.1016/j.urology.2020.03.026.
- Farci F, Teratoma SST. StatPearls. .
- Bois JI, Vagni RL, Badiola FI, Moldes JM, Losty PD, Lobos PA. Testis-sparing surgery for testicular tumors in children: a 20 year single center experience and systematic review of the literature. Pediatr Surg Int 2021; 37 (5): 607–616. DOI: 10.1007/s00383-020-04850-6.
- Vergouwe Y, Steyerberg EW, Eijkemans MJ, Albers P, Habbema JD. Predictors of occult metastasis in clinical stage I nonseminoma: a systematic review. J Clin Oncol 2003; 21 (22): 4092–4099. DOI: 10.1016/j.urolonc.2004.02.005.
- Shapiro E, Strother D. Pediatric genitourinary rhabdomyosarcoma. J Urol 1992; 148 (6): 1761–1768. DOI: 10.1016/s0022-5347(17)37023-4.
- Rogers TN, Seitz G, Fuchs J, Martelli H, Dasgupta R, Routh JC. Surgical management of paratesticular rhabdomyosarcoma: A consensus opinion from the Childrenś Oncology Group, European paediatric Soft tissue sarcoma Study Group, and the Cooperative Weichteilsarkom Studiengruppe. Pediatr Blood Cancer 2021; 68 (4). DOI: 10.1002/pbc.28938.
- Crist WM, Anderson M JR, JL F, C R, RB R, F.B.. Intergroup rhabdomyosarcoma study-IV: results for patients with nonmetastatic disease. J Clin Oncol 2001; 19 (12): 3091–3102. DOI: 10.1200/jco.2001.19.12.3091.
- Sanguesa C, Veiga D, Llavador M, Serrano A. Testicular tumours in children: an approach to diagnosis and management with pathologic correlation. Insights Imaging 2020; 11 (1). DOI: 10.1186/s13244-020-00867-6.
Última actualización: 2025-09-21 13:35