21: Complejo de extrofia vesical y epispadias
Este capítulo durará aproximadamente 40 minutos para leer.
Introducción
La extrofia vesical es una rara malformación genitourinaria que, cuando se define de manera simple, se refiere a la eversión de la vejiga hacia el exterior del cuerpo (Figura 1). Es una malformación genitourinaria rara cuyo manejo sigue suponiendo un desafío para el campo de la urología pediátrica. De forma más completa, el Complejo de Extrofia-Epispadias comprende múltiples defectos que abarcan desde epispadias aislado en varones o en mujeres, la extrofia vesical clásica e incluso la extrofia cloacal.
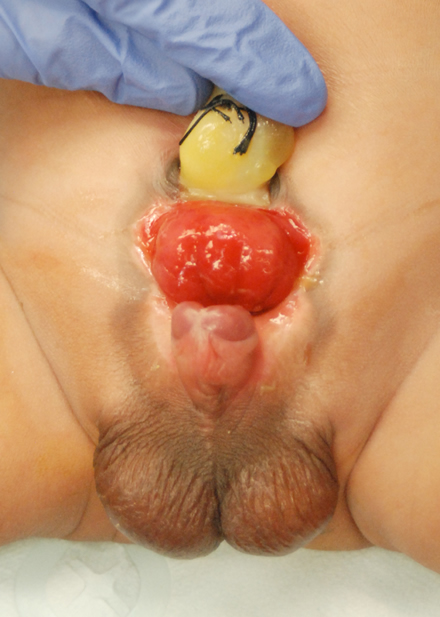
Figura 1 Recién nacido varón con extrofia vesical clásica.
Incidencia
La incidencia de la extrofia vesical se estimó originalmente entre 1:10,000 y 1:50,000 nacidos vivos. Sin embargo, datos más recientes del sistema de monitoreo de la International Clearinghouse for Birth Defects y de la Healthcare Cost and Utilization Project Nationwide Inpatient Sample de los Estados Unidos estimaron la incidencia en 2.15–3.3 por 100,000 nacidos vivos. Existe un predominio masculino, con una razón varón:mujer reportada entre 2.3–6:1.
Embriología
La invasión mesodérmica entre las capas ectodérmica y endodérmica de la membrana cloacal bilaminar da lugar a la formación de la musculatura abdominal inferior y los huesos pélvicos. Tras la invasión mesenquimática, el crecimiento caudal del tabique urorrectal divide la cloaca en una vejiga anterior y un recto posterior. Los tubérculos genitales migran medialmente y se fusionan en la línea media, craneal a la membrana dorsal, antes de que esta se perfore. La membrana cloacal puede sufrir ruptura prematura según la magnitud del defecto infraumbilical. El estadio de desarrollo en el que ocurre la ruptura de la membrana determina si se producirá extrofia vesical, extrofia cloacal o epispadias.
La teoría más relacionada con el desarrollo embrionario en la extrofia, sostenida por Marshall y Muecke, describe el defecto básico como un sobredesarrollo inferior anómalo de la membrana cloacal, que impide la migración medial del tejido mesenquimatoso. Por lo tanto, no se produce un desarrollo adecuado de la pared abdominal. El momento en que se produce la ruptura de este defecto cloacal determina la gravedad del trastorno. Las perforaciones centrales que dan lugar a la extrofia clásica tienen la mayor incidencia (60%), mientras que las variantes de la extrofia representan el 30% y la extrofia cloacal el 10%.
Se han propuesto otras teorías respecto a la causa del complejo extrofia-epispadias. Ambrose y O’Brian postularon que un desarrollo anómalo de los tubérculos genitales, con fusión en la línea media por debajo y no por encima de la membrana cloacal, da lugar al defecto de extrofia.1 Otra hipótesis describe una inserción caudal anómala del pedículo corporal con falta de interposición del tejido mesenquimatoso en la línea media. Debido a esta falla, no se produce el desplazamiento de la cloaca hacia las profundidades de la cavidad abdominal. Una membrana cloacal que permanece en una posición infraumbilical superficial representa un estado embrionario inestable con una marcada tendencia a desintegrarse. Ninguna teoría parece dilucidar todos los aspectos del complejo observado clínicamente y continúan los estudios para describir por completo el proceso de desarrollo que finalmente forma el complejo extrofia-epispadias.
Herencia
Existe evidencia de una predisposición genética a la extrofia y al epispadias. El riesgo de recurrencia de la extrofia vesical en una familia determinada es de aproximadamente 1 en 100, mucho mayor que en la población general. Hay muchos informes de gemelos con extrofia. Al mismo tiempo, sin embargo, también hay informes de gemelos idénticos en los que ambos presentaban extrofia y de otro par en el que solo uno estaba afectado. Hay numerosos casos de gemelos no idénticos en los que solo uno de los hermanos estaba afectado. Estos pares de gemelos se encontraron tanto en pares masculinos como femeninos.2,3 Los análisis de concordancia de gemelos con complejo extrofia vesical-epispadias también sugieren una etiología genética. Un informe de 151 familias con complejo extrofia-epispadias encontró 4 familias multiplex, para una tasa del 2.7%. La probabilidad de que un progenitor con extrofia tenga un hijo con extrofia es de aproximadamente 1:70 nacidos vivos o 500 veces el riesgo para la población general.3
Se han realizado numerosos esfuerzos por comprender las posibles etiologías del complejo extrofia-epispadias. Se ha postulado la participación del entorno hormonal del desarrollo temprano asociado con la fecundación in vitro, a partir de estudios que mostraron un incremento de 7,5 veces en la extrofia y la extrofia cloacal asociado con el uso de tecnologías de reproducción asistida como la inyección intracitoplasmática de espermatozoides. Otro estudio epidemiológico mostró una mayor tasa de nacimientos con complejo extrofia-epispadias en mujeres que se sometieron a fecundación in vitro. Un estudio más reciente, proveniente de un estudio nacional sueco de casos y controles, encontró que, en general, la extrofia vesical se observa como una malformación aislada sin malformaciones mayores adicionales. Los pacientes con extrofia vesical tendieron a asociarse con bajo peso al nacer (< 1,500 gramos) y edad materna elevada (≥ 35 años).
El gen CASPR3 en el cromosoma 9 ha sido implicado por Boyadjiev y colaboradores como asociado al complejo de extrofia. Otro conjunto de genes en el noveno cromosoma se ha identificado como asociado a la extrofia vesical. Los estudios genéticos están intentando determinar dónde y si pueden encontrarse factores genéticos específicos relacionados con el complejo extrofia-epispadias. Se han identificado múltiples otros posibles loci génicos, pero no se han confirmado.
Diagnóstico prenatal
A pesar de la magnitud del defecto en la pared abdominal inferior y del desarrollo de los órganos pélvicos, la extrofia vesical sigue siendo difícil de diagnosticar de forma fiable mediante ecografía prenatal. Esto probablemente se deba a su baja incidencia y a que a menudo se confunde con diagnósticos más frecuentes como onfalocele o gastrosquisis. Varios grupos han descrito hallazgos ecográficos importantes para el diagnóstico prenatal de la extrofia. En una revisión de 25 ecografías prenatales con el nacimiento subsiguiente de un recién nacido con extrofia vesical clásica, Gearhart et al describieron los criterios principales para el diagnóstico prenatal de la extrofia. Estos criterios incluían la ausencia de llenado vesical, masa abdominal inferior que se vuelve más protuberante a medida que avanza el embarazo, un ombligo de implantación baja, separación de las ramas púbicas y dificultades para determinar el sexo del bebé.2,4,3,5 Un estudio retrospectivo más reciente de Alemania halló que la edad gestacional mediana era de aproximadamente 24 semanas. Nuevamente, todos los fetos presentaron los hallazgos patognomónicos de no visualización de la vejiga fetal y masa abdominal protuberante por debajo del cordón umbilical inserción. Al analizar estos datos, siempre se debe sospechar la extrofia vesical sobre la base de la no visualización de la vejiga.
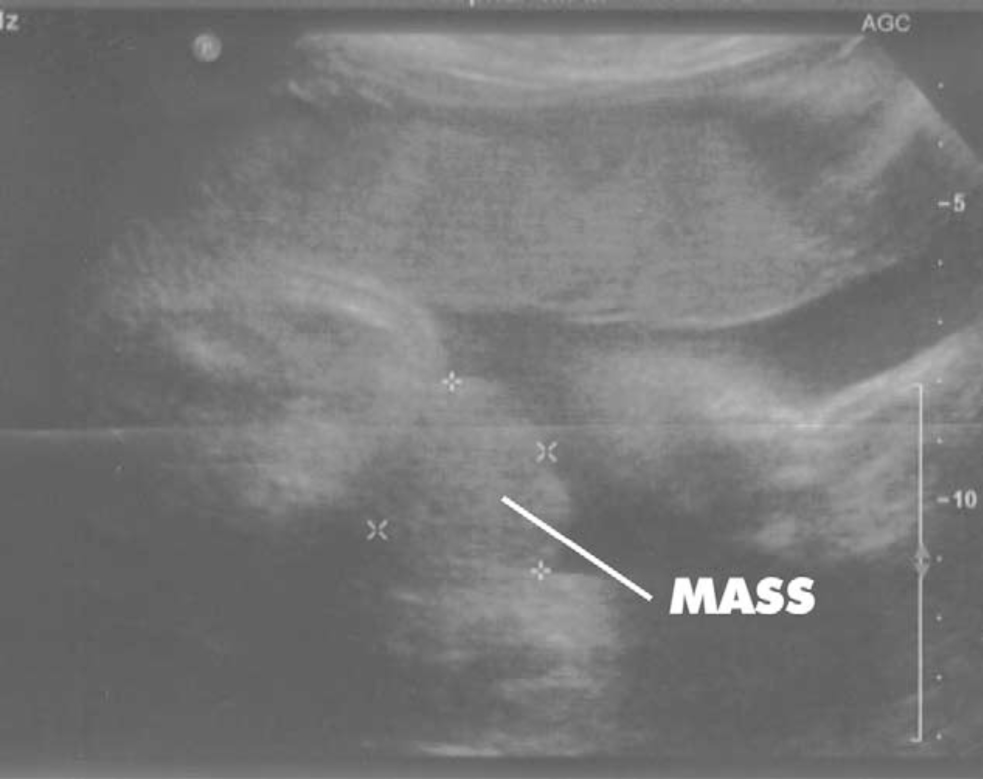
Figura 2 Ecografía a las 30 semanas de gestación que demuestra ausencia de visualización de la vejiga y una masa en el abdomen inferior.
Se considera que la ecografía tridimensional (3D) y el uso creciente de la resonancia magnética fetal (RM fetal) mejorarán la capacidad de diagnosticar la extrofia vesical y cloacal. El diagnóstico prenatal permite realizar asesoramiento prenatal y organizar el parto en un centro especializado en extrofia. Esto permite un enfoque multidisciplinario por equipos con experiencia en el manejo de la naturaleza única del complejo extrofia-epispadias. Esto incluye la disponibilidad de equipos de cirugía reconstructiva en el periodo neonatal inmediato y apoyo psicosocial para los padres y las familias. Con la RM fetal, podría ser posible distinguir entre la extrofia vesical clásica y la extrofia cloacal con la RM. Esto podría ayudar en el asesoramiento prenatal para la madre.
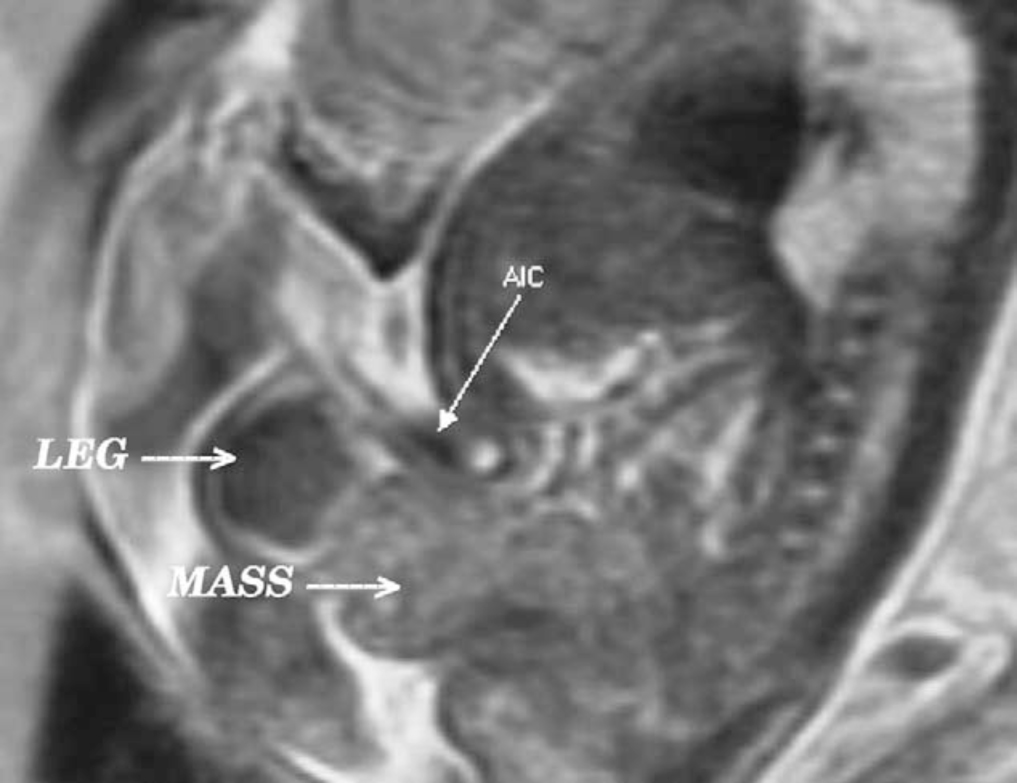
Figura 3 Vista sagital de extrofia vesical (masa) por debajo de la inserción abdominal del cordón umbilical (AIC) en la RM prenatal T2.
El diagnóstico de la extrofia vesical se realiza (o confirma) al nacer mediante la visualización de la placa vesical que, de manera característica, protruye por debajo del cordón umbilical, con músculos rectos divergentes a ambos lados, lo que conduce a unos huesos púbicos ampliamente separados.
Anomalías asociadas
Defectos esqueléticos
El defecto esquelético más evidente es la separación de los huesos púbicos, que está causada por la rotación externa de los huesos innominados, la eversión de las ramas púbicas y una deficiencia del 30% de hueso en la rama púbica.6 Las reconstrucciones por TC 3D determinaron una rotación externa media del aspecto posterior de la pelvis de 12˚ a cada lado, retroversión del acetábulo y una rotación externa media de 18˚ de la pelvis anterior. El uso adicional de tomografías computarizadas 3D mostró que el ángulo de la articulación sacroilíaca (antes del cierre) era 10˚ mayor en la pelvis con extrofia en comparación con los controles pareados por edad y 10˚ más orientado hacia el plano coronal que hacia el sagital. La pelvis ósea también estaba rotada inferiormente 14.7˚. El sacro era un 42.6% mayor según mediciones volumétricas y tenía un 23.5% más de superficie. En conjunto, estas deformidades conducen a una diástasis púbica media de 4.2 cm al nacer, que aumenta a 14.2 cm en adultos. Esto se compara con un ancho de la sínfisis de 0.6 cm en los sujetos control. Estas deformidades de los huesos pélvicos contribuyen al falo acortado, la marcha bamboleante y la rotación externa de los miembros inferiores en los pacientes con extrofia. Un estudio de 299 niños con extrofia vesical indicó que se presentan variaciones espinales sin significación clínica: espina bífida oculta, lumbarización o sacralización de vértebras en el 11%, escoliosis no complicada en el 2.7% y disrafismo espinal en el 4%, incluidos mielomeningocele, lipomeningocele, sacro en cimitarra y hemivértebras. Solo un paciente mostró evidencia de disfunción neurológica.7
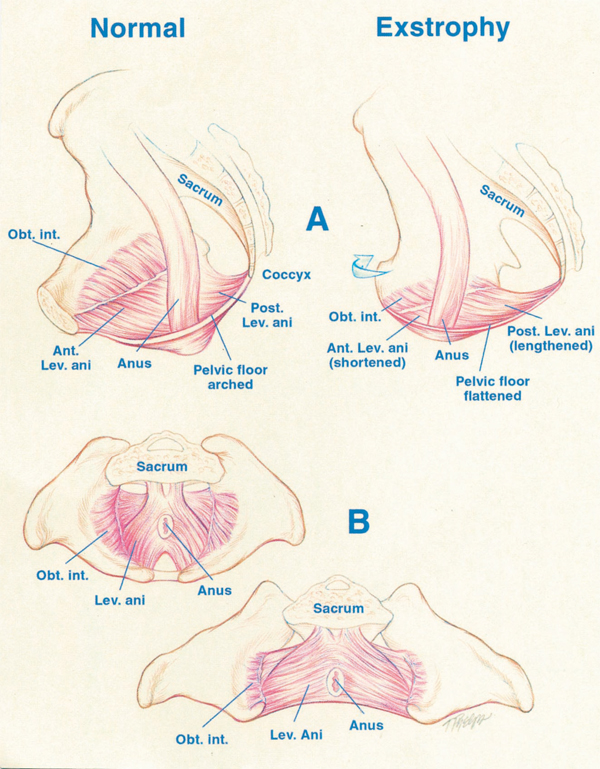
Figura 4 A, desplazamiento del elevador (Lev.) del ano a una posición más posterior (Post.) en el paciente con extrofia, es decir, 68% posterior al ano frente a controles normales. Obsérvese también el acortamiento del segmento anterior (Ant.) del elevador del ano en la extrofia: 32% anterior al ano frente a 48% en los controles. Obt. int., obturador interno. B, mayor rotación externa de 15.1˚ del obturador interno en el grupo con extrofia frente a los controles. Obsérvese también que el área delimitada por el puborrectal es el doble que la de los controles y está más aplanada.
Defectos del suelo pélvico
Los datos de Stec et al que utilizan imágenes de TC 3D demostraron que los cabestrillos puborrectales en pacientes con extrofia vesical clásica soportan un volumen de cavidad corporal dos veces mayor que en los controles normales emparejados por edad.4 Mientras que el grupo muscular elevador del ano en los controles normales está distribuido uniformemente de posterior a anterior (52% a 48%) respecto al recto, en la pelvis con extrofia hay una distribución desigual de 68% a 32% de posterior a anterior. También existe un aplanamiento significativo de los músculos elevadores del ano. Se observa una disminución de 31.7 grados en la inclinación entre las mitades derecha e izquierda de los músculos elevadores del ano y del cabestrillo puborrectal. En consecuencia, el ano está anteriorizado y en ocasiones pátulo, como parte de la extensión posterior del defecto miofascial. Estas malformaciones musculoesqueléticas explican la mayor tasa de prolapso rectal, especialmente en la población femenina con extrofia.
El estudio adicional del suelo pélvico se ha realizado con RM tridimensional (3D) y ha repercutido en la comprensión de la pelvis en la extrofia vesical para la reconstrucción. Williams et al demostraron que el grupo del elevador del ano presentaba una forma menos abovedada y más irregular en la población con extrofia antes del cierre en comparación con los controles normales.8 Tampoco se observó relación entre el grado de diástasis púbica y la magnitud de la curvatura desproporcionada del grupo muscular elevador del ano. La revisión por RM de pelvises posteriores al cierre reveló que, en aquellos con algún grado de continencia, la distancia intersinfisaria era la más corta, el ángulo de divergencia del elevador del ano el más agudo y el cuello vesical el más profundamente situado en la pelvis. Gargollo informó sobre RM antes y después del cierre de la extrofia, señalando que el ángulo puborrectal en aquellos con intervalos secos estaba disminuido en comparación con el previo al cierre.9 Nuevos informes sobre el uso de ecografía perineal 3D para evaluar el suelo pélvico de mujeres adultas con extrofia mostraron que los hallazgos ecográficos se correlacionaban bien con los hallazgos de RM. Estos informes refuerzan la necesidad de una disección agresiva y la colocación posterior de la uretra posterior y la vejiga, junto con una buena reaproximación del pubis en el momento del cierre. Se deben utilizar osteotomías y fijación pélvica si la reconstrucción no se realiza en el período neonatal inmediato.
Defectos de la pared abdominal
Existe un defecto triangular debido a la rotura prematura de la membrana cloacal anómala en la pared abdominal, el cual está ocupado por la vejiga extrofiada y la uretra posterior. Este defecto en la fascia está limitado inferiormente por la banda intrasinfisaria, que representa el diafragma urogenital divergente y conecta el cuello vesical y la uretra posterior con las ramas púbicas. Wakim y Barbet investigaron la relación del músculo recto del abdomen y la fascia con el diafragma urogenital y no encontraron evidencia macroscópica ni histológica del esfínter estriado.10 Sí encontraron evidencia de musculatura vesical que se extiende lateralmente hasta el pubis, donde se interdigita con fibras de la fascia del músculo recto del abdomen para formar el diafragma urogenital fibroso. La importancia de la incisión radical de estas fibras, lateral a la placa uretral, hasta el nivel de la rama púbica inferior y del hiato del elevador del ano, para lograr la posición profunda en la pelvis de la vejiga y la uretra posterior, fue demostrada por Gearhart y sus colegas, utilizando datos de cierres fallidos de extrofia vesical en los que estas fibras estaban intactas en el momento del recierre.11
En el límite cefálico del defecto fascial triangular se encuentra el ombligo. La distancia entre el ombligo y el ano está acortada en la extrofia vesical porque el ombligo se encuentra bien por debajo de la línea horizontal de la cresta ilíaca. Aunque suele haber una hernia umbilical, por lo general es de tamaño insignificante y se repara en el momento del cierre inicial de la extrofia.
Las hernias inguinales son frecuentes. Se deben a una falta de oblicuidad del canal inguinal combinada con anillos inguinales interno y externo grandes y persistencia del conducto peritoneo-vaginal. Connolly y sus colaboradores informaron una incidencia de hernia inguinal del 81,8 % en varones y del 10,5 % en mujeres.12 Se recomienda explorar los canales inguinales en el momento del cierre de la extrofia y extirpar el saco herniario, con reparación de la fascia transversalis y del defecto muscular, para prevenir la recurrencia o una hernia directa, independientemente de si se utiliza un abordaje por etapas o una reparación primaria completa. Además, en el contexto de cierre concomitante de la extrofia y reparación de la hernia inguinal, la tasa de recurrencia de hernia inguinal es superior al 30 % (mucho mayor en varones), lo que refleja una debilidad innata de la pared abdominal y la falta de oblicuidad del canal inguinal. Esto es especialmente marcado durante los primeros 6 meses tras el cierre vesical inicial mediante CPRE.
Defectos anorrectales
El periné del paciente con extrofia es corto y ancho y el ano está directamente detrás del diafragma urogenital. Está desplazado anteriormente y corresponde al límite posterior del defecto de la fascia triangular. El complejo esfinteriano anal también está desplazado anteriormente y debe conservarse íntegro. Estos factores anatómicos contribuyen a grados variables de incontinencia anal y prolapso rectal. El prolapso rectal ocurre con frecuencia en pacientes con extrofia no tratada y con una sínfisis púbica ampliamente separada. Por lo general es transitorio, de fácil reducción y desaparece tras el cierre vesical o la cistectomía/desviación urinaria. La aparición de prolapso del recto también es una indicación para proceder con el manejo definitivo de la vejiga extrofiada. Si ocurre en cualquier momento después del cierre de la extrofia, debe sospecharse obstrucción de la uretra posterior/salida vesical y realizarse de inmediato una evaluación del tracto de salida mediante cistoscopia.
Las implicaciones de la extrofia cloacal (complejo OEIS) sobre el intestino posterior se tratarán más adelante en este capítulo.
Malformaciones genitales masculinas
Los defectos genitales masculinos son graves y difíciles en el momento de la reconstrucción. El falo es corto debido a una deficiencia del 50% en la longitud cavernosa anterior, con preservación de la longitud posterior de los cuerpos cavernosos en comparación con controles emparejados por edad en RM.3 El diámetro del segmento cavernoso posterior fue mayor que en los controles normales. La diástasis de la sínfisis púbica incrementó las distancias intrasinfisarias e intracavernosas, pero el ángulo entre los cuerpos cavernosos no se modificó porque los cuerpos cavernosos estaban separados de forma paralela. Esto da lugar a un pene que parece corto debido a la diástasis y a la marcada deficiencia congénita de tejido cavernoso anterior. La liberación de la cordea dorsal, el alargamiento del surco uretral y la movilización de los pilares en la línea media para alargar en cierta medida el pene pueden resultar en un falo funcional y estéticamente adecuado.
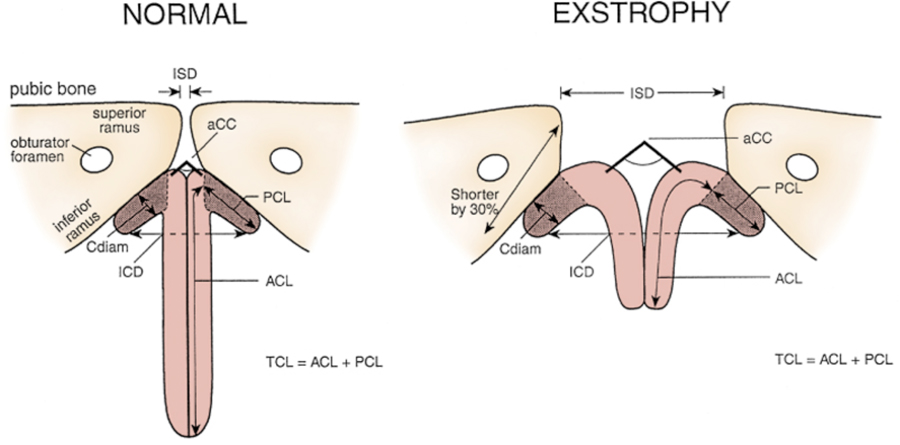
Figura 5 Mediciones del pene y de la pelvis en hombres normales y pacientes con extrofia. ZSD, distancia intersinfisaria. UCC, ángulo subtendido por los cuerpos cavernosos. Cdiam, diámetro del cuerpo cavernoso. PCL, longitud corpórea posterior. ZCD, distancia intercorpórea. ACL, longitud corpórea anterior. EL, longitud corpórea total
El epispadias suele observarse en conjunción con la extrofia vesical clásica. Sin embargo, rara vez se presenta como un defecto congénito aislado en 1 en 117 000 varones y 1 en 150 000 a 300 000 mujeres. Se caracteriza por el fracaso de la placa uretral para tubulizarse en el dorso, con un defecto que varía desde una localización balánica hasta penopúbica. La mayoría de los pacientes varones también presentan algún grado de curvatura dorsal del pene. Algunas pacientes presentan un clítoris bífido. En los varones, la probabilidad de incontinencia urinaria puede depender de la gravedad del defecto de epispadias. Sin embargo, incluso aquellos con epispadias balánico se han descrito como que presentan incontinencia debido a “a field defect” que dificulta la contractilidad y la coaptación vesical y uretral. En contraste, casi todas las pacientes con epispadias presentan incontinencia urinaria, dada la alta probabilidad de un defecto concomitante del cuello vesical.
Gearhart y colaboradores utilizaron RM para demostrar en 13 hombres adultos con extrofia vesical que el volumen, el peso y el área máxima de sección transversal de la próstata parecían normales en comparación con los controles publicados.13 Sin embargo, encontraron que en ninguno de los pacientes evaluados la próstata se extendía circunferencialmente alrededor de la uretra, y la uretra estaba anterior a la próstata en todos los pacientes. Se encontró que los niveles de PSA libre y total en hombres adultos con extrofia vesical eran medibles pero estaban por debajo de los límites superiores de los rangos de referencia establecidos específicos por edad para varones normales.13 Existe un único informe de un paciente de 56 años con epispadias que presentaba cáncer de próstata con un PSA de 4.2 en el momento de la biopsia.14
Los conductos deferentes y los conductos eyaculadores son normales en el paciente con extrofia siempre que no se lesionen iatrogénicamente durante el cierre o la reconstrucción. Se encontró que la longitud media de las vesículas seminales era normal.
Los nervios autónomos que inervan el cuerpo cavernoso (nervios cavernosos) están desplazados lateralmente en los pacientes con extrofia, y estos nervios se preservan en casi todos los pacientes con extrofia, ya que la potencia eréctil se conserva después de la cirugía. Se observa eyaculación retrógrada después del cierre vesical y la reconstrucción del cuello vesical.
Los testículos con frecuencia parecen retráctiles, pero tienen una longitud adecuada en el cordón espermático para alcanzar el escroto plano y ancho sin necesidad de orquidopexia. Los testículos no se han estudiado en un grupo grande de pacientes pospuberales con extrofia, pero en general se considera que no están alterados. D’Hauwers et al informaron del uso de la aspiración percutánea de espermatozoides y de la inyección intracitoplasmática de espermatozoides, y señalan que en 3 pacientes con extrofia obtuvieron buenos resultados en la obtención de espermatozoides.(missing reference)
Defectos genitales femeninos
En las niñas, el monte de Venus, el clítoris y los labios están separados y el introito vaginal está desplazado anteriormente y con estenosis. El clítoris es bífido y la vagina es más corta que en los controles normales pero de calibre normal. El cuello uterino se encuentra en la pared vaginal anterior porque el útero entra en la vagina superiormente. Las trompas de Falopio y los ovarios suelen ser normales. El clítoris bífido debe reaproximarse con los dos extremos de los labios menores para formar la comisura posterior en el momento del cierre primario. Con frecuencia, la dilatación vaginal o una episiotomía pueden ser necesarias para permitir relaciones sexuales satisfactorias en la mujer adulta. Un estudio asociado con la Association for the Bladder Exstrophy Community y redes sociales encontró a 13- mujeres adultas con antecedentes de extrofia vesical. De estas, el 28.5% fueron tratadas por prolapso uterino. 36.2 % informaron embarazos, y de estas el 68% informaron complicaciones con el embarazo.15 La mayoría de las mujeres adultas requieren intervenciones, médicas y quirúrgicas, por problemas ginecológicos posteriores a la menarquia.16
No obstante, a pesar de que la extrofia vesical es una afección grave, se han reportado embarazos saludables, con consecuencias a largo plazo en la continencia y la salud sexual.17
Defectos urinarios
La mucosa vesical expuesta es susceptible a cambios quísticos o metaplásicos y, por lo tanto, debe irrigarse con frecuencia con solución salina y protegerse del traumatismo superficial y de la exposición mediante una membrana protectora hasta que pueda realizarse el cierre vesical quirúrgico. Por lo general, basta con un film plástico (es decir, Saran Wrap). La mucosa vesical al nacimiento puede presentar un segmento de mucosa intestinal ectópica, un asa intestinal aislada o, con mayor frecuencia, pólipos hamartomatosos.
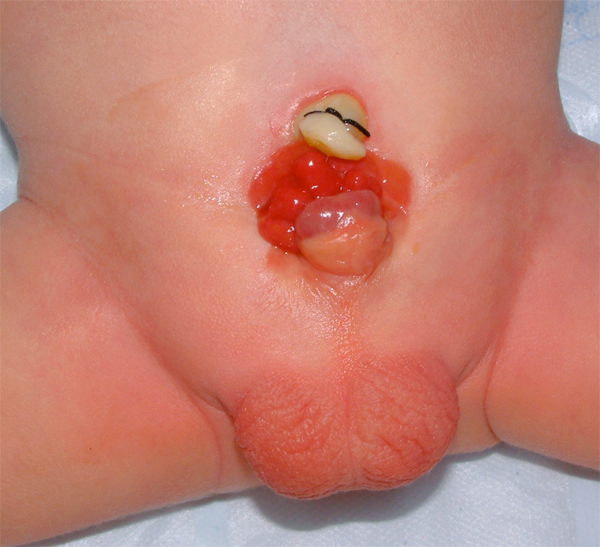
Figura 6 Recién nacido con extrofia vesical clásica. Nótese la presencia de múltiples pólipos en la placa vesical.
Shapiro y colaboradores caracterizaron la función neuromuscular de la vejiga. Demostraron que la densidad de receptores colinérgicos muscarínicos y la afinidad de unión eran similares en sujetos con extrofia y controles.18 Las biopsias vesicales de 12 recién nacidos con extrofia vesical, comparadas con controles apareados por edad, hallaron un aumento en la relación de colágeno respecto al músculo liso en las vejigas con extrofia.19 Se analizaron los tipos de colágeno y se observó una distribución normal de colágeno tipo I, pero se encontró un incremento triple de colágeno tipo III. Más tarde se vio que aquellos pacientes que demostraron crecimiento vesical mediante la medición de la capacidad tras un cierre exitoso, que estaban libres de infección, presentaban una relación de colágeno respecto al músculo liso marcadamente disminuida. Los cultivos primarios de células de músculo liso vesical de extrofia mostraron características de crecimiento similares a las previamente reportadas en células sin extrofia, lo que indica que probablemente conservan su potencial de crecimiento y función. Mathews y asociados encontraron que el número promedio de pequeñas fibras nerviosas mielinizadas por campo estaba significativamente reducido en las vejigas con extrofia en comparación con los controles.20 Se observó preservación de las fibras nerviosas de mayor calibre, lo que llevó al estudio a plantear la hipótesis de que la extrofia vesical en un recién nacido representaba una etapa más temprana del desarrollo vesical. Se han estudiado múltiples marcadores inmunocitoquímicos e histoquímicos, polipéptido intestinal vasoactivo (VIP), neuropéptido Y (NPY), sustancia P (SP), péptido relacionado con el gen de la calcitonina (CGRP), producto génico proteico 9.5 (PGP 9.5) y diaforasa del fosfato de dinucleótido de nicotinamida y adenina (NADPHd), y no hubo evidencia morfológica de desinervación del músculo vesical en ningún caso de extrofia vesical. Sin embargo, los casos de extrofia vesical tras reconstrucción fallida sí presentaron deficiencias de inervación muscular que aumentaron las inervaciones subepiteliales e intraepiteliales. El análisis mediante microarreglos del músculo liso vesical de vejigas con extrofia, comparado con controles ‘sanos’, mostró lo que parece ser un hallazgo de inmadurez del desarrollo en el músculo liso vesical con extrofia.Por lo tanto, se considera que, aunque la vejiga en un paciente con extrofia puede ser inmadura, tiene el potencial de un desarrollo normal tras un cierre inicial exitoso.
Se encontraron dos tipos de pólipos de la placa vesical con hallazgos superpuestos: fibróticos y edematosos. Ambos se asociaron con metaplasia escamosa suprayacente en el 50% de los casos. Se observaron grados variables de nidos de von Brunn, cistitis quística y cistitis glandularis. Se observó cistitis glandularis en un mayor porcentaje de cierres secundarios. Se recomienda la vigilancia futura de aquellos pacientes con cistitis glandularis dado su riesgo potencial de adenocarcinoma. Esto puede realizarse con citología urinaria y cistoscopia a medida que entran en la edad adulta.21
La placa vesical puede invaginarse o protruir a través de un pequeño defecto fascial al nacer, pero la valoración precisa de la placa vesical no puede completarse hasta que el recién nacido esté bajo anestesia y completamente relajado. Una vejiga pequeña, fibrosada, inelástica y/o cubierta de pólipos puede hacer que una reparación funcional sea difícil y potencialmente imposible.
Se obtuvieron cistometrogramas normales en 70–90% de los evaluados en un grupo de pacientes con extrofia vesical continentes y vejigas con reflejo normal.22 Una evaluación de 30 pacientes con extrofia en diversas fases de la reparación moderna por etapas, antes de la reconstrucción del cuello vesical, encontró que el 80% tenía vejigas complacientes y estables después de la reconstrucción del cuello vesical. Aproximadamente la mitad mantuvo una complacencia vesical normal y menos mantuvieron una estabilidad normal. Los autores de ese estudio consideraron que el 25% de los pacientes con extrofia podría mantener una función detrusora normal después de la reconstrucción.23 Se encontró que la microestructura de la vejiga de pacientes con extrofia en distintos momentos de la reparación moderna por etapas presentaba caveolas diferentes (estructuras intracelulares importantes para la señalización de célula a célula). Se consideró que estas caveolas eran normales en quienes lograron un cierre exitoso y mostraban mejoría de la capacidad vesical, pero estaban ausentes en quienes requirieron una cistoplastia de aumento. También observaron que la ultraestructura de las células era anormal en el grupo que fracasó en el cierre inicial.
El resto del tracto urinario suele ser normal, pero sí se presentan anomalías. Pueden encontrarse riñón en herradura, riñón pélvico, riñón hipoplásico, riñón único y displasia con megauréteres. El trayecto del uréter es anómalo en cuanto a su terminación. Debido a que el fondo de saco peritoneal de Douglas, entre la vejiga y el recto, está agrandado y es inusualmente profundo, el uréter se ve forzado a descender lateralmente en su trayecto a través de la pelvis verdadera. El segmento distal se aproxima a la vejiga inferior y lateralmente al orificio. Esto da lugar a reflujo vesicoureteral en el 100% de los casos de extrofia. Las reimplantaciones ureterales se realizan en el momento de la reparación del cuello vesical, pero a veces se necesitan antes. Si existen problemas de infecciones y resistencia excesiva a la salida, puede ser necesaria la reimplantación ureteral antes de la reconstrucción del cuello vesical o en cualquier momento si se desarrollan reflujo grave y alteraciones del tracto superior.
Evaluación y manejo al nacimiento
En la sala de partos, el cordón umbilical debe ligarse con seda 2-0 cerca de la pared abdominal, para que la pinza umbilical no irrite ni traumatice la mucosa vesical expuesta. La mucosa vesical debe irrigarse frecuentemente con solución salina tibia y mantenerse siempre cubierta con una envoltura plástica transparente protectora hasta el momento del cierre. La vejiga debe irrigarse y la envoltura plástica cambiarse en cada cambio de pañal.
Un enfoque multidisciplinario es importante. El equipo debe incluir, entre otros, a un urólogo pediátrico, un cirujano ortopédico pediátrico, un anestesiólogo pediátrico, un neonatólogo, un psiquiatra infantil (con experiencia y pericia en anomalías genitales) y trabajadores sociales. Los estudios han demostrado que los padres de pacientes con extrofia experimentan un nivel significativo de estrés. No debe pasarse por alto el estrés de los padres durante la atención inicial y a largo plazo del paciente.24 Se debe tranquilizar a los padres de que los niños con extrofia vesical clásica son, por lo general, lactantes sanos y robustos, con la perspectiva de llevar una vida muy normal. Puede esperarse una reconstrucción eficaz que permita el almacenamiento, el drenaje y el control urinarios, con una apariencia estética aceptable. El apoyo de psicólogos, personal de enfermería y padres de otros niños con extrofia es inestimable.
Un neonatólogo debe evaluar al paciente desde una perspectiva pediátrica general y cardiopulmonar, considerando la probabilidad de una cirugía mayor en las primeras 48 horas de vida. Suele realizarse un ecocardiograma para descartar anomalías cardiopulmonares significativas que podrían contraindicar una reconstrucción temprana. Debe obtenerse una ecografía renal para evaluar las vías urinarias superiores. Se realiza una KUB para evaluar la anatomía ósea de la pelvis y una ecografía de la columna para descartar un disrafismo espinal asociado.
Es esencial que un cirujano genitourinario pediátrico con experiencia e interés en el complejo extrofia-epispadias evalúe al paciente recién nacido con extrofia, ya que el impacto de una malformación congénita mayor se ve significativamente agravado por un manejo inicial inapropiado.25,26,27
En aquellos pacientes con ambigüedad genital además de extrofia vesical, los padres deberían ser informados y asesorados por un equipo multidisciplinario de trastornos de la diferenciación sexual, pero deben entender que, con los resultados reconstructivos actuales, la necesidad de cambiar el sexo de crianza en la extrofia vesical clásica es casi inexistente en el lactante varón.
Como muchos de estos casos aún pasan desapercibidos hasta el momento del parto, la mayoría requerirá traslado a un centro de extrofia poco después del nacimiento. Durante el traslado, la vejiga debe protegerse con una membrana plástica transparente y mantenerse húmeda para proteger la delicada mucosa vesical.
Reconstrucción quirúrgica
Los objetivos de la reconstrucción quirúrgica en el paciente con extrofia son corregir los defectos urogenitales, proporcionando un reservorio que sea adecuado para el almacenamiento urinario a bajas presiones con la capacidad de vaciarse por completo sin comprometer la función renal, crear genitales externos funcionales y estéticamente aceptables, y maximizar la calidad de vida del paciente.
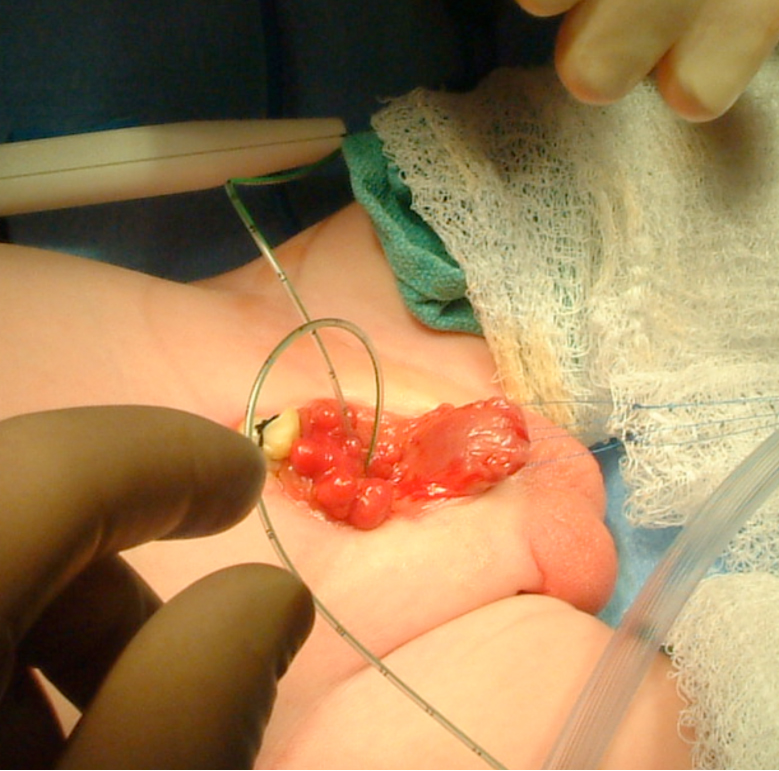
Figura 7 Intubación de los meatos ureterales bilaterales en preparación para la disección.
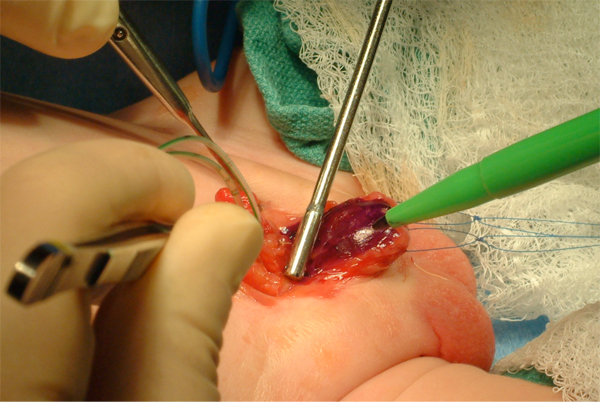
Figura 8 Marcaje de la placa uretral. Obsérvense dos suturas de tracción en cada hemiglande.
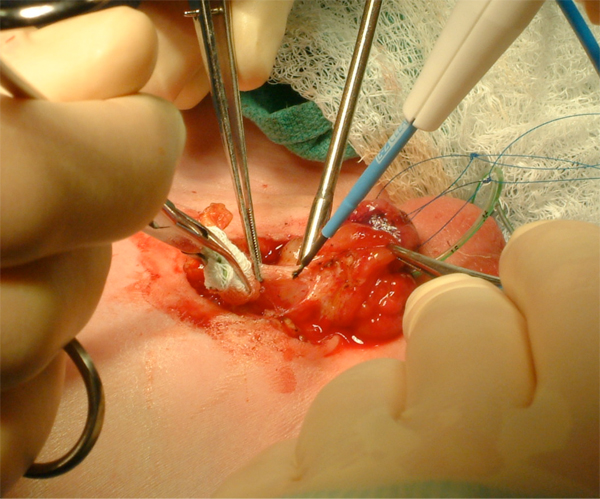
Figura 9 Movilización agresiva de la vejiga, incluyendo el ombligo.
Los primeros intentos de reconstrucción de la extrofia vesical no tuvieron éxito y los pacientes tenían esperanzas de vida cortas. Por lo tanto, durante muchos años el manejo de la extrofia consistió en la extirpación de la vejiga extrofiada y una derivación urinaria, comúnmente mediante ureterosigmoidostomía. Diversas reparaciones en etapas comenzaron a mostrar éxitos iniciales en la década de 1950.En la década de 1970 se iniciaron los esquemas preliminares de la reparación en etapas que se utilizan hoy en día. Esto evolucionó hacia la reparación moderna en etapas de la extrofia que se utiliza comúnmente en la actualidad.28 A finales de la década de 1980 se inició un abordaje anatómico de la reparación de la extrofia, que se ha modificado hasta lo que ahora se denomina reparación primaria completa de la extrofia o técnica de Mitchell.29 Actualmente, la mayoría de los pacientes se manejan ya sea con una reparación primaria completa de la extrofia (CPRE) o con una reconstrucción moderna en etapas de la extrofia (MSRE).28 Continúa habiendo un amplio debate sobre el tratamiento óptimo de la extrofia en el período neonatal. Con esto en mente, la ureterosigmoidostomía sigue siendo una reconstrucción popular y preferida en muchas partes del mundo porque logra de forma fiable la continencia urinaria y es relativamente segura para quienes no tienen acceso a establecimientos de atención sanitaria confiables o a un centro especializado en extrofia.
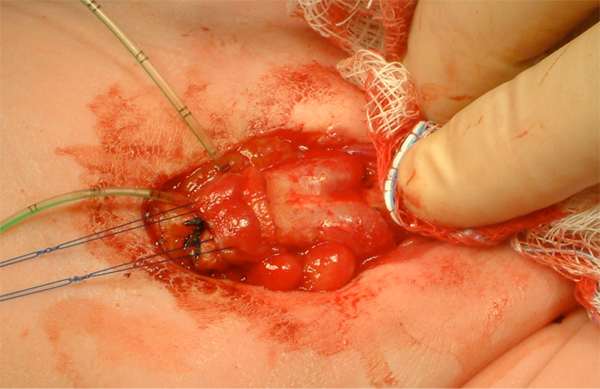
Figura 10 Identificación de los cuerpos cavernosos bilaterales tras el despegamiento cutáneo del falo.
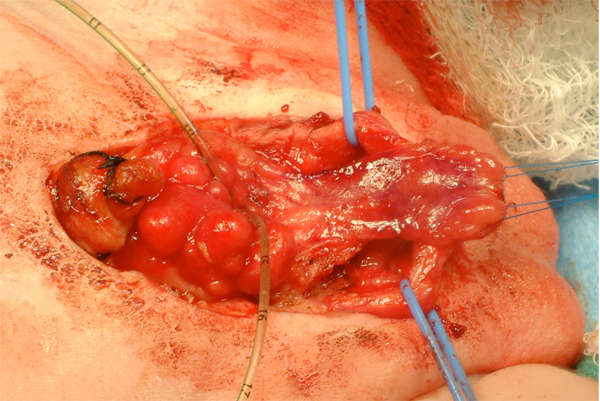
Figura 11 Después de la separación de los cuerpos cavernosos y la movilización de la placa uretral.
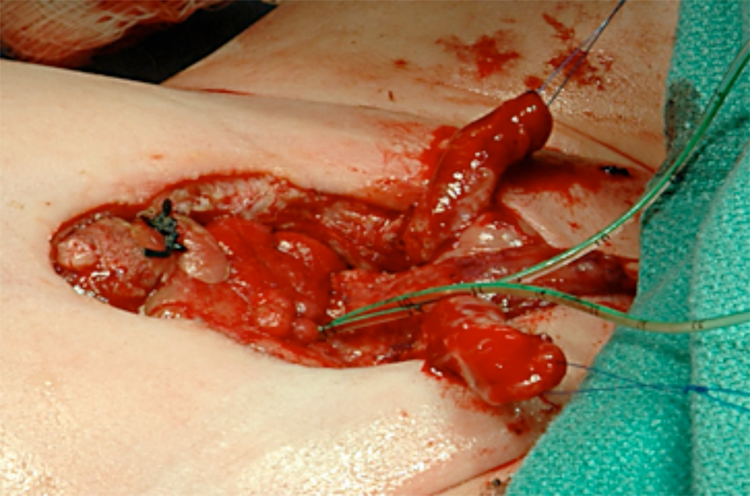
Figura 12 Después de la separación completa de los cuerpos cavernosos y el glande.
Reparación primaria completa de la extrofia
La CPRE es el desarrollo más reciente en el manejo quirúrgico de los pacientes con extrofia, iniciado por el Dr. Mitchell en 1989.30 Este enfoque ha sido adoptado y reproducido por múltiples centros de excelencia en el manejo de la extrofia. En el CPRE, un enfoque anatómico de la reconstrucción incluye el cierre vesical con remodelación del cuello vesical y una técnica de desensamblaje para la reparación del epispadias con o sin osteotomías en un solo tiempo quirúrgico. Se considera que esto permite el ciclaje vesical y un crecimiento y desarrollo más ‘normales’ porque la vejiga experimenta una resistencia a la salida. La técnica de desensamblaje para la reparación del epispadias también permite la división de los ligamentos intersinfisarios y la colocación anatómica adecuada del cuello vesical y la uretra posterior profundamente en la pelvis en su posición ortotópica. Cuando se realiza dentro de las primeras 72 horas de vida, la pelvis es lo suficientemente maleable como para cerrarse sin osteotomías. Los pacientes aún requieren tracción de Bryant durante aproximadamente 1 semana y luego enyesado de las extremidades inferiores durante 3 semanas para prevenir tensión sobre el cierre pélvico. La incidencia de dehiscencia y prolapso vesical es rara en la era moderna.
La CPRE se promueve como un abordaje para permitir el máximo desarrollo de la vejiga y para identificar a aquellos pacientes cuyas vejigas crecerán y se desarrollarán más precozmente que en quienes se manejan por etapas. Normalizar la anatomía en el cierre inicial justo después del nacimiento puede tener otros beneficios, como minimizar el trauma psicosocial de la familia. Los pacientes cuya vejiga sí se desarrolla probablemente se someterán a menos procedimientos que con un manejo por etapas.
Se ha informado una continencia del 76% después de la CPRE, definida como intervalos secos mayores de 2 horas y micción espontánea sin cateterismos. Sin embargo, es probable que un porcentaje significativo de los pacientes aún requiera un procedimiento formal del cuello vesical para lograr la continencia. En otra serie, el 75% de los pacientes después de la CPRE fueron continentes con intervalos de 4 horas y secos por la noche, con un 31.3% que requirió CIC.
Las preocupaciones respecto a la CPRE se relacionan con la posibilidad de deterioro renal asociado a un tracto urinario inferior de alta presión, el riesgo de lesión o pérdida peneana con el desensamblaje peneano a una edad tan temprana, y la necesidad de múltiples procedimientos a pesar del nombre ‘reparación completa.’ El seguimiento estrecho de las vías urinarias superiores es importante en la extrofia independientemente de la reparación. Se observan hidronefrosis, pielonefritis y cicatrización renal tras la CPRE y deben tratarse de forma agresiva con antibióticos profilácticos, ya que se espera reflujo vesicoureteral en el postoperatorio. El seguimiento a largo plazo en la serie de Seattle muestra que se observa hidronefrosis leve (45%), moderada (17.8%) y grave (7.1%) tras la CPRE. Pero en la mitad de aquellos con hidronefrosis, y en todos los casos con hidronefrosis grave, fue transitoria. Borer y colaboradores informaron una incidencia de pielonefritis del 28% y de cicatrización renal en DMSA del 19% tras la CPRE.31 La necesidad de reimplante ureteral bilateral después de la CPRE, excluyendo los realizados en el momento de la reparación del cuello vesical, es de 25–34%.31,32,33
Aproximadamente el 36–68% de los pacientes quedarán con un hipospadias tras la CPRE que requerirá cirugía peneana adicional.30,34,31,32,33 Se han reportado necrosis del glande, pérdida de piel peneana y/o pérdida de tejido peneano después de la CPRE, pero son muy poco frecuentes cuando se realiza en centros de excelencia en extrofia.
Una revisión sistemática reciente examinó los resultados de diez grupos que utilizaron la técnica CPRE con 236 pacientes. La reparación de hipospadias fue necesaria en la mayoría de los niños sometidos a desmontaje peneano completo (22.7–68 %). El reimplante ureteral fue necesario como un procedimiento separado en 48–66%. La mayoría de los niños eventualmente también requirieron reconstrucción del cuello vesical para la continencia. En general, se observó micción sin BNR en 16–37 % de los niños en las series reportadas.
Comparar el número de procedimientos a los que se espera que un paciente se someta es un tema controvertido cuando se comparan la CPRE y la MSRE. Los informes varían ampliamente en cuanto al número y los tipos de procedimientos, y están plagados de posibles sesgos, lo que dificulta extraer conclusiones sólidas sobre este tema. Sin embargo, se acepta que los pacientes manejados con un enfoque CPRE o MSRE probablemente requerirán múltiples procedimientos y que los resultados son mejores si son tratados en un centro de excelencia para extrofia.
En 2013, se estableció el Consorcio Multiinstitucional de Extrofia Vesical (MIBEC) para perfeccionar la CPRE, disminuir las complicaciones y mejorar los resultados. Desde entonces, MIBEC ha logrado agrupar sus resultados (tanto antes como después del consorcio) con el fin de estudiar mejor este trastorno relativamente raro y evaluar críticamente su técnica. A través del consorcio, los urólogos pediátricos trabajan de manera colaborativa como “entrenadores quirúrgicos” en la institución anfitriona para aunar la pericia de múltiples expertos.
Otros grupos han adoptado este enfoque colaborativo para el tratamiento quirúrgico de la extrofia vesical. Por ejemplo, la Pediatric Urology Midwest Alliance (PUMA) agrupó sus resultados para evaluar los resultados del aumento vesical/derivación urinaria y la necesidad de cateterismo intermitente limpio.
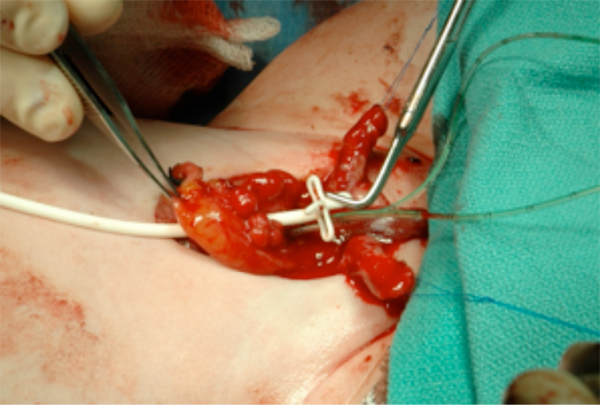
Figura 13 Colocación de un catéter suprapúbico antes del cierre vesical. Este saldrá del abdomen por el ombligo.
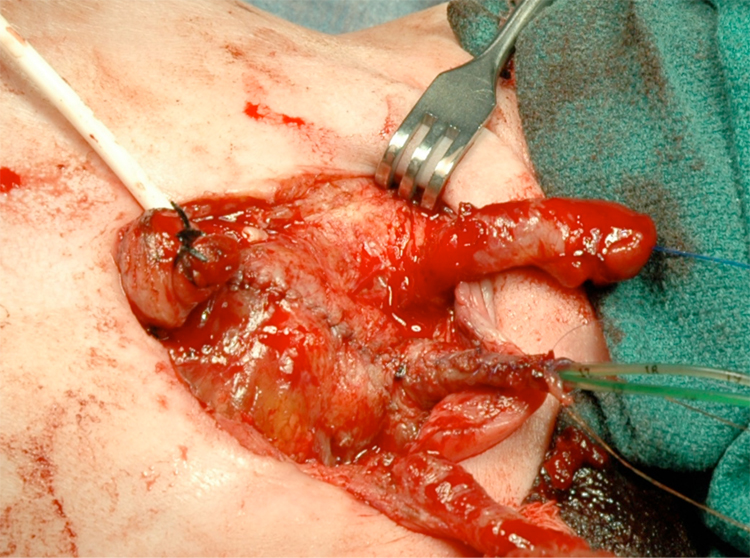
Figura 14 Vejiga y uretra cerradas en 2 planos como una sola unidad. Obsérvese los catéteres ureterales bilaterales que salen a través del meato uretral.
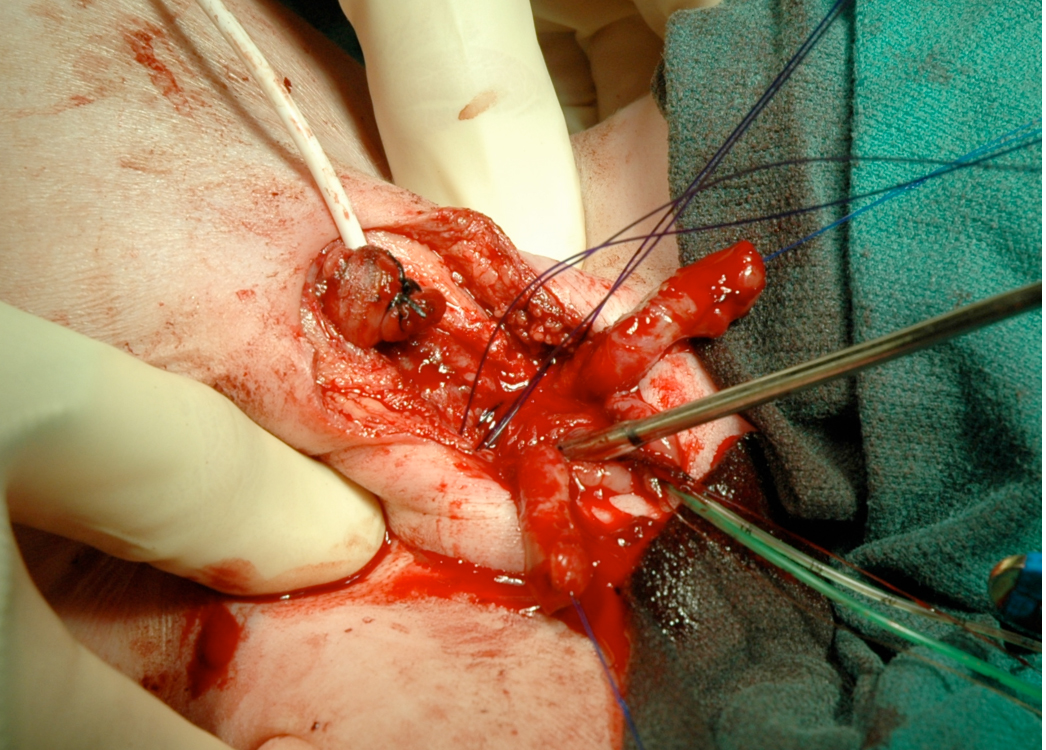
Figura 15 La rotación interna de la pelvis para reaproximar el pubis puede lograrse cuando la reconstrucción se realiza en las primeras 72 horas de vida.
Reconstrucción moderna por etapas de la extrofia
La MSRE tal como se practica actualmente ha evolucionado a partir del trabajo original de Cendron y Jeffs.25,26 El grupo de Hopkins, dirigido por el Dr. Gearhart, actualmente cuenta con la mayor población con extrofia y publica la mayor parte de la literatura respecto a la MSRE. En la MSRE, el objetivo en la reconstrucción inicial es convertir la vejiga extrofiada en un epispadias completo. Se realizan osteotomías pélvicas junto con el cierre vesical cuando está indicado. Se considera que esto permitirá protección frente a la disfunción renal porque el paciente sigue incontinente, pero también puede estimular el crecimiento vesical ya que ahora existe cierta resistencia en la salida vesical. La reparación del epispadias se realiza entre los 6 y 12 meses de edad y se administra estimulación con testosterona de forma preoperatoria. La reparación del cuello vesical para la continencia se realiza entre los 4 y 5 años de edad si el paciente tiene una capacidad vesical adecuada y se determina que está preparado para participar en un programa de micción posoperatorio.35 Si no se cumplen estos criterios, se mantiene al paciente incontinente hasta que la vejiga crezca y mejore la madurez o se les deriva mediante una ampliación con un conducto cateterizable y cierre del cuello vesical cuando sea necesario.
Las tasas de continencia después de la MSRE, según Gearhart, son del 70% en varones y del 74% en mujeres, con períodos secos superiores a 3 horas con micción espontánea y continencia nocturna sin CIC.35 Concluyeron que una capacidad vesical de 100 ml predice el éxito en el momento de la reconstrucción del cuello vesical utilizando la reparación modificada de Young-Dees-Leadbetter. Esto aumentó la probabilidad de continencia y el tiempo para lograr la continencia en sus revisiones.35,36 Si no se alcanza esta capacidad de 100 ml, se considera que deben someterse a una ampliación en el momento de la reconstrucción para la continencia. También encontraron que las mujeres tenían más probabilidades de lograr continencia y en un menor tiempo después de la reconstrucción del cuello vesical.36 Sus informes también muestran tasas de complicaciones igualmente bajas. En varones, después del cierre vesical, la reparación del epispadias y la reconstrucción del cuello vesical, la tasa total de complicaciones fue del 41,7% con una incidencia de fracaso del cierre primario.35 En mujeres, después del cierre vesical y la reconstrucción del cuello vesical, la tasa total de complicaciones fue del 19,5%.36 En sus series modernas, si ocurre un crecimiento vesical exitoso, el 19,4% de los varones y el 17% de las mujeres fracasaron en la reconstrucción del cuello vesical y han sido sometidos o requerirán una ampliación con un estoma cateterizable y cierre del cuello vesical, según esté indicado.35,36
En la MSRE, si la capacidad vesical de un paciente no se desarrolla hasta el nivel que predice éxito con la reconstrucción del cuello vesical, el paciente pasa directamente a un aumento vesical para la continencia. Esto es razonable pero dificulta las comparaciones entre MSRE y CPRE. La MSRE informa sobre aquellos que completan la serie. Debido a que la CPRE realiza un procedimiento de continencia en el cierre inicial, están incluyendo a aquellos pacientes cuyas vejigas pueden no haberse desarrollado y que nunca habrían sido candidatos a una reconstrucción del cuello vesical si se los hubiera manejado con MSRE. Además, es difícil determinar cuántas, si es que alguna, de aquellas vejigas que no alcanzaron una capacidad de 100 ml a la edad de continencia habrían crecido si hubieran tenido una CPRE en el cierre inicial con una mayor resistencia del tracto de salida disponible para promover el desarrollo. También puede haber un cierto subconjunto de vejigas con extrofia que son ‘malas’ y no crecerán independientemente de la técnica de cierre, pero que no pueden identificarse al nacer. Estos factores dificultan definir el éxito y el fracaso al comparar técnicas. Es necesario continuar con análisis prospectivos a largo plazo de manera imparcial y con mente abierta para promover el intercambio de ideas que, con suerte, conduzcan a los próximos avances en el manejo de la extrofia y que sigan mejorando la calidad de vida de estos pacientes.
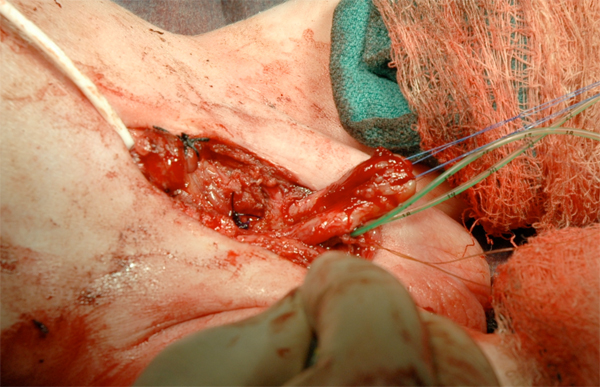
Figura 16 Reconstrucción del falo.
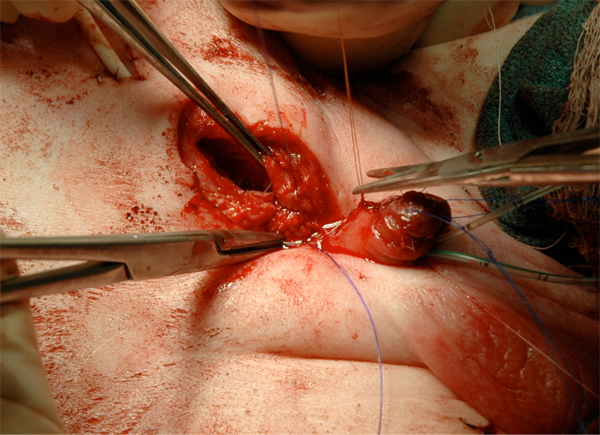
Figura 17 Cierre fascial.
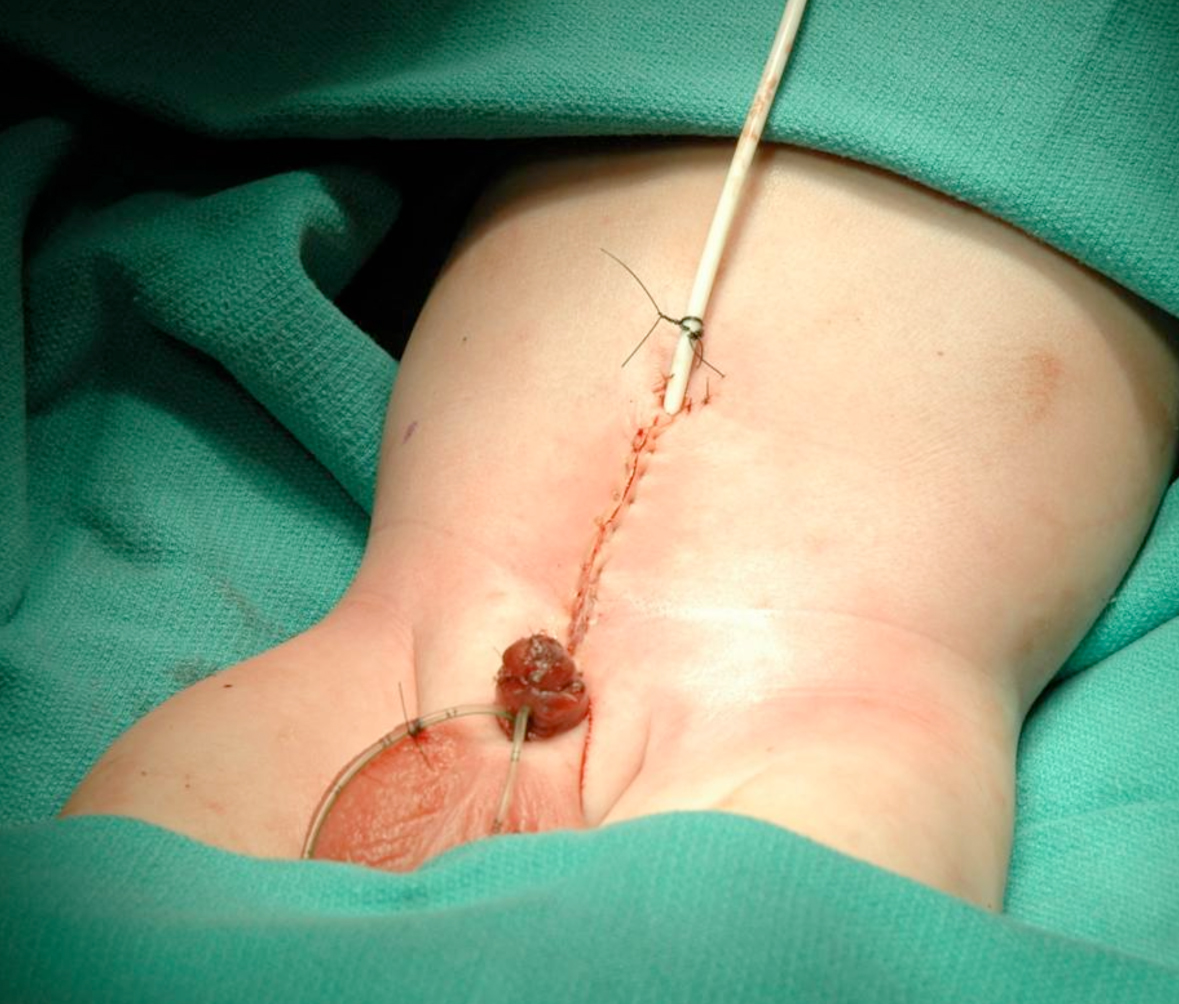
Figura 18 Cierre de la pared abdominal.
Resumen de los principios consensuados de la reconstrucción quirúrgica
- El manejo debe realizarse en un centro de excelencia en extrofia y con un equipo multidisciplinario con la experiencia e interés necesarios para atender a estos pacientes a largo plazo.
- La placa vesical debe mantenerse húmeda y cubierta con saran wrap después del nacimiento hasta el cierre
- El cierre primario temprano exitoso es fundamental para lograr la continencia posteriormente
- Las osteotomías son necesarias si la pelvis se cierra a las > 72 horas de vida
- Es importante un seguimiento estrecho de las vías urinarias superiores después del cierre vesical
- Se requieren múltiples procedimientos para lograr la continencia y la reconstrucción de la anatomía
- Puede requerirse aumento vesical, con o sin estoma cateterizable, y cierre del cuello vesical en quienes no logran alcanzar la continencia o una vejiga con capacidad > 100 mL antes de la reconstrucción del cuello vesical.
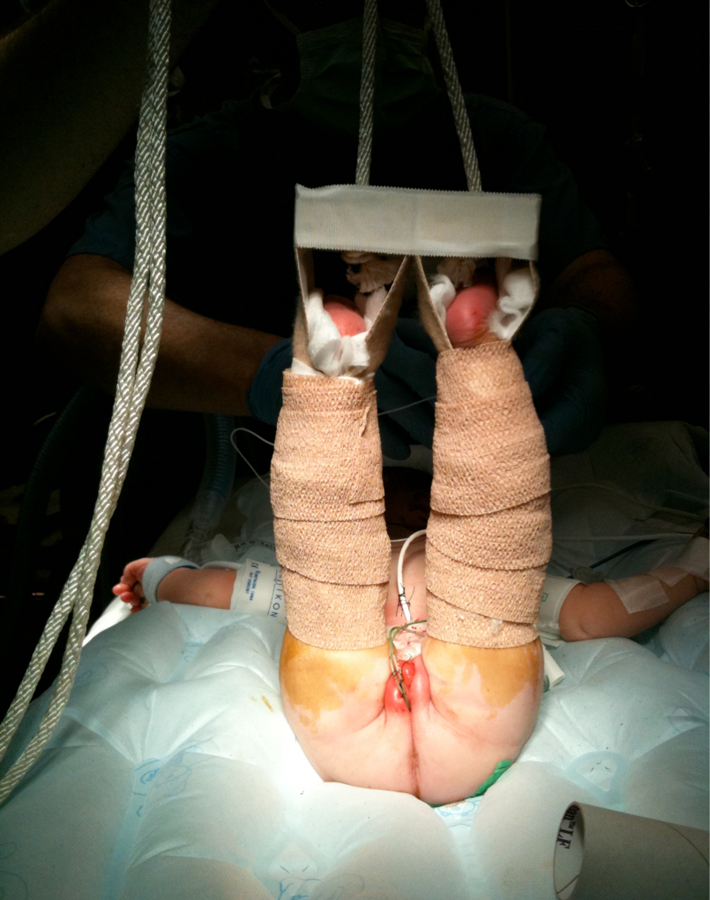
Figura 19 Tracción de Bryant modificada.
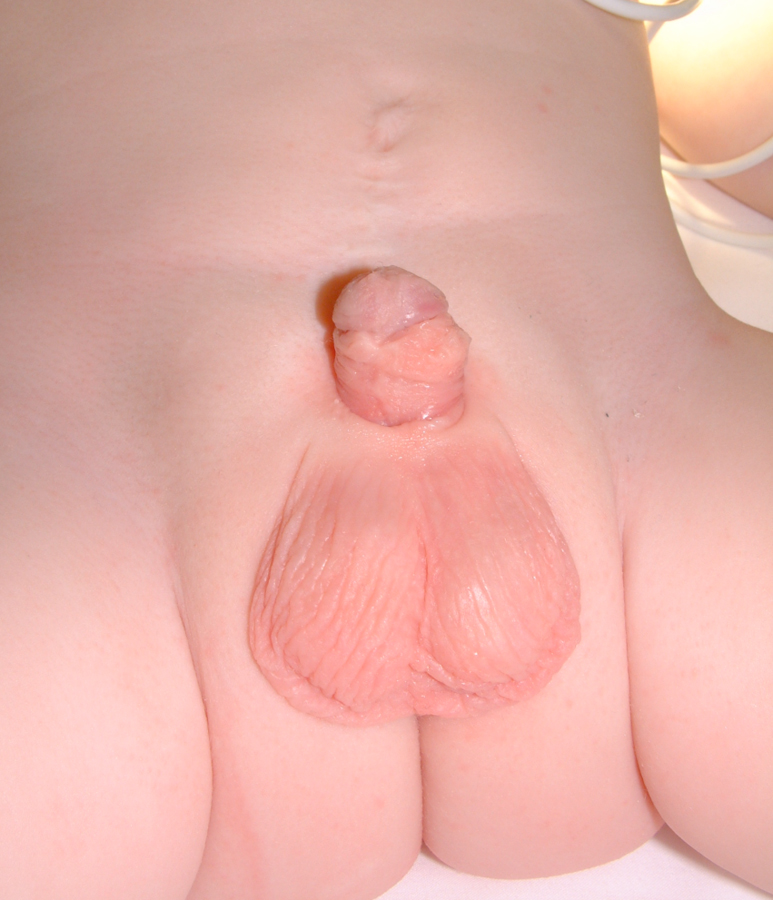
Figura 20 Postoperatorio.
Función sexual en el paciente con extrofia
Se han informado casos de pacientes varones adultos con extrofia vesical que han engendrado o iniciado un embarazo. Esto demuestra que la fertilidad es posible en estos pacientes, aunque puede no ser habitual. La gran serie de Shapiro de 2,500 pacientes solo documentó 38 varones que habían engendrado hijos.3 Estudios de análisis seminal que compararon a hombres sometidos a reparación primaria con derivación ureterosigmoidea encontraron un recuento espermático normal en solo uno de ocho en el grupo de cierre y en cuatro de ocho en el grupo derivado. Estas diferencias se atribuyeron a la eyaculación retrógrada y a la lesión iatrogénica durante el cierre funcional de la vejiga. Otro estudio encontró que ninguno de sus pacientes reconstruidos podía eyacular con normalidad, ni había engendrado hijos. Cinco pacientes que no se habían sometido a reconstrucción presentaban eyaculación normal y dos habían engendrado hijos.Esto lleva a la conclusión de que el paciente varón presenta un alto riesgo de infertilidad tras la reconstrucción. Bastuba y sus colaboradores demostraron que el uso de la reproducción asistida en cualquier modalidad fue exitoso en 13 varones con extrofia vesical, lo que condujo a embarazo exitoso sin incidencia de extrofia en la descendencia.37
Woodhouse informó que la función sexual y la libido del paciente con extrofia son normales.38 Múltiples informes muestran que la función eréctil se mantiene en una gran mayoría después de la reconstrucción uretral y fálica, y que la eyaculación a menudo no es normal pero generalmente está presente. La mayoría reportó orgasmos satisfactorios y describió las relaciones íntimas como serias y de larga duración.39 Sin embargo, un estudio reciente que utilizó una encuesta anónima en redes sociales dirigida a los hombres de la Association for the Bladder Exstrophy Communities informa que el Penile Perception Score y el International Index of Erectile Function son inferiores a los controles publicados. De manera interesante, una mayor puntuación en el Penile Perception Score se correlacionó con una puntuación IIEF-15 (satisfacción sexual) más alta. Estudios recientes de Rubenwolf et al demuestran que la satisfacción sexual tanto de hombres como de mujeres adultos tras una derivación urinaria continente parece ser comparable a la de aquellos en quienes se preserva la vejiga, con la mayoría en relaciones estables.40
Los genitales externos femeninos ahora se reconstruyen completamente de forma rutinaria en el momento del cierre de la extrofia. Anteriormente, esta reconstrucción consistía en una reaproximación cosmética del clítoris bífido y de los labios anteriores para crear una horquilla vulvar, pero no abordaba la anomalía anatómica inherente de la ubicación y el ángulo de la vagina en relación con el abdomen y el perineo en mujeres con extrofia. No era infrecuente realizar reconstrucciones adicionales durante la adolescencia, antes del inicio de la actividad sexual o del uso de tampones en algunas pacientes con extrofia. Se aplicó la movilización total del complejo urogenital y ello resultó en la corrección exitosa de la ubicación y el ángulo de la vagina en pacientes femeninas con extrofia.18 En un estudio se informó coito exitoso en todas las pacientes y se reportó dispareunia en una minoría.19 Una serie amplia también informó que las pacientes con extrofia mayores de 18 años tenían deseos sexuales normales y muchas eran sexualmente activas con orgasmos normales. Algunas pacientes se sentían cohibidas y limitaban su actividad sexual debido al aspecto cosmético de sus genitales externos. Una monoplastia es una parte importante de la reconstrucción en mujeres y el uso de piel con vello y grasa para cubrir el defecto de la línea media es rutinario. También se describió una reparación diferida con el uso de colgajos romboidales con buenos resultados.41
Implicaciones obstétricas y ginecológicas
Muchas mujeres con extrofia vesical han dado a luz con éxito descendencia normal (45 mujeres con 49 hijos en un informe). Otro estudio mostró 40 mujeres, de 19 a 36 años, que fueron tratadas por extrofia vesical cuando eran lactantes, y de esas 40 mujeres se reportaron 14 embarazos en 11 mujeres. De esos 14 embarazos hubo 9 partos normales, 3 abortos espontáneos y 2 abortos electivos. El prolapso uterino ocurrió en 7 de las 11 pacientes durante el embarazo. Se observa que es muy común que estas mujeres presenten prolapso cervical y uterino después del embarazo y el parto.42 En estos informes iniciales, al parecer todas las mujeres se habían sometido previamente a derivaciones urinarias permanentes, pero informes recientes muestran que se han reportado embarazos exitosos en mujeres que se han sometido a derivaciones urinarias continentes. Se realizaron cesáreas en mujeres con cierres vesicales funcionales para eliminar el estrés sobre el suelo pélvico y evitar lesiones traumáticas del mecanismo del esfínter urinario.42
Como se mencionó anteriormente, el prolapso de órganos pélvicos parece ser un problema significativo en pacientes femeninas con extrofia. Se observa comúnmente durante y después del embarazo o el parto, posiblemente en hasta la mitad de las pacientes.19 Puede ocurrir a edades tempranas y sin actividad sexual previa ni embarazo.19,43 El desplazamiento anterior del introito vaginal y el marcado desplazamiento posterior del cabestrillo dorsorrectal, así como la deficiencia de su compartimento anterior, se postularon como causas de hallazgos significativos de prolapso.44 Se considera que una reconstrucción más moderna del suelo pélvico y la recolocación anatómica de la vejiga en la pelvis y el uso de osteotomías pueden mejorar este problema preocupante. Informes previos mostraron que la suspensión uterina tuvo solo un éxito modesto en la prevención del prolapso recurrente.44 Sin embargo, Stein informó que la fijación uterina mediante sacrocolpopexia corrigió el prolapso en 13 mujeres con más de 25 años de seguimiento.
Referencias
- Hsieh K, O’Loughlin MT, Ferrer FA. Bladder exstrophy and phenotypic gender determination on fetal magnetic resonance imaging. Urology 2005; 65 (5): 998–999. DOI: 10.1016/j.urology.2004.12.060.
- Stec AA, Pannu HK, Tadros YE, Sponseller PD, Fishman EK, Gearhart JP. Pelvic Floor Anatomy In Classic Bladder Exstrophy Using 3-dimensional Computerized Tomography: J Urol 2001; 166 (1444): 1444–1449. DOI: 10.1097/00005392-200110000-00066.
- Silver RI, Partin AW, Epstein JI, Chan DW, Carter HB, Jeffs RD, et al.. Prostate-specific antigen in men born with bladder exstrophy. Urology 1997; 49 (2): 253–256. DOI: 10.1016/s0090-4295(96)00438-4.
- Purves JT, Gearhart JP. The Bladder Exstrophy–epispadias–cloacal Exstrophy Complex. J Pediatr Urol 1999; 22 (8): 386–415. DOI: 10.1016/b978-1-4160-3204-5.00030-x.
- Schober JM, Carmichael PA, Hines M, Ransley PG. The Ultimate Challenge Of Cloacal Exstrophy. J Urol 2002; 167 (300): 300–304. DOI: 10.1097/00005392-200201000-00088.
- Lee RS, Grady R, Joyner B, Casale P, Mitchell M. Can a Complete Primary Repair Approach be Applied to Cloacal Exstrophy? J Urol 2006; 176 (6): 2643–2648. DOI: 10.1016/j.juro.2006.08.052.
- Ben-Chaim J, Peppas DS, Sponseller PD, Jeffs RD, Gearhart JP. Applications of Osteotomy in the Cloacal Exstrophy Patient. J Urol 1995; 5 (1): 865–867. DOI: 10.1097/00005392-199508000-00146.
- Silver RI, Sponseller PD, Gearhart JP. Staged Closure Of The Pelvis In Cloacal Exstrophy: First Description Of A New Approach. J Urol 1999; 161 (1): 263–266. DOI: 10.1016/s0022-5347(01)62128-1.
- Adams MC, Mitchell ME, Rink RC. Gastrocystoplasty: An Alternative Solution to the Problem of Urological Reconstruction in the Severely Compromised Patient. J Urol 1988; 140 (5 Part 2): 1152–1156. DOI: 10.1016/s0022-5347(17)41986-0.
- Hendren WH. Ileal Nipple for Continence in Cloacal Exstrophy. J Urol 1992; 148 (2 Part 1): 372–379. DOI: 10.1016/s0022-5347(17)36601-6.
- Tank ES, Lindenauer SM. Principles of management of exstrophy of the cloaca. Am J Surg 1970; 119 (1): 95–98. DOI: 10.1016/0002-9610(70)90018-8.
- Gearhart JP, Jeffs RD. Techniques to Create Urinary Continence in the Cloacal Exstrophy Patient. J Urol 1991; 146 (2 Part 2): 616–618. DOI: 10.1016/s0022-5347(17)37871-0.
- Ricketts RR, Woodard JR, Zwiren GT, Andrews HG, Broecker BH. Modern treatment of cloacal exstrophy. J Pediatr Surg 1991; 26 (4): 444–450. DOI: 10.1016/0022-3468(91)90993-4.
- Austin PF, Homsy YL, Gearhart JP, Porter K, Guidi C, Madsen K, et al.. The Prenatal Diagnosis Of Cloacal Exstrophy. J Urol 1998; 160 (1179): 1179–1181. DOI: 10.1097/00005392-199809020-00061.
- Hamada H, Takano K, Shiina H, Sakai T, Sohda S, Kubo T. New Ultrasonographic Criterion For The Prenatal Diagnosis Of Cloacal Exstrophy: Elephant Trunk-like Image. J Urol 1999; 162 (6): 2123–2124. DOI: 10.1016/s0022-5347(05)68138-4.
- Husmann DA, McLorie GA, Churchill BM. Phallic Reconstruction in Cloacae Exstrophy. J Urol 1989; 142 (2 Part 2): 563–564. DOI: 10.1016/s0022-5347(17)38816-x.
- Mathews, Perlman, Marsh, Gearhart. Gonadal morphology in cloacal exstrophy: implications in gender assignment. BJU Int 1999; 84 (1): 99–100. DOI: 10.1046/j.1464-410x.1999.00148.x.
- Reiner WG. Psychosexual development in genetic males assigned female: the cloacal exstrophy experience. Child Adolesc Psychiatr Clin N Am 2004; 13 (3): 657–674. DOI: 10.1016/j.chc.2004.02.009.
- Baker Towell DM, Towell AD. A Preliminary Investigation Into Quality of Life, Psychological Distress and Social Competence in Children With Cloacal Exstrophy. J Urol 2003; 169 (5): 1850–1853. DOI: 10.1097/01.ju.0000062480.01456.34.
- Taghizadeh A, Qteishat A, Cuckow PM. Restoring Hindgut Continuity in Cloacal Exstrophy: A Valuable Method of Optimising Bowel Length. Eur J Pediatr Surg 2009; 19 (03): 141–144. DOI: 10.1055/s-0029-1192048.
- Husmann DA, McLorie GA, Churchill BM. Closure of the Exstrophic Bladder: An Evaluation of the Factors Leading to its Success and its Importance on Urinary Continence. J Urol 1989; 142 (2 Part 2): 522–524. DOI: 10.1016/s0022-5347(17)38803-1.
- Levitt MA, Mak GZ, Falcone RA, Peña A. Cloacal exstrophy–pull-through or permanent stoma? J Pediatr Surg 2008; 43 (1): 164–170. DOI: 10.1016/j.jpedsurg.2007.09.039.
- Hurwitz RS, Manzoni GAM, Ransley PG, Stephens FD. Cloacal Exstrophy: A Report of 34 Cases. J Urol 1987; 138 (4 Part 2): 1060–1064. DOI: 10.1016/s0022-5347(17)43502-6.
- Thauvin-Robinet C, Faivre L, Cusin V, Khau Van Kien P, Callier P, Parker KL, et al.. Cloacal exstrophy in an infant with 9q34.1-qter deletion resulting from a de novo unbalanced translocation between chromosome 9q and Yq. Am J Med Genet 2004; 126a (3): 303–307. DOI: 10.1002/ajmg.a.20596.
- Rickham PP. Vesicointestinal Fissure. Anorectal Malformations in Children 1960; 35 (97): 239–249. DOI: 10.1007/978-3-540-31751-7_14.
- Mathews R, Jeffs RD, Reiner WG, Docimo SG, Gearhart JP. Cloacal Exstrophy-improving The Quality Of Life. J Urol 1998; 160 (2452): 2452–2456. DOI: 10.1097/00005392-199812020-00017.
- M K. OEIS Complex (Omphalocele, Exstrophy of Bladder, Imperforate Anus and Spine Defects). Journal of Human Anatomy 2001; 2 (1). DOI: 10.23880/jhua-16000122.
- Appignani BA, Jaramillo D, Barnes PD, Poussaint TY. Dysraphic myelodysplasias associated with urogenital and anorectal anomalies: prevalence and types seen with MR imaging. AJR Am J Roentgenol 1994; 163 (5): 1199–1203. DOI: 10.2214/ajr.163.5.7976901.
- McLaughlin KP, Rink RC, Kalsbeck JE, Keating MA, Adams MC, King SJ, et al.. Cloacal Exstrophy: The Neurological Implications. J Urol 1995; 154 (2): 782–784. DOI: 10.1016/s0022-5347(01)67162-3.
- Karrer FM, Flannery AM, Nelson MD, McLone DG, Raffensperger JG. Anorectal malformations: Evaluation of associated spinal dysraphic syndromes. J Pediatr Surg 1988; 23 (1): 45–48. DOI: 10.1016/s0022-3468(88)80538-4.
- Dick EA, Bruyn R de, Patel K, Owens CM. Spinal Ultrasound in Cloacal Exstrophy. Clin Radiol 2001; 56 (4): 289–294. DOI: 10.1053/crad.2000.0648.
- Husmann DA, Vandersteen DR, Mclorie GA, Churchill BM. Urinary Continence After Staged Bladder Reconstruction For Cloacal Exstrophy: The Effect Of Coexisting Neurological Abnormalities On Urinary Continence. J Urol 1999; 161 (5): 1598–1602. DOI: 10.1016/s0022-5347(05)68990-2.
- Schlegel PN, Gearhart JP. Neuroanatomy of the Pelvis in an Infant with Cloacal Exstrophy: A Detailed Microdissection with Histology. J Urol 1989; 141 (3 Part 1): 583–585. DOI: 10.1016/s0022-5347(17)40901-3.
- Cohen AR. The Mermaid Malformation: Cloacal Exstrophy and Occult Spinal Dysraphism. Neurosurgery 1991; 28 (6): 834–843. DOI: 10.1227/00006123-199106000-00008.
- Sponseller PD, Bisson LJ, Gearhart JP, Jeffs RD, Magid D, Fishman E. The anatomy of the pelvis in the exstrophy complex. J Bone Joint Surg Am 1995; 77 (2): 177–189. DOI: 10.2106/00004623-199502000-00003.
- Stec AAJ, Wakim A, Barbet P, McCarthy EF, Lakshmanan Y, Sponseller PD, et al.. Fetal bony pelvis in the bladder exstrophy complex: normal potential for growth? Urology 2003; 62 (2): 337–341. DOI: 10.1016/s0090-4295(03)00474-6.
- Williams AM, Solaiyappan M, Pannu HK, Bluemke D, Shechter G, Gearhart JP. 3-dimensional Magnetic Resonance Imaging Modeling Of The Pelvic Floor Musculature In Classic Bladder Exstrophy Before Pelvic Osteotomy. J Urol 2004; 172 (4 Part 2): 1702–1705. DOI: 10.1097/01.ju.0000140212.56826.4c.
- Sugar EC, Firlit CF. Management of cloacal exstrophy. Urology 1990; 32 (4): 320–322. DOI: 10.1016/0090-4295(88)90234-8.
- Greene WB, Dias LS, Lindseth RE, Torch MA. Musculoskeletal problems in association with cloacal exstrophy. J Bone Joint Surg Am 1991; 73 (4): 551–560. DOI: 10.2106/00004623-199173040-00012.
- Baird AD, Nelson CP, Gearhart JP. Modern staged repair of bladder exstrophy. J Pediatr Urol 2007; 3 (311). DOI: 10.18591/bjuik.0243.
- Purves JT, Baird AD, Gearhart JP. The modern staged repair of bladder exstrophy in the female: A contemporary series. J Pediatr Urol 2008; 4 (2): 150–153. DOI: 10.1016/j.jpurol.2007.08.003.
- Hanna MK, Williams DI. Genital Function In Males With Vesical Exstrophy And Epispadias. Br J Urol 1969; 44 (2): 169–174. DOI: 10.1111/j.1464-410x.1972.tb10062.x.
- Stein R, Stöckle M, Fisch M, Nakai H, Müller SC, Hohenfellner R. The Fate Of The Adult Exstrophy Patient. J Urol 1994; 152 (5 Part 1): 1413–1416. DOI: 10.1016/s0022-5347(17)32433-3.
- Bastuba MD, Alper MM, Oates RD. Fertility and the use of assisted reproductive techniques in the adult male exstrophy/epispadias patient. Fertil Steril 1993; 60 (4): 733–736. DOI: 10.1016/s0015-0282(16)56234-7.
- Woodhouse CRJ. Sexual function in boys born with exstrophy, myelomeningocele, and micropenis. Urology 1998; 52 (1): 3–11. DOI: 10.1016/s0090-4295(98)00121-6.
- Ben-Chaim J, Jeffs RD, Reiner WG, Gearhart JP. The Outcome of Patients with Classic Bladder Exstrophy in Adult Life. The Exstrophy–Epispadias Complex 1996; 155 (1251): 169–173. DOI: 10.1007/978-1-4757-3056-2_26.
- Kropp BP, Cheng EY. Total Urogenital Complex Mobilization In Female Patients With Exstrophy. J Urol 2000; 164 (1035): 1035–1039. DOI: 10.1097/00005392-200009020-00028.
- Woodhouse CRJ. The gynaecology of exstrophy. BJU Int 1999; 83 (S3): 34–38. DOI: 10.1046/j.1464-410x.1999.0830s3034.x.
- Mathews RI, Gan M, Gearhart JP. Urogynaecological and obstetric issues in women with the exstrophy-epispadias complex. BJU Int 2003; 91 (9): 845–849. DOI: 10.1046/j.1464-410x.2003.04244.x.
- Canalichio KL, Ahn J, Artigas P, Amies Oelschlager A-ME, Rowe C, Merguerian P, et al.. Patient-reported outcomes in adult females with bladder exstrophy: A study of long-term sexual, reproductive and urinary outcomes using social media. J Pediatr Urol 2020; 16 (5): 567.e1–567.e7. DOI: 10.1016/j.jpurol.2020.06.020.
- Canalichio KL, Ahn J, Hwang C, Amies AM, Merguerian P, Shnorhavorian M. Faculty Opinions recommendation of Long-term urological and gynecological outcomes following complete primary repair in females with bladder exstrophy. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2021; 7 (5): 08 1–608 8. DOI: 10.3410/f.740664374.793590655.
- Giron AM, Passerotti CC, Nguyen H, Cruz JASda, Srougi M. Bladder exstrophy: reconstructed female patients achieving normal pregnancy and delivering normal babies. Int Braz J Urol 2011; 37 (5): 605–610. DOI: 10.1590/s1677-55382011000500006.
- Kramer SA, Jackson IT. Bilateral Rhomboid Flaps for Reconstruction of the External Genitalia in Epispadias-Exstrophy. Plast Reconstr Surg 1986; 77 (4): 621–629. DOI: 10.1097/00006534-198604000-00019.
- Krisiloff M, Puchner PJ, Tretter W, Macfarlane MT, Lattimer JK. Pregnancy in Women with Bladder Exstrophy. J Urol 1978; 119 (4): 478–479. DOI: 10.1016/s0022-5347(17)57522-9.
- Burbige KA, Hensle TW, Chambers WJ, Leb R, Jeter KF. Pregnancy and sexual function in women with bladder exstrophy. Urology 1986; 28 (1): 12–14. DOI: 10.1016/0090-4295(86)90172-x.
- Kennedy WA, Hensle TW, Reiley EA, Fox HE, Haus T. Pregnancy after orthotopic continent urinary diversion. Int J Gynaecol Obstet 1993; 46 (1): 88–89. DOI: 10.1016/0020-7292(94)90337-9.
- Stein R, Fisch M, Bauer H, Friedberg V, Hohenfellner R. Operative Reconstruction of the External and Internal Genitalia in Female Patients with Bladder Exstrophy or Incontinent Epispadias. J Urol 1995; 154 (1002): 1002–1007. DOI: 10.1097/00005392-199509000-00026.
- Mednick L, Gargollo P, Oliva M, Grant R, Borer J. Stress and Coping of Parents of Young Children Diagnosed With Bladder Exstrophy. J Urol 2009; 181 (3): 1312–1317. DOI: 10.1016/j.juro.2008.10.051.
- Meldrum KK, Mathews RI, Nelson CP, Gearhart JP. Subspecialty training and surgical outcomes in children with failed bladder exstrophy closure. J Pediatr Urol 2005; 1 (2): 95–99. DOI: 10.1016/j.jpurol.2005.01.002.
- Nelson CP, North AC, Ward MK, Gearhart JP. Economic Impact of Failed or Delayed Primary Repair of Bladder Exstrophy: Differences in Cost of Hospitalization. J Urol 2008; 179 (2): 680–683. DOI: 10.1016/j.juro.2007.09.093.
- Nelson CP, Dunn RL, Wei JT, Gearhart JP. Surgical Repair Of Bladder Exstrophy In The Modern Era: Contemporary Practice Patterns And The Role Of Hospital Case Volume. J Urol 2005; 174 (3): 1099–1102. DOI: 10.1097/01.ju.0000169132.14799.33.
- Bethell G, Johal N, Cuckow P. Cloacal Exstrophy Repair with Primary Closure of Bladder Exstrophy: A Case Report and Review of Literature. Case Rep Pediatr 1952; 2016 (654): 1–3. DOI: 10.1155/2016/8538935.
- Cendron l., Zanotti G, Percudani R, Ramazzina I, Puggioni V, Maccacaro E, et al.. Crystal structure of allantoin racemase from Pseudomonas fluorescens AllR. Ann Chir Infant 1971; 12 (371). DOI: 10.2210/pdb5lfd/pdb.
- Jeffs RD, Charrios R, Mnay M. Primary closure of the exstrophied bladder. In: Scott R, editor. Current Controversies in Urologic Management. Philadelphia:WB Saunders; 1972. DOI: 10.1097/00006534-195701000-00025.
- Landes RR, Melnick I, Klein R. Vesical exstrophy with epispadias twenty-year follo-up. Urology 1973; 9 (1): 53–56. DOI: 10.1016/0090-4295(77)90285-0.
- Gearhart JP, Jeffs RD. State-of-the-Art Reconstructive Surgery for Bladder Exstrophy at The Johns Hopkins Hospital. Arch Pediatr Adolesc Med 1989; 143 (12): 1475. DOI: 10.1001/archpedi.1989.02150240097026.
- Grady RW, Mitchell ME. Complete Primary Repair Of Exstrophy. J Urol 1999; 162 (4): 1415–1420. DOI: 10.1016/s0022-5347(05)68327-9.
- Chan DY, Jeffs RD, Gearhart JP. Determinants of continence in the bladder exstrophy population: predictors of success? Urology 2001; 57 (4): 774–777. DOI: 10.1016/s0090-4295(00)01102-x.
- Stein R, Fisch M, Black P, Hohenfellner R. Strategies For Reconstruction After Unsuccessful Or Unsatisfactory Primary Treatment Of Patients With Bladder Exstrophy Or Incontinent Epispadias. J Urol 1999; 161 (1934): 1934–1941. DOI: 10.1097/00005392-199906000-00066.
- Grady RW, Mitchell ME. Surgical techniques for one-stage reconstruction of the exstrophy-epispadias complex. In: Wein AJ, Kavoussi LR, Novick AC, Partin AW, Peters CA, editors. Campbell-Walsh Urology. Philadelphia: Saunders; 2007.
- Husmann DA. Surgery Insight: advantages and pitfalls of surgical techniques for the correction of bladder exstrophy. Nat Clin Pract Urol 2006; 3 (2): 95–100. DOI: 10.1038/ncpuro0407.
- Kibar Y, Roth CC, Frimberger D, Kropp BP. Our initial experience with the technique of complete primary repair for bladder exstrophy. J Pediatr Urol 2009; 5 (3): 186–189. DOI: 10.1016/j.jpurol.2008.11.005.
- Mitchell ME. Bladder exstrophy repair: Complete primary repair of exstrophy. Urology 2005; 65 (1): 5–8. DOI: 10.1016/j.urology.2004.07.030.
- Gargollo PC, Borer JG, Diamond DA, Hendren WH, Rosoklija I, Grant R, et al.. Prospective Followup in Patients After Complete Primary Repair of Bladder Exstrophy. J Urol 2008; 180 (4s): 1665–1670. DOI: 10.1016/j.juro.2008.05.076.
- Shnorhavorian M, Grady RW, Anderson A. Long-Term Followup of Complete Primary Repair of Exstrophy: The Seattle Experience. Yearbook of Urology 2008; 2009 (1615): 214–215. DOI: 10.1016/s0084-4071(09)79240-1.
- Hafez AT, El-Sherbiny MT. Complete Repair Of Bladder Exstrophy: Management Of Resultant Hypospadias. J Urol 2005; 173 (3): 958–961. DOI: 10.1097/01.ju.0000147012.49955.6f.
- Gearhart JP, Baird AD. The Failed Complete Repair Of Bladder Exstrophy: Insights And Outcomes. J Urol 2005; 174 (4 Part 2): 1669–1673. DOI: 10.1097/01.ju.0000175994.35468.2f.
- Gargollo PC, Borer JG. Contemporary outcomes in bladder exstrophy. Curr Opin Urol 2007; 17 (4): 272–280. DOI: 10.1097/mou.0b013e3281ddb32f.
- Shapiro E, Jeffs RD, Gearhart JP, Lepor H. Muscarinic Cholinergic Receptors in Bladder Exstrophy: Insights Into Surgical Management. J Urol 1985; 134 (2): 308–310. DOI: 10.1016/s0022-5347(17)47139-4.
- Lee BR, Perlman EJ, Partin AW, Jeffs RD, Gearhart JP. Evaluation of Smooth Muscle and Collagen Subtypes in Normal Newborns and Those With Bladder Exstrophy. J Urol 1996; 156 (203): 2034–2036. DOI: 10.1097/00005392-199612000-00042.
- Peppas DS, Tchetgen M-B, Lee BR, Jeffs RD, Gearhart JP. A Quantitative Histological Analysis of the Bladder in Classical Bladder Exstrophy in Various Stages of Reconstruction Utilizing Color Morphometry. The Exstrophy–Epispadias Complex 1999; 1999 (41): 41–47. DOI: 10.1007/978-1-4757-3056-2_7.
- Lais A, Paolocci N, Ferro F, Bosman C, Boldrini R, Caione P. Morphometric Analysis of Smooth Muscle in the Exstrophy-Epispadias Complex. J Urol 1996; 156 (819): 819–821. DOI: 10.1097/00005392-199608001-00074.
- Orsola A, Estrada CR, Nguyen HT, Retik AB, Freeman MR, Peters CA, et al.. Growth and stretch response of human exstrophy bladder smooth muscle cells: molecular evidence of normal intrinsic function. BJU Int 2005; 95 (1): 144–148. DOI: 10.1111/j.1464-410x.2004.05267.x.
- Mathews R, Wills M, Perlman E, Gearhart JP. Neural Innervation Of The Newborn Exstrophic Bladder. J Urol 1999; 162 (506): 506–508. DOI: 10.1097/00005392-199908000-00076.
- Rösch W, Christl A, Strauss B, Schrott K-M, Neuhuber WL. Comparison of Preoperative Innervation Pattern and Postreconstructive Urodynamics in the Exstrophy-Epispadias Complex. Urol Int 1997; 59 (1): 6–15. DOI: 10.1159/000283009.
- Hipp J, Andersson K-E, Kwon TG, Kwak EK, Yoo J, Atala A. Microarray analysis of exstrophic human bladder smooth muscle. BJU Int 2008; 0 (0): 070916224627009–??? DOI: 10.1111/j.1464-410x.2007.07211.x.
- Novak TE, Lakshmanan Y, Frimberger D, Epstein JI, Gearhart JP. Polyps In The Exstrophic Bladder. A Cause For Concern? J Urol 2005; 174 (4 Part 2): 1522–1526. DOI: 10.1097/01.ju.0000179240.25781.1b.
- Toguri AG, Churchill BM, Schillinger JF, Jeffs RD. Continence in Cases of Bladder Exstrophy. J Urol 1987; 119 (4): 538–540. DOI: 10.1016/s0022-5347(17)57541-2.
- Diamond DA, Bauer SB, Dinlenc C, Hendren WH, Peters CA, Atala A, et al.. Normal Urodynamics In Patients With Bladder Exstrophy: Are They Achievable? J Urol 1999; 162 (3 Part 1): 841–845. DOI: 10.1097/00005392-199909010-00072.
- Mathews R, Gosling JA, Gearhart JP. Ultrastructure Of The Bladder In Classic Exstrophy: Correlation With Development Of Continence. J Urol 2004; 172 (4 Part 1): 1446–1449. DOI: 10.1097/01.ju.0000138248.43831.27.
- Wakim A, Barbet JP. Connections of the bladder plate and bladder neck with the bony pelvis in a fetus with classic bladder exstrophy. Urology 2002; 60 (1): 142–146. DOI: 10.1016/s0090-4295(02)01715-6.
- Gearhart JP, Mathews R. The Failed Exstrophy Closure. The Exstrophy–Epispadias Complex 1991; 18 (687): 93–96. DOI: 10.1007/978-1-4757-3056-2_15.
- Connolly JA, Peppas DS, Jeffs RD, Gearhart JP. Prevalence and Repair of Inguinal Hernias in Children with Bladder Exstrophy. J Urol 1995; 154 (1900): 1900–1901. DOI: 10.1097/00005392-199511000-00093.
- Baker LA, Gearhart JP. The staged approach to bladder exstrophy closure and the role of osteotomies. World J Urol 1998; 16 (3): 205–211. DOI: 10.1007/s003450050054.
- Silver RI, Yang A, Ben-Chaim J, Jeffs RD, Gearhart JP. Penile Length in Adulthood after Exstrophy Reconstruction. The Exstrophy–Epispadias Complex 1997; 158 (999): 117–125. DOI: 10.1007/978-1-4757-3056-2_19.
- Gearhart JP, Yang A, Leonard MP, Jeffs RD, Zerhouni EA. Prostate Size and Configuration in Adults with Bladder Exstrophy. J Urol 1993; 149 (2): 308–310. DOI: 10.1016/s0022-5347(17)36064-0.
- Berkowitz J, Carter HB, Gearhart JP. Prostate Cancer in Patients with the Bladder Exstrophy-Epispadias Complex: Insights and Outcomes. Urology 2008; 71 (6): 1064–1066. DOI: 10.1016/j.urology.2007.12.069.
- D’Hauwers KWM, Feitz WFJ, Kremer JAM. Bladder exstrophy and male fertility: pregnancies after ICSI with ejaculated or epididymal sperm. Fertil Steril 2008; 89 (2): 387–389. DOI: 10.1016/j.fertnstert.2007.03.005.
- Cadeddu JA, Benson JE, Silver RI, Lakshmanan Y, Jeffs RD, Gearhart JP. Spinal abnormalities in classic bladder exstrophy. BJU Int 1997; 79 (6): 975–978. DOI: 10.1046/j.1464-410x.1997.00190.x.
- Halachmi S, Farhat W, Konen O, Khan A, Hodapp J, Bagli DJ, et al.. Pelvic Floor Magnetic Resonance Imaging after Neonatal Single Stage Reconstruction in Male Patients With Classic Bladder Exstrophy. J Urol 2003; 170 (4 Part 2): 1505–1509. DOI: 10.1097/01.ju.0000087463.92231.b1.
- Gargollo PC, Borer JG, Retik AB, Peters CA, Diamond DA, Atala A, et al.. Magnetic Resonance Imaging Of Pelvic Musculoskeletal And Genitourinary Anatomy In Patients Before And After Complete Primary Repair Of Bladder Exstrophy. J Urol 2005; 174 (4 Part 2): 1559–1566. DOI: 10.1097/01.ju.0000175997.60933.fe.
- Ebert AK, Falkert A, Brandl R, Hirschfelder H, Koller M, RÃ\textparagraphsch WH. Pelvic-floor imaging using three-dimensional ultrasonography and magnetic resonance imaging in the long term follow-up of the bladder-exstrophy-epispadias complex. BJU Int 2010; 105 (2): 248–253. DOI: 10.1111/j.1464-410x.2009.08736.x.
- Ives E, Coffey R, Carter CO. A family study of bladder exstrophy. J Med Genet 1980; 17 (2): 139–141. DOI: 10.1136/jmg.17.2.139.
- Reutter H, Qi L, Gearhart JP, Boemers T, Ebert A-K, Rösch W, et al.. Concordance analyses of twins with bladder exstrophy–epispadias complex suggest genetic etiology. Am J Med Genet A 2007; 143a (22): 2751–2756. DOI: 10.1002/ajmg.a.31975.
- Boyadjiev SA, Dodson JL, Radford CL, Ashrafi GH, Beaty TH, Mathews RI, et al.. Clinical and molecular characterization of the bladder exstrophy-epispadias complex: analysis of 232 families. BJU Int 2004; 94 (9): 1337–1343. DOI: 10.1111/j.1464-410x.2004.05170.x.
- Wood HM, Trock BJ, Gearhart JP. In Vitro Fertilization and the Cloacal-Bladder Exstrophy-Epispadias Complex: Is there an Association? J Urol 2003; 169 (4): 1512–1515. DOI: 10.1097/01.ju.0000054984.76384.66.
- Wood HM, Babineau D, Gearhart JP. In vitro fertilization and the cloacal/bladder exstrophy–epispadias complex: A continuing association. J Pediatr Urol 2007; 3 (4): 305–310. DOI: 10.1016/j.jpurol.2006.10.007.
- Boyadjiev SA, South ST, Radford CL, Patel A, Zhang G, Hur DJ, et al.. A reciprocal translocation 46,XY,t(8;9)(p11.2;q13) in a bladder exstrophy patient disrupts CNTNAP3 and presents evidence of a pericentromeric duplication on chromosome 9. Genomics 2004; 85 (5): 622–629. DOI: 10.1016/j.ygeno.2005.01.002.
- Reutter H, Thauvin-Robinet C, Boemers TM, Rösch WH, Ludwig M. Bladder exstrophy–epispadias complex: Investigation of suppressor of variegation, enhancer of zeste and Trithorax (SET) as a candidate gene in a large cohort of patients. Scand J Urol Nephrol 2006; 40 (3): 221–224. DOI: 10.1080/00365590600621204.
- Ludwig M, Ruschenforf F, Saar K, Hubner N, Siekmann L, Boyadjiev SA, et al.. Genome-wide linkage scan for bladder exstrophy-epispadias complex. Birth Defects Res A Clin Mol Teratol. 2009; 5 (2): 74–78.
- Gearhart J, Benchaim J, Jeffs R, Sanders R. Criteria for the prenatal diagnosis of classic bladder exstrophy. Obstet Gynecol 1995; 85 (6): 961–964. DOI: 10.1016/0029-7844(95)00069-4.
- Gobbi D, Fascetti Leon F, Tregnaghi A, Gamba PG, Midrio P. Early Prenatal Diagnosis of Cloacal Exstrophy with Fetal Magnetic Resonance Imaging. Fetal Diagn Ther 2008; 24 (4): 437–439. DOI: 10.1159/000174570.
- Lattimer JK, Vernon Smith MJ. Exstrophy Closure: a Followup on 70 Cases. J Urol 1966; 95 (3): 356–359. DOI: 10.1016/s0022-5347(17)63460-8.
- Birth Defects Monitoring Systems IC for. Epidemiology of bladder exstrophy and epispadias: A communication from the international clearinghouse for birth defects monitoring systems. Teratology 1987; 36 (2): 221–227. DOI: 10.1002/tera.1420360210.
- Nelson CP, Dunn RL, Wei JT. Contemporary Epidemiology Of Bladder Exstrophy In The United States. J Urol 2005; 173 (5): 1728–1731. DOI: 10.1097/01.ju.0000154821.21521.9b.
- Ambrose SS, O’Brien DP. Surgical Embryology of the Exstrophy-Epispadias Complex. Surg Clin North Am 1974; 54 (6): 1379–1390. DOI: 10.1016/s0039-6109(16)40493-7.
- Marshall VF, Muecke C. Congenital abnormalities of the bladder. Handbuch der Urologie. New York: Springer Verlag; 1968. DOI: 10.1007/978-3-642-87399-7_4.
- Mildenberger H, Kluth D, Dziuba M. Embryology of bladder exstrophy. J Pediatr Surg 1988; 23 (2): 166–170. DOI: 10.1016/s0022-3468(88)80150-7.
- Johnson JH, Kogan SJ. The exstrophic anomalies and their surgical reconstruction. Curr Prob Surg 1974 (August):1-3. DOI: 10.1016/s0011-3840(74)80011-0.
- Rubenwolf P, Thomas C, Thüroff JW, Stein R. Sexual Function and Fertility of Women with Classic Bladder Exstrophy and Continent Urinary Diversion. J Urol 2016; 196 (1): 140–145. DOI: 10.1016/j.juro.2015.12.099.
Última actualización: 2025-09-21 13:35