44: 儿童睾丸及睾丸旁肿瘤
阅读本章大约需要 8 分钟。
引言
儿童中睾丸及睾丸旁肿瘤并不常见。可为原发或继发,良性或恶性。本章概述儿童临床上遇到的各类病变。从临床相关性的角度,将睾丸内病变按两个儿科年龄组进行考虑:
- 青春期前儿童
- 青少年和青年(AYA)
在上述任一年龄组中,睾丸肿瘤均具有需要考虑的特征性表现,影响管理与预后。对于大多数青春期前的良性睾丸病变,可计划行睾丸保留手术(TSS);而大多数 AYA 肿瘤自起初即被怀疑为恶性,原发性睾丸内或睾丸旁恶性肿瘤的标准手术治疗为根治性睾丸切除术。
胚胎学
胎儿睾丸在6周后由未分化的中胚层性腺发育而来。在男性胎儿中,发育中的睾丸分泌的AMH使苗勒管退化。沃尔夫管系统在发育中的睾丸分泌的睾酮作用下发育。产生睾酮的Leydig细胞源自性腺中胚层,位于成熟睾丸的间质中。中胚层基质的性索发育为曲细精管,支持性上皮细胞分化为Sertoli细胞。睾丸的体细胞源自性腺嵴的中胚层,而原始生殖细胞则在胚胎发育约8天后起源于上胚层/卵黄囊,并迁移至性腺嵴,最终停留在靠近性腺中胚层的部位。1
发育中的睾丸内,细胞源自不同的胚胎学起源,这种来源差异是儿科睾丸中可能出现的众多肿瘤及其不同生物学行为的基础。
流行病学
儿童睾丸肿瘤占所有儿童实体肿瘤的1-2%。2 发病率估计为每10万名儿童0.5-2例。3 在儿科年龄组中,发病高峰出现在青春期,3岁以下还有一个较小的高峰。4
现在很清楚,青春期前儿童的大多数睾丸内肿瘤为良性。青春期前睾丸内肿瘤中有60-70%被报道为良性。5,6 青春期后的青少年与青年(AYA)中,75%的睾丸内肿瘤为恶性。7 青春期前年龄组中最常见的良性肿瘤是畸胎瘤,其中位发病年龄为13个月。8 卵黄囊瘤是青春期前年龄组中最常见的恶性睾丸肿瘤,其中位发病年龄约为16个月。9 这两种生殖细胞来源的肿瘤构成了睾丸肿瘤在3岁以下年龄段早期发病高峰中的很大比例。
AYA 人群中最常见的睾丸恶性肿瘤为混合型生殖细胞肿瘤。10 纯型精原细胞瘤在 AYA 中较为罕见。与青春期前儿童(后者以纯型卵黄囊瘤为主)不同,AYA 的生殖细胞肿瘤多为非精原细胞性,且一般为混合组织学类型,其中以胚胎性癌为最常见的组织学亚型。10 发生于 AYA 的畸胎瘤通常为恶性,这一点不同于青春期前儿童。7
儿童睾丸及睾丸旁肿瘤类型的发病机制与概述
原发性睾丸肿瘤可起源于睾丸的生殖细胞(生殖细胞肿瘤,GCTs)或间质细胞(性索/间质细胞肿瘤)。GCTs远比间质细胞肿瘤常见。
生殖细胞肿瘤(GCTs)根据世界卫生组织2016年分类进行分型 - 要么为生殖细胞原位肿瘤来源(GCNIS来源),其多在青春期后出现;要么为非生殖细胞原位肿瘤来源(非GCNIS来源),其多在青春期前出现。11
非GCNIS来源的一组生殖细胞肿瘤(GCTs)包括青春期前卵黄囊肿瘤、青春期前型畸胎瘤(包括皮样囊肿和表皮样囊肿),以及精原细胞性肿瘤(主要见于成人)。在青春期前年龄组,原位癌或小管内生殖细胞肿瘤几乎不存在,这与AYA和年长成人不同。12,13
源自原位生殖细胞肿瘤(GCNIS)的生殖细胞肿瘤(GCTs)包括青春期后型畸胎瘤、卵黄囊肿瘤、胚胎性癌、滋养细胞肿瘤(包括绒毛膜癌),上述各型均可见于青少年及青年(AYA)人群;以及精原细胞瘤,后者在较年长的成人中更为常见。
性索间质性睾丸肿瘤在儿童中罕见。Leydig细胞瘤在青春期前儿童中几乎总是良性。14,15 幼年型颗粒细胞瘤在青春期前人群通常为良性。16 Sertoli细胞瘤多为良性,但约10%可为恶性,尤其见于年龄较大的儿童。17 Sertoli细胞瘤可能与Carney综合征、Peutz-Jeghers综合征等相关。
性腺母细胞瘤是儿童期性腺的一种独特的恶性肿瘤。性腺母细胞瘤的细胞既包括性腺的间质细胞,也包括生殖细胞。性腺母细胞瘤几乎总是在性发育差异或变异的背景下出现。18
睾丸的罕见发育异常,如睾丸网发育不良,可表现为青春前期睾丸肿块。睾丸网发育不良几乎总是与同侧肾缺如相关。19 单纯性睾丸囊肿和附睾囊肿也可在儿童期表现为睾丸或阴囊肿块。
儿童期的睾丸旁肿瘤可以为良性或恶性。良性睾丸旁肿瘤较为罕见,包括血管瘤、平滑肌瘤和脂肪瘤等病变。2 恶性睾丸旁肿瘤包括横纹肌肉瘤,它是儿童最常见的睾丸旁恶性肿瘤。2 以及罕见的婴儿黑色素性神经外胚层肿瘤,其多为良性,但可表现出恶性行为。20
必须记住,儿童期的睾丸是转移性或浸润性恶性肿瘤的常见部位,例如白血病或淋巴瘤的转移。7
虽然隐睾是睾丸恶性肿瘤的已知危险因素,但多数已报道的儿童期睾丸肿瘤与隐睾无关。隐睾与青春期后发生的恶性肿瘤风险增加有关,双侧风险为普通人群的2–5倍。21 在儿童早期行睾丸固定术似乎可降低这一风险。22 在未矫治或手术较晚的隐睾中,最常见的恶性肿瘤类型是精原细胞瘤。23
睾丸微石症通常在儿童的超声检查中偶然发现,尚未证实与儿童期睾丸肿瘤风险增加相关。睾丸微石症在成年期可能与睾丸恶性肿瘤风险增加相关,尤其是在合并隐睾等其他危险因素时。因此,建议青春期后进行睾丸自我检查,以促进早期发现。24
评估与诊断
睾丸或睾丸旁肿瘤最常见的临床表现为无痛性阴囊肿块,由患儿或照护者发现。有时可见反应性鞘膜积液。阴囊肿胀可能促使复诊和进一步检查;偶尔在因外伤就诊后偶然发现肿块,或在超声检查(USS)中发现。若触及阴囊肿块,除此之外往往缺乏其他有助于鉴别的临床特征。然而,Leydig 细胞瘤可能伴有性早熟的体征,且约 10% 的 Sertoli 细胞瘤也可表现为性早熟的体征。25
阴囊和睾丸的超声检查(USS)是非常有用的初始检查。它通常可清楚提示肿块的位置和大小、性质为实性或囊性、弥漫性或边界清楚、位于睾丸内或睾丸旁、血供情况以及为单灶或多灶。某些青春期前病变在超声上具有特征性表现,例如表皮样囊肿的“洋葱皮样”分层(图 1)、皮样囊肿的分叶状外观(图 2),以及睾丸网发育不良的特征性囊性表现(图 3)。26 畸胎瘤可呈多变的囊性/实性外观(图 4)。良性病变在超声上倾向于表现为低血供。恶性病变在超声上通常表现为低回声、实性且回声均一。
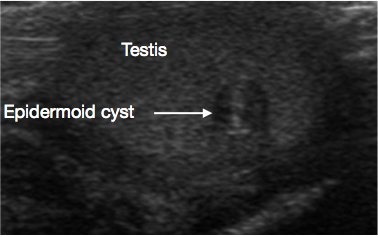
图 1 睾丸表皮样囊肿的超声图像,呈洋葱皮样外观(箭头)
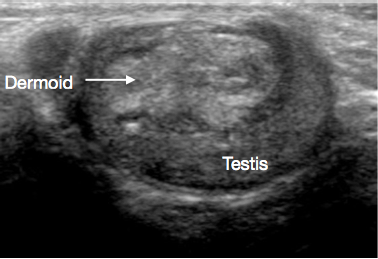
图 2 睾丸皮样囊肿的超声,分叶状囊肿,内含碎屑
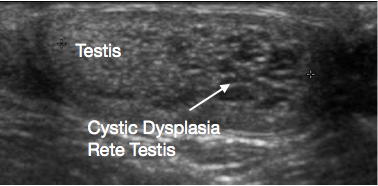
图3 睾丸网囊性发育不良的超声图像,图像左侧为睾丸,右侧为囊性发育不良
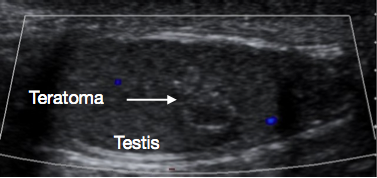
图4 青春期前睾丸畸胎瘤的超声,呈斑驳样外观
血清肿瘤标志物可有助于区分良性与恶性病变。对于睾丸肿瘤,甲胎蛋白(AFP)、β-人绒毛膜促性腺激素(BHCG)和乳酸脱氢酶(LDH)是最常用的标志物。由于可能分泌 BHCG 的绒毛膜癌和胚胎性癌在该年龄组几乎不见,BHCG 在青春期前肿瘤的评估中通常意义不大。7,27 然而,在青春期后的 AYA 人群中,这些病变可能发生,因此 BHCG 非常重要。AFP 是青春期前年龄组中最重要的标志物,因为在几乎所有卵黄囊瘤中其明显升高,而该年龄组常见此类肿瘤。9 畸胎瘤可能出现轻度升高的 AFP,但青春期前畸胎瘤 AFP 水平超过 100ng/mL 尚未有报道。9 良性畸胎瘤与恶性卵黄囊瘤之间 AFP 水平的显著差异,也有助于在 TSS 与根治性睾丸切除术之间进行术式规划。解读 AFP 水平时应注意,8 个月以内的婴儿可能具有生理性偏高的血清 AFP 水平。28
临床特征、病变的影像学特征以及血清肿瘤标志物水平有助于指导后续管理。若怀疑病变为恶性,进行腹部、盆腔及胸部CT分期检查以评估局部区域扩散和转移情况十分重要。20%的青春期前卵黄囊瘤在初诊时即有肺转移。29
具有良性肿瘤的临床和USS特征,且肿瘤标志物血清水平未升高的病变,通常在切除前不需要进行分期CT检查。
青春期前儿童睾丸肿瘤总结
表 1 儿童期睾丸及睾丸旁肿瘤
| 分类 | 类型 | 亚型 | 良性 | 多为良性,可能为恶性 | 恶性 |
|---|---|---|---|---|---|
| 原发性睾丸/性腺肿瘤 | 青春期前睾丸肿瘤 | GCT - 非GCNIS来源 | 青春期前畸胎瘤 | 卵黄囊瘤 | |
| 表皮样囊肿 | |||||
| 皮样囊肿 | |||||
| 性索/间质肿瘤 | 幼年型颗粒细胞瘤 | 莱迪希细胞瘤 | |||
| 塞尔托利细胞瘤 | |||||
| 发育异常与单纯性囊肿 | 睾网囊性发育不良 | ||||
| 睾丸囊肿 | |||||
| 附睾囊肿 | |||||
| 青少年及青年(AYA)睾丸肿瘤 | GCT - 源自GCNIS | 青春期后畸胎瘤 | |||
| 胚胎性癌 | |||||
| 卵黄细胞瘤 | |||||
| 绒毛膜癌 | |||||
| 混合型GCTs | |||||
| 精原细胞瘤 | |||||
| 性发育差异(DSD)相关的性腺肿瘤 | 性腺母细胞瘤 | ||||
| 继发性睾丸转移/浸润 | 白血病,例如急性淋巴母细胞白血病 | ||||
| 淋巴瘤,例如伯基特淋巴瘤 | |||||
| 睾丸旁肿瘤 | 血管瘤 | 婴儿期黑色素性神经外胚层肿瘤 | 睾丸旁横纹肌肉瘤 | ||
| 平滑肌瘤 | |||||
| 脂肪瘤 | |||||
GCT=生殖细胞肿瘤, GCNIS=原位生殖细胞肿瘤
原发性睾丸/ 性腺肿瘤
睾丸良性生殖细胞肿瘤(非由GCNIS起源)
畸胎瘤
这些在青春期前出现时几乎总是良性的。8 就诊的中位年龄为13个月。2 它们在超声检查(USS)上常呈异质性外观(图4),因为畸胎瘤可含有来自三种胚胎生殖细胞层 - 内胚层、中胚层和外胚层 的任意一种或全部。在该年龄组,畸胎瘤通常包含成熟成分,偶尔可见未成熟成分。即使存在未成熟成分,该年龄组在TSS后通常也有良好预后。30 对于青春期前畸胎瘤,TSS通常可行;在成功切除并经组织学证实为良性后,通常无需进一步随访。27
表皮样囊肿
这些为源自外胚层的良性囊肿,内衬可产生角蛋白的上皮。该囊肿在超声检查(USS)上呈现特征性的层状’洋葱皮’样外观(图 1)。11 它们易于剜除,因此 TSS 是标准治疗。切除后无需常规的长期随访,但已有罕见复发的报道。26
皮样囊肿
皮样囊肿由皮肤样成分构成,包括皮肤附属器,如毛囊和皮脂腺。为良性。超声表现常示厚壁、轮廓光滑的囊性病变,内含无血流信号的高回声碎屑 (图 2).31,32 TSS 为标准治疗,切除后通常不需要常规随访。27
睾丸恶性生殖细胞肿瘤 (非GCNIS来源)
卵黄细胞肿瘤
这是青春期前儿童最常见的睾丸内恶性肿瘤。典型的就诊年龄为3岁以下的早期高峰期,中位年龄16个月。9 肿瘤在超声检查(USS)上通常呈实性且均匀。血清甲胎蛋白(AFP)显著升高。80%的青春期前卵黄囊瘤在就诊时为I期。33 20%在就诊时已有肺转移。2 若怀疑卵黄囊瘤,应行胸部、腹部及盆腔分期CT检查,并计划行根治性睾丸切除术。对于青春期前卵黄囊瘤不常规实施根治性淋巴结清扫术(RLND),因为卵黄囊瘤常见经血行转移而无局部区域播散;对此类转移,RLND(且其并发症风险显著)并不能起作用。34
对于已确诊的Ⅰ期疾病,若术后血清AFP恢复正常,通常不需要化疗。复发率约为20%。因此建议进行定期的术后肿瘤学随访,包括AFP水平监测及MRI等影像学检查;复发后挽救治疗的成功率非常高。2,35 对于临床Ⅱ期伴淋巴结受累的疾病以及转移性疾病,大多数方案均建议化疗。以铂类为基础的化疗对卵黄囊瘤疗效显著。RLND仅用于局部或区域性残留或复发的病灶。2,33
睾丸性索-间质肿瘤
幼年型颗粒细胞瘤
这些通常为良性的肿瘤多发生于婴儿,并且是新生儿最常见的睾丸肿瘤。从组织学上看,它们由成片的颗粒细胞样细胞组成,常伴有囊性变。16,36 TSS通常成功并可达到治愈,尚无复发报道,切除后通常不需要长期随访。27
莱迪希细胞瘤
在儿童中,莱迪希细胞瘤通常为良性,但在成人中可能为恶性。莱迪希细胞瘤通常发生于约5–10岁的儿童。14,15 大多数表现为无痛性睾丸肿块。然而,莱迪希细胞瘤也可因睾酮分泌而表现为性早熟。此外,10-15%的莱迪希细胞瘤患儿可因雌二醇分泌出现女性化征象,如男性乳腺发育。2 术中外观为黄色均质结节。在青春期前儿童中,鉴于该年龄组的莱迪希细胞瘤几乎总为良性,建议行TSS。若伴有性早熟,建议进行内分泌科评估与随访。肿瘤切除后青春期改变不会逆转,因为青春期激素轴已被激活。2
塞尔托利细胞肿瘤
这类肿瘤的中位起病年龄为6个月,尽管可发生于青春期前的任何年龄。三分之一与Peutz-Jeghers 综合征或Carney 综合征等相关。10%因具有激素活性而表现为性早熟的改变;甚至可出现男性乳房发育,这是由于肿瘤分泌芳香化酶,使雄烯二酮转化为雌酮。37 它们多为良性,但在年长儿童中也可呈恶性。因此,进行术前分期CT是谨慎之举,尤其是在5岁以上的儿童中。当前指南建议对于儿童Sertoli细胞肿瘤考虑进行TSS。27
发育异常和囊肿
睾丸网囊性发育不良是一种罕见的发育异常,表现为睾丸包块。它几乎总是与同侧肾缺如相关。USS显示该病变为囊性,通常位于睾丸上极,并压迫邻近正常睾丸组织(图3)。传统上建议对该病变行TSS。已有报道TSS后存在显著的复发率。鉴于其在超声上的特征性表现及合并同侧肾脏异常、其良性性质,以及关于病变随时间回归的报道日益增多,目前建议采取保守的、保留睾丸的管理并进行监测。若在实施保守管理前对诊断仍有疑虑,可考虑对病变进行活检。38,39
单纯性附睾囊肿和睾丸内囊肿可见于儿童期。偶尔会出现症状。必要时通常可行剜除或去顶术。
青少年与年轻成人(AYA)睾丸肿瘤概述
AYA人群的睾丸肿瘤通常为恶性,且多为胚细胞肿瘤(GCTs),主要起源于原位生殖细胞肿瘤(GCNIS). 睾丸胚细胞肿瘤占青少年期恶性肿瘤的14%,并且是该年龄段最常见的实体肿瘤 .
从组织学角度看,它们多为胚胎性癌,且常伴有混合型非精原细胞性生殖细胞肿瘤(GCT)成分。它们常以转移性疾病表现,并具有较高的复发率。对疑似恶性肿瘤的评估包括超声(USS)影像学检查、肿瘤标志物(AFP、BHCG 和 LDH),以及胸部、腹部和盆腔的分期 CT。10 青春期后的畸胎瘤也来源于 GCNIS,这与青春期前的对应类型不同。AYA 畸胎瘤中有 22-37% 发生转移。40 还应注意,AYA 人群的睾丸恶性肿瘤未必伴有肿瘤标志物升高。41
对于疑似 AYA 睾丸恶性肿瘤的标准治疗是经腹股沟途径行根治性睾丸切除术。对于局限性疾病,根治性睾丸切除通常具有治愈性。在睾丸切除术后处于临床分期 1 的 AYA,通常接受主动监测以检测复发;20-30% 会出现临床复发,而挽救性化疗后的生存率极佳。10 这种保守策略通过将治疗针对那些可证实存在复发疾病的患者,限制了对大多数临床分期 1 患者的过度治疗,并减少了暴露于以铂类为基础的化疗副作用的机会。肿瘤 >4cm、淋巴血管侵犯以及胚胎性癌成分增加与更高的转移性疾病风险相关。42
临床II期和III期的青少年与年轻成人(AYA)患者通常接受化疗。对于化疗后仍有残留病变或肿块者,即便肿瘤标志物为阴性,也可选择性行RLND,因为残留病灶可能为畸胎瘤,而畸胎瘤通常对化疗反应较差。10
儿童睾丸旁肿瘤概述
TSS 联合病灶局部切除通常考虑用于罕见的良性睾丸旁病变,如脂肪瘤。
婴儿黑色素性神经外胚层肿瘤是一种罕见肿瘤,累及附睾和睾丸旁区域。20 它通常为良性,但在活检的组织学上将其与小圆蓝细胞恶性肿瘤鉴别可能具有挑战性。由于多为良性,行睾丸切除术通常可治愈;但约10%的病例可表现出恶性行为,出现复发和/或转移。术后建议采用MRI等横断面影像学检查进行随访监测。2
睾丸旁横纹肌肉瘤是儿童期最常见的睾丸旁恶性肿瘤。它占全部阴囊内恶性肿瘤的5%,以及全部睾丸旁恶性肿瘤的40%。43 发病率呈双峰分布,一峰见于青少年及青年(AYA)人群,另一峰见于6个月以下婴儿。该肿瘤起源于睾丸旁组织的间充质成分。临床多表现为无痛性阴囊肿块,且相当一部分患者在初诊时已存在转移病灶。超声检查(USS)通常显示为实性睾丸旁病变(图5)。分期评估需行腹部、盆腔及胸部CT,以评估局部区域与远处转移。肿瘤标志物通常为阴性。
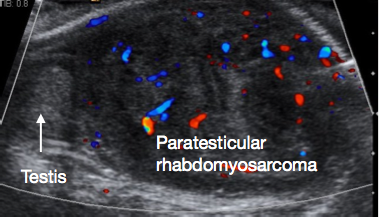
图 5 睾旁横纹肌肉瘤的超声图像,图像左侧为正常睾丸,图像右侧为大的睾旁肿块
由儿童肿瘤学组(COG)、欧洲儿科软组织肉瘤研究组(EpSSG)和协作性软组织肉瘤研究组(CWS)就睾丸旁横纹肌肉瘤外科处理发布的共识声明已于近期发表。44 目前推荐的睾丸旁横纹肌肉瘤外科处理是行根治性睾丸切除术,整块切除肿瘤、睾丸及精索至腹股沟内环。经阴囊入路切除为禁忌,因为这会使在腹股沟内环水平实现近端清除变得困难;同样应避免经阴囊活检,因为其会增加肿瘤播散的风险。
儿童期大多数睾丸旁横纹肌肉瘤在组织学上属于胚胎型。若病灶为胚胎型,则对于年龄超过10岁的儿童,在任何临床分期均建议进行腹膜后淋巴结评估;但对于10岁以下男孩,仅在存在局部播散证据或淋巴结肿大时才进行腹膜后淋巴结评估。若影像学显示淋巴结肿大而未进行淋巴结评估,建议按淋巴结受累对待并给予化疗。44
对于组织学为肺泡型横纹肌肉瘤的患者,建议所有患者均进行后腹膜淋巴结评估,不论影像学发现如何。若淋巴结阳性,则应行化疗和放疗。44
睾丸旁横纹肌肉瘤治疗后的预后在青春期前组优于 AYA 组。青春期前年龄组的无失败生存率为90%,而青少年为63%。45
儿童期睾丸内转移灶或浸润性恶性肿瘤
睾丸是白血病和淋巴瘤的常见浸润部位,儿童中常见的类型包括急性淋巴细胞白血病、滤泡性淋巴瘤或伯基特淋巴瘤。临床表现通常为单侧或双侧睾丸显著增大。超声检查常显示弥漫性低回声的增大睾丸,并伴血供丰富。46
睾丸保留手术与根治性睾丸切除术
临床指南目前强烈建议,对于经评估后强烈怀疑为良性的青春期前睾丸肿瘤采用TSS。27 TSS通过腹股沟入路进行。在进行睾丸游离与分离之前,对精索进行无损伤血管夹闭被视为标准肿瘤外科技术,可尽量减少出血,并在通常体积较小的青春期前睾丸中优化分离视野。 (图 6).
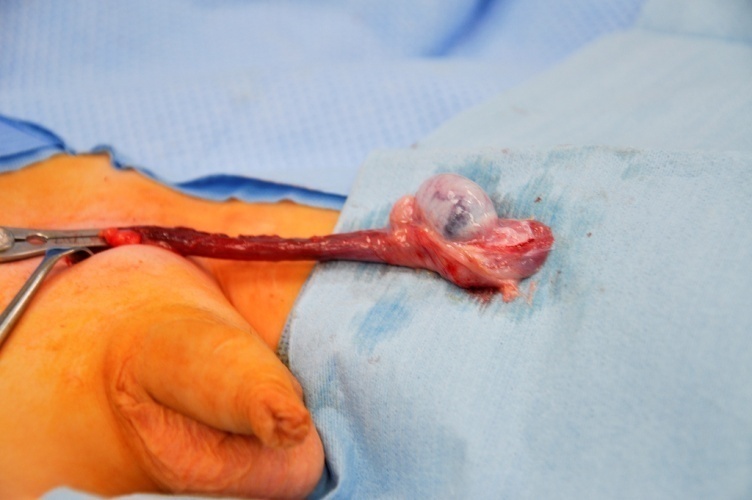
图 6 TSS - 置于精索上的无损伤血管钳,位于睾丸下极的Leydig细胞瘤
冰冻切片评估有助于确认病变为良性以及切缘为阴性。在许多经验丰富的中心,对于青春期前患儿、临床与超声表现为良性且肿瘤标志物阴性的病变,目前并不常规进行冰冻切片。41 如果尽管按照TSS的步骤进行仍存在疑虑或怀疑恶性,则放弃TSS并行根治性睾丸切除术。若TSS成功实施,于切除病变后缝合关闭睾丸白膜,并将睾丸复位于阴囊内。
对所有临床怀疑存在睾丸及睾丸旁恶性肿瘤的患儿,均应进行针对局部-区域受累及远处转移的术前分期评估。恶性病变的标准治疗为根治性睾丸切除术,采用腹股沟入路,并在游离睾丸及病灶之前先行精索血管夹闭。精索应在腹股沟内环水平结扎并切除。对于睾丸旁病变,肿瘤应连同睾丸及精索整块切除;若存在阴囊皮肤侵犯,则受累的阴囊皮肤亦应与病灶整块切除。44
恶性肿瘤的临床分期
儿童肿瘤学组(COG)对青春期前睾丸恶性肿瘤采用 I-IV 期临床分期系统(表 2)。I 期本质上是指在手术切除时局限于睾丸的疾病。
表 2 儿童肿瘤学组睾丸肿瘤分期
| 分期 | 描述 |
|---|---|
| I | 局限于睾丸,经高位腹股沟睾丸切除术完全切除;无睾丸以外疾病的临床、影像学或组织学证据 |
| 诊断时肿瘤标志物正常或未知的患者,如影像学显示淋巴结>2 cm,必须行同侧RPLND且结果为阴性以确认I期疾病 | |
| 经阴囊途径行睾丸切除并精索高位结扎的患者为I期” | |
| II | “经阴囊活检;阴囊内或精索近端(距近端<5 cm)存在显微病灶 |
| 肿瘤标志物未能按适当的半衰期恢复正常或下降” | |
| III | 经阴囊活检;阴囊内或精索近端(距近端<5 cm)存在显微病灶 |
| CT 显示淋巴结>4 cm,或2–4 cm并经活检证实” | |
| IV | 远处转移,包括肝脏 |
| III | 后腹膜淋巴结受累,但无内脏或腹腔外受累 |
美国癌症联合委员会(AJCC)通常采用肿瘤(T)、淋巴结(N)和转移(M)分期系统,并对术后肿瘤标志物使用 S 分级(表 3)。
表 3 AJCC 分期
| T-原发肿瘤 | N-区域淋巴结 | M-远处转移 | S-血清肿瘤标志物 |
|---|---|---|---|
| pT0 – 无原发肿瘤证据 | cN0 – 无区域淋巴结转移 | M0 – 无远处转移 | S0 – 标志物水平在正常范围内 |
| pTis – 管内生殖细胞肿瘤(原位癌) | pN0 – 无区域淋巴结转移 | M1 – 远处转移 | S1 - LDH < 1.5 X N 且 hCG (mIU/mL) <5000 且 AFP (ng/mL) <1000 |
| pT1 – 肿瘤局限于睾丸和附睾,无 LVI;肿瘤可侵及睾丸白膜但不侵及睾丸鞘膜 | cN1 – 转移,单个淋巴结肿块≤ 2 cm,或多发淋巴结,且无一>2 cm | M1a – 非区域淋巴结或肺转移 | S2 LDH 1.5–10 X N 或 hCG (mIU/mL) 5000–50,000 或 AFP (ng/mL) 1000–10,000 |
| pT2 – 肿瘤局限于睾丸和附睾,伴有 LVI,或肿瘤穿透睾丸白膜并累及睾丸鞘膜 | pN1 – 转移,单个淋巴结肿块≤2 cm,且阳性淋巴结≤5 个, 无一 >2 cm | M1b – 非区域淋巴结和肺以外部位的远处转移 | S3 LDH >10 x N 或 hCG (mIU/mL) >50,000 或 AFP (ng/mL) >10,000 |
| pT3 – 肿瘤侵及精索,可有或无 LVI | cN2 – 转移,淋巴结肿块 2–5 cm,或多发淋巴结,其中任一>2 cm 但不>5 cm | ||
| pT4 –肿瘤侵及阴囊,可有或无 LVI | pN2 – 转移,淋巴结肿块 2–5 cm,或阳性淋巴结>5 个,且无一 >5 cm,或有结外肿瘤扩展的证据 | ||
| cN3 – 转移,淋巴结肿块 >5 cm | |||
| pN3 – 转移,淋巴结肿块>5 cm |
AFP: 甲胎蛋白; hCG : β-人绒毛膜促性腺激素; LDH: 乳酸脱氢酶; LN: 淋巴结; LVI: 淋巴血管侵犯; N: 正常; c: 临床; p: 病理; T: 原发肿瘤; N: 区域淋巴结; M: 转移; S: 血清肿瘤标志物.
现已被取代的跨组横纹肌肉瘤研究(IRS)既建立了一个基于手术可切除性的’分组’系统,又为睾丸旁横纹肌肉瘤建立了一个经 IRS 修订的 TNM 分期系统。
治疗的并发症
无论是 TSS 还是根治性睾丸切除术,均与良好的恢复相关,但仍存在较小的相关风险,包括出血及阴囊血肿、感染以及病变复发。TSS 后睾丸萎缩较为罕见。41
近年来,儿童睾丸及睾丸旁肿瘤的管理重点在于通过对肿瘤风险进行分层,降低化疗和放疗的风险及长期不良影响,并仅对符合相应标准的患儿给予进一步治疗。目前,大多数I期患儿在肿瘤切除后将采取积极监测,只有在证实出现复发时才需要进行化疗。
化疗相关不良反应,如顺铂所致肾毒性和周围神经病变,以及博来霉素后出现的肺纤维化,已在文献中有充分报道。
化疗和放疗的长期不良影响包括生育功能受损和继发性恶性肿瘤。
建议的治疗后随访与监测
经证实为良性且切缘阴性的病变,如青春期前畸胎瘤,在TSS术后通常不需要常规的长期随访监测。然而,临床指南建议在术后第一年进行初始术后随访,每3-6个月进行一次超声检查。27
所有患有睾丸及睾丸旁恶性肿瘤的儿童均需按照肿瘤学方案进行为期数年的适当随访与监测。这是为了维持对疾病复发的主动监测,并评估手术以及化疗和/或放疗后的长期影响。
要点
- 大多数青春期前睾丸肿瘤为良性
- 大多数青春期前恶性睾丸肿瘤为纯型卵黄囊肿瘤
- 性索 / 间质性睾丸肿瘤在儿童期罕见,且大多为良性
- AYA 人群中的大多数睾丸肿瘤为恶性
- 睾丸旁横纹肌肉瘤是儿童中最常见的睾丸旁恶性肿瘤,但总体仍然罕见
结论
大多数青春期前睾丸肿瘤为良性。对于具有良性病变的临床和 USS 特征且肿瘤标志物阴性的青春期前睾丸肿瘤,TSS 可安全考虑并予以推荐。
青春期前恶性睾丸肿瘤的大多数为纯型卵黄囊肿瘤。大多数卵黄囊肿瘤的AFP明显升高。在进行分期CT评估后,治疗为根治性睾丸切除术。大多数为局限于睾丸的I期疾病,手术即可治愈。化疗保留用于II期及以上的患儿,或I期术后复发者。
在 AYA 人群中,大多数睾丸肿瘤为恶性。它们多为胚胎性癌和混合性生殖细胞肿瘤。
性索/间质性睾丸肿瘤在儿童期较为罕见,且大多为良性,适合行TSS。
睾丸旁横纹肌肉瘤是儿童最常见的睾丸旁恶性肿瘤。在进行适当的分期和评估后,治疗通常为经腹股沟入路将睾丸旁肿块与睾丸整块切除的根治性睾丸切除术。若病变的组织学为胚胎型,建议对所有10岁以上儿童进行后腹膜淋巴结评估,不论分期;对于10岁以下但有局部区域性疾病证据或淋巴结复发的男孩也建议进行评估。若病变的组织学为肺泡型,则无论影像学发现如何,均建议对所有患者进行后腹膜淋巴结评估。
参考文献
- Silber S. Testis Development, Embryology, and Anatomy. 2018. In: Fundamentals of Male Infertility \[Internet\]. Springer; , DOI: 10.1007/978-3-319-76523-5_1.
- Ahmed HU, Arya M, Muneer A, Mushtaq I, Sebire NJ. Testicular and paratesticular tumours in the prepubertal population. Lancet Oncol 2010; 11 (5): 476–483. DOI: 10.1016/s1470-2045(10)70012-7.
- Coppes MJ, Rackley R, Kay R. Primary testicular and paratesticular tumors of childhood. Med Pediatr Oncol 1994; 22 (5): 329–340. DOI: 10.1002/mpo.2950220506.
- Schneider DT, Calaminus G, Koch S, Teske C, Schmidt P, Haas RJ. Epidemiologic analysis of 1,442 children and adolescents registered in the German germ cell tumor protocols. Pediatr Blood Cancer 2004; 42 (2): 169–175. DOI: 10.1002/pbc.10321.
- Nerli RB, Ajay G, Shivangouda P, Pravin P, Reddy M, Pujar VC. Prepubertal testicular tumors: our 10 years experience. Indian J Cancer 2010; 47 (3): 292–295. DOI: 10.4103/0019-509x.64730.
- Woo LL, Ross JH. Partial orchiectomy vs. radical orchiectomy for pediatric testis tumors. Transl Androl Urol 2020; 9 (5): 2400–2407. DOI: 10.21037/tau-19-815.
- Jarvis H, Cost NG, Saltzman AF. Testicular tumors in the pediatric patient. Semin Pediatr Surg 2021; 30 (4). DOI: 10.1016/j.sempedsurg.2021.151079.
- Grady RW, Ross JH, Kay R. Epidemiological features of testicular teratoma in a prepubertal population. J Urol 1997; 158 (3 Pt 2): 1191–1192. DOI: 10.1097/00005392-199709000-00129.
- Ross JH, Rybicki L, Kay R. Clinical behavior and a contemporary management algorithm for prepubertal testis tumors: a summary of the Prepubertal Testis Tumor Registry. J Urol 2002; 168 (4 Pt 2): 8–9. DOI: 10.1097/00005392-200210020-00004.
- Saltzman AF, Cost NG. Adolescent and Young Adult Testicular Germ Cell Tumors: Special Considerations. Adv Urol 2018; 2018 (2375176). DOI: 10.1155/2018/2375176.
- Williamson D SR, B M-G, C A, F E, L U, T.M.. The World Health Organization 2016 classification of testicular germ cell tumours: a review and update from the International Society of Urological Pathology Testis Consultation Panel. Histopathology 2017; 70: 335–346. DOI: 10.1111/his.13102.
- Renedo DE, Trainer TD. Intratubular germ cell neoplasia (ITGCN) with p53 and PCNA expression and adjacent mature teratoma in an infant testis. An immunohistochemical and morphologic study with a review of the literature. Am J Surg Pathol 1994; 18 (9): 947–952. DOI: 10.1097/00000478-199409000-00010.
- Hawkins E, Heifetz SA, Giller R, Cushing B. The prepubertal testis (prenatal and postnatal): its relationship to intratubular germ cell neoplasia: a combined Pediatric Oncology Group and Childrenś Cancer Study Group. Hum Pathol 1997; 28 (4): 404–410. DOI: 10.1016/s0046-8177(97)90027-7.
- Agarwal PK, Palmer JS. Testicular and paratesticular neoplasms in prepubertal males. J Urol 2006; 176 (3): 875–881. DOI: 10.1016/j.juro.2006.04.021.
- Luckie TM, Danzig M, Zhou S, Wu H, Cost NG, Karaviti L. A Multicenter Retrospective Review of Pediatric Leydig Cell Tumor of the Testis. J Pediatr Hematol Oncol 2019; 41 (1): 74–76. DOI: 10.1097/mph.0000000000001124.
- Grogg JB, Schneider K, Bode PK, Kranzbuhler B, Eberli D, Sulser T. Risk factors and treatment outcomes of 239 patients with testicular granulosa cell tumors: a systematic review of published case series data. J Cancer Res Clin Oncol 2020; 146 (11): 2829–2841. DOI: 10.1007/s00432-020-03326-3.
- Talon I, Moog R, Kauffmann I, Grandadam S, Becmeur F. Sertoli cell tumor of the testis in children: reevaluation of a rarely encountered tumor. J Pediatr Hematol Oncol 2005; 27 (9): 491–494.
- Chung JM, Lee SD. Overview of pediatric testicular tumors in Korea. Korean J Urol 2014; 55 (12): 789–796. DOI: 10.4111/kju.2014.55.12.789.
- Ulbright TM, Young RH. Testicular and paratesticular tumors and tumor-like lesions in the first 2 decades. Semin Diagn Pathol 2014; 31 (5): 323–381. DOI: 10.1053/j.semdp.2014.07.003.
- Calabrese F, Danieli D, Valente M. Melanotic neuroectodermal tumor of the epididymis in infancy: case report and review of the literature. Urology 1995; 46 (3): 415–418. DOI: 10.1016/s0090-4295(99)80234-9.
- Pettersson A, Richiardi L, Nordenskjold A, Kaijser M, Akre O. Age at surgery for undescended testis and risk of testicular cancer. N Engl J Med 2007; 356 (18): 1835–1841. DOI: 10.1016/j.urolonc.2007.08.002.
- Schneuer FJ, Milne E, Jamieson SE, Pereira G, Hansen M, Barker A. Association between male genital anomalies and adult male reproductive disorders: a population-based data linkage study spanning more than 40 years. Lancet Child Adolesc Health 2018; 2 (10): 736–743. DOI: 10.1016/s2352-4642(18)30254-2.
- Wood HM, Elder JS. Cryptorchidism and testicular cancer: separating fact from fiction. J Urol 2009; 181 (2): 452–461. DOI: 10.1016/s0084-4071(09)79277-2.
- LAt H, NR B, C R, HS D, RJM N, J Q. The prognostic value of testicular microlithiasis as an incidental finding for the risk of testicular malignancy in children and the adult population: A systematic review. On Behalf of the EAU Pediatric Urology Guidelines Panel Epub Ahead of Print Journal of Pediatric Urology 2021. DOI: 10.1016/j.jpurol.2021.06.013.
- Thomas JC, Ross JH, Kay R. Stromal testis tumors in children: a report from the prepubertal testis tumor registry. J Urol 2001; 166 (6): 2338–2340. DOI: 10.1016/s0022-5347(05)65583-8.
- Friend J, Barker A, Khosa J, Samnakay N. Benign scrotal masses in children - some new lessons learned. J Pediatr Surg 2016; 51 (10): 1737–1742. DOI: 10.1016/j.jpedsurg.2016.07.016.
- Stein R, Quaedackers J, Bhat NR, Dogan HS, Nijman RJM, Rawashdeh YF. EAU-ESPU pediatric urology guidelines on testicular tumors in prepubertal boys. J Pediatr Urol 2021; 17 (4): 529–533. DOI: 10.1016/j.jpurol.2021.06.006.
- Wu JT, Book L, Sudar K. Serum alpha fetoprotein (AFP) levels in normal infants. Pediatr Res 1981; 15 (1): 50–52. DOI: 10.1203/00006450-198101000-00012.
- Haas RJ, Schmidt P, Gobel U, Harms D. Testicular germ cell tumors, an update. Results of the German cooperative studies 1982-1997. Klin Padiatr 1999; 211 (4): 300–304.
- A DB, GC M, R P, P H, FG H-C, JW O. Influence of tumor site and histology on long-term survival in 193 children with extracranial germ cell tumors. Eur J Pediatr Surg 2008; 18 (1): 1–6. DOI: 10.1055/s-2007-989399.
- Ulbright TM, Srigley JR. Dermoid cyst of the testis: a study of five postpubertal cases, including a pilomatrixoma-like variant, with evidence supporting its separate classification from mature testicular teratoma. Am J Surg Pathol 2001; 25 (6): 788–793.
- P GA, LM HF, M JG, C SF, D SA, S NL. \[Mature cystic teratoma of the testis (dermoid cyst. Case Report and Literature Review\] Arch Esp Urol 2009; 62 (9): 747–751.
- Grady RW. Current management of prepubertal yolk sac tumors of the testis. Urol Clin North Am 2000; 27 (3): 503–508. DOI: 10.1016/s0094-0143(05)70097-5.
- Grady RW, Ross JH, Kay R. Patterns of metastatic spread in prepubertal yolk sac tumor of the testis. J Urol 1995; 153 (4): 1259–1261. DOI: 10.1097/00005392-199504000-00068.
- Ye YL, Zheng FF, Chen D, Zhang J, Liu ZW, Qin ZK. Relapse in children with clinical stage I testicular yolk sac tumors after initial orchiectomy. Pediatr Surg Int 2019; 35 (3): 383–389. DOI: 10.1007/s00383-018-04426-5.
- Kao CS, Cornejo KM, Ulbright TM, Young RH. Juvenile granulosa cell tumors of the testis: a clinicopathologic study of 70 cases with emphasis on its wide morphologic spectrum. Am J Surg Pathol 2015; 39 (9): 1159–1169. DOI: 10.1016/j.juro.2016.07.011.
- Dursun F, Su Dur SM, Sahin C, Kirmizibekmez H, Karabulut MH, Yoruk A. A Rare Cause of Prepubertal Gynecomastia: Sertoli Cell Tumor. Case Rep Pediatr 2015; 2015 (439239). DOI: 10.1155/2015/439239.
- Gelas T, Margain Deslandes L, Mestrallet G, Pracros JP, Mouriquand P. Spontaneous regression of suspected cystic dysplasia of the rete testis in three neonates. J Pediatr Urol 2016; 12 (6): 1–4. DOI: 10.1016/j.jpurol.2016.05.032.
- Helman T, Epelman M, Ellsworth P. Cystic Dysplasia of the Rete Testis: Does Pathophysiology Guide Management? Urology 2020; 141: 150–153. DOI: 10.1016/j.urology.2020.03.026.
- Farci F, Teratoma SST. StatPearls. .
- Bois JI, Vagni RL, Badiola FI, Moldes JM, Losty PD, Lobos PA. Testis-sparing surgery for testicular tumors in children: a 20 year single center experience and systematic review of the literature. Pediatr Surg Int 2021; 37 (5): 607–616. DOI: 10.1007/s00383-020-04850-6.
- Vergouwe Y, Steyerberg EW, Eijkemans MJ, Albers P, Habbema JD. Predictors of occult metastasis in clinical stage I nonseminoma: a systematic review. J Clin Oncol 2003; 21 (22): 4092–4099. DOI: 10.1016/j.urolonc.2004.02.005.
- Shapiro E, Strother D. Pediatric genitourinary rhabdomyosarcoma. J Urol 1992; 148 (6): 1761–1768. DOI: 10.1016/s0022-5347(17)37023-4.
- Rogers TN, Seitz G, Fuchs J, Martelli H, Dasgupta R, Routh JC. Surgical management of paratesticular rhabdomyosarcoma: A consensus opinion from the Childrenś Oncology Group, European paediatric Soft tissue sarcoma Study Group, and the Cooperative Weichteilsarkom Studiengruppe. Pediatr Blood Cancer 2021; 68 (4). DOI: 10.1002/pbc.28938.
- Crist WM, Anderson M JR, JL F, C R, RB R, F.B.. Intergroup rhabdomyosarcoma study-IV: results for patients with nonmetastatic disease. J Clin Oncol 2001; 19 (12): 3091–3102. DOI: 10.1200/jco.2001.19.12.3091.
- Sanguesa C, Veiga D, Llavador M, Serrano A. Testicular tumours in children: an approach to diagnosis and management with pathologic correlation. Insights Imaging 2020; 11 (1). DOI: 10.1186/s13244-020-00867-6.
最近更新时间: 2025-09-22 08:00