24: 后尿道瓣膜与膀胱下梗阻
阅读本章大约需要 10 分钟。
引言
后尿道瓣膜(PUV)仍然是男性新生儿膀胱出口梗阻最常见的先天性原因。它是男性儿童发生终末期肾病(ESRD)的首要原因。1 目前绝大多数病例在产前即被怀疑,出生后转诊至专科中心。此外,对患有尿路感染的男童进行检查的阈值较低,因此通常能够及时确诊。患儿的肾功能障碍谱及其随后的功能结局差异很大。PUV及其后果(包括肾发育不良、上尿路扩张、膀胱输尿管返流、尿路感染和膀胱功能障碍)占英国儿科肾移植的25–30%(UK Transplant Registry)。
本章旨在提供关于后尿道瓣膜的最新概述,并介绍我们中心的管理方式。
胚胎学
关于后尿道瓣膜(PUV)起源有两种不同的理论。第一种理论认为,中肾管异常插入泌尿生殖窦,阻止这些导管的正常迁移及其在前方的融合。另一种理论则认为,瓣膜代表持续存在的泌尿生殖膜。2 对 PUV 的早期分型由 Hugh Hampton Young 于 1919 年提出,基于尸检解剖研究,将其分为 I-III 型。随后研究提示,致梗阻的后尿道膜在外观上更为一致;Dewan 等人对未行器械操作的尿道所作的前瞻性评估在所有研究病例中均发现了相似的外观。3 他们的内镜评估显示,该膜在后方附着,紧邻精阜远侧。该膜向前并呈斜行越过外括约肌延伸,其内在精阜水平处有一个大小可变的开口,他们将这种情况描述为先天性致梗阻性后尿道膜(COPUM)。
发病率与遗传学方面
PUV的常见报告发生率为每5000例活产中1例,其中50%在10年内进展为ESRD。4 该发生率存在一定差异:在澳大利亚为1:7800,在英国和爱尔兰为每3800例中1例。5,6 对该异常的遗传学基础以及潜在的环境或母体因素的认识仍在不断发展。Chiraramonte等提出11号染色体短臂具有特定作用。7 约40%的这些男孩会出现相关畸形,主要涉及心血管系统、胃肠道系统以及其他泌尿系统疾病,如尿道下裂、小/巨阴茎和前尿道瓣膜。8,9,10 有报道称患有PUV瓣膜的男孩可见外耳道缺如、双侧肾上腺缺如。
产前诊断
随着产前异常筛查的应用和敏感度提高,产前被诊断的PUV病例数增加。在英国,对孕妇至少进行两次超声检查。第一次是在妊娠约10–12周进行的孕周测定扫描。第二次是在妊娠约20周进行的更为详细的畸形筛查扫描。大约有一半至三分之二的PUV男胎会在产前被怀疑。可疑病例的产前超声所见可包括膀胱壁增厚、膀胱和后尿道扩张所致的’钥匙孔征’、单侧或双侧输尿管肾积水、高回声肾脏以及羊水过少。鉴别诊断包括梅干腹综合征、尿道闭锁、双侧膀胱输尿管返流,以及较少见的巨膀胱-小结肠-肠蠕动低下综合征。最近的BAPS CASS全国审计在产前识别出35%的PUV病例,约40%在生命第一年内识别。6 该审计还显示,诊断时机与肾功能损害风险增加之间存在统计学显著关系。
产前干预
针对后尿道瓣膜的产前干预包括膀胱穿刺抽吸、置入膀胱-羊膜腔分流管以及胎儿内镜下瓣膜消融术。其依据在于,早期对胎儿泌尿道进行减压可在保留肾功能的同时提高存活率,并减少与重度羊水过少相关的呼吸功能受损和肢体异常。然而,正常的羊水量并不能保证出生后的肾功能良好。北美胎儿治疗网络对32例连续妊娠、存在LUTO且中孕期羊水量正常的结局进行了研究。11 围产期存活率为97%。根据单变量分析,在出现羊水过少和/或无羊水、肾皮质囊肿、PUV、早产以及新生儿重症监护病房住院时间延长等情况下,需要进行肾脏替代治疗。多变量分析显示,RRT的唯一预测因素是早产。
从历史上看,Johnson 于 1994 年提出的算法已被用于选择进行产前干预的胎儿。12 其标准包括:在不存在其他会不利影响预后的胎儿异常的情况下,正常的男性核型,以及母体少羊水/无羊水或羊水量减少。 可能从干预中获益。近年来,Ruano 等提出了一个基于阻塞 4 个阶段的患者选择模型。 对于 III-IV 期,不建议进行胎儿干预。13
表 1 Ruano分期系统
| 胎儿超声检查 | 胎儿生化检查 18-30 周 | 可能的治疗 | |
|---|---|---|---|
| 第1期 | AFI正常 无肾囊肿或发育不良 | 序贯采样后结果良好 | 每周超声监测 |
| 第2期 | 羊水过少 重度双侧肾积水 无肾囊肿或发育不良 | 最多3次序贯采样后结果良好 | 膀胱镜检查或膀胱-羊膜腔分流术 |
| 第3期 | 无羊水或羊水过少 肾脏高回声 肾囊肿和/或发育不良 | 序贯采样后结果不佳 | VAS,可能联合羊水灌注 |
| 第4期 | 监测膀胱充盈速率后出现无羊水和无尿。肾发育不良及肾脏高回声 | 生化指标不利,且在监测再次充盈后证实无尿 | 羊水灌注 |
有利的生化指标:钠 <100 mEq/L,氯 <90 mEq/L,渗透压 <200 mOsm/L,以及 β2-微球蛋白 <6 mg/L。
一项近期关于 LUTO 产前干预的 10 篇文章的系统综述和荟萃分析纳入了 355 例胎儿,证实与保守组相比,VAS 组的总体存活率更高。14 在 VAS 组中有略多于一半(57%)存活,高于对照组。五项研究显示,与保守组相比,VAS 组的出生后肾功能更好。两项涉及 45 例接受胎儿膀胱镜的胎儿的研究表明,与保守治疗组相比,膀胱镜组的围产期存活率更高。在 6 个月随访时,膀胱镜组有 13/34 例胎儿肾功能正常,而保守治疗组为 12/61。
更近期,曾尝试通过对疑似膀胱流出道梗阻实施产前干预(膀胱-羊水分流)来回答其是否有益的问题。PLUTO 试验被设立为一项泛欧洲的多中心试验。15 进入该试验的依据是不确定性原则。在对干预获益存在疑问时,患者被随机分配至膀胱-羊水分流或不治疗组。结局指标包括出生后死亡率、1 岁时以血清肌酐评估的肾功能,以及与该操作相关的任何发病或并发症。该试验运行了 5 年,但未能招募到所需数量的患者,现已关闭。不幸的是,由于入组患者数量较少,未能明确产前干预在疑似膀胱流出道梗阻的治疗中是否具有显著获益。
新生儿期管理
对于那些在产前怀疑存在 PUV、且对羊水量无顾虑的新生儿,分娩可以在非小儿泌尿专科中心进行。首要任务是使用规格为 6/8 Fr 的不带囊尿道导管引流膀胱。必须开始抗生素预防,例如:甲氧苄啶 2 mg/kg。不带囊的导管比带囊的导管更安全,尤其是在缺乏经验的操作者手中。将球囊充盈于后尿道而非膀胱内,可能导致尿道损伤。
对于无法经尿道置管的新生儿,通常是由于无法获得6 Fr导尿管或膀胱颈位置过高致使导尿无法成功,此时需要置入耻骨上导尿管。在成功引流膀胱后,应密切关注尿量和电解质检测结果,因为这些患儿可能出现梗阻解除后利尿,导致钠、钾和碳酸氢根水平异常。应每日监测肌酐,直至达到肌酐最低值。对于存在显著肾功能障碍和电解质紊乱的患者,应尽早邀请肾脏科同事参与,以优化肾功能和内环境稳态。
对于出生时有羊水过少病史并伴显著肺发育不良的男婴,处理的首要任务是呼吸支持和膀胱引流。等待体内稳态和呼吸稳定期间,置入尿道导尿管或耻骨上导尿管均足以优化尿路引流。
在产前未被怀疑存在后尿道瓣膜(PUV)的新生儿和婴儿,可能表现为尿源性脓毒症、梗阻性排尿症状、膀胱胀大或肾脏可触及,其处理原则相同。虽然尿流细弱提示膀胱出口梗阻,但观察到尿流正常并不能排除该诊断。
在新生儿期确认诊断
一旦新生儿病情稳定后,必须确认诊断。肾脏超声检查(USS)可提供肾实质的大小和质量、肾盂输尿管积水的程度以及对膀胱壁厚度的评估等信息。还可显示扩张的后尿道。
排尿性膀胱尿道造影(MCUG)可明确诊断,且必须包括拔除导尿管后的影像,以显示后尿道的管腔直径(图 1)。为降低感染和泌尿源性脓毒症的风险,应给予患儿为期 3 天的预防性抗生素治疗。
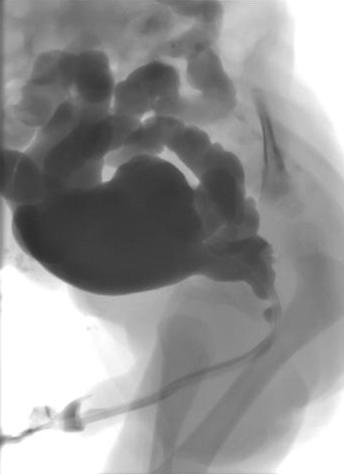
图 1 MCUG 显示后尿道扩张、膀胱轮廓不规则及双侧膀胱输尿管返流。
从MCUG可获得的其他信息包括膀胱大小、因壁增厚、小梁形成及憩室形成所致的膀胱不规则、膀胱输尿管返流(VUR)以及膀胱颈的形态。约有50%的合并后尿道瓣膜(PUV)的新生儿存在VUR。若VUR为高级别且为单侧,可能存在“pop-off”,使由尿道梗阻产生的反压得到选择性缓解。
Hoover 和 Duckett 描述的 VURD(瓣膜-单侧返流-发育不良)综合征导致返流侧的肾功能极差或无功能,而对侧(无返流侧)的肾功能相对得以保留。16 这些作者还提出,这种 ‘pop-off’ 机制由于对侧肾受到保护并保持正常,可使长期肾功能保持正常。随后,这一假设被 Cuckow 等人所质疑;他们通过血清肌酐和 GFR 测量显示,在 VURD 病例中肾功能受损,提示 ‘pop-off’ 机制所提供的保护并不完全。17
原发瓣膜切除术
PUV 的首选手术是在婴儿从医学角度病情稳定后进行的原发瓣膜消融术。麻醉诱导时给予一剂静脉抗生素,例如阿莫西林/克拉维酸 30mg/kg。将婴儿置于截石位,使用0° 6/8 Fr 新生儿膀胱镜行诊断性膀胱镜检查。应仔细检查后尿道并记录瓣膜形态。还应记录膀胱颈的构型以及膀胱和输尿管开口的外观。将11 Fr 电切镜与冷刀/镰刀刀片或 Bugbee 电极组装,通常在5、7 和12 点位行瓣膜切开(图 2)
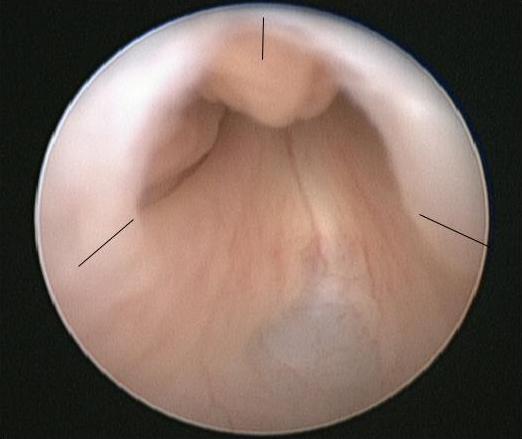
图2 PUV的内镜视图,其中已标记瓣膜切开位点。
在术毕置入导尿管,并于24–48小时后拔除。应在拔除导尿管后复查血清肌酐,并通过称重尿布来记录尿量。预防性抗生素和肾脏补充治疗应持续进行,直至进一步评估。
原发性瓣膜消融术的并发症包括出血、瓣膜切除不全、尿道狭窄,或对外尿道括约肌的无意损伤。技术的选择取决于可用器械、新生儿尿道的管腔口径,以及婴儿的体格大小和成熟度。
对于早产儿或体重很轻的新生儿,由于尿道管径很小带来的困难,以及使用相对较大器械可能出现的并发症,内镜切除术应予以推迟。这些患儿可先通过置入尿道导尿管或耻骨上导尿管进行处理,直至其体格足以接受该手术。作为大致参考,当体重达到2.5 kg时,通常可使用标准内镜器械安全且准确地进行PUV切除术。
对于一些体型较小的新生儿,尿道导尿管或耻骨上导尿管可能反复出现脱落、阻塞、移位或引流不充分的情况,在这种情况下,为确保充分且持续的膀胱引流,建立膀胱造口可能被视为最安全的选择。
我们建议所有男孩在初次手术后3个月内进行复查膀胱镜检查,以确保瓣膜消融的彻底性。这是因为重复MCUG在诊断残余瓣叶方面与膀胱镜对需进一步切除的残余瓣叶的评估之间相关性较差;阳性预测值为56%。18 然而,一些中心会选择在此阶段进行一次重复MCUG,只有当MCUG提示持续性尿道梗阻时才进行膀胱镜检查。直接进行复查膀胱镜的另一优势是,可同时行包皮环切术;已证明在患有后尿道瓣膜的男孩中可将尿路感染发生率至少降低83%。19 这一点已被近期多中心随机对照试验CIRCUP证实。在91名男孩的研究人群中,发热性尿路感染的发生概率在抗生素组为20%,而在包皮环切+抗生素组为3%。20
较大儿童的临床表现、诊断与管理
一小部分患有后尿道瓣膜(PUV)的患儿并非在新生儿期或婴儿期发病,而是在儿童期或青春期早期因日间遗尿、尿滴沥或尿流无力、感染,或较少见的血尿等症状而就诊。详尽的排尿史可提示诊断,无创检查(如尿流率和排尿后残余尿量测定)也可指向异常。对较大儿童进行尿道导尿属于有创操作且困难较多;因此,我们倾向于省略MCUG,而直接进行诊断性膀胱镜检查,若确诊,则行原发瓣膜消融术。成功完成且彻底的瓣膜消融术后,随访按下文所述进行;对于较晚就诊者,更需高度怀疑其存在持续性膀胱功能障碍。
随访
每个机构对患有后尿道瓣膜的儿童都会有各自独特的随访方案。然而,随访的目标是:
- 优化肾功能
- 将尿路感染和肾瘢痕降至最低
- 评估与管理排尿功能障碍,以实现完全控尿为目标
- 向青少年及成人医疗服务的过渡
儿科肾脏科的参与对于优化结局并确保这些儿童得到恰当的医疗管理至关重要。
表 2 英国大奥蒙德街医院采用的 PUV 患者随访方案示例。FBC=全血细胞计数,GFR=肾小球滤过率,US=肾脏及泌尿道超声,MCUG=排尿性膀胱尿道造影,MSU=中段尿标本(包含蛋白尿检测),BFA=膀胱功能评估。按年龄定义:婴儿期使用尿布报警器和排尿后残余尿量测量;较大儿童使用频率-容量图、尿流率检查和排尿后残余尿量测量,SPC=耻骨上导尿管。
| 肌酐与电解质 | FBC | 校正 GFR | 超声 | MCUG | MAG3 | 膀胱镜/瓣膜消融 | MSU | BFA | 经 SPC 的视频尿动力学 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 出生 | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| 3 个月 | ✓ | ✓ | ✓ | ✓ | +/- 包皮环切术 | ✓ | ||||
| 1 年 | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 2 年 | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 3 年 | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 4 年 | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 5 年 | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | |||
| 6 年 | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 7 年 | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| 8 年 | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 9 年 | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| 10 年 | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | |||
| 11-14 岁 每年 | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| >15 岁 | ✓ | ✓ | ✓ | ✓ | +/- | ✓ | ✓ | 青少年专科转诊 |
早期尿路改道
有一小部分男孩,对上述标准措施未能达到预期效果,且其肾功能仍然脆弱或进一步恶化,或出现反复尿路感染,或上尿路影像表现明显恶化,或在系列随访超声检查中提示膀胱排空不全。对这些患儿的目标是最大限度发挥其肾功能潜能,并延迟或避免肾脏替代治疗。早期尿流改道,可采用膀胱造口术、双侧输尿管造口术或肾盂造口术,旨在保护上尿路并尽量降低感染风险。
Chua 等人对40名接受单纯瓣膜消融术或消融术 + 膀胱造口术/ 膀胱上尿路转流的男孩进行了回顾性分析。他们指出,对于患有与后尿道瓣膜相关的3期慢性肾脏病的儿童,在瓣膜消融术后进行尿路转流,可能会暂时延缓其向终末期肾病的进展。因此,这可能并不提供任何长期获益,更像是一种权宜性措施。21 这重申了Tietjen 和 Lopez-Pereira 等人先前工作的发现。22,23
将返流性输尿管造口作为一种尿流改道的理念显示出一定前景。这是一种精巧的技术,既可使膀胱的充盈-排空循环得以继续,又能同时消散此年龄段瓣膜膀胱中存在的高储尿与高排尿压力。其首要条件是存在一条可自由返流的输尿管,手术通过低位腹股沟皮纹切口进行。在后腹膜腔内,于膀胱外辨认并游离输尿管。随后建立袢式返流性输尿管造口,尿液将引流入尿布。与端式输尿管造口不同,其逆转相对容易。一旦该术式达到目的或不再发生返流,仅需关闭造口,并将输尿管还纳至后腹膜腔。返流性输尿管造口对肾功能脆弱的男婴尤为有用,因为它可最大程度减少瓣膜消融术后早期高压膀胱的潜在不利影响。这对这些新生儿的管理至关重要,因为婴儿期的肾脏替代治疗极其不稳定且难以维持。
人们一直有合理的担忧,即绕过膀胱或使膀胱持续保持空虚可能会对未来的膀胱功能产生不利影响。此外,尚缺乏令人信服的证据表明尿路改道能够改善长期肾功能。
在比较原发性瓣膜消融与原发性膀胱造口时,Godbole 等人发现两组在1岁时的血清肌酐和肾小球滤过率(GFR)无显著差异。24 以膀胱造口作为初始手术的组,分流的中位时间为18个月;其后接受尿动力学检查的7名男孩显示膀胱容量正常。Jaureguizar 等人将接受膀胱上分流治疗的男孩与仅行原发性瓣膜消融的男孩的膀胱功能结局进行了比较。25 膀胱上分流持续的平均时间为13个月,且全部在生后前2个月内进行分流。他们在9–10岁时进行了有创尿动力学检查,发现两组中正常、低顺应性、不稳定和失代偿膀胱的比例非常相近。
与接受高袢和低袢输尿管造口术管理的11名男孩相比,接受原发性瓣膜消融治疗的8名患者显示出更有利的膀胱结局、膀胱容量的改善、在预期膀胱容量时更低的逼尿肌充盈末期压力,以及较少发生的逼尿肌不稳定性。26 在这些男孩中进行尿动力学检查时的最低平均年龄为11岁,分流的持续时间平均为57个月。
因此,早期尿路分流在对患有PUV的男孩的管理中的作用有限。它有可能在短期内改善肾功能,这对于肾功能脆弱的男孩非常重要,并且可以将肾脏替代治疗推迟至更晚阶段。目前没有令人信服的证据支持其作为改善长期肾功能的手段,其对长期膀胱功能的影响尚无定论。因此,尿路分流必须在经过选择的病例中并以明确的目标和终点为前提来考虑,并且在患有PUV的男孩的管理中具有一定作用。
长期结局:上尿路
妊娠8-9周开始产生尿液,第一孕期结束时集合系统已形成。此后不久,在产前超声上即可见到胎儿膀胱。膀胱出口梗阻的存在会将升高的腔内压力传递至正在发育的肾实质,一旦达到临界水平,便会在肾内引发细胞凋亡、异常的细胞分化以及肾小球改变。这些早期改变决定了日后肾功能的潜力。在梗阻较轻或在妊娠后期才显现的情况下,梗阻的影响更偏重于膀胱,而对肾脏的影响多局限于集合系统扩张,对正常肾发生的干扰最小。另一种或许是补充性的理论,用以解释与后尿道瓣膜相关的肾发育不良,认为其与输尿管芽的位置异常及其植入后肾胚芽有关。27 因此,肾功能障碍似乎是不同程度的固有发育不良与膀胱出口梗阻影响共同作用的结果。在出生后,这些影响还可因泌尿道感染、VUR和膀胱功能障碍而进一步加重
当肾单位显著丧失时,通过入球小动脉的血管扩张,现存的功能性肾单位发生过度滤过。由此导致的肾小球毛细血管高压使肾功能可暂时维持在正常水平。随着时间推移,该代偿机制逐渐失代偿,继而出现肾小球硬化,并出现蛋白尿、高血压及肾小球滤过率下降。远端肾单位的损伤削弱肾脏的浓缩能力,导致多尿和多饮(肾性尿崩症),这可使膀胱功能恶化,从而进一步危及上尿路功能。
Parkhouse 等人的论文经常被引用,描述了在产前诊断时代之前、于1966-1975年间就诊并被诊断为后尿道瓣膜的98名男孩的长期转归。28 本研究的随访期为11至22年。该队列中有66%在生后第一年即就诊,且一半的患者接受了原发性瓣膜切除治疗,其余患者则行分流术。32%(31例)出现了’不良的长期肾脏结局;’ 随访期间,10例患者死于急性肾功能衰竭,15例进展为终末期肾病,6例出现了确立的慢性肾功能损害。年龄小于1岁时就诊(p<0.05)、存在双侧膀胱输尿管返流(p<0.0010)、初次出院时血浆尿素 >10 mmol/升,以及在5岁时存在蛋白尿(p<0.001)和持续性尿失禁,均与不良肾脏结局相关。
更近年的系列研究报告了相似的结果。Kousidis 等人报道了1984–1996年间产前及产后确诊的后尿道瓣膜患者病例系列,共42例。29 随访期为10-23年。共有3例(7%)死亡(其中2例发生于新生儿期,另1例在移植失败后于3岁时死亡),11例(26%)进展为终末期肾衰竭,其中1例直到青少年晚期才发生。
在一组于1987–2004年就诊并进行了较短时间随访(范围1–14.3年;中位随访6.8年)的65例后尿道瓣膜(PUV)患儿中,Sarhan 等人发现总体肾功能损害率为17%,其中9%进展至终末期肾病(ESRD)。30 诊断时妊娠周龄较早(<24周;p=0.003)以及产前羊水过少或无羊水(p=0.02)与预后不良相关。该组无死亡,但在同一研究期间,有14例产前确诊的胎儿终止了妊娠。所有病例均进行了胎尿分析,尸检结果证实存在严重的肾脏组织学改变。这提示,在将终止妊娠的胎儿考虑在内时,肾衰竭的总体发生率与上述其他研究相似。
DeFoor 的一个由 119 例 PUV 患者组成、随访时长相近的更大队列(范围 3–24 年;平均随访 7.2 年),发现有 13% 的患者在中位年龄 8.2 岁(范围 7 天–17.5 年)时已发展为终末期肾衰竭。31 在该研究中,膀胱功能障碍,需要进行清洁间歇性导尿和/或使用抗胆碱能药物,与 ESRD 风险增加相关。最低血清肌酐值 > 1.0 mg/dl 也与 ESRD 风险增加相关(OR 71,CI 10–482),并且这一点已在多项既往和后续研究中得到证实,其中 1 岁时血清肌酐 <1.0 mg/dl 预示着良好的长期肾脏结局。
Heikkila 等人对更大规模的后尿道瓣膜患者队列(n=193)进行了评估,随访时间更长(范围6–69年;中位随访31年)。32 进展至终末期肾衰竭的比例为22.8%,其中68%在17岁之前发展为ESRF,其余在17岁之后。在肾发育不良儿童中,青春期前后出现肾功能恶化是公认的现象,其可能的解释是肾脏为应对生长、体质量增加和血压升高而发生的内部改变。33 然而,该论文所强调的青春期后的肾功能晚期恶化提示有必要将这类患者的随访延续至成年期乃至更久。
Pereira 等人在其 77 例 PUV 病例的系列中,这些病例在 < 6 个月大时被诊断并平均随访 11.7 年,发现 27 例(35.1%)有 CRF,其中 14 例处于 ESRD。对于这 27 名处于 CRF 的男孩,其中 22 名在生命的前三年进展为 CRF:其中 4 名在 15-16 岁之间,1 名在 20 岁时。34
终末期肾病(ESRD)的发生仍难以预测。蛋白尿可提示肾功能开始恶化,必须监测。多尿可增加排尿后残余尿量,导致进行性尿路病变,并使肾髓质的浓缩能力下降,进一步加重多尿,形成恶性循环。良好的膀胱排空至关重要;在极端情况下,夜间膀胱引流可延缓肾功能恶化,并可改善多尿患者的睡眠。35
膀胱输尿管反流
在初次就诊时,约有50%的患者在首次MCUG检查中发现膀胱输尿管返流(VUR)。一般认为这源于膀胱出口梗阻及合并的膀胱功能障碍。约15%的患者会出现单侧高级别VUR,并伴同侧肾无功能。瓣膜消融术后,25-50%的病例中VUR的严重程度可能降低或完全消失,这种改善在新生儿期或婴儿期就诊者中更为常见。成功的瓣膜消融术后仍持续存在的VUR,尤其是高级别且双侧者,与肾脏长期预后不良相关,并且是Parkhouse等人所识别的不良预后指标之一。28 目前不再倾向于对患有PUV的男孩实施抗返流手术,因为这种方法的失败率较高。对于返流分级较高且同侧肾功能不佳的病例,可在切除无功能肾的同时,利用宽大的输尿管进行膀胱扩容。其他创新策略包括如前所述建立返流型输尿管造口;另外,偶尔也将远端输尿管用作Mitrofanoff通道,可伴或不伴抗返流处理。持续的高级别返流是复发性尿路感染的潜在危险因素,并可能对移植肾产生不利影响,因此通常在肾移植前予以手术治疗。
在一项近期的RCT中,Abdelhalim 等人观察到,在瓣膜消融术后联合使用奥昔布宁时,返流有所改善。奥昔布宁组有24例患者,对照组25例。奥昔布宁组的肾脏单位更可能出现肾积水改善(61.9% vs 34.8%,p=0.011)和膀胱输尿管返流的消失(62.5% vs 25%,p=0.023)。36
肾输尿管积水
大多数因后尿道瓣膜就诊的新生儿会表现为双侧输尿管肾盂积水。初次导尿后常可见此情况改善,但也可能因功能性梗阻而一过性加重:导尿减压后增厚的膀胱壁塌陷,在VUJ水平夹闭输尿管口。识别这一现象很重要;偶尔可出现持续24-48小时的无尿。该梗阻通常在48-72小时内自行解除,随后常出现梗阻后多尿。需保持冷静,避免因急于处理而尝试通过内置JJ支架或建立肾造口来为上尿路减压。进行初次瓣膜消融术后,应预期上尿路扩张程度将逐步改善,甚至完全消退。37 这种改善受持续存在的VUR、膀胱功能障碍、多尿和异常的输尿管蠕动所影响,评估瓣膜消融术后结局时必须将这些因素纳入考量。随着对膀胱出口梗阻病理生理学认识的提高,人们越来越认识到膀胱及其相关功能障碍以及肾小管功能障碍所致多尿在其中的作用;因此,在PUV病例中,当输尿管肾盂积水加重时,已不再进行有或无锥形成形的输尿管再植术。
远期结局:下尿路
关于后尿道瓣膜患者膀胱功能的潜在病因仍存在广泛争议。被认为涉及病因的两个主要机制是:异常的膀胱源于宫内对尿液外流梗阻所做出的改变;和/或膀胱功能障碍是尿路分流的结果。对于第二种理论尚无定论,因为目前多数病例并未行分流,尽管膀胱功能障碍的发生率仍然很高。Godbole 等人已表明,分流未必对膀胱功能结局有害,甚至可能加以改善。24
组织学上,胎儿动物模型中的梗阻性膀胱显示平滑肌量增加、毒蕈碱受体数量增加以及胶原沉积增多。但更近期的研究提示纤维化增加参与膀胱功能障碍的发病机制。38 本章作者之一的一篇论文指出,在高张性的PUV膀胱中,平滑肌被纤维化所取代是导致收缩功能障碍的一个主要促成因素。这为探索抗纤维化药物在恢复正常收缩性方面的潜力开辟了研究途径。39
研究人员还表明,解除梗阻后,其中一些改变具有可逆性,尽管恢复可能是部分性的,具体取决于解除的时机以及已发生的不可逆损伤的程度。产前诊断所带来的早期发现使得能够及时治疗,因此,合理地预期当前这群在产前被怀疑存在膀胱排出道梗阻的男孩的膀胱功能预后将有所改善。
“‘瓣膜膀胱综合征’”这一术语在20世纪80年代被提出,用以概括许多已接受治疗的后尿道瓣膜男孩中所见的异常排尿模式与排尿功能障碍的症状、持续性的膀胱壁增厚、膀胱排空不全以及相关的上尿路扩张。Peters 等人在一组主要因持续性尿失禁和‘瓣膜膀胱综合征’而接受评估的41名男孩中,通过有创检查发现了三种主要的尿动力学模式;分别为过度活动膀胱、顺应性差的膀胱或无收缩膀胱,且这些模式之间存在一定的重叠。40
在过去30年间,临床医师开始认识并理解膀胱功能障碍的重要性,以及其对患有后尿道瓣膜的男童在尿控与肾功能结局方面的影响。查阅该主题的文献时,可以看到在尿动力学检查技术、不同模式的分类以及检查时机方面存在显著差异。
Holmdahl 等人随访了15岁以下患有 PUV 的12名男孩。在5岁时,2/3 的患者在尿动力学充盈期观察到不稳定性,但到青春期时这种情况有所减少。41 5岁时膀胱容量看似正常,但青春期后容量被证实约为预期容量的两倍。尿动力学模式随时间发生改变,随着年龄增长,不稳定性减少,转而呈现为过度扩张型。De Gennaro 等人也显示了这种膀胱行为的改变,在其研究的48名10个月-15岁患者中有71%出现尿动力学异常。42 在年龄组 <8 岁中,44% 为高收缩性、31% 为低收缩性膀胱;而 >8 岁患者则表现为 28 % 高收缩性和 50% 低收缩性尿动力学模式。Misseri 等人在对51名男孩的回顾性研究中显示肌源性衰竭的发生率较低(5.9%)(指无收缩或无法产生足以完成充分排空的持续性逼尿肌收缩),并得出结论认为其队列病例中的逼尿肌衰竭是由于合并的抗胆碱能治疗所致。43
膀胱功能障碍是决定长期肾功能结局的关键,正如 Parkhouse 等人的长期随访研究所示,其中在5年时有44%的患者存在尿失禁,定义为白天不能保持干燥,这与该组中46%出现不良肾脏结局相关(p<0.001)。20,24 在 Ansari 的227名后尿道瓣膜男童中,显示总体有30%的发生慢性肾病风险,其中10%进展为终末期肾衰竭。1 严重的膀胱功能障碍,定义为顺应性低且充盈末期压力 >40 cm H20,或排尿后残余尿量 >30%,或逼尿肌低活动,或需要进行CIC,在进展至ESRD的患者中更为常见(p<0.0001)。Mazen 对116例PUV患者的研究,平均随访10.3年(范围18个月–22年),发现42%的患者已出现ESRF或已接受移植。在总体患者群体中,有80%存在尿动力学异常,且膀胱不稳定和顺应性差与较差的肾功能结局相关(p=0.04)。44
在产前接受治疗的PUV队列中,关于膀胱功能障碍的相关数据较为匮乏。Abbo等比较了38例产前诊断和31例产后诊断的PUV男孩的结局,随访7.2年时,排尿功能障碍的发生率无显著差异(27% vs. 31%)。45
膀胱功能在青春期期间持续演变,且有效的膀胱管理必须延续至成年期。前列腺的生长会改变膀胱排出动力学,而幼年期所见的膀胱动力学变化模式在青春期仍持续改变,其中以膀胱容量增大和排尿后残余尿量较大最为常见。部分年轻男性可能需要开始进行清洁间歇导尿,以应对这种膀胱功能的不可逆性恶化。
肾移植
随着相当数量患有PUV的男孩进展至终末期肾衰竭,作为移植前评估的一部分,全面的膀胱评估的重要性怎么强调都不为过。高压、顺应性差、低容量的膀胱可能使移植肾处于风险之中,从而使移植物丢失成为切实可能。在过去的20年中,PUV人群的5年移植物存活率已从20世纪80年代的40%提高到90年代的70%,到2000年代接近90%。46
对于那些需要通过手术干预以获得被认为对移植而言’安全’的膀胱储器的患者,关于该手术应在移植前还是移植后进行,存在分歧意见。在肾移植前行膀胱扩大术(可伴或不伴可导尿通道),可使术后愈合不受免疫抑制影响,但存在’干性膀胱成形’的风险;尤其在无或极少自身尿生成时,必须通过膀胱周期性充盈-排空训练和冲洗来处理。此策略的另一风险是,该大型手术可能使脆弱的肾功能恶化,并在预先移植情境下加速对肾脏替代治疗和临时透析的需求。在移植前已行膀胱扩大时,任何后续操作(包括移植本身)都不得损伤通向扩大部位的血管蒂,尤其当两次手术间隔较短时,更应格外谨慎以确保重建膀胱的安全性。对于在肾移植后实施膀胱扩大成形的患者,关键在于免疫抑制方案已趋于稳定,且肾功能改善带来明显优势。在这种情况下,移植输尿管可再植入原有膀胱,或改行皮肤输尿管造口。Jesus 和 Pippi Salle 在回顾现有文献后得出结论,扩大术会增加移植后的泌尿道感染(UTI)风险。47 他们一致认为,预先进行扩大术仅应限于精心选择的病例,即当与膀胱压力升高相关的风险超过因扩大术及UTI带来的风险时才考虑。鉴于相当数量的后尿道瓣膜(PUV)男孩将发生肌源性衰竭,只要在密切监测之下,扩大术可以推迟实施。在后尿道瓣膜及肾移植的情境下,移植后持续监测膀胱功能至关重要。Riley 等对在下尿路功能障碍与肾移植背景下的膀胱管理不同策略进行了全面综述。48
生育能力
针对既往有后尿道瓣膜病史男性的生育力和生育结局的研究很少。持续存在的后尿道扩张、精阜周围组织损伤,或既往手术导致的继发性尿道狭窄,均会影响射精功能。勃起功能障碍在慢性肾病患者及接受透析者中更为常见。Woodhouse 研究的9名有PUV病史的患者,其精液分析被认为在正常范围内;而在向 Lopez Pereira 提交精液进行分析的6名男性中,有2名患者出现精子形态异常或不动精子比例偏高。49,50
进一步研究方向
后尿道瓣膜的管理为探索用于预测结局和生存的新策略提供了广阔空间。Kwong 等人近期开发了一种机器学习工具,用于预测具有临床相关性的结局。该工具显示出一定的前景,值得进一步验证。51
要点
- 后尿道瓣膜仍是男性新生儿膀胱出口梗阻最常见的病因。
- 越来越多的病例在产前即被诊断,但产前干预似乎并不能改善肾功能的长期结局。
- 首选推荐的治疗是瓣膜消融,尿路分流仅保留用于特定个案。
- 相当一部分患有PUV的男孩将发展为慢性肾脏病并进展至终末期肾衰竭。
- 结构化随访旨在预防上尿路恶化、预防尿路感染、最大程度促进生长,并在PUV患者的移植前后均对膀胱功能障碍进行监测。
参考文献
- Ansari MS. Risk factors for progression to end-stage renal disease in children with posterior urethral valves. Journal of Pediatric Urology 6 (ue 3): 261–264. DOI: 10.1590/s1677-55382011000200030.
- Krishnan A, Souza A, Konijeti R, Baskin LS. The anatomy and embryology of posterior urethral valves. J Urol 2006; Apr;175(4):1214-20. DOI: 10.1016/s0022-5347(05)00642-7.
- Dewan PA, Zappala SM, Ransley PG, Duffy PG. Endoscopic reappraisal of the morphology of congenital obstruction of the posterior urethra. J Urol 1992; 70: 439–444. DOI: 10.1111/j.1464-410x.1992.tb15805.x.
- Casella DP, Tomaszewski JJ, Ost MC. Posterior urethral valves: renal failure and prenatal treatment. Int J Nephrol 2012; 2012 (351067). DOI: 10.1155/2012/351067.
- Thakkar D, Deshpande AV, Kennedy SE. Epidemiology and demography of recently diagnosed cases of posterior urethral valves. Pediatr Res 2014; Dec;76(6):560-3. DOI: 10.1038/pr.2014.134.
- Brownlee E, Wragg R, Robb A, Chandran H, Knight M, L. MC, et al.. Current epidemiology and antenatal presentation of posterior urethral valves: Outcome of BAPS CASS National Audit. J Pediatr Surg 2019; Feb;54(2):318-321. DOI: 10.1016/j.jpedsurg.2018.10.091.
- Chiaramonte C, Bommarito D, Zambaiti E, Antona V, Li Voti G. Genetic Basis of Posterior Urethral Valves Inheritance. Urology 2016. DOI: 10.1016/j.urology.2016.05.043.
- A. HS, D. RP, H. PD, L. M-JM, obstruction CWHP. Prenatal sonographic findings and clinical outcome in fourteen cases. Journal of Ultrasound in Medicine 1988; 7 (7). DOI: 10.7863/jum.1988.7.7.371.
- J. C, R M. A case of hypospadias, anterior and posterior urethral valves. Journal of Surgical Case Reports 2013; 2013 (2). DOI: 10.1093/jscr/rjt003.
- L. RK, B. E, P M. Anterior and posterior urethral valves: a rare association. Journal of Pediatric Surgery 2003; 38 (7). DOI: 10.1016/s0022-3468(03)00218-5.
- Johnson MP, Danzer E, Koh J, Polzin W, Harman C, O’Shaughnessy R. Natural history of fetal lower urinary tract obstruction with normal amniotic fluid volume at initial diagnosis. Fetal Diagn Ther 2018; 44 (1): 10–17. DOI: 10.1159/000478011.
- Johnson MP, Bukowski TP, Reitleman C, Isada NB, Pryde PG, Evans MI. In utero surgical treatment of fetal obstructive uropathy: a new comprehensive approach to identify appropriate candidates for vesicoamniotic shunt therapy. Am J Obs Gynecol 1994; 170 (6): 1770–1779. DOI: 10.1016/s0002-9378(12)91847-5.
- Ruano R, Dunn T, Braun MC, Angelo JR, Safdar A. Lower urinary tract obstruction: fetal intervention based on prenatal staging, Pediatr. Nephrol 2017; 32 (10): 1871–1878. DOI: 10.1007/s00467-017-3593-8.
- Saccone G, D’Alessandro P, Escolino M, Esposito R, Arduino B, Vitagliano A. Antenatal intervention for congenital fetal lower urinary tract obstruction (LUTO): a systematic review and meta-analysis. J Matern Fetal Neonatal Med 2020; 33 (15): 2664–2670. DOI: 10.1080/14767058.2018.1555704.
- group PLUTO, M K, K K, K M, J D. PLUTO trial protocol: percutaneous shunting for lower urinary tract obstruction randomised controlled trial. BJOG 2007; 114 (7): 904–905. DOI: 10.1111/j.1471-0528.2007.01382.x.
- Hoover DL, Duckett JJ. Posterior urethral valves, unilateral reflux and renal dysplasia: a syndrome. J Urol 1982; 128 (5): 994–997. DOI: 10.1016/s0022-3468(83)80243-7.
- Cuckow PM, Dineen MD, Risdon RA, PG R. Longterm renal function in posterior urethral valves, unilateral reflux and renal dysplasia syndrome. J Urol 1997; 158(3: 2 1004–1007. DOI: 10.1016/s0022-5347(01)64375-1.
- Smeulders N, Makin E, Desai D, P D. The predictive value of a repeat micturating cystourethrogram for remnant leaflets after primary endoscopic ablation of posterior urethral valves. J Ped Urol 2011; 7 (2): 203–208. DOI: 10.1016/j.jpurol.2010.04.011.
- Mukherjee S, Joshi A, Carroll D, al CH. What is the effect of circumcision on risk of urinary tract infection in boys with posterior urethral valves? J Ped Surg 2009; 44: 417–421. DOI: 10.1016/j.jpedsurg.2008.10.102.
- Harper L, Blanc T, Peycelon M, Michel JL, Leclair MD, Garnier S, et al.. Circumcision and Risk of Febrile Urinary Tract Infection in Boys with Posterior Urethral Valves: Result of the CIRCUP Randomized Trial. Eur Urol 2021; 22:S0302-2838(21)01993-X. DOI: 10.1016/j.eururo.2021.08.024.
- Chua ME, Ming JM, Carter S, El Hout Y, Koyle MA, Noone D, et al.. Impact of Adjuvant Urinary Diversion versus Valve Ablation Alone on Progression from Chronic to End Stage Renal Disease in Posterior Urethral Valves: A Single Institution 15-Year Time-to-Event Analysis. J Urol 2018. DOI: 10.1016/j.juro.2017.10.024.
- Tietjen DN, Gloor JM, Husmann DA. Proximal urinary diversion in the management of posterior urethral valves: is it necessary? J Urol 1997; 158: 1008–1010. DOI: 10.1016/s0022-3468(98)90257-3.
- P LP, L E, MJ MU, R L. Posterior urethral valves: prognostic factors. BJU Int 2003; 91: 687–690. DOI: 10.1016/s0022-5347(05)61251-7.
- Godbole P, Wade A, Mushtaq I, Wilcox D. Vesicostomy vs. primary valve ablation of posterior urethral valves: Always a difference in outcome? J Ped Urol 2007; 3: 273–275. DOI: 10.1016/j.jpurol.2006.11.007.
- Jaureguizar E, Lopez Pereira P, Urrutina MJM, L E. Does neonatal pyeloureterostomy worsen bladder function in children with posterior urethral valves? J Urol 2000; 164: 1031–1034. DOI: 10.1097/00005392-200009020-00027.
- Podesta M, Ruarte A, Garguilo C, R M. Bladder function associated with posterior urethral valves after primary valve ablation or proximal urinary diversion in children and adolescents. J Urol 2002; 168: 1830–1835. DOI: 10.1097/00005392-200210020-00042.
- Henneberry MO, Stephens FD. Renal hypoplasia and dysplasia in infants with posterior urethral valves. J Urol 1980; 123: 912–915. DOI: 10.1016/s0022-5347(17)56190-x.
- Parkhouse HF, Barratt TM, Dillon MJ, al DPG. Long-term otcome of boys with posterior urethral valves. Br J Urol 1988; 62: 59–62. DOI: 10.1111/j.1464-410x.1988.tb04267.x.
- Kousidis G, Thomas DFM, Morgan H, N H. The long-term outcome of prenatally detected posterior urethral valves:10 to 23 year follow-up study. BJU Int 2008; 102: 1020–1024. DOI: 10.1111/j.1464-410x.2008.07745.x.
- Sarhan O, Zaccaria I, Macher M, F M. Long-term outcome of prenatally detected posterior urethral valves: a single centre study of 65 cases managed by primary valve ablation. J Urol 2008; 179 (1): 307–312. DOI: 10.1016/j.juro.2007.08.160.
- DeFoor W, Clark C, Jackson E, P R. Risk factors for end stage renal disease in children with posterior urethral valves. J Urol 2008; 180: 1705–1708. DOI: 10.1016/s0084-3954(09)79530-2.
- Heikkila J, Holmberg C, Kyllonen L, al RR. Long term risk of end stage renal disease in patients with posterior urethral valves. J Urol 2011; 186: 2392–2396. DOI: 10.1016/j.juro.2011.07.109.
- Celedon CG, Bitsori M, Tullus K. Progression of chronic renal failure in children with dysplastic kidneys. Pediatr Nephrol 2007; 22: 1014–1020. DOI: 10.1007/s00467-007-0459-5.
- P LP, MJ MU, L E, E J. Long-term consequences of posterior urethral valves. J Pediatr Urol 2013; Oct;9(5):590-6. DOI: 10.1016/j.jpurol.2013.06.007.
- Nguyen MT, Pavlock CL, Zderic SA, Carr MC, Canning DA. Overnight catheter drainage in children with poorly compliant bladders improves post-obstructive diuresis and urinary incontinence. J Urol 2005; 174 (1633). DOI: 10.1097/01.ju.0000179394.57859.9d.
- Abdelhalim A, El-Hefnawy AS, Dawaba ME, Bazeed MA, Hafez AT. Effect of Early Oxybutynin Treatment on Posterior Urethral Valve Outcomes in Infants: A Randomized Controlled Trial. J Urol 2020; Apr;203(4):826-831. DOI: 10.1097/ju.0000000000000691.
- Farhat W, McLorie G, Capolicchio G, A K. Outcomes of primary valve ablation versus upper tract diversion in patients with posterior urethral valves. Urology 2000; 56 (4): 653–657. DOI: 10.1016/s0090-4295(00)00784-6.
- Metcalfe PD, Wang J, Jiao H, Huang Y, Hori K, Moore RB. Bladder outlet obstruction: progression from inflammation to fibrosis. BJU Int 2010; 106 (1686). DOI: 10.1111/j.1464-410x.2010.09445.x.
- Johal N, Cao K, Arthurs C, Millar M, Thrasivoulou C, Ahmed A, et al.. Contractile function of detrusor smooth muscle from children with posterior urethral valves - The role of fibrosis. J Pediatr Urol 2021; 100 (e1-100.e10). DOI: 10.1016/j.jpurol.2020.11.001.
- Peters CA, Bolkier M, Bauer SB, WH H. The urodynamic consequences of posterior urethral valves. J Urol 1990; 144 (1): 122–126. DOI: 10.1016/s0022-5347(17)39388-6.
- Holmdahl G, Sillen U, Hanson E, G H. Bladder dysfunction in boys with posterior urethral valves before and after puberty. J Urol 1996; 155: 694–698. DOI: 10.1016/s0022-5347(01)66502-9.
- M G, G M, ML C, M S. Early detection of bladder dysfunction following posterior urethral valves ablation. Eur J Pediatr Surg 1996; 6: 163–165. DOI: 10.1055/s-2008-1066497.
- Misseri R, Combs AJ, Hrowitz DJM. Myogenic failure in posterior urethral valve disease: real or imagined? J Urol 2002; 168: 1844–1848. DOI: 10.1097/00005392-200210020-00045.
- Ghanem MA, Wolffenbuttel KP, Vylder A, Nijman RJM. Long-term bladder dysfunction and renal function in boys with posterior urethral valves based on urodynamic findings. J Urol 2004; 171: 2409–2412. DOI: 10.1097/01.ju.0000127762.95045.93.
- Abbo O, Bouali O, Ballouhey Q, Mouttalib S, Lemandat A. Decramer S, et al.\[Is there an outcome difference between posterior urethral valves diagnosed prenatally and postnatally at the time of antenatal screening?\. Prog Urol 2013; 23: 144–149.
- Marchal S, Kalfa N, Iborra F, Badet L, Karam G, Broudeur L, et al.. Long-term Outcome of Renal Transplantation in Patients with Congenital Lower Urinary Tract Malformations: A Multicenter Study. Transplantation 2020; Jan;104(1):165-171. DOI: 10.1097/tp.0000000000002746.
- Jesus LE, Pippi Salle JL. Pre-transplant management of valve bladder: a critical literature review. J Pediatr Urol 2015; Feb;11(1):5-11. DOI: 10.1016/j.jpurol.2014.12.001.
- Riley P, Marks SD, Desai D, I M. Challenges facing renal transplantation in pediatric patients with lower urinary tract dysfunction. Transplantation 2010; 89 (11): 1299–1307. DOI: 10.1097/tp.0b013e3181de5b8c.
- Woodhouse C, Reilly JM, Bahadur G. Sexual function and fertility in patients treated for posterior urethral valves. J Urol 1989; 142 (2 part 2): 586–588. DOI: 10.1016/s0022-5347(17)38824-9.
- P LP, M M, MJ MU, JA M. Long-term bladder function, fertility and sexual function in patients with posterior urethral valves treated in infancy. J Pediatr Urol 2011. DOI: 10.1016/j.jpurol.2011.11.006.
- Wong JC, Khondker A, Kim JK, Chua M, Keefe DT, Dos Santos J, et al.. Posterior Urethral Valves Outcomes Prediction (PUVOP): a machine learning tool to predict clinically relevant outcomes in boys with posterior urethral valves. Pediatr Nephrol 2021. DOI: 10.1007/s00467-021-05321-3.
最近更新时间: 2025-09-22 08:00