44: Tumeurs testiculaires et paratesticulaires chez l'enfant
Ce chapitre prendra environ 23 minutes de lecture.
Introduction
Les tumeurs testiculaires et paratesticulaires sont rares chez l’enfant. Elles peuvent être primitives ou secondaires, bénignes ou malignes. Ce chapitre présente un aperçu des différentes lésions rencontrées cliniquement chez l’enfant. Les lésions intratesticulaires sont considérées, pour des raisons de pertinence clinique, en deux groupes d’âge pédiatriques:
- L’enfant prépubère
- L’adolescent et le jeune adulte (AYA)
Dans chacun de ces groupes d’âge, les tumeurs testiculaires présentent des caractéristiques spécifiques à prendre en compte, ayant un impact sur la prise en charge et le pronostic. La chirurgie épargnant le testicule (TSS) peut être envisagée pour la plupart des lésions testiculaires bénignes du prépubère; alors que la plupart des tumeurs des AYA sont d’emblée suspectées malignes, et l’orchidectomie radicale constitue le traitement chirurgical standard pour une tumeur maligne primitive intratesticulaire ou paratesticulaire.
Embryologie
Le testicule fœtal se développe à partir de la gonade mésodermique indifférenciée après 6 semaines. Chez un fœtus mâle, le canal de Müller régresse en réponse à l’AMH sécrétée par le testicule en développement. Le système wolffien se développe en réponse à la testostérone sécrétée par le testicule en développement. Les cellules de Leydig produisant de la testostérone dérivent du mésoderme gonadique et se trouvent dans l’interstitium du testicule mature. Les cordons sexuels stromaux mésodermiques se transforment en tubules séminifères et les cellules épithéliales de soutien donnent naissance aux cellules de Sertoli. Les cellules somatiques du testicule dérivent du mésoderme de la crête gonadique, mais les cellules germinales primordiales proviennent de l’épiblaste/sac vitellin après environ 8 jours de développement embryonnaire, et migrent vers la crête gonadique, s’installant à proximité immédiate du mésoderme gonadique.1
Cette dérivation de cellules issues de différentes origines embryologiques au sein du testicule en développement sous-tend la myriade de tumeurs possibles, aux comportements distincts, qui peuvent se présenter au niveau du testicule de l’enfant.
Épidémiologie
Les tumeurs testiculaires chez l’enfant représentent 1 à 2 % de toutes les tumeurs solides pédiatriques.2 L’incidence est estimée à 0,5 à 2 pour 100 000 enfants.3 Dans le groupe d’âge pédiatrique, l’incidence présente un pic à l’adolescence, avec un pic plus faible avant l’âge de 3 ans.4
Il est désormais très clair que la plupart des tumeurs intra-testiculaires chez les enfants prépubères sont bénignes. 60 à 70 % des tumeurs intra-testiculaires prépubères seraient bénignes.5,6 75 % des tumeurs intra-testiculaires chez les AYA post-pubertaires sont malignes.7 La tumeur bénigne la plus fréquente dans le groupe d’âge prépubère est le tératome, survenant à un âge médian de 13 mois.8 Les tumeurs du sac vitellin sont les tumeurs testiculaires malignes les plus fréquentes dans le groupe d’âge prépubère, avec un âge médian de présentation d’environ 16 mois.9 Ces deux tumeurs d’origine germinale représentent une large part du pic précoce d’incidence des tumeurs testiculaires observé avant l’âge de 3 ans.
La tumeur maligne testiculaire la plus fréquente dans le groupe AYA est la tumeur germinale mixte.10 Le séminome pur est rare chez les AYA. Contrairement aux enfants prépubères, qui présentent majoritairement des tumeurs du sac vitellin pures, les tumeurs germinales chez les AYA sont non séminomateuses et généralement d’histologie mixte, incluant le carcinome embryonnaire comme sous-type histologique le plus fréquent.10 Le tératome survenant chez les AYA est habituellement malin, contrairement à celui des enfants prépubères.7
Physiopathologie et vue d’ensemble des types de tumeurs testiculaires et paratesticulaires chez l’enfant
Les tumeurs testiculaires primitives peuvent provenir des cellules germinales (tumeurs des cellules germinales, TCG) ou des cellules stromales (tumeurs des cordons sexuels et du stroma) du testicule. Les TCG sont de loin plus fréquentes que les tumeurs stromales .
Les tumeurs à cellules germinales (TCG) sont classées selon la classification 2016 de l’Organisation mondiale de la Santé - soit dérivées de la néoplasie germinale in situ (dérivées de la GCNIS), qui se présentent le plus souvent après la puberté; soit non dérivées de la néoplasie germinale in situ (non dérivées de la GCNIS), qui se présentent le plus souvent en période prépubertaire.11
Le groupe des tumeurs à cellules germinales (GCTs) non dérivées de la GCNIS comprend les tumeurs du sac vitellin prépubertaires, le tératome de type prépubertaire, y compris les kystes dermoïdes et épidermoïdes, et la tumeur spermatocytaire (qui survient principalement chez l’adulte). Le carcinome in situ ou la néoplasie germinale intratubulaire est presque inexistante dans le groupe d’âge prépubertaire, contrairement aux AYA et aux adultes plus âgés.12,13
Le groupe de tumeurs à cellules germinales dérivées de la GCNIS comprend le tératome de type postpubertaire, la tumeur du sac vitellin, le carcinome embryonnaire, les tumeurs trophoblastiques, y compris le choriocarcinome, qui peuvent tous se présenter dans le groupe AYA ; et le séminome, qui est plus fréquent chez les adultes plus âgés.
Les tumeurs testiculaires des cordons sexuels et du stroma sont rares chez l’enfant. Les tumeurs à cellules de Leydig sont presque toujours bénignes chez les enfants prépubères.14,15 Les tumeurs à cellules de la granulosa juvénile sont généralement bénignes dans le groupe prépubère.16 Les tumeurs à cellules de Sertoli sont le plus souvent bénignes mais peuvent être malignes dans environ 10 %, en particulier chez les enfants plus âgés.17 Les tumeurs à cellules de Sertoli peuvent être associées à des syndromes tels que le syndrome de Carney et le syndrome de Peutz-Jeghers.
Le gonadoblastome est une tumeur maligne singulière de la gonade chez l’enfant. Les cellules de gonadoblastome comprennent à la fois des cellules stromales et des cellules germinales de la gonade. Le gonadoblastome se présente presque toujours dans le contexte de différences ou de variations du développement sexuel.18
De rares anomalies du développement du testicule, telles que la dysplasie du rete testis, peuvent se présenter sous la forme d’une masse du testicule prépubère. La dysplasie du rete testis est presque toujours associée à une agénésie rénale ipsilatérale.19 Les kystes testiculaires simples et les kystes épididymaires peuvent également se présenter chez l’enfant sous la forme de masses testiculaires ou scrotales.
Les tumeurs paratesticulaires chez l’enfant peuvent être bénignes ou malignes. Les tumeurs paratesticulaires bénignes sont rares et comprennent des lésions telles que l’hémangiome, le léiomyome et le lipome.2 Les tumeurs paratesticulaires malignes comprennent le rhabdomyosarcome, qui est la malignité paratesticulaire la plus fréquente chez l’enfant.2 et la rare tumeur neuroectodermique mélanotique du nourrisson, qui est le plus souvent bénigne, mais peut présenter un comportement malin.20
Il faut se rappeler que le testicule chez l’enfant est une localisation fréquente de malignité métastatique ou infiltrante, comme la leucémie métastatique ou le lymphome.7
Bien que la cryptorchidie soit un facteur de risque connu de malignité testiculaire, la majorité des tumeurs testiculaires de l’enfant rapportées ne sont pas associées à une cryptorchidie. La cryptorchidie est associée à un risque accru de malignité post-pubertaire, bilatéralement, de 2 à 5 fois supérieur à celui de la population générale.21 Ce risque semble être réduit par l’orchidopexie réalisée précocement dans l’enfance.22 Le type de malignité survenant le plus fréquemment en cas de cryptorchidie non corrigée ou opérée tardivement est le séminome.23
La microlithiase testiculaire, habituellement détectée fortuitement à l’échographie chez les enfants, n’a pas été démontrée comme étant associée à un risque accru de tumeurs testiculaires chez l’enfant. La microlithiase testiculaire peut être associée à un risque accru de cancer testiculaire à l’âge adulte, en particulier si elle est associée à d’autres facteurs de risque tels que la cryptorchidie. Il est donc conseillé de pratiquer un auto-examen testiculaire postpubertaire afin de faciliter une détection précoce.24
Évaluation et diagnostic
Le mode de présentation le plus fréquent d’une tumeur testiculaire ou paratesticulaire est une masse scrotale indolore, remarquée par l’enfant ou son aidant. Parfois, une hydrocèle réactionnelle peut être présente. Une tuméfaction scrotale peut motiver une consultation et des investigations, et il arrive que la masse soit découverte fortuitement après une présentation pour traumatisme, ou à l’échographie (USS). Il peut y avoir peu d’autres caractéristiques cliniques discriminantes lors de la palpation d’une masse scrotale. Cependant, les tumeurs à cellules de Leydig peuvent s’associer à des signes de puberté précoce, et 10 % des tumeurs à cellules de Sertoli peuvent également se présenter avec des signes de puberté précoce.25
L’échographie du scrotum et du testicule est un examen initial très utile. Elle fournit habituellement une indication claire de la localisation et de la taille de la masse, de son caractère solide ou kystique, de son aspect diffus ou bien limité, de sa localisation intratesticulaire ou paratesticulaire, de sa vascularisation et de son caractère unifocal ou multifocal. Certaines lésions prépubertaires ont des caractéristiques évocatrices en échographie, telles que les couches en ‘pelure d’oignon’ d’un kyste épidermique (Figure 1), l’aspect lobulé du kyste dermoïde (Figure 2), et l’aspect kystique caractéristique de la dysplasie du rete testis (Figure 3).26 Les tératomes peuvent présenter un aspect hétérogène kystique/solide (Figure 4). Les lésions bénignes tendent à présenter une faible vascularisation en échographie. Les lésions malignes sont habituellement hypoéchogènes, solides et homogènes à l’échographie.
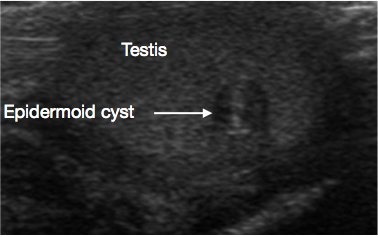
Figure 1 Échographie d’un kyste épidermoïde testiculaire, aspect en pelure d’oignon (flèche)
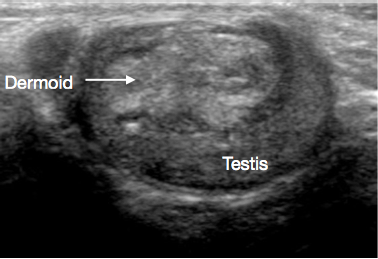
Figure 2 Échographie d’un kyste dermoïde testiculaire, kyste lobulé rempli de débris
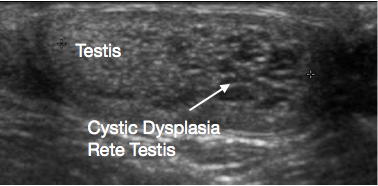
Figure 3 Échographie de la dysplasie kystique du rete testis, testicule à gauche et dysplasie kystique à droite de l’image
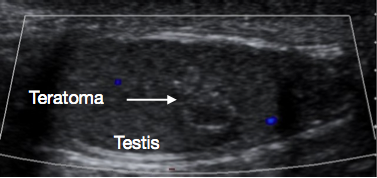
Figure 4 Échographie d’un tératome testiculaire prépubertaire, aspect hétérogène
Les marqueurs tumoraux sériques peuvent être utiles pour distinguer les lésions bénignes des lésions malignes. Pour les tumeurs testiculaires, l’alpha-foetoprotéine (AFP), la bêta-gonadotrophine chorionique humaine (BHCG) et la lactate déshydrogénase (LDH) sont les marqueurs les plus couramment utilisés. La BHCG est généralement peu utile dans l’évaluation tumorale prépubertaire, car le choriocarcinome et le carcinome embryonnaire, qui peuvent sécréter de la BHCG, sont presque jamais observés dans ce groupe d’âge.7,27 Toutefois, la BHCG est très importante dans le groupe AYA post-pubertaire, où ces lésions peuvent survenir. L’AFP est le marqueur le plus important dans le groupe d’âge prépubertaire, car elle est nettement élevée dans presque toutes les tumeurs du sac vitellin, fréquemment observées dans ce groupe d’âge.9 Le tératome peut présenter une AFP légèrement élevée, mais des taux d’AFP supérieurs à 100ng/mL n’ont pas été rapportés dans le tératome prépubertaire.9 Cette différence marquée des taux d’AFP entre le tératome bénin et la tumeur maligne du sac vitellin aide également à planifier une TSS versus une orchidectomie radicale. Il convient de noter, lors de l’interprétation des taux d’AFP, que les nourrissons jusqu’à l’âge de 8 mois peuvent avoir des taux sériques d’AFP naturellement élevés.28
Les caractéristiques cliniques, les caractéristiques en imagerie de la lésion et les taux des marqueurs tumoraux sériques contribueront à orienter la suite de la prise en charge. Si la lésion est suspecte de malignité, la réalisation d’un scanner abdomino-pelvien et thoracique de stadification afin d’évaluer l’extension locorégionale et les métastases serait importante. 20 % des tumeurs du sac vitellin prépubères présentent des métastases pulmonaires au diagnostic.29
Une lésion présentant des caractéristiques cliniques et échographiques de tumeur bénigne et sans élévation des taux sériques de marqueurs tumoraux ne nécessite habituellement pas de TDM de bilan d’extension avant la résection.
Résumé des tumeurs testiculaires chez les enfants prépubères
Tableau 1 Tumeurs testiculaires et paratesticulaires chez l’enfant
| Classification | Type | Sous-type | Bénin | Le plus souvent bénin, peut être malin | Malin |
|---|---|---|---|---|---|
| Tumeurs testiculaires/gonadiques primitives | Tumeurs testiculaires prépubères | TCG - non dérivée de la GCNIS | Tératome prépubertaire | Tumeur du sac vitellin | |
| Kyste épidermoïde | |||||
| Kyste dermoïde | |||||
| Tumeurs des cordons sexuels / stromales | Tumeur à cellules de la granulosa juvénile | Tumeur à cellules de Leydig | |||
| Tumeur à cellules de Sertoli | |||||
| Anomalies du développement et kystes simples | Dysplasie kystique du rete testis | ||||
| Kyste testiculaire | |||||
| Kyste épididymaire | |||||
| Tumeurs testiculaires chez les adolescents et jeunes adultes (AYA) | TCG - dérivée de la GCNIS | Tératome postpubertaire | |||
| Carcinome embryonnaire | |||||
| Tumeur du sac vitellin | |||||
| Choriocarcinome | |||||
| TCG mixtes | |||||
| Séminome | |||||
| Tumeur gonadique dans les différences du développement sexuel (DSD) | Gonadoblastome | ||||
| Métastases/infiltration testiculaires secondaires | Leucémie, p. ex., leucémie lymphoblastique aiguë | ||||
| Lymphome, p. ex., lymphome de Burkitt | |||||
| Tumeurs paratesticulaires | Hémangiome | Tumeur neuroectodermique mélanotique du nourrisson | Rhabdomyosarcome paratesticulaire | ||
| Léiomyome | |||||
| Lipome | |||||
GCT=tumeur des cellules germinales, GCNIS=néoplasie des cellules germinales in situ
Tumeurs primitives testiculaires/ gonadiques
Tumeurs germinales testiculaires bénignes (non dérivées de la GCNIS)
Tératome
Ils sont presque toujours bénins lors d’une présentation prépubertaire.8 L’âge médian de présentation est de 13 mois.2 Ils ont souvent un aspect hétérogène à l’USS (Figure 4) car les tératomes peuvent comporter des éléments provenant de l’un ou de l’ensemble des trois feuillets germinatifs embryonnaires - endoderme, mésoderme et ectoderme. Les tératomes contiennent habituellement des éléments matures dans ce groupe d’âge, des éléments immatures étant occasionnellement rapportés. Même en présence d’éléments immatures, le pronostic après TSS est généralement bon dans ce groupe d’âge.30 La TSS est généralement réalisable pour le tératome prépubertaire et, après exérèse réussie et confirmation histologique de la nature bénigne, aucun autre suivi n’est habituellement requis.27
Kyste épidermoïde
Ce sont des kystes bénins d’origine ectodermique, tapissés d’un épithélium produisant de la kératine. Le kyste présente à l’échographie un aspect stratifié caractéristique en ‘pelure d’oignon’ (Figure 1).11 Ils sont facilement énucléés, de sorte que la TSS constitue le standard de soins. Une surveillance prolongée de routine n’est pas nécessaire après l’exérèse, mais de rares récidives ont été rapportées.26
Kyste dermoïde
Les kystes dermoïdes comprennent des éléments de type cutané, y compris des annexes telles que les follicules pileux et les glandes sébacées. Ils sont bénins. À l’échographie, on observe souvent des lésions kystiques à paroi épaisse, aux contours lisses, avec des débris échogènes avasculaires (Figure 2).31,32 La TSS est le standard de prise en charge, et une surveillance systématique après exérèse n’est généralement pas nécessaire.27
Tumeurs germinales malignes testiculaires (non dérivées de la GCNIS)
Tumeur du sac vitellin
Il s’agit de la tumeur intratesticulaire maligne la plus fréquente chez l’enfant prépubère. L’âge habituel de présentation correspond au premier pic avant 3 ans, avec une médiane de 16 mois.9 Les tumeurs sont généralement solides et homogènes à l’échographie (USS). L’AFP sérique est nettement élevée. 80 % des tumeurs à cellules vitellines prépubères sont au stade 1 au moment du diagnostic.33 20 % présentent des métastases pulmonaires à la présentation.2 Si une tumeur du sac vitellin est suspectée, un scanner de stadification thoraco-abdomino-pelvien doit être réalisé et une orchidectomie radicale planifiée. Le curage ganglionnaire radical (RLND) n’est pas réalisé en routine pour les tumeurs à cellules vitellines prépubères, car la dissémination hématogène sans extension locorégionale est fréquente dans ces tumeurs ; ce que le RLND, avec son risque significatif de morbidité, ne permettra pas de traiter.34
Pour une maladie de stade 1 confirmée, avec normalisation de l’AFP sérique après la chirurgie, la chimiothérapie n’est généralement pas nécessaire. Les taux de récidive sont d’environ 20 % . Une surveillance oncologique régulière post-chirurgicale avec dosage de l’AFP et imagerie telle que l’IRM est donc recommandée, et les taux de succès du traitement de rattrapage des récidives sont excellents.2,35 Pour une maladie de stade clinique 2 avec atteinte ganglionnaire, et pour la maladie métastatique, la chimiothérapie est indiquée dans la plupart des protocoles. La chimiothérapie à base de platine est très efficace pour la tumeur du sac vitellin. La RLND est réservée à la maladie résiduelle ou récidivante locorégionale.2,33
Tumeurs testiculaires des cordons sexuels et du stroma
Tumeurs à cellules de la granulosa juvéniles
Ces tumeurs généralement bénignes surviennent habituellement chez les nourrissons et constituent les tumeurs testiculaires néonatales les plus fréquentes. Sur le plan histologique, elles sont constituées de nappes de cellules de type granulosa, souvent avec des remaniements kystiques.16,36 La TSS est généralement réussie et curative, aucune récidive n’a été rapportée, et une surveillance à long terme après l’exérèse n’est généralement pas nécessaire.27
Tumeurs des cellules de Leydig
Chez les enfants, les tumeurs des cellules de Leydig sont généralement bénignes, bien qu’elles puissent être malignes chez les adultes. Les tumeurs des cellules de Leydig se présentent habituellement chez des enfants d’environ 5 à 10 ans.14,15 La plupart se présentent comme une masse testiculaire indolore. Cependant, les tumeurs des cellules de Leydig peuvent se manifester par une puberté précoce due à la production de testostérone . De plus, 10 à 15 % des enfants atteints de tumeurs des cellules de Leydig peuvent présenter des signes de féminisation tels que la gynécomastie en raison d’une sécrétion d’estradiol.2 L’aspect peropératoire des tumeurs des cellules de Leydig est celui de nodules jaunes homogènes. Chez les enfants prépubères, la TSS est recommandée, car les tumeurs des cellules de Leydig sont presque toujours bénignes dans ce groupe d’âge. Si une puberté précoce est présente, une évaluation en endocrinologie et un suivi sont recommandés. Les modifications pubertaires ne régressent pas après l’exérèse de la tumeur, car l’axe hormonal pubertaire a été activé.2
Tumeurs à cellules de Sertoli
Celles-ci surviennent à un âge médian précoce de 6 mois, bien qu’elles puissent apparaître à tout âge prépubère. Un tiers sont associées à des syndromes tels que Peutz-Jeghers ou le syndrome de Carney. 10% se présentent avec des signes de puberté précoce parce qu’elles sont hormonosécrétantes; voire une gynécomastie, due à la sécrétion tumorale d’aromatase, entraînant la conversion de l’androstènedione en estrone.37 Elles sont le plus souvent bénignes, mais peuvent être malignes chez les enfants plus âgés. Ainsi, un CT de stadification préopératoire serait prudent, en particulier chez les enfants de plus de 5 ans. Les recommandations actuelles préconisent d’envisager la TSS pour les tumeurs à cellules de Sertoli chez l’enfant.27
Anomalies du développement et kystes
La dysplasie kystique du réseau testiculaire est une anomalie du développement rare qui se manifeste par une masse testiculaire. Elle est presque toujours associée à une agénésie rénale homolatérale. L’USS montre que la lésion est kystique, habituellement au pôle supérieur du testicule, avec compression du tissu testiculaire normal adjacent (Figure 3). Traditionnellement, une TSS était recommandée pour cette lésion. Des taux significatifs de récidive après TSS ont été rapportés. Compte tenu de l’aspect échographique caractéristique et de l’anomalie rénale homolatérale associée, de son caractère bénin et des rapports de plus en plus nombreux de régression de la lésion au fil du temps, une prise en charge conservatrice épargnant le testicule avec surveillance est désormais suggérée. Une biopsie de la lésion, en cas de doute diagnostique avant d’opter pour une prise en charge conservatrice, peut être envisagée.38,39
Les kystes épididymaires simples et les kystes intratesticulaires peuvent survenir chez l’enfant. Parfois, ils sont symptomatiques. Ils se prêtent habituellement à une énucléation ou à une fenestration si nécessaire.
Résumé des tumeurs testiculaires chez les AJA
Les tumeurs testiculaires chez les AYA sont habituellement malignes, et habituellement des tumeurs germinales, principalement dérivées du GCNIS. Les tumeurs germinales testiculaires représentent 14 % des cancers chez les adolescents et sont la tumeur solide la plus fréquente dans cette tranche d’âge.
Histologiquement, elles tendent le plus souvent à être des carcinomes embryonnaires, avec des composantes mixtes de tumeurs germinales non séminomateuses. Elles se présentent souvent avec une maladie métastatique et ont un taux de rechute plus élevé. L’évaluation des tumeurs malignes suspectées comprend une imagerie par échographie, les marqueurs tumoraux - AFP, BHCG et LDH, et une TDM de stadification du thorax, de l’abdomen et du pelvis.10 Le tératome postpubertaire est également dérivé de la GCNIS, contrairement à son homologue prépubertaire. Des métastases surviennent dans 22-37% des tératomes chez les AYA.40 Il convient également de noter que les tumeurs testiculaires malignes chez les AYA peuvent ne pas présenter d’élévation des marqueurs tumoraux.41
La prise en charge de référence d’une suspicion de tumeur testiculaire chez les AYA est l’orchidectomie radicale par voie inguinale. Pour une maladie localisée, l’orchidectomie radicale est habituellement curative. Les AYA qui présentent un stade clinique 1 après l’orchidectomie sont généralement placés sous surveillance active pour la détection d’une récidive; 20-30% auront une récidive clinique, et la survie avec une chimiothérapie de rattrapage est excellente.10 Cette approche conservatrice limite le surtraitement de la majorité avec un stade clinique 1, et limite l’exposition aux effets indésirables de la chimiothérapie à base de platine, en ciblant le traitement sur ceux qui présentent une récidive avérée. Les tumeurs >4cm, l’invasion lymphovasculaire et une composante croissante de carcinome embryonnaire sont associées à un risque accru de maladie métastatique.42
Les AYAs présentant une maladie aux stades cliniques II et III reçoivent généralement une chimiothérapie. La RLND est utilisée de manière sélective chez ceux qui présentent une maladie résiduelle ou une masse après la chimiothérapie, malgré des marqueurs tumoraux négatifs, car la lésion résiduelle peut être un tératome, généralement moins sensible à la chimiothérapie.10
Résumé des tumeurs paratesticulaires chez l’enfant
La TSS avec exérèse focale de la lésion est généralement envisagée pour les rares lésions paratesticulaires bénignes telles que le lipome.
La tumeur neuroectodermique mélanotique du nourrisson est une tumeur rare affectant la région épididymaire et paratesticulaire.20 Elle est généralement bénigne, mais la différencier histologiquement des tumeurs malignes à petites cellules rondes bleues sur biopsie peut être difficile. Étant typiquement bénigne, la tumeur est habituellement guérie par une orchidectomie; cependant, 10 % peuvent présenter un comportement malin avec récidive et/ou métastases. Après la chirurgie, un suivi avec imagerie en coupes telle que l’IRM est conseillé.2
Le rhabdomyosarcome paratesticulaire est la malignité paratesticulaire la plus fréquemment rencontrée chez l’enfant. Il représente 5 % de toutes les malignités intrascrotales, et 40 % de toutes les malignités paratesticulaires.43 On observe un pic d’incidence bimodal, l’un dans le groupe AYA et l’autre chez les nourrissons de moins de 6 mois. La tumeur prend naissance à partir des éléments mésenchymateux des tissus paratesticulaires. La présentation est généralement une masse scrotale indolore, et une proportion significative présente une maladie métastatique au diagnostic. L’échographie montre habituellement une lésion paratesticulaire solide (Figure 5). Une TDM de stadification de l’abdomen, du pelvis et du thorax est nécessaire pour évaluer l’extension locorégionale et métastatique. Les marqueurs tumoraux sont habituellement négatifs.
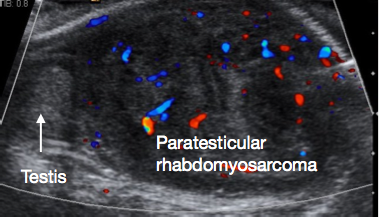
Figure 5 Échographie d’un rhabdomyosarcome paratesticulaire, testicule normal à gauche de l’image, volumineuse masse paratesticulaire à droite de l’image
Une déclaration de consensus du Children’s Oncology Group (COG), de l’European paediatric Soft tissue sarcoma Study Group (EpSSG) et de la Cooperative Weichteilsarkom Studiengruppe (CWS) concernant la prise en charge chirurgicale du rhabdomyosarcome paratesticulaire a été récemment publiée.44 L’orchidectomie radicale avec résection en bloc de la tumeur, du testicule et du cordon spermatique jusqu’à l’anneau inguinal interne constitue actuellement la prise en charge chirurgicale recommandée du rhabdomyosarcome paratesticulaire. L’abord scrotal pour la résection est contre-indiqué car il rend difficile l’obtention d’un contrôle proximal au niveau de l’anneau inguinal interne ; la biopsie trans-scrotale doit également être évitée car elle augmente le risque de dissémination tumorale.
La plupart des rhabdomyosarcomes paratesticulaires chez l’enfant sont histologiquement de type embryonnaire. Si la lésion est embryonnaire, alors chez les enfants de plus de 10 ans, un bilan ganglionnaire rétropéritonéal est recommandé quel que soit le stade clinique ; mais chez les garçons de moins de 10 ans, ce bilan n’est réalisé qu’en cas de signes d’extension locale ou d’adénopathies. S’il existe des adénopathies à l’imagerie et qu’aucune évaluation ganglionnaire n’est réalisée, il est recommandé de traiter par chimiothérapie comme si les ganglions étaient atteints.44
En cas de rhabdomyosarcome alvéolaire sur le plan histologique, une évaluation des ganglions lymphatiques rétropéritonéaux est recommandée chez tous les patients, indépendamment des résultats de l’imagerie. Si les ganglions sont positifs, une chimiothérapie et une radiothérapie sont indiquées.44
Les résultats après traitement du rhabdomyosarcome paratesticulaire sont meilleurs dans le groupe prépubertaire que dans le groupe AYA. On observe une survie sans échec de 90% dans le groupe d’âge prépubertaire contre 63% chez les adolescents.45
Métastases ou tumeur maligne infiltrante des testicules chez l’enfant
Les testicules sont un site fréquent d’infiltration dans la leucémie et le lymphome - tels que la leucémie aiguë lymphoblastique, le lymphome folliculaire ou le lymphome de Burkitt chez l’enfant. La présentation est généralement une augmentation notable du volume testiculaire, unilatérale ou bilatérale. Les résultats de l’échographie montrent souvent un testicule augmenté de volume, diffusément hypoéchogène, avec hypervascularisation.46
TSS et orchidectomie radicale
Les recommandations cliniques préconisent désormais fortement la TSS pour les tumeurs testiculaires prépubertaires fortement suspectées d’être bénignes au bilan.27 La TSS est réalisée par voie inguinale. Le clampage atraumatique des vaisseaux du cordon spermatique avant la mobilisation et la dissection testiculaires est considéré comme une technique oncologique standard, et permet de minimiser le saignement et d’optimiser la visualisation de la dissection dans l’organe prépubère, généralement de petite taille. (Figure 6).
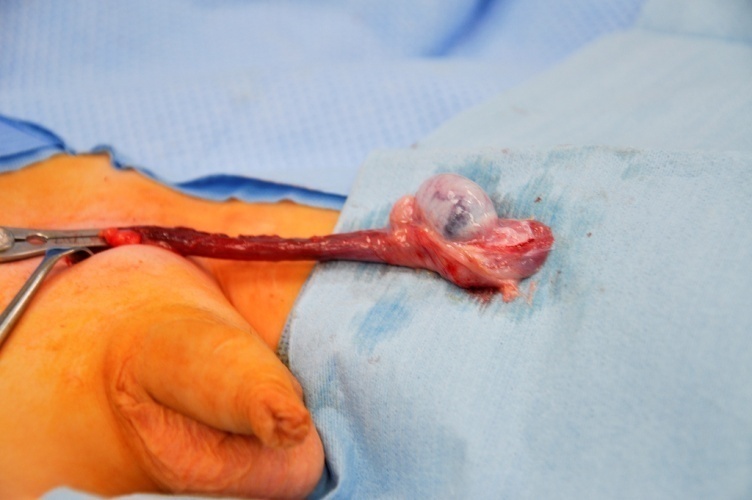
Figure 6 TSS - Clamp vasculaire atraumatique sur le cordon spermatique, tumeur à cellules de Leydig au pôle inférieur du testicule
L’examen extemporané est utile pour aider à confirmer que la lésion est bénigne et que les marges sont saines. Dans de nombreux centres expérimentés, l’examen extemporané n’est plus réalisé de façon systématique pour les lésions prépubères négatives pour les marqueurs tumoraux et présentant des caractéristiques cliniques et échographiques bénignes.41 En cas de doute ou de suspicion de malignité malgré les étapes de la TSS, la TSS est alors abandonnée et une orchidectomie radicale est réalisée. Si la TSS est réalisée avec succès, l’albuginée est refermée par suture après la résection de la lésion, et le testicule est replacé dans le scrotum.
Chez tous les enfants présentant une suspicion clinique de tumeur maligne testiculaire ou paratestisculaire, un bilan d’extension préopératoire locorégionale et métastatique doit être réalisé. Le traitement de référence des lésions malignes est l’orchidectomie radicale, réalisée par voie inguinale avec clampage vasculaire avant la mobilisation du testicule et de la lésion. Le cordon spermatique doit être ligaturé et réséqué au niveau de l’orifice inguinal profond. Pour les lésions paratesticulaires, la tumeur doit être réséquée en bloc avec le testicule et le cordon spermatique ; en cas d’envahissement de la peau scrotale, la peau scrotale atteinte doit également être réséquée en bloc avec la lésion.44
Stadification clinique des tumeurs malignes
Le Children’s Oncology Group (COG) utilise un système de stadification clinique en stades I à IV pour les tumeurs testiculaires malignes prépubères (Tableau 2). Le stade I correspond essentiellement à une maladie localisée au testicule au moment de la résection.
Tableau 2 Système de stadification du Children’s Oncology Group pour les tumeurs testiculaires
| Stade | Description |
|---|---|
| I | Limité au testicule, complètement réséqué par orchidectomie inguinale haute; aucune preuve clinique, radiologique ou histologique de maladie au-delà des testicules |
| Les patients avec des marqueurs tumoraux normaux ou inconnus au diagnostic doivent avoir une RPLND homolatérale négative pour confirmer une maladie de stade I si l’imagerie montre des ganglions lymphatiques >2 cm | |
| Les patients ayant subi une orchidectomie scrotale avec ligature haute du cordon sont de stade I” | |
| II | “Biopsie trans-scrotale; maladie microscopique dans le scrotum ou haute dans le cordon spermatique (<5 cm de l’extrémité proximale) |
| Absence de normalisation ou de diminution des marqueurs tumoraux avec une demi-vie appropriée” | |
| III | Biopsie trans-scrotale; maladie microscopique dans le scrotum ou haute dans le cordon spermatique (<5 cm de l’extrémité proximale) |
| Ganglions lymphatiques >4 cm à la TDM ou 2–4 cm avec preuve biopsique” | |
| IV | Métastases à distance, y compris le foie |
| III | Atteinte des ganglions lymphatiques rétropéritonéaux, mais pas d’atteinte viscérale ou extra-abdominale |
L’American Joint Commission on Cancer (AJCC) utilise généralement le système Tumeur (T), Ganglions (N) et Métastases (M) avec une catégorie S pour les marqueurs tumoraux postchirurgicaux (Tableau 3).
Tableau 3 Stadification AJCC
| T-Tumeur primitive | N-Ganglions lymphatiques régionaux | M-Métastases à distance | S-Marqueurs tumoraux sériques |
|---|---|---|---|
| pT0 – aucune preuve de tumeur primitive | cN0 – pas de métastase ganglionnaire régionale | M0 – pas de métastase à distance | S0 – taux des marqueurs dans les limites de la normale |
| pTis – néoplasie germinale intratubulaire (carcinome in situ) | pN0 – pas de métastase ganglionnaire régionale | M1 – métastase à distance | S1 - LDH < 1.5 X N et hCG (mIU/mL) <5000 et AFP (ng/mL) <1000 |
| pT1 – tumeur limitée au testicule et à l’épididyme sans LVI; la tumeur peut envahir la tunique albuginée mais pas la tunique vaginale | cN1 – métastase avec une masse ganglionnaire≤ 2 cm ou plusieurs ganglions, aucun>2 cm | M1a – métastase ganglionnaire non régionale ou pulmonaire | S2 LDH 1.5–10 X N ou hCG (mIU/mL) 5000–50,000 ou AFP (ng/mL) 1000–10,000 |
| pT2 – tumeur limitée au testicule et à l’épididyme avec LVI, ou tumeur s’étendant à travers la tunique albuginée avec atteinte de la tunique vaginale | pN1 – métastase avec une masse ganglionnaire≤2 cm et ≤5 ganglions positifs, aucun >2 cm | M1b – métastase à distance autre qu’aux ganglions non régionaux et au poumon | S3 LDH >10 x N ou hCG (mIU/mL) >50,000 ou AFP (ng/mL) >10,000 |
| pT3 – tumeur envahissant le cordon spermatique avec ou sans LVI | cN2 – métastase avec une masse ganglionnaire 2–5 cm ou plusieurs ganglions, au moins un>2 cm mais pas >5 cm | ||
| pT4 –tumeur envahissant le scrotum avec ou sans LVI | pN2 – métastase avec une masse ganglionnaire 2–5 cm, ou >5 ganglions positifs, aucun >5 cm, ou preuve d’extension tumorale extranodale | ||
| cN3 – métastase avec une masse ganglionnaire >5 cm | |||
| pN3 – métastase avec une masse ganglionnaire>5 cm |
AFP: alpha-foetoprotéine; hCG : bêta gonadotrophine chorionique humaine; LDH: lactate déshydrogénase; LN: ganglion lymphatique; LVI: invasion lymphovasculaire; N: normal; c: clinique; p: pathologique; T: tumeur primitive; N: ganglions lymphatiques régionaux; M: métastase; S: marqueurs tumoraux sériques.
Les Intergroup Rhabdomyosarcoma Studies (IRS), désormais remplacées, ont établi à la fois un système de ‘groupement’ basé sur la résécabilité chirurgicale, et un système de stadification TNM modifié par l’IRS pour le rhabdomyosarcome paratesticulaire.
Complications du traitement
La TSS et l’orchidectomie radicale sont des interventions associées à une bonne récupération, avec de faibles risques de saignement avec hématome scrotal, d’infection et de récidive lésionnelle. L’atrophie testiculaire est rare après la TSS.41
Ces dernières années, la prise en charge des tumeurs testiculaires et paratesticulaires pédiatriques s’est attachée à réduire les risques et les effets indésirables à long terme de la chimiothérapie et de la radiothérapie, en stratifiant le risque tumoral et en ne proposant des traitements complémentaires qu’aux enfants répondant aux critères requis. La plupart des enfants atteints d’une maladie de stade I se voient désormais proposer une surveillance active après la résection tumorale, et seuls ceux présentant une récidive avérée nécessiteront une chimiothérapie.
Les effets indésirables de la chimiothérapie tels que la néphrotoxicité du cisplatine et la neuropathie périphérique, ainsi que la fibrose pulmonaire après administration de bléomycine, sont bien documentés.
Les effets négatifs à long terme de la chimiothérapie et de la radiothérapie comprennent une altération de la fertilité et des cancers secondaires.
Suivi et surveillance suggérés après traitement
Les lésions bénignes confirmées avec des marges d’exérèse saines, telles que le tératome prépubertaire, ne nécessitent généralement pas de surveillance de routine à long terme après une TSS. Cependant, les recommandations cliniques suggèrent un suivi postopératoire initial avec échographie tous les 3 à 6 mois pendant la première année postopératoire.27
Tous les enfants atteints d’une tumeur maligne testiculaire ou paratestisculaire nécessitent un suivi et une surveillance appropriés pendant quelques années, conformément aux protocoles oncologiques. Cela permet d’assurer une surveillance active d’une éventuelle récidive et de contrôler les effets à long terme après la chirurgie et les traitements par chimiothérapie et/ou radiothérapie.
Points clés
- La majorité des tumeurs testiculaires prépubères sont bénignes
- La majorité des tumeurs testiculaires malignes chez les prépubères sont des tumeurs du sac vitellin pures
- Les tumeurs testiculaires des cordons sexuels / stromales sont rares chez l’enfant et sont le plus souvent bénignes
- La majorité des tumeurs testiculaires chez les AYA sont malignes
- Le rhabdomyosarcome paratesticulaire est la tumeur maligne paratesticulaire la plus fréquente chez l’enfant, mais demeure rare
Conclusions
La majorité des tumeurs testiculaires prépubertaires sont bénignes. La TSS peut être envisagée en toute sécurité et est recommandée pour les tumeurs testiculaires prépubertaires présentant des caractéristiques cliniques et échographiques d’une lésion bénigne, et des marqueurs tumoraux négatifs.
La majorité des tumeurs testiculaires malignes chez les enfants prépubères sont des tumeurs du sac vitellin pures. L’AFP est nettement élevée dans la plupart des tumeurs du sac vitellin. Après un bilan d’extension au scanner, le traitement repose sur une orchidectomie radicale. La plupart présentent une maladie de stade I localisée au testicule, et la chirurgie est curative. La chimiothérapie est réservée aux enfants ayant une maladie de stade II ou supérieure, ou à ceux avec un stade I qui présentent une récidive après la chirurgie.
La majorité des tumeurs testiculaires chez les AYA est maligne. Elles tendent à être des carcinomes embryonnaires et des tumeurs germinales mixtes.
Les tumeurs testiculaires des cordons sexuels / du stroma sont rares chez l’enfant et sont en grande partie bénignes et compatibles avec une TSS.
Le rhabdomyosarcome paratesticulaire est la tumeur maligne paratesticulaire la plus fréquente chez l’enfant. Après une stadification et un bilan appropriés, le traitement consiste généralement en une orchidectomie radicale en bloc avec la masse tumorale paratesticulaire, par voie inguinale. Si la lésion est de type embryonnaire à l’histologie, une évaluation des ganglions lymphatiques rétropéritonéaux est recommandée chez les enfants de plus de 10 ans, quel que soit le stade; et chez les garçons de moins de 10 ans qui ont une atteinte locorégionale ou une récidive ganglionnaire. Si la lésion est de type alvéolaire à l’histologie, une évaluation des ganglions lymphatiques rétropéritonéaux est recommandée pour tous, indépendamment des résultats de l’imagerie.
Références
- Silber S. Testis Development, Embryology, and Anatomy. 2018. In: Fundamentals of Male Infertility \[Internet\]. Springer; , DOI: 10.1007/978-3-319-76523-5_1.
- Ahmed HU, Arya M, Muneer A, Mushtaq I, Sebire NJ. Testicular and paratesticular tumours in the prepubertal population. Lancet Oncol 2010; 11 (5): 476–483. DOI: 10.1016/s1470-2045(10)70012-7.
- Coppes MJ, Rackley R, Kay R. Primary testicular and paratesticular tumors of childhood. Med Pediatr Oncol 1994; 22 (5): 329–340. DOI: 10.1002/mpo.2950220506.
- Schneider DT, Calaminus G, Koch S, Teske C, Schmidt P, Haas RJ. Epidemiologic analysis of 1,442 children and adolescents registered in the German germ cell tumor protocols. Pediatr Blood Cancer 2004; 42 (2): 169–175. DOI: 10.1002/pbc.10321.
- Nerli RB, Ajay G, Shivangouda P, Pravin P, Reddy M, Pujar VC. Prepubertal testicular tumors: our 10 years experience. Indian J Cancer 2010; 47 (3): 292–295. DOI: 10.4103/0019-509x.64730.
- Woo LL, Ross JH. Partial orchiectomy vs. radical orchiectomy for pediatric testis tumors. Transl Androl Urol 2020; 9 (5): 2400–2407. DOI: 10.21037/tau-19-815.
- Jarvis H, Cost NG, Saltzman AF. Testicular tumors in the pediatric patient. Semin Pediatr Surg 2021; 30 (4). DOI: 10.1016/j.sempedsurg.2021.151079.
- Grady RW, Ross JH, Kay R. Epidemiological features of testicular teratoma in a prepubertal population. J Urol 1997; 158 (3 Pt 2): 1191–1192. DOI: 10.1097/00005392-199709000-00129.
- Ross JH, Rybicki L, Kay R. Clinical behavior and a contemporary management algorithm for prepubertal testis tumors: a summary of the Prepubertal Testis Tumor Registry. J Urol 2002; 168 (4 Pt 2): 8–9. DOI: 10.1097/00005392-200210020-00004.
- Saltzman AF, Cost NG. Adolescent and Young Adult Testicular Germ Cell Tumors: Special Considerations. Adv Urol 2018; 2018 (2375176). DOI: 10.1155/2018/2375176.
- Williamson D SR, B M-G, C A, F E, L U, T.M.. The World Health Organization 2016 classification of testicular germ cell tumours: a review and update from the International Society of Urological Pathology Testis Consultation Panel. Histopathology 2017; 70: 335–346. DOI: 10.1111/his.13102.
- Renedo DE, Trainer TD. Intratubular germ cell neoplasia (ITGCN) with p53 and PCNA expression and adjacent mature teratoma in an infant testis. An immunohistochemical and morphologic study with a review of the literature. Am J Surg Pathol 1994; 18 (9): 947–952. DOI: 10.1097/00000478-199409000-00010.
- Hawkins E, Heifetz SA, Giller R, Cushing B. The prepubertal testis (prenatal and postnatal): its relationship to intratubular germ cell neoplasia: a combined Pediatric Oncology Group and Childrenś Cancer Study Group. Hum Pathol 1997; 28 (4): 404–410. DOI: 10.1016/s0046-8177(97)90027-7.
- Agarwal PK, Palmer JS. Testicular and paratesticular neoplasms in prepubertal males. J Urol 2006; 176 (3): 875–881. DOI: 10.1016/j.juro.2006.04.021.
- Luckie TM, Danzig M, Zhou S, Wu H, Cost NG, Karaviti L. A Multicenter Retrospective Review of Pediatric Leydig Cell Tumor of the Testis. J Pediatr Hematol Oncol 2019; 41 (1): 74–76. DOI: 10.1097/mph.0000000000001124.
- Grogg JB, Schneider K, Bode PK, Kranzbuhler B, Eberli D, Sulser T. Risk factors and treatment outcomes of 239 patients with testicular granulosa cell tumors: a systematic review of published case series data. J Cancer Res Clin Oncol 2020; 146 (11): 2829–2841. DOI: 10.1007/s00432-020-03326-3.
- Talon I, Moog R, Kauffmann I, Grandadam S, Becmeur F. Sertoli cell tumor of the testis in children: reevaluation of a rarely encountered tumor. J Pediatr Hematol Oncol 2005; 27 (9): 491–494.
- Chung JM, Lee SD. Overview of pediatric testicular tumors in Korea. Korean J Urol 2014; 55 (12): 789–796. DOI: 10.4111/kju.2014.55.12.789.
- Ulbright TM, Young RH. Testicular and paratesticular tumors and tumor-like lesions in the first 2 decades. Semin Diagn Pathol 2014; 31 (5): 323–381. DOI: 10.1053/j.semdp.2014.07.003.
- Calabrese F, Danieli D, Valente M. Melanotic neuroectodermal tumor of the epididymis in infancy: case report and review of the literature. Urology 1995; 46 (3): 415–418. DOI: 10.1016/s0090-4295(99)80234-9.
- Pettersson A, Richiardi L, Nordenskjold A, Kaijser M, Akre O. Age at surgery for undescended testis and risk of testicular cancer. N Engl J Med 2007; 356 (18): 1835–1841. DOI: 10.1016/j.urolonc.2007.08.002.
- Schneuer FJ, Milne E, Jamieson SE, Pereira G, Hansen M, Barker A. Association between male genital anomalies and adult male reproductive disorders: a population-based data linkage study spanning more than 40 years. Lancet Child Adolesc Health 2018; 2 (10): 736–743. DOI: 10.1016/s2352-4642(18)30254-2.
- Wood HM, Elder JS. Cryptorchidism and testicular cancer: separating fact from fiction. J Urol 2009; 181 (2): 452–461. DOI: 10.1016/s0084-4071(09)79277-2.
- LAt H, NR B, C R, HS D, RJM N, J Q. The prognostic value of testicular microlithiasis as an incidental finding for the risk of testicular malignancy in children and the adult population: A systematic review. On Behalf of the EAU Pediatric Urology Guidelines Panel Epub Ahead of Print Journal of Pediatric Urology 2021. DOI: 10.1016/j.jpurol.2021.06.013.
- Thomas JC, Ross JH, Kay R. Stromal testis tumors in children: a report from the prepubertal testis tumor registry. J Urol 2001; 166 (6): 2338–2340. DOI: 10.1016/s0022-5347(05)65583-8.
- Friend J, Barker A, Khosa J, Samnakay N. Benign scrotal masses in children - some new lessons learned. J Pediatr Surg 2016; 51 (10): 1737–1742. DOI: 10.1016/j.jpedsurg.2016.07.016.
- Stein R, Quaedackers J, Bhat NR, Dogan HS, Nijman RJM, Rawashdeh YF. EAU-ESPU pediatric urology guidelines on testicular tumors in prepubertal boys. J Pediatr Urol 2021; 17 (4): 529–533. DOI: 10.1016/j.jpurol.2021.06.006.
- Wu JT, Book L, Sudar K. Serum alpha fetoprotein (AFP) levels in normal infants. Pediatr Res 1981; 15 (1): 50–52. DOI: 10.1203/00006450-198101000-00012.
- Haas RJ, Schmidt P, Gobel U, Harms D. Testicular germ cell tumors, an update. Results of the German cooperative studies 1982-1997. Klin Padiatr 1999; 211 (4): 300–304.
- A DB, GC M, R P, P H, FG H-C, JW O. Influence of tumor site and histology on long-term survival in 193 children with extracranial germ cell tumors. Eur J Pediatr Surg 2008; 18 (1): 1–6. DOI: 10.1055/s-2007-989399.
- Ulbright TM, Srigley JR. Dermoid cyst of the testis: a study of five postpubertal cases, including a pilomatrixoma-like variant, with evidence supporting its separate classification from mature testicular teratoma. Am J Surg Pathol 2001; 25 (6): 788–793.
- P GA, LM HF, M JG, C SF, D SA, S NL. \[Mature cystic teratoma of the testis (dermoid cyst. Case Report and Literature Review\] Arch Esp Urol 2009; 62 (9): 747–751.
- Grady RW. Current management of prepubertal yolk sac tumors of the testis. Urol Clin North Am 2000; 27 (3): 503–508. DOI: 10.1016/s0094-0143(05)70097-5.
- Grady RW, Ross JH, Kay R. Patterns of metastatic spread in prepubertal yolk sac tumor of the testis. J Urol 1995; 153 (4): 1259–1261. DOI: 10.1097/00005392-199504000-00068.
- Ye YL, Zheng FF, Chen D, Zhang J, Liu ZW, Qin ZK. Relapse in children with clinical stage I testicular yolk sac tumors after initial orchiectomy. Pediatr Surg Int 2019; 35 (3): 383–389. DOI: 10.1007/s00383-018-04426-5.
- Kao CS, Cornejo KM, Ulbright TM, Young RH. Juvenile granulosa cell tumors of the testis: a clinicopathologic study of 70 cases with emphasis on its wide morphologic spectrum. Am J Surg Pathol 2015; 39 (9): 1159–1169. DOI: 10.1016/j.juro.2016.07.011.
- Dursun F, Su Dur SM, Sahin C, Kirmizibekmez H, Karabulut MH, Yoruk A. A Rare Cause of Prepubertal Gynecomastia: Sertoli Cell Tumor. Case Rep Pediatr 2015; 2015 (439239). DOI: 10.1155/2015/439239.
- Gelas T, Margain Deslandes L, Mestrallet G, Pracros JP, Mouriquand P. Spontaneous regression of suspected cystic dysplasia of the rete testis in three neonates. J Pediatr Urol 2016; 12 (6): 1–4. DOI: 10.1016/j.jpurol.2016.05.032.
- Helman T, Epelman M, Ellsworth P. Cystic Dysplasia of the Rete Testis: Does Pathophysiology Guide Management? Urology 2020; 141: 150–153. DOI: 10.1016/j.urology.2020.03.026.
- Farci F, Teratoma SST. StatPearls. .
- Bois JI, Vagni RL, Badiola FI, Moldes JM, Losty PD, Lobos PA. Testis-sparing surgery for testicular tumors in children: a 20 year single center experience and systematic review of the literature. Pediatr Surg Int 2021; 37 (5): 607–616. DOI: 10.1007/s00383-020-04850-6.
- Vergouwe Y, Steyerberg EW, Eijkemans MJ, Albers P, Habbema JD. Predictors of occult metastasis in clinical stage I nonseminoma: a systematic review. J Clin Oncol 2003; 21 (22): 4092–4099. DOI: 10.1016/j.urolonc.2004.02.005.
- Shapiro E, Strother D. Pediatric genitourinary rhabdomyosarcoma. J Urol 1992; 148 (6): 1761–1768. DOI: 10.1016/s0022-5347(17)37023-4.
- Rogers TN, Seitz G, Fuchs J, Martelli H, Dasgupta R, Routh JC. Surgical management of paratesticular rhabdomyosarcoma: A consensus opinion from the Childrenś Oncology Group, European paediatric Soft tissue sarcoma Study Group, and the Cooperative Weichteilsarkom Studiengruppe. Pediatr Blood Cancer 2021; 68 (4). DOI: 10.1002/pbc.28938.
- Crist WM, Anderson M JR, JL F, C R, RB R, F.B.. Intergroup rhabdomyosarcoma study-IV: results for patients with nonmetastatic disease. J Clin Oncol 2001; 19 (12): 3091–3102. DOI: 10.1200/jco.2001.19.12.3091.
- Sanguesa C, Veiga D, Llavador M, Serrano A. Testicular tumours in children: an approach to diagnosis and management with pathologic correlation. Insights Imaging 2020; 11 (1). DOI: 10.1186/s13244-020-00867-6.
Dernière mise à jour: 2025-09-22 07:59