21: Complexe d'exstrophie vésicale et d'épispadias
Ce chapitre prendra environ 41 minutes de lecture.
Introduction
L’exstrophie vésicale est une malformation génito-urinaire rare qui, définie simplement, correspond à l’éversion de la vessie vers l’extérieur du corps (Figure 1). Il s’agit d’une malformation génito-urinaire rare dont la prise en charge continue de poser un défi au domaine de l’urologie pédiatrique. Plus précisément, le complexe exstrophie-épispadias englobe de nombreuses anomalies allant de l’épispadias isolé, masculin ou féminin, à l’exstrophie vésicale classique, et même à l’exstrophie cloacale.
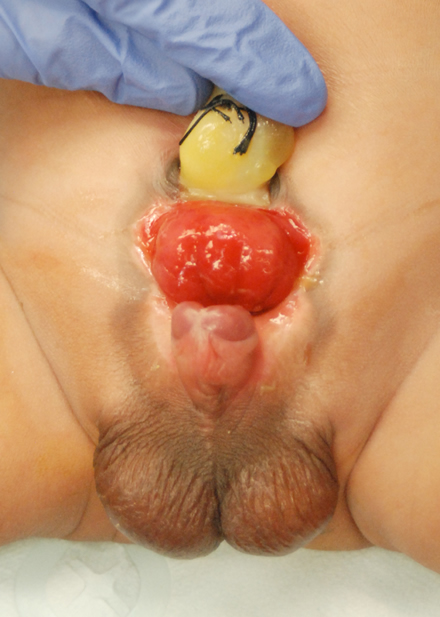
Figure 1 Nouveau-né de sexe masculin présentant une exstrophie vésicale classique.
Incidence
L’incidence de l’exstrophie vésicale était initialement estimée entre 1:10 000 et 1:50 000 naissances vivantes. Cependant, des données plus récentes provenant de l’International Clearinghouse for Birth Defects monitoring system et du Healthcare Cost and Utilization Project Nationwide Inpatient Sample des États-Unis ont estimé l’incidence à 2,15–3,3 pour 100 000 naissances vivantes. Il existe une prédominance masculine, avec un ratio homme:femme rapporté entre 2,3–6:1.
Embryologie
L’ingression mésodermique entre les couches ectodermique et endodermique de la membrane cloacale bilaminaire aboutit à la formation de la musculature de la paroi abdominale inférieure et des os pelviens. Après l’ingression mésenchymateuse, la croissance caudale du septum rectal divise la cloaque en une vessie en avant et un rectum en arrière. Les tubercules génitaux migrent médialement et fusionnent sur la ligne médiane, en position céphalique par rapport à la membrane dorsale, avant que celle-ci ne se perfore. La membrane cloacale peut se rompre prématurément en fonction de l’étendue du défaut infra-ombilical. Le stade du développement auquel survient la rupture de la membrane détermine si l’issue sera une exstrophie vésicale, une exstrophie cloacale ou un épispadias.
La théorie la plus admise concernant le développement embryonnaire de l’exstrophie, soutenue par Marshall et Muecke, décrit le défaut de base comme un surdéveloppement inférieur anormal de la membrane cloacale, ce qui empêche la migration médiane du tissu mésenchymateux. Par conséquent, le développement normal de la paroi abdominale ne se produit pas. Le moment de la rupture de ce défaut cloacal détermine la gravité de l’affection. Les perforations centrales entraînant une exstrophie classique présentent l’incidence la plus élevée (60 %), tandis que les variantes d’exstrophie représentent 30 % et l’exstrophie cloacale 10 %.
D’autres théories ont été proposées concernant la cause du complexe exstrophie-épispadias. Ambrose et O’Brian ont postulé qu’un développement anormal des bourgeons génitaux, avec une fusion sur la ligne médiane au-dessous plutôt qu’au-dessus de la membrane cloacale, entraîne l’exstrophie.1 Une autre hypothèse décrit une insertion caudale anormale du pédicule embryonnaire, avec défaut d’interposition du tissu mésenchymateux sur la ligne médiane. En raison de ce défaut, la translocation de la cloaque en profondeur dans la cavité abdominale ne se produit pas. Une membrane cloacale qui demeure en position infra-ombilicale superficielle représente un état embryonnaire instable, avec une forte tendance à se désintégrer. Aucune théorie ne semble élucider tous les aspects du complexe observé cliniquement, et des études se poursuivent afin de décrire pleinement le processus développemental qui aboutit finalement à la formation du complexe exstrophie-épispadias.
Hérédité
Des preuves indiquent une prédisposition génétique à l’exstrophie et à l’épispadias. Le risque de récidive de l’exstrophie vésicale au sein d’une famille donnée est d’environ 1 sur 100, bien plus élevé que dans la population générale. De nombreux rapports décrivent des jumeaux présentant une exstrophie. Parallèlement, toutefois, il existe également des rapports de jumeaux monozygotes où les deux présentent une exstrophie, et d’autres séries dans lesquelles un seul était atteint. De nombreux cas de jumeaux dizygotes ont été rapportés, dans lesquels un seul des jumeaux était atteint. Ces paires de jumeaux ont été observées tant chez des paires masculines que féminines.2,3 Les analyses de concordance chez des jumeaux atteints du complexe exstrophie-épispadias suggèrent également une étiologie génétique. Un rapport portant sur 151 familles atteintes du complexe exstrophie-épispadias a identifié 4 familles multiplex, soit un taux de 2,7 %. La probabilité qu’un parent atteint d’exstrophie ait un enfant atteint d’exstrophie est d’environ 1:70 naissances vivantes, soit 500 fois le risque pour la population générale.3
De nombreux efforts ont été déployés pour comprendre les étiologies possibles du complexe exstrophie-épispadias. Le milieu hormonal du développement précoce associé à la fécondation in vitro a été supposé impliqué, sur la base d’études ayant montré une augmentation d’un facteur 7,5 de l’exstrophie et de l’exstrophie cloacale associée à l’utilisation de technologies de reproduction assistée telles que l’injection intracytoplasmique de spermatozoïdes. Une autre étude épidémiologique a montré un taux accru de naissances avec un complexe exstrophie-épispadias chez des femmes ayant eu recours à la fécondation in vitro. Une étude plus récente, issue d’une étude cas-témoins suédoise à l’échelle nationale, a constaté que, en général, l’exstrophie vésicale est observée comme une malformation isolée sans autres malformations majeures. Les patients atteints d’exstrophie vésicale étaient plus souvent associés à un faible poids de naissance (< 1,500 grammes) et à un âge maternel élevé (≥ 35 ans).
Le gène CASPR3 sur le chromosome 9 a été mis en cause par Boyadjiev et ses collègues comme étant associé au complexe d’exstrophie. Un autre ensemble de gènes sur le 9e chromosome a été identifié comme étant associé à l’exstrophie vésicale. Des études génétiques cherchent à déterminer où se situent, et s’il existe, des facteurs génétiques spécifiques liés au complexe exstrophie-épispadias. De nombreux autres loci géniques possibles ont été identifiés, mais non confirmés.
Diagnostic prénatal
Malgré l’ampleur du défaut touchant la paroi abdominale inférieure et le développement des organes pelviens, l’exstrophie vésicale reste difficile à diagnostiquer de manière fiable par échographie prénatale. Cela est probablement dû à sa faible incidence et au fait qu’elle est souvent confondue avec des diagnostics plus fréquents d’omphalocèle ou de gastroschisis. Plusieurs équipes ont illustré des constatations échographiques importantes dans le diagnostic prénatal de l’exstrophie. Dans une revue de 25 échographies prénatales suivies de la naissance d’un nouveau-né atteint d’une exstrophie vésicale classique, Gearhart et al ont décrit les principaux critères du diagnostic prénatal de l’exstrophie. Ces critères comprenaient l’absence de remplissage vésical, une masse abdominale inférieure qui devient plus protubérante à mesure que la grossesse progresse, un ombilic bas situé, la séparation des branches pubiennes, et des difficultés à déterminer le sexe du fœtus.2,4,3,5 Une étude rétrospective plus récente menée en Allemagne a trouvé un âge gestationnel médian d’environ 24 semaines. Là encore, tous les fœtus présentaient les signes pathognomoniques de non-visualisation de la vessie fœtale et masse abdominale proéminente sous le cordon ombilical insertion. À l’analyse de ces données, l’exstrophie vésicale doit toujours être suspectée sur la base de la non-visualisation de la vessie.
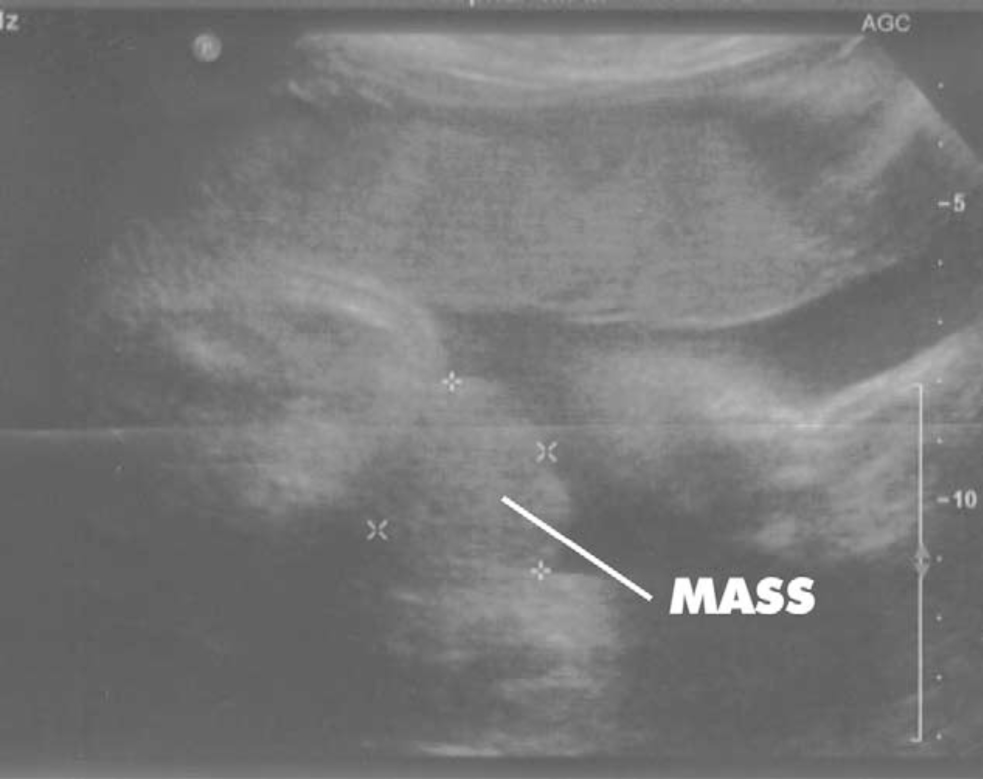
Figure 2 Échographie à 30 semaines de gestation montrant la non-visualisation de la vessie et une masse abdominale inférieure.
On estime que l’échographie 3D et l’utilisation croissante de l’IRM fœtale amélioreront la capacité à diagnostiquer l’exstrophie vésicale et cloaquale. Le diagnostic prénatal permet un conseil prénatal et l’organisation d’un accouchement dans un centre spécialisé dans l’exstrophie. Cela autorise une approche multidisciplinaire par des équipes expérimentées dans la prise en charge du caractère particulier du complexe exstrophie-épispadias. Cela inclut la disponibilité d’équipes de chirurgie reconstructrice durant la période néonatale immédiate ainsi qu’un soutien psychosocial pour les parents et les familles. Grâce à l’IRM fœtale, il peut être possible de distinguer, à l’IRM, l’exstrophie vésicale classique de l’exstrophie cloaquale. Cela pourrait aider lors du conseil prénatal destiné à la mère.
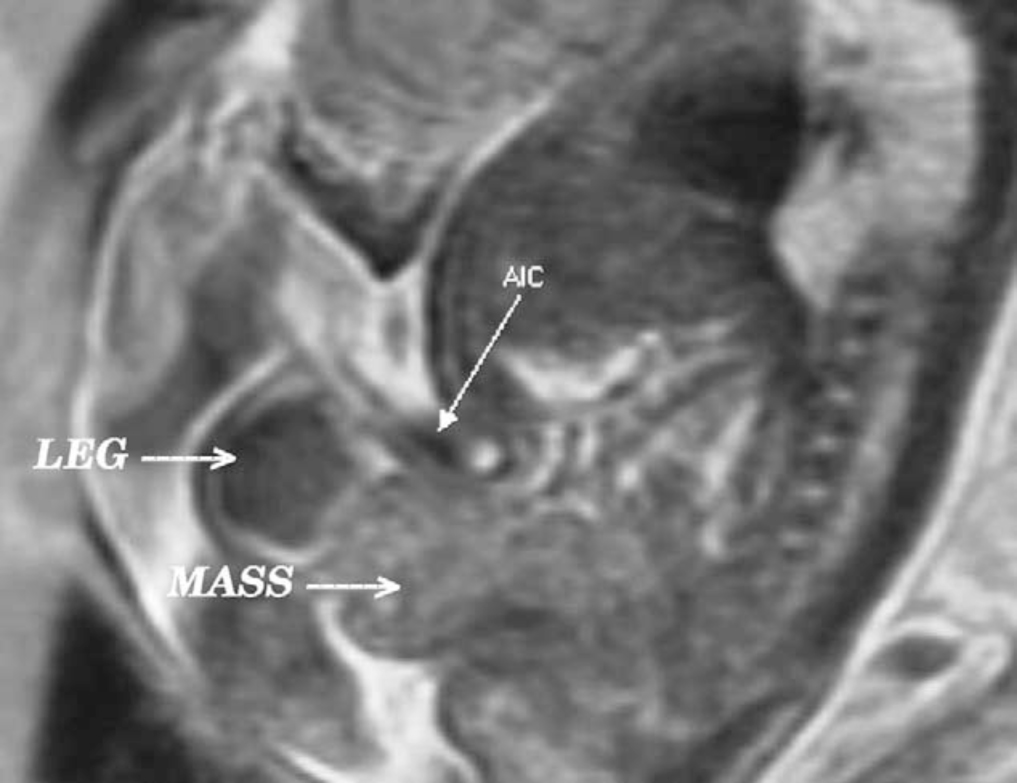
Figure 3 Vue sagittale d’une exstrophie vésicale (masse) sous l’insertion abdominale du cordon ombilical (AIC) en IRM prénatale T2.
Le diagnostic d’exstrophie vésicale est posé (ou confirmé) à la naissance par la visualisation d’une plaque vésicale faisant saillie de manière caractéristique sous le cordon ombilical, avec des muscles droits de l’abdomen divergents de part et d’autre, aboutissant à un large écartement des os pubiens.
Anomalies associées
Anomalies squelettiques
La malformation squelettique la plus évidente est la séparation des os pubiens, causée par la rotation vers l’extérieur des os coxaux, l’éversion des branches pubiennes et un déficit osseux de 30 % de la branche pubienne.6 Les reconstructions TDM 3D ont mis en évidence une rotation externe moyenne de 12˚ de l’aspect postérieur du bassin de chaque côté, une rétroversion de l’acétabulum, et une rotation externe moyenne de 18˚ de la portion antérieure du bassin. L’utilisation supplémentaire de scanners TDM 3D a montré que l’angle de l’articulation sacro-iliaque (avant fermeture) était supérieur de 10˚ dans le bassin exstrophique par rapport à des témoins appariés selon l’âge et 10˚ plus orienté vers le plan coronal que vers le plan sagittal. Le bassin osseux présentait également une rotation caudale de 14,7˚. Le sacrum était plus volumineux de 42,6 % selon les mesures de volume et présentait 23,5 % de surface en plus. Combinées, ces déformations conduisent à un diastasis pubien moyen de 4,2 cm à la naissance, augmentant à 14,2 cm chez l’adulte. Cela se compare à une largeur symphysaire de 0,6 cm chez les sujets témoins. Ces déformations des os du bassin contribuent au phallus raccourci, à une démarche dandinante et à la rotation externe des membres inférieurs chez les patients exstrophiques. Une étude de 299 enfants porteurs d’exstrophie vésicale a indiqué que des variations rachidiennes surviennent sans signification clinique : spina bifida occulta, lombarisation ou sacralisation de vertèbres dans 11 %, scoliose non compliquée dans 2,7 %, et dysraphisme spinal dans 4 %, incluant myéloméningocèle, lipoméningocèle, sacrum en cimeterre et hémivertèbres. Un seul patient présentait des signes de dysfonction neurologique.7
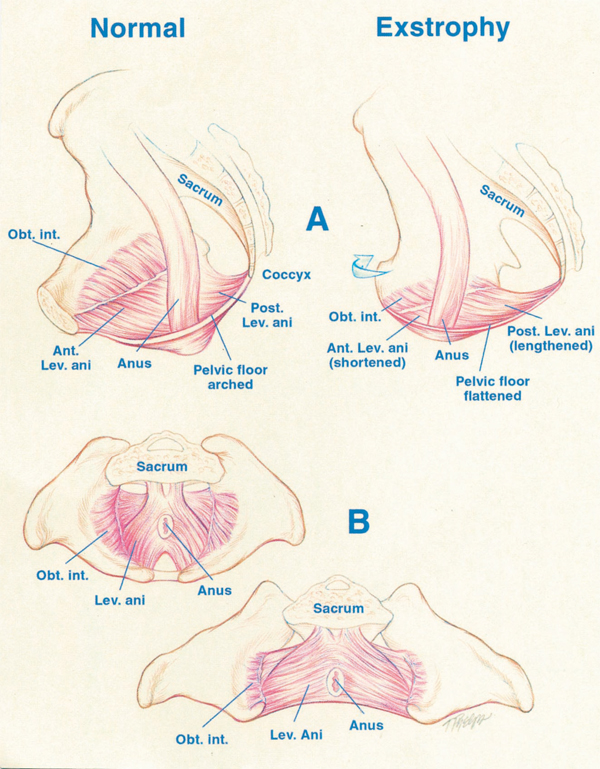
Figure 4 A, déplacement de l’élévateur (Lev.) de l’anus vers une position plus postérieure (Post.) chez le patient atteint d’exstrophie, soit 68 % en arrière de l’anus par rapport à des témoins normaux. Noter également le segment antérieur (Ant.) raccourci de l’élévateur de l’anus dans l’exstrophie, 32 % en avant de l’anus contre 48 % chez les témoins. Obt. int., obturateur interne. B, rotation vers l’extérieur plus importante de 15.1˚ de l’obturateur interne dans le groupe avec exstrophie par rapport aux témoins. Noter également que la zone délimitée par le muscle puborectal est le double de celle des témoins et plus aplatie.
Anomalies du plancher pelvien
Les données de Stec et al utilisant l’imagerie TDM 3D ont montré que les sangles puborectales chez les patients présentant une exstrophie vésicale classique soutiennent une cavité corporelle deux fois plus importante que chez des témoins appariés pour l’âge.4 Alors que le groupe musculaire des releveurs chez les témoins est uniformément réparti de l’arrière vers l’avant (52 % contre 48 %) par rapport au rectum, on observe une répartition inégale de 68 % contre 32 % postérieure versus antérieure dans le bassin exstrophique. On note également un aplatissement significatif des releveurs. Une diminution de 31,7 degrés de l’inclinaison est observée entre les moitiés droite et gauche du muscle élévateur de l’anus et de la sangle puborectale. Par conséquent, l’anus est en position antérieure et parfois béant, faisant partie de l’extension postérieure du défaut myofascial. Ces malformations musculosquelettiques expliquent l’augmentation du taux de prolapsus rectal, en particulier dans la population féminine atteinte d’exstrophie.
Des études complémentaires du plancher pelvien ont été réalisées par IRM 3D et ont influencé la compréhension du bassin exstrophique en vue de la reconstruction. Williams et al ont démontré que le groupe musculaire élévateur de l’anus était moins en dôme et plus irrégulier, dans la population exstrophique avant la fermeture, comparativement aux témoins normaux.8 Aucune relation n’a également été observée entre le degré de diastasis pubien et l’ampleur de la courbure disproportionnée du groupe musculaire élévateur de l’anus. L’examen des bassins post-fermeture par IRM a révélé que, chez ceux présentant un certain degré de continence, la distance intersymphysaire était la plus courte, l’angle de divergence de l’élévateur de l’anus le plus aigu et le col vésical positionné le plus profondément dans le bassin. Gargollo a rapporté des IRM avant et après la fermeture de l’exstrophie, en notant que l’angle puborectal chez ceux avec des intervalles secs était diminué par rapport à celui d’avant la fermeture.9 De nouveaux rapports sur l’utilisation de l’échographie périnéale 3D pour évaluer le plancher pelvien chez des femmes adultes atteintes d’exstrophie ont montré que les résultats échographiques correspondaient bien aux constatations en IRM. Ces rapports renforcent la nécessité d’une dissection agressive et d’un positionnement postérieur de l’urètre postérieur et de la vessie, ainsi qu’une bonne réapproximation du pubis au moment de la fermeture. Des ostéotomies et une fixation pelvienne doivent être utilisées si la reconstruction n’est pas réalisée en période néonatale immédiate.
Défauts de la paroi abdominale
Il existe un défaut triangulaire en raison de la rupture prématurée de la membrane cloacale anormale dans la paroi abdominale, et il est occupé par la vessie exstrophiée et l’urètre postérieur. Ce défaut du fascia est limité inférieurement par la bande intrasymphysaire qui représente le diaphragme urogénital divergent et relie le col vésical et l’urètre postérieur aux branches pubiennes. Wakim et Barbet ont étudié la relation du muscle droit et du fascia avec le diaphragme urogénital et n’ont trouvé aucune preuve macroscopique ni histologique du sphincter strié.10 Ils ont toutefois mis en évidence une musculature vésicale s’étendant latéralement jusqu’au pubis, où elle s’interdigite avec des fibres provenant du fascia du muscle droit de l’abdomen pour former le diaphragme urogénital fibreux. L’importance de pratiquer une incision radicale de ces fibres, latéralement à la plaque urétrale, jusqu’au niveau de la branche pubienne inférieure et du hiatus levatorien, afin de permettre la position profonde de la vessie et de l’urètre postérieur dans le pelvis, a été démontrée par Gearhart et ses collègues, à partir de données issues d’échecs de fermeture de l’exstrophie où ces fibres étaient intactes au moment de la reprise de la fermeture.11
À la limite céphalique du défaut fascial triangulaire se situe l’ombilic. La distance entre l’ombilic et l’anus est raccourcie dans l’exstrophie vésicale, car l’ombilic se trouve bien au-dessous de la ligne horizontale des crêtes iliaques. Bien qu’une hernie ombilicale soit habituellement présente, elle est généralement de petite taille et réparée lors de la fermeture initiale de l’exstrophie.
Les hernies inguinales sont fréquentes. Elles sont dues à une absence d’obliquité du canal inguinal associée à des anneaux inguinaux internes et externes larges et à la persistance du processus vaginal. Connolly et ses collaborateurs ont rapporté une incidence de hernie inguinale de 81,8 % chez les sujets de sexe masculin et de 10,5 % chez les sujets de sexe féminin.12 Il est recommandé d’explorer les canaux inguinaux au moment de la fermeture de l’exstrophie et d’exciser le sac herniaire avec réparation du fascia transversalis et du défaut musculaire afin de prévenir une récidive ou une hernie directe, indépendamment d’une approche en plusieurs temps ou d’une réparation primaire complète. En outre, dans le cadre d’une fermeture de l’exstrophie concomitante à une cure de hernie inguinale, le taux de récidive de hernie inguinale est supérieur à 30 % (beaucoup plus élevé chez les sujets de sexe masculin), traduisant une faiblesse innée de la paroi abdominale et l’absence d’obliquité du canal inguinal. Cela est particulièrement marqué au cours des 6 premiers mois suivant la fermeture vésicale initiale par CPRE.
Malformations anorectales
Le périnée du patient atteint d’exstrophie est court et large et l’anus se trouve directement en arrière du diaphragme urogénital. Il est déplacé vers l’avant et correspond à la limite postérieure du défaut du fascia triangulaire. Le complexe sphinctérien anal est également déplacé vers l’avant et doit être préservé intact. Ces facteurs anatomiques contribuent, à des degrés variables, à l’incontinence anale et au prolapsus rectal. Le prolapsus rectal survient fréquemment chez les patients présentant une exstrophie non traitée avec une symphyse pubienne largement séparée. Habituellement, il est transitoire, facilement réductible et disparaît après fermeture vésicale ou cystectomie/dérivation urinaire. L’apparition d’un prolapsus du rectum constitue également une indication pour procéder à la prise en charge définitive de la vessie exstrophiée. S’il survient à n’importe quel moment après la fermeture de l’exstrophie, il faut suspecter une obstruction de l’urètre postérieur ou de la voie de sortie vésicale, et une évaluation immédiate de la voie de sortie par cystoscopie doit être réalisée.
Les implications de l’exstrophie cloacale (complexe OEIS) sur l’intestin postérieur seront abordées plus loin dans ce chapitre.
Anomalies des organes génitaux masculins
Les malformations génitales masculines sont sévères et difficiles au moment de la reconstruction. Le phallus est court en raison d’un déficit de 50% de la longueur antérieure des corps caverneux, avec conservation de la longueur postérieure des corps caverneux par rapport à des témoins appariés pour l’âge à l’IRM.3 Le diamètre du segment postérieur des corps caverneux était supérieur à celui des témoins normaux. La diastase de la symphyse pubienne augmentait les distances intrasymphysaires et intercaverneuses, mais l’angle entre les corps caverneux était inchangé parce que les corps caverneux étaient séparés de façon parallèle. Il en résulte un pénis d’aspect court en raison de la diastase et de la nette déficience congénitale du tissu caverneux antérieur. La libération de la chordée dorsale, l’allongement de la gouttière urétrale et la mobilisation des piliers sur la ligne médiane afin d’allonger quelque peu le pénis peuvent aboutir à un phallus fonctionnel et esthétiquement approprié.
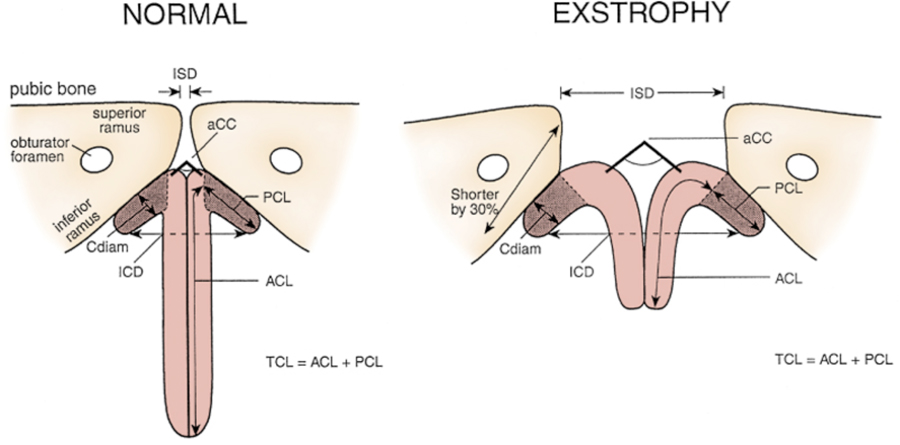
Figure 5 Mesures péniennes et pelviennes chez des hommes normaux et des patients atteints d’exstrophie. ZSD, distance intersymphysaire. UCC, angle sous-tendu par les corps caverneux. Cdiam, diamètre du corps caverneux. PCL, longueur postérieure des corps caverneux. ZCD, distance entre les corps caverneux. ACL, longueur antérieure des corps caverneux. EL, longueur totale des corps caverneux
L’épispadias est généralement observé en association avec l’exstrophie vésicale classique. Cependant, plus rarement, il se présente comme une malformation congénitale isolée chez 1 homme sur 117 000 et chez 1 femme sur 150 000 à 300 000. Il se caractérise par l’absence de tubulisation de la plaque urétrale sur la face dorsale, avec une atteinte dont la localisation s’étend de glandulaire à pénopubienne. La plupart des patients masculins présentent également un certain degré de chordée dorsale pénienne. Certaines patientes présentent un clitoris bifide. Chez les hommes, la probabilité d’incontinence urinaire peut dépendre de la sévérité de l’épispadias. Cependant, l’incontinence a été décrite même chez des patients présentant un épispadias glandulaire, en raison d’un “défaut de champ” entravant la contractilité et la coaptation de la vessie et de l’urètre. À l’inverse, presque toutes les patientes atteintes d’épispadias présentent une incontinence urinaire, compte tenu de la forte probabilité d’une anomalie concomitante du col vésical.
Gearhart et ses collaborateurs ont utilisé l’IRM pour démontrer, chez 13 hommes adultes atteints d’exstrophie vésicale, que le volume, le poids et la surface maximale en coupe transversale de la prostate semblaient normaux par rapport aux témoins publiés.13 Cependant, ils ont constaté que chez aucun des patients évalués la prostate ne s’étendait circonférentiellement autour de l’urètre, et que l’urètre était antérieur à la prostate chez tous les patients. Les taux de PSA libre et total chez des hommes adultes atteints d’exstrophie vésicale étaient mesurables mais inférieurs aux limites supérieures des intervalles de référence établis selon l’âge pour des hommes sains.13 Il existe un seul rapport décrivant un patient de 56 ans atteint d’épispadias présentant un cancer de la prostate, avec un PSA à 4,2 au moment de la biopsie.14
Les canaux déférents et les canaux éjaculateurs sont normaux chez le patient atteint d’exstrophie vésicale, pour autant qu’ils ne soient pas lésés iatrogéniquement lors de la fermeture ou de la reconstruction. La longueur moyenne des vésicules séminales s’est avérée normale.
Les nerfs autonomes qui innervent les corps caverneux (nerfs caverneux) sont déplacés latéralement chez les patients atteints d’exstrophie vésicale, et ces nerfs sont préservés chez la quasi-totalité de ces patients, la fonction érectile étant conservée après la chirurgie. Une éjaculation rétrograde est observée après la fermeture vésicale et la reconstruction du col vésical.
Les testicules paraissent souvent rétractiles, mais la longueur du cordon spermatique est suffisante pour leur permettre d’atteindre un scrotum plat et large sans nécessiter d’orchidopexie. Les testicules n’ont pas été étudiés dans un large groupe de patients postpubères atteints d’exstrophie, mais on considère généralement qu’ils ne sont pas altérés. D’Hauwers et al ont rapporté l’utilisation de l’aspiration spermatique percutanée et de l’injection intracytoplasmique de spermatozoïdes, et indiquent que, chez 3 patients atteints d’exstrophie, ils ont obtenu de bons résultats pour le prélèvement de spermatozoïdes.(missing reference)
Malformations des organes génitaux féminins
Chez les filles, le mont du pubis, le clitoris et les lèvres sont séparés et l’orifice vaginal est déplacé en avant et sténosé. Le clitoris est bifide et le vagin est plus court que chez les témoins sains mais de calibre normal. Le col de l’utérus se trouve sur la paroi vaginale antérieure parce que l’utérus s’abouche au vagin par sa partie supérieure. Les trompes de Fallope et les ovaires sont habituellement normaux. Le clitoris bifide doit être rapproché des deux extrémités des petites lèvres pour former une fourchette vulvaire au moment de la fermeture primaire. Fréquemment, une dilatation vaginale ou une épisiotomie peut être nécessaire pour permettre des rapports sexuels satisfaisants chez la femme adulte. Une étude associée à l’Association for the Bladder Exstrophy Community et aux médias sociaux a identifié 13- femmes adultes ayant des antécédents d’exstrophie vésicale. Parmi elles, 28,5 % ont été traitées pour un prolapsus utérin. 36,2 % ont déclaré des grossesses, et parmi celles-ci 68 % ont signalé des complications de grossesse.15 La plupart des femmes adultes nécessitent des interventions, médicales et chirurgicales, pour des problèmes gynécologiques après la ménarche.16
Pourtant, bien que l’exstrophie vésicale soit une affection sévère, des grossesses normales sont rapportées, avec des conséquences à long terme sur la continence et la santé sexuelle.17
Anomalies urinaires
La muqueuse vésicale exposée est sujette à des modifications kystiques ou métaplasiques et doit, par conséquent, être irriguée fréquemment avec du sérum physiologique et protégée des traumatismes superficiels et de l’exposition par une membrane protectrice jusqu’à ce qu’une fermeture vésicale chirurgicale puisse être réalisée. Le plus souvent, un film plastique (c.-à-d., Saran Wrap) suffit. À la naissance, la muqueuse peut comporter un segment de muqueuse intestinale ectopique, une anse intestinale isolée ou, le plus souvent, des polypes hamartomateux.
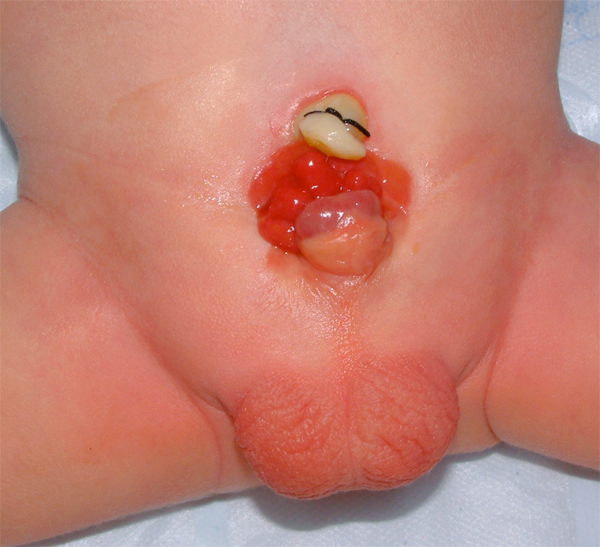
Figure 6 Nouveau-né présentant une exstrophie vésicale classique. Noter la présence de multiples polypes sur la plaque vésicale.
Shapiro et ses collègues ont caractérisé la fonction neuromusculaire de la vessie. Ils ont montré que la densité des récepteurs cholinergiques muscariniques et l’affinité de liaison étaient similaires chez les sujets atteints d’exstrophie vésicale et les témoins.18 Des biopsies vésicales de 12 nouveau-nés présentant une exstrophie vésicale, comparées à des témoins appariés pour l’âge, ont mis en évidence une augmentation du rapport collagène/muscle lisse dans les vessies exstrophiques.19 Les types de collagènes ont été analysés et une distribution normale du collagène de type I était présente, mais un triplement du collagène de type III a été observé. Il a ensuite été constaté que les patients qui démontraient une croissance vésicale en mesurant la capacité après une fermeture réussie, et qui étaient indemnes d’infection, présentaient un rapport collagène/muscle lisse nettement diminué. Des cultures primaires de cellules musculaires lisses de vessies exstrophiques ont montré des caractéristiques de croissance similaires à celles rapportées précédemment dans des cellules non exstrophiques, indiquant qu’elles conservent vraisemblablement leur potentiel de croissance et de fonction. Mathews et ses collaborateurs ont constaté que le nombre moyen de petites fibres nerveuses myélinisées par champ était significativement réduit dans les vessies exstrophiques par rapport aux témoins.20 La préservation de fibres nerveuses de plus grand calibre a été observée, ce qui a conduit l’étude à émettre l’hypothèse que l’exstrophie vésicale chez le nouveau-né représentait un stade plus précoce du développement vésical. De multiples marqueurs immunocytochimiques et histochimiques, le polypeptide intestinal vasoactif (VIP), le neuropeptide Y (NPY), la substance P (SP), le peptide relié au gène de la calcitonine (CGRP), le produit du gène protéique (PGP) 9.5, et la diaphorase du nicotinamide adénine dinucléotide phosphate (NADPHd) ont été étudiés, et il n’y avait aucune preuve morphologique de désinnervation du muscle vésical dans aucun cas d’exstrophie vésicale. Cependant, des cas d’exstrophie vésicale après une reconstruction ayant échoué présentaient des déficits d’innervation musculaire avec augmentation des innervations sous-épithéliales et intra-épithéliales. L’analyse par microréseaux du muscle lisse vésical exstrophique, comparée à des témoins ‘sains’, a montré ce qui semble correspondre à un caractère immature sur le plan du développement du muscle lisse vésical exstrophique. Ainsi, on considère que, bien que la vessie d’un patient atteint d’exstrophie puisse être immature, elle a le potentiel d’un développement normal après une fermeture initiale réussie.
Les polypes de la plaque vésicale se répartissaient en deux types aux constatations qui se chevauchaient : fibreux et œdémateux. Les deux étaient associés à une métaplasie squameuse sus-jacente dans 50 % des cas. Des degrés variables de nids de von Brunn, de cystite cystique et de cystite glandulaire ont été notés. La cystite glandulaire a été notée dans un pourcentage plus élevé lors des fermetures secondaires. Une surveillance ultérieure de ces patients atteints de cystite glandulaire est recommandée compte tenu de leur risque potentiel d’adénocarcinome. Celle-ci peut être réalisée par cytologie urinaire et cystoscopie lorsqu’ils entrent dans l’âge adulte.21
La plaque vésicale peut s’invaginer ou faire saillie à travers un petit défaut aponévrotique à la naissance, mais l’évaluation exacte de la plaque vésicale ne peut être réalisée complètement que lorsque le nouveau-né est sous anesthésie et complètement relâché. Une vessie de petite taille, fibrosée, inélastique et/ou recouverte de polypes peut rendre une réparation fonctionnelle difficile et potentiellement impossible.
Des cystométries normales ont été obtenues chez 70–90% des personnes évaluées dans un groupe de patients exstrophiques continents présentant des vessies réflexes normales.22 Une évaluation de 30 patients exstrophiques à différents stades de la réparation moderne en plusieurs temps, avant la reconstruction du col vésical, a constaté que 80% avaient des vessies compliantes et stables après reconstruction du col vésical. Environ la moitié a maintenu une compliance vésicale normale et un nombre moindre a maintenu une stabilité normale. Les auteurs de cette étude estimaient que 25% des patients atteints d’exstrophie pourraient conserver une fonction détrusorienne normale après reconstruction.23 La microstructure de la vessie chez les patients exstrophiques, à différents moments de la réparation moderne en plusieurs temps, présentait des cavéoles différentes (structures intracellulaires importantes pour la signalisation cellule à cellule). Ces cavéoles étaient considérées comme normales chez ceux ayant une fermeture réussie et une capacité vésicale en amélioration, mais absentes chez ceux qui ont nécessité une cystoplastie d’augmentation. Ils ont également noté que l’ultrastructure des cellules était anormale dans le groupe chez lequel la fermeture initiale avait échoué.
Le reste des voies urinaires est généralement normal, mais des anomalies surviennent. Un rein en fer à cheval, un rein pelvien, un rein hypoplasique, un rein unique et une dysplasie avec méga-uretères peuvent tous être rencontrés. Le trajet de l’uretère est anormal quant à sa terminaison. En raison de la dilatation et de la profondeur inhabituelle du cul-de-sac péritonéal de Douglas, entre la vessie et le rectum, l’uretère est refoulé vers le bas et latéralement lors de son trajet à travers le petit bassin. Le segment distal aborde la vessie en position inférieure et latérale par rapport à l’orifice. Cela entraîne un reflux vésico-urétéral dans 100 % des cas d’exstrophie. Les réimplantations urétérales sont effectuées au moment de la réparation du col vésical, mais sont parfois nécessaires plus tôt. En cas de problèmes d’infections et de résistance excessive de la voie de sortie vésicale, une réimplantation urétérale peut être nécessaire avant la reconstruction du col vésical ou à tout moment si un reflux sévère et des atteintes du haut appareil urinaire se développent.
Évaluation et prise en charge à la naissance
En salle d’accouchement, le cordon ombilical doit être ligaturé avec de la soie 2-0 au ras de la paroi abdominale, afin que la pince ombilicale n’irrite ni ne traumatise la muqueuse vésicale exposée. La muqueuse vésicale doit être fréquemment irriguée avec du sérum physiologique tiède et toujours recouverte d’un film plastique transparent protecteur jusqu’au moment de la fermeture. La vessie doit être irriguée et le film plastique changé à chaque changement de couche.
Une approche multidisciplinaire est importante. L’équipe devrait comprendre, sans s’y limiter, un urologue pédiatrique, un chirurgien orthopédiste pédiatrique, un anesthésiste-réanimateur pédiatrique, un néonatologiste, un psychiatre pédiatrique (ayant une expertise et une expérience des anomalies génitales) et des travailleurs sociaux. Des études ont démontré que les parents des patients atteints d’exstrophie subissent un niveau de stress important. Le stress des parents ne doit pas être négligé lors de la prise en charge initiale et à long terme du patient.24 Il convient de rassurer les parents: les enfants atteints d’exstrophie vésicale classique sont généralement des nourrissons en bonne santé et robustes, avec la perspective de mener une vie très normale. On peut s’attendre à une reconstruction efficace permettant le stockage, le drainage et le contrôle urinaires, avec un aspect esthétique acceptable. Le soutien des psychologues, des infirmiers et infirmières, et des parents d’autres enfants atteints d’exstrophie est inestimable.
Un néonatologue devrait évaluer le patient sur les plans pédiatrique général et cardiopulmonaire, compte tenu de la probabilité d’une chirurgie majeure dans les 48 premières heures de vie. Une échocardiographie est généralement réalisée afin d’exclure des anomalies cardiopulmonaires significatives qui contre-indiqueraient une reconstruction précoce. Une échographie rénale doit être réalisée pour évaluer les voies urinaires supérieures. Une radiographie KUB est réalisée pour évaluer l’anatomie osseuse du bassin et une échographie rachidienne pour exclure un dysraphisme spinal associé.
Il est essentiel qu’un chirurgien urologue pédiatrique, ayant de l’expérience et un intérêt particulier pour le complexe exstrophie-épispadias, évalue le nouveau-né atteint d’exstrophie, car l’impact d’une malformation congénitale majeure est significativement aggravé par une prise en charge initiale inappropriée.25,26,27
Chez les patients présentant une ambiguïté génitale en plus d’une exstrophie vésicale, les parents doivent être informés et conseillés par une équipe pluridisciplinaire spécialisée dans les troubles de la différenciation sexuelle, mais ils doivent comprendre que la nécessité de changer le sexe d’éducation dans l’exstrophie vésicale classique est quasi inexistante chez le nourrisson de sexe masculin compte tenu des résultats actuels de la chirurgie reconstructrice.
Étant donné que nombre de ces cas passent encore inaperçus jusqu’au moment de l’accouchement, la plupart nécessiteront un transfert vers un centre spécialisé dans l’exstrophie vésicale peu après la naissance. Pendant le transport, la vessie doit être protégée par une membrane plastique transparente et maintenue humide afin de préserver la muqueuse vésicale fragile.
Reconstruction chirurgicale
Les objectifs de la reconstruction chirurgicale chez le patient atteint d’exstrophie sont de corriger les malformations urogénitales en fournissant un réservoir adéquat pour le stockage urinaire à basse pression, capable de se vider complètement sans compromettre la fonction rénale, de créer des organes génitaux externes fonctionnels et acceptables sur le plan esthétique, et d’optimiser la qualité de vie du patient.
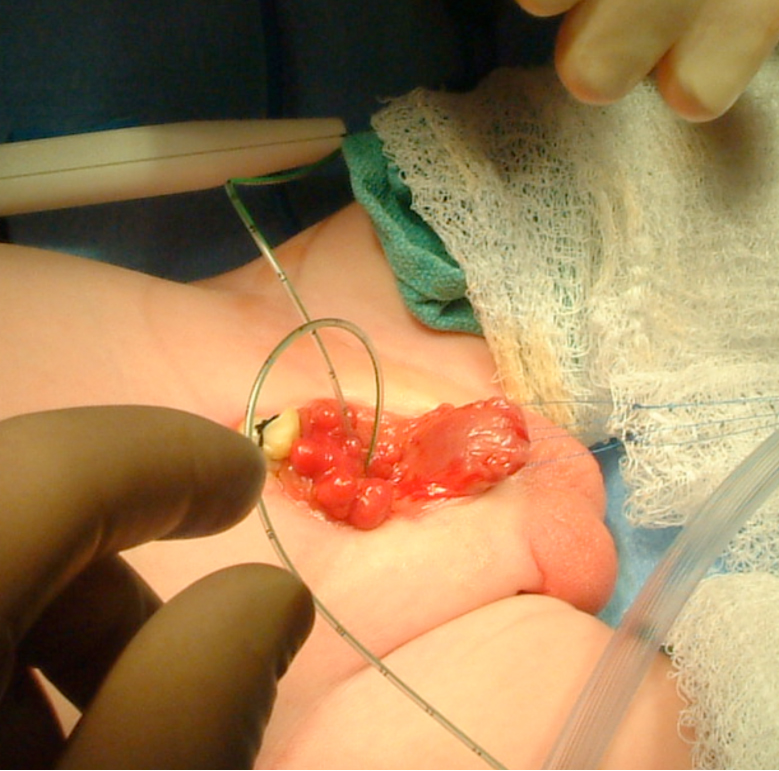
Figure 7 Cathétérisme des orifices urétéraux bilatéraux en préparation de la dissection.
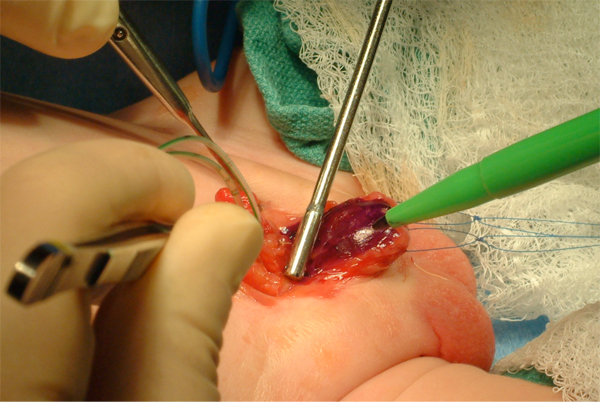
Figure 8 Marquage de la plaque urétrale. Remarquez deux points de traction sur chaque hémi-gland.
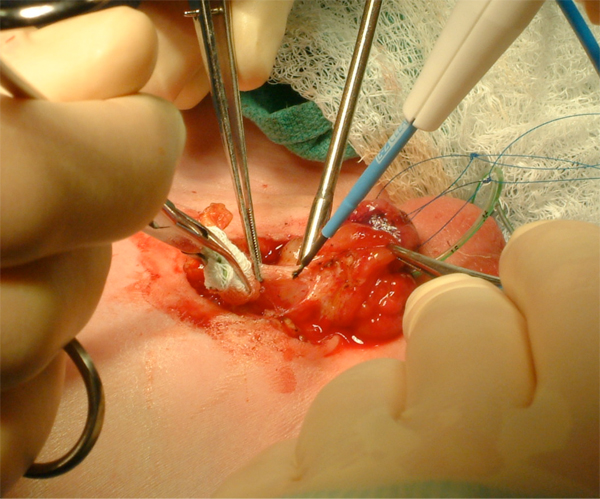
Figure 9 Mobilisation vésicale agressive, incluant l’ombilic.
Les premières tentatives de reconstruction de l’exstrophie vésicale ont été infructueuses et les patients avaient une espérance de vie courte. Par conséquent, pendant de nombreuses années, la prise en charge de l’exstrophie a consisté en l’ablation de la vessie exstrophique et une dérivation urinaire, le plus souvent par urétérosigmoïdostomie. Diverses réparations en plusieurs temps ont commencé à montrer des succès précoces dans les années 1950.Dans les années 1970, les concepts préliminaires de la réparation en plusieurs temps utilisés aujourd’hui ont été élaborés. Cela a évolué vers la réparation moderne en plusieurs temps de l’exstrophie, qui est couramment utilisée aujourd’hui.28 À la fin des années 1980, une approche anatomique de la réparation de l’exstrophie a vu le jour et a été modifiée pour devenir ce que l’on appelle aujourd’hui la réparation primaire complète de l’exstrophie, ou technique de Mitchell.29 Actuellement, la plupart des patients sont pris en charge soit par une réparation primaire complète de l’exstrophie (CPRE), soit par une reconstruction moderne en plusieurs temps de l’exstrophie (MSRE).28 De nombreux débats se poursuivent concernant le traitement optimal de l’exstrophie en période néonatale. Dans ce contexte, l’urétérosigmoïdostomie demeure une reconstruction populaire et privilégiée dans de nombreuses régions du monde, car elle permet d’obtenir de manière fiable la continence urinaire et est relativement sûre pour les personnes n’ayant pas accès à des établissements de santé fiables ou à un centre spécialisé dans l’exstrophie.
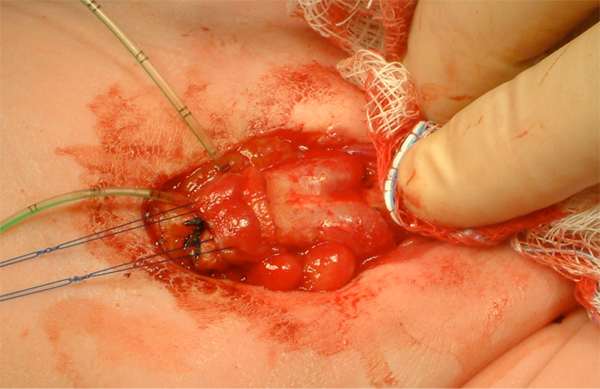
Figure 10 Identification des corps caverneux bilatéraux après déglovage du phallus.
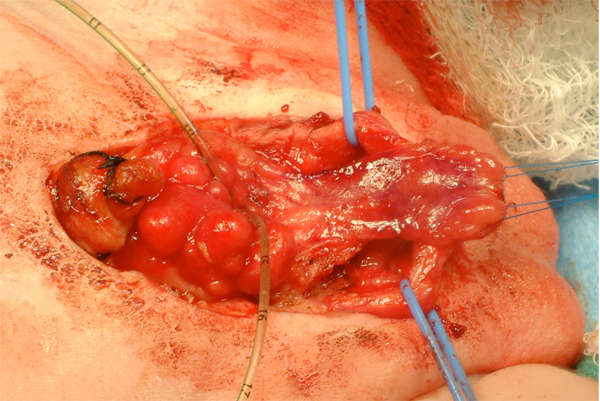
Figure 11 Après séparation des corps caverneux et mobilisation de la plaque urétrale.
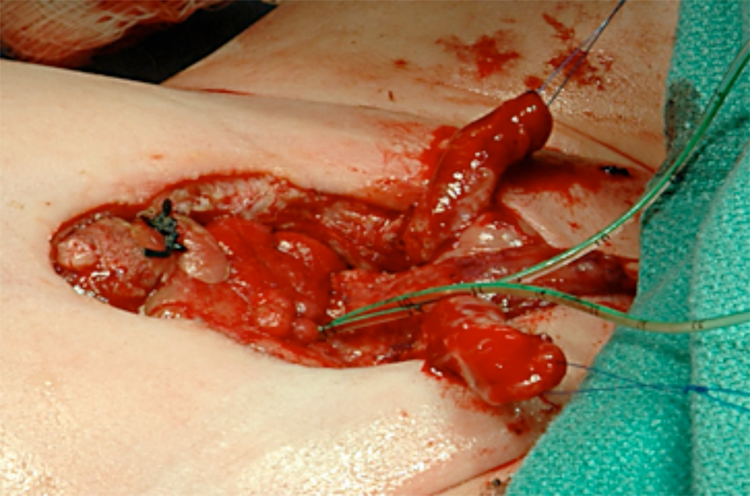
Figure 12 Après séparation complète des corps caverneux et du gland.
Réparation primaire complète de l’exstrophie
La CPRE est l’évolution la plus récente de la prise en charge chirurgicale des patients atteints d’exstrophie vésicale, mise au point par le Dr Mitchell en 1989.30 Cette approche a été adoptée et reproduite par de nombreux centres d’excellence pour la prise en charge de l’exstrophie. Dans la CPRE, une approche anatomique de la reconstruction comprend la fermeture vésicale avec remodelage du col vésical et une technique de désassemblage pour la réparation de l’épispadias, avec ou sans ostéotomies, en un seul temps opératoire. On considère que cela permet un cyclage vésical et une croissance et un développement plus ‘normaux’ parce que la vessie rencontre une résistance à l’évacuation. La technique de désassemblage pour la réparation de l’épispadias permet également la section des ligaments intersymphysaires et le positionnement anatomique approprié du col vésical et de l’urètre postérieur, profondément dans le bassin, en position orthotopique.Lorsqu’elle est réalisée dans les 72 premières heures de vie, le bassin est suffisamment malléable pour être refermé sans ostéotomies. Les patients nécessitent tout de même une traction de Bryant pendant environ 1 semaine, puis une mise en plâtre des membres inférieurs pendant 3 semaines afin d’éviter toute tension sur la fermeture pelvienne. L’incidence des désunions et du prolapsus vésical est rare à l’ère moderne.
Le CPRE est préconisé comme une approche visant à permettre un développement maximal de la vessie et à identifier les patients dont la vessie grandira et se développera plus tôt que chez ceux pris en charge de manière échelonnée. La normalisation de l’anatomie lors de la fermeture initiale juste après la naissance peut avoir d’autres bénéfices, tels que la réduction du traumatisme psychosocial de la famille. Les patients chez qui la vessie se développe subiront probablement moins d’interventions qu’avec une approche échelonnée.
La continence après la CPRE a été rapportée à 76 %, définie comme des intervalles sans fuite de plus de 2 heures et une miction spontanée sans sondages. Cependant, un pourcentage significatif de patients nécessitera probablement encore une intervention formelle sur le col vésical pour obtenir la continence. Dans une autre série, 75 % des patients après la CPRE étaient continents, avec des intervalles de 4 heures et secs la nuit, 31,3 % nécessitant des sondages intermittents propres.
Les préoccupations concernant la CPRE tiennent au risque potentiel de détérioration rénale due à un bas appareil urinaire à haute pression, au risque de lésion pénienne ou de perte du pénis lors du désassemblage à un si jeune âge, et à la nécessité de multiples interventions malgré l’appellation « réparation complète ». Un suivi rapproché des voies urinaires supérieures est important dans l’exstrophie, indépendamment de la réparation. Hydronéphrose, pyélonéphrite et cicatrices rénales sont observées après la CPRE et doivent être prises en charge de manière énergique par des antibiotiques prophylactiques, le reflux vésico-urétéral étant attendu en postopératoire. Le suivi à long terme dans la série de Seattle montre que des hydronéphroses légères (45 %), modérées (17,8 %) et sévères (7,1 %) sont observées après CPRE. Cependant, chez la moitié des patients présentant une hydronéphrose, et chez tous ceux avec hydronéphrose sévère, elle était transitoire. Borer et ses collaborateurs ont rapporté une incidence de pyélonéphrite de 28 % et de cicatrices rénales au DMSA de 19 % après CPRE.31 La nécessité d’une réimplantation urétérale bilatérale après CPRE, en excluant celles réalisées au moment de la réparation du col vésical, est estimée à 25–34 %.31,32,33
Environ 36–68% des patients présenteront un hypospadias après la CPRE qui nécessitera une chirurgie pénienne supplémentaire.30,34,31,32,33 La nécrose du gland, la perte de peau pénienne et/ou la perte de tissu pénien ont été rapportées après la CPRE, mais ces complications sont assez rares lorsque la CPRE est réalisée dans des centres d’excellence pour l’exstrophie.
Une revue systématique récente a examiné les résultats de dix groupes utilisant la technique CPRE avec 236 patients. La réparation de l’hypospadias a été nécessaire pour la plupart des garçons ayant bénéficié d’un désassemblage pénien complet (22.7–68 %). Une réimplantation urétérale a été nécessaire comme procédure distincte dans 48–66%. La plupart des enfants ont également, à terme, nécessité une reconstruction du col vésical pour la continence. Globalement, une miction, sans BNR, a été observée chez 16–37 % des enfants dans les séries rapportées.
Comparer le nombre d’interventions qu’un patient peut être amené à subir est un sujet controversé lorsqu’on compare la CPRE et la MSRE. Les rapports varient largement quant au nombre et aux types d’interventions, et ils sont entachés de biais potentiels, ce qui rend difficile de tirer de véritables conclusions sur ce sujet. Cependant, il est admis que les patients pris en charge selon une approche CPRE ou MSRE nécessiteront probablement plusieurs interventions, et les résultats sont meilleurs s’ils sont pris en charge dans un centre d’excellence pour l’exstrophie.
En 2013, le Consortium multi-institutionnel sur l’exstrophie vésicale (MIBEC) a été créé pour affiner la CPRE, réduire les complications et améliorer les résultats. Depuis lors, le MIBEC a réussi à mettre en commun les résultats (tant avant qu’après la création du consortium) afin d’étudier plus en profondeur cette affection relativement rare et d’évaluer de manière critique leur technique. Grâce au consortium, des urologues pédiatriques travaillent en collaboration comme “coachs chirurgicaux” au sein de l’établissement hôte afin de conjuguer l’expertise de plusieurs experts.
D’autres groupes ont adopté cette approche collaborative pour le traitement chirurgical de l’exstrophie vésicale. Par exemple, la Pediatric Urology Midwest Alliance (PUMA) a mis en commun ses résultats afin d’évaluer les résultats de l’augmentation vésicale/de la dérivation urinaire et la nécessité d’un sondage intermittent propre.
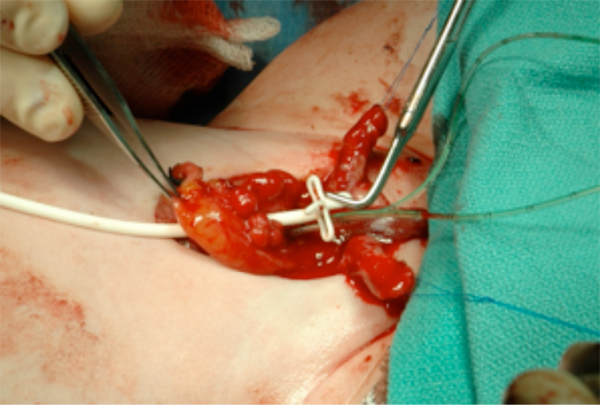
Figure 13 Mise en place d’une sonde sus-pubienne avant la fermeture de la vessie. Elle sortira de l’abdomen au niveau de l’ombilic.
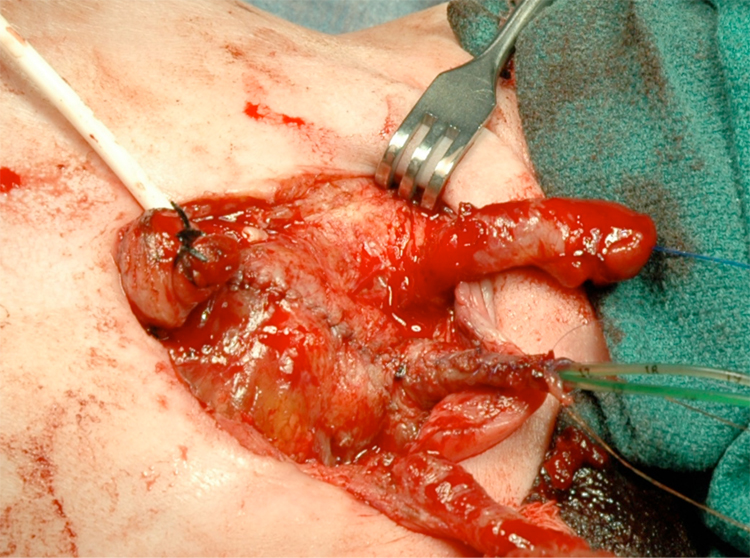
Figure 14 Vessie et urètre fermés en deux plans, en un seul bloc. À noter la présence de cathéters urétéraux bilatéraux sortant par le méat urétral.
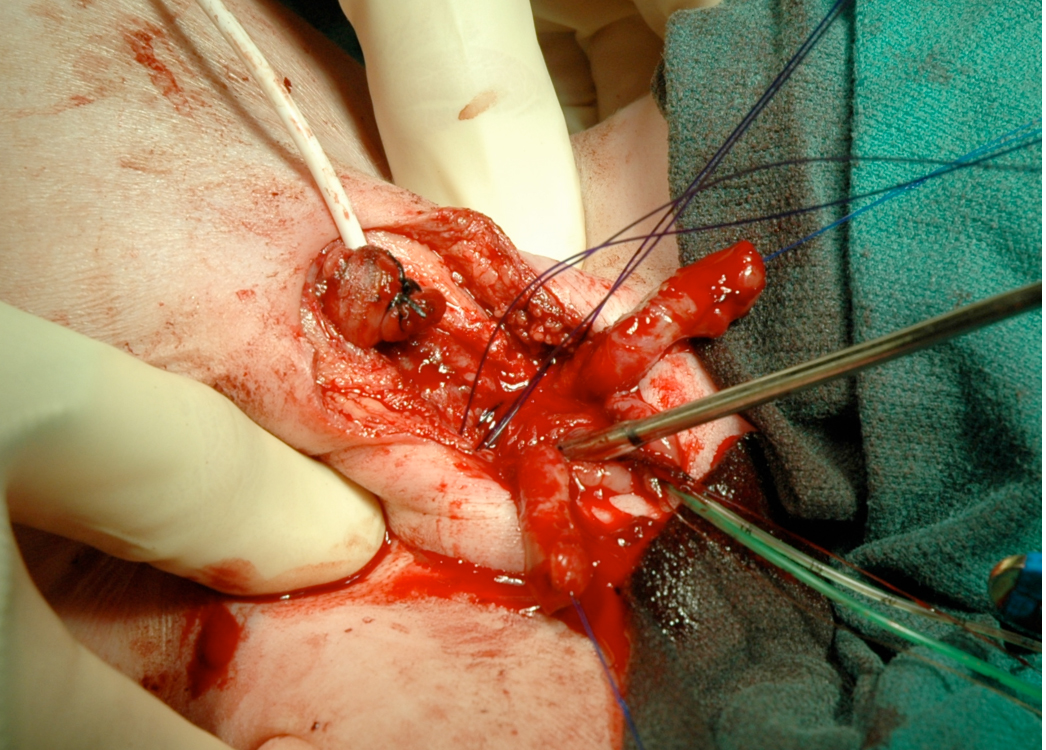
Figure 15 La rotation interne du bassin visant à rapprocher les os pubiens peut être réalisée lorsque la reconstruction est effectuée dans les 72 premières heures de vie.
Reconstruction moderne en plusieurs étapes de l’exstrophie
La MSRE telle qu’elle est actuellement pratiquée a évolué à partir des travaux initiaux de Cendron et Jeffs.25,26 Le groupe de Hopkins, dirigé par le Dr Gearhart, possède actuellement la plus vaste cohorte de patients atteints d’exstrophie et publie la majorité de la littérature concernant la MSRE. Dans la MSRE, l’objectif lors de la reconstruction initiale est de convertir la vessie exstrophique en un épispadias complet. Des ostéotomies pelviennes sont réalisées conjointement avec la fermeture vésicale lorsque cela est indiqué. On considère que cela permet une protection contre la dysfonction rénale parce que le patient reste incontinent, mais peut également stimuler la croissance vésicale puisqu’il existe désormais une certaine résistance urétrale. La réparation de l’épispadias est réalisée entre 6-12 mois de vie et une stimulation par testostérone est administrée en préopératoire. La réparation du col vésical en vue de la continence est effectuée entre 4-5 ans si la capacité vésicale est adéquate et si le patient est jugé prêt à participer à un programme mictionnel postopératoire.35 Si ces critères ne sont pas remplis, le patient est laissé incontinent jusqu’à ce que la vessie croisse et que la maturité s’améliore, ou bien il est dérivé avec une augmentation avec un conduit cathétérisable et fermeture du col vésical si nécessaire.
Les taux de continence après MSRE sont rapportés par Gearhart à 70 % chez les hommes et à 74 % chez les femmes, avec des périodes d’absence de fuite supérieures à 3 heures, des mictions spontanées et un état sec la nuit sans CIC.35 Ils ont conclu qu’une capacité vésicale de 100 ml prédit la réussite au moment de la reconstruction du col vésical en utilisant la réparation modifiée de Young-Dees-Leadbetter. Cela a augmenté la probabilité de continence et le délai pour atteindre la continence dans leurs revues.35,36 Si cette capacité de 100 ml n’est pas atteinte, il est estimé qu’ils devraient subir une augmentation au moment de la reconstruction pour la continence. Ils ont également constaté que les femmes étaient plus susceptibles d’atteindre la continence et dans un délai plus court après la reconstruction du col vésical.36 Leurs rapports montrent également des taux de complications similaires et faibles. Chez les hommes, après fermeture vésicale, réparation de l’épispadias et reconstruction du col vésical, le taux global de complications était de 41,7 % avec un cas d’échec de fermeture primaire.35 Chez les femmes, après fermeture vésicale et reconstruction du col vésical, le taux global de complications était de 19,5 %.36 Dans leur série moderne, en cas de croissance vésicale réussie, 19,4 % des hommes et 17 % des femmes ont présenté un échec de la reconstruction du col vésical et ont subi ou nécessiteront une augmentation avec stomie cathétérisable et fermeture du col vésical selon les indications.35,36
Dans la MSRE, si la capacité vésicale d’un patient n’évolue pas jusqu’au niveau prédisant le succès d’une reconstruction du col vésical, le patient passe directement à une augmentation vésicale pour la continence. Cela est raisonnable mais brouille les comparaisons entre la MSRE et la CPRE. La MSRE rapporte ceux qui complètent la série. Comme la CPRE réalise un geste de continence lors de la fermeture initiale, elle inclut des patients dont la vessie peut ne pas s’être développée et qui n’auraient jamais été candidats à une reconstruction du col vésical s’ils avaient été pris en charge selon la MSRE. De plus, il est difficile de déterminer combien, le cas échéant, de ces vessies qui n’ont pas atteint une capacité de 100 ml à l’âge de la continence auraient augmenté de taille si elles avaient bénéficié d’une CPRE lors de la fermeture initiale, avec une résistance de sortie accrue disponible pour favoriser le développement. Il peut également exister un certain sous-groupe de vessies d’exstrophie qui sont ‘mauvaises’ et ne croîtront pas, quelle que soit la technique de fermeture, mais qui ne peuvent pas être identifiées à la naissance. Ces facteurs rendent difficile la définition du succès et de l’échec lors de la comparaison des techniques. Des analyses prospectives supplémentaires à long terme doivent se poursuivre de manière impartiale et ouverte afin de favoriser l’échange d’idées qui, espérons-le, mènera aux prochaines avancées dans la prise en charge de l’exstrophie et continuera d’améliorer la qualité de vie de ces patients.
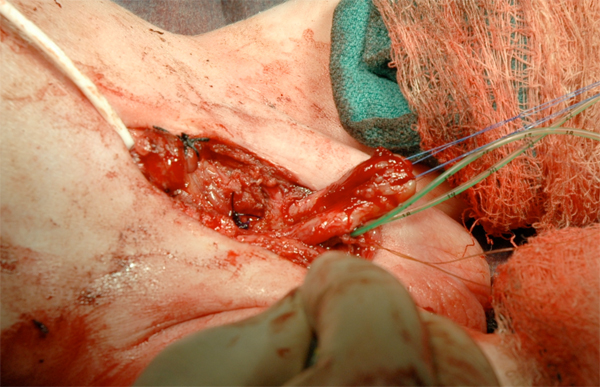
Figure 16 Reconstruction du phallus.
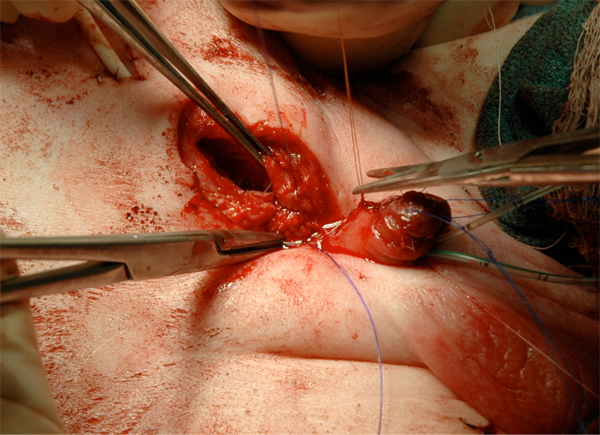
Figure 17 Fermeture fasciale.
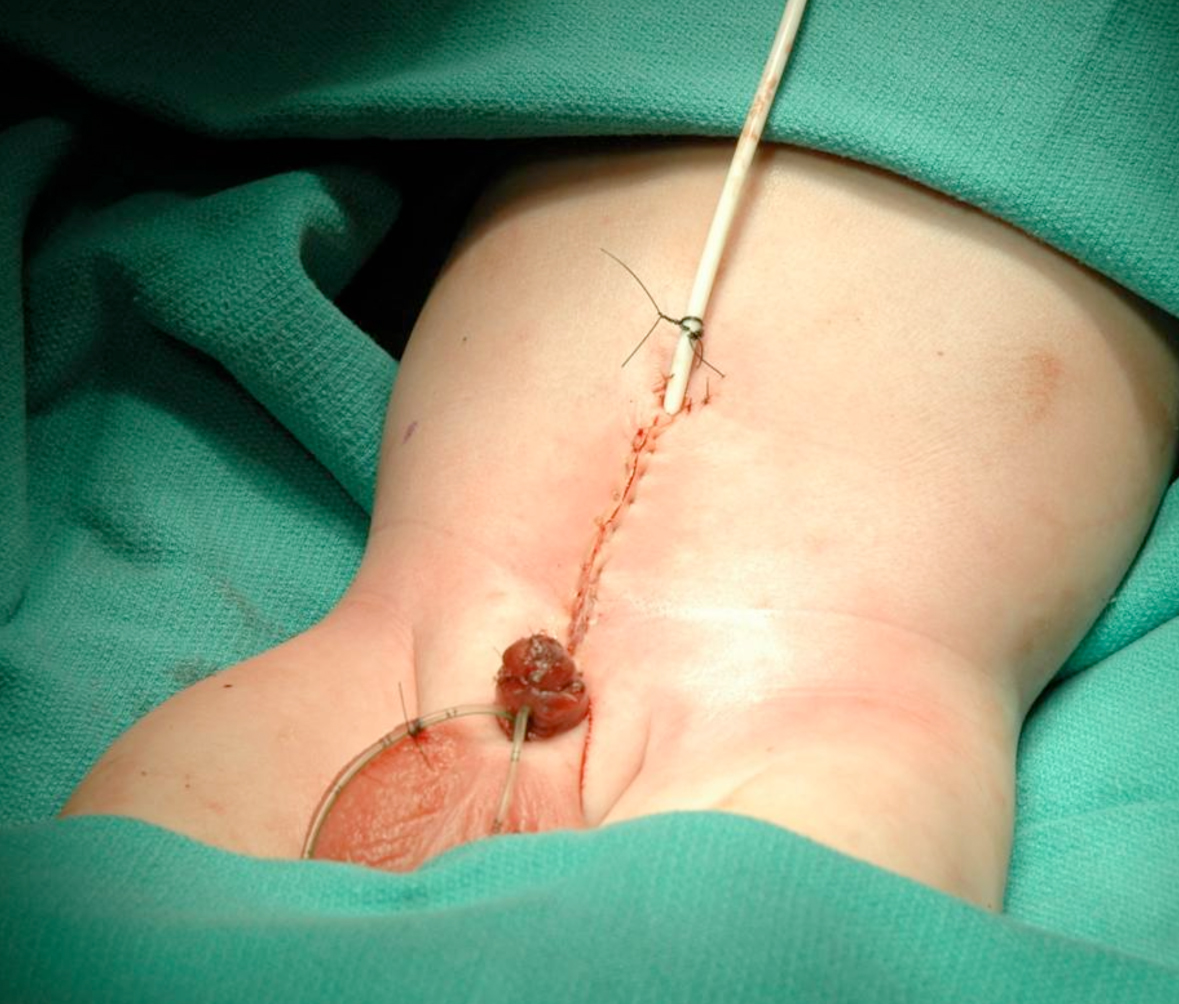
Figure 18 Fermeture de la paroi abdominale.
Résumé des principes convenus de la reconstruction chirurgicale
- La prise en charge doit être effectuée dans un centre d’excellence pour l’exstrophie, avec une équipe multidisciplinaire possédant l’expérience et l’engagement nécessaires pour assurer la prise en charge à long terme de ces patients.
- La plaque vésicale doit être maintenue humide et recouverte de film plastique après la naissance jusqu’à la fermeture
- Une fermeture primaire précoce réussie est primordiale pour obtenir la continence ultérieure
- Des ostéotomies sont nécessaires si la fermeture pelvienne est réalisée après > 72 heures de vie
- Une surveillance étroite des voies urinaires supérieures est importante après la fermeture vésicale
- Plusieurs interventions sont nécessaires pour obtenir la continence et reconstruire l’anatomie
- Une augmentation vésicale, avec ou sans stomie cathétérisable, et une fermeture du col vésical peuvent être nécessaires chez ceux qui n’obtiennent pas la continence ou une capacité vésicale > 100 mL avant la reconstruction du col vésical.
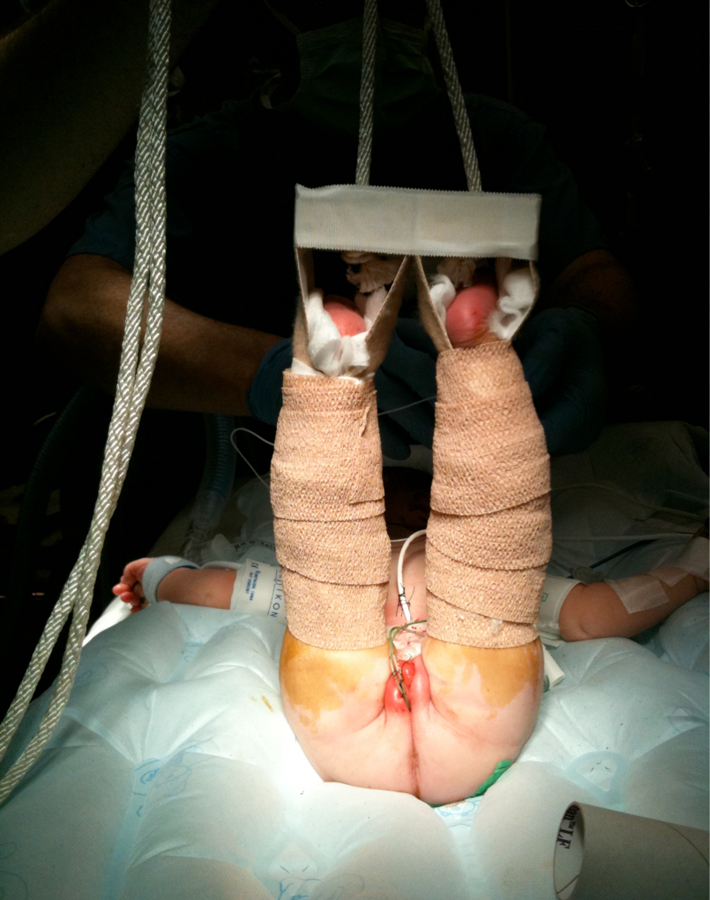
Figure 19 Traction de Bryant modifiée.
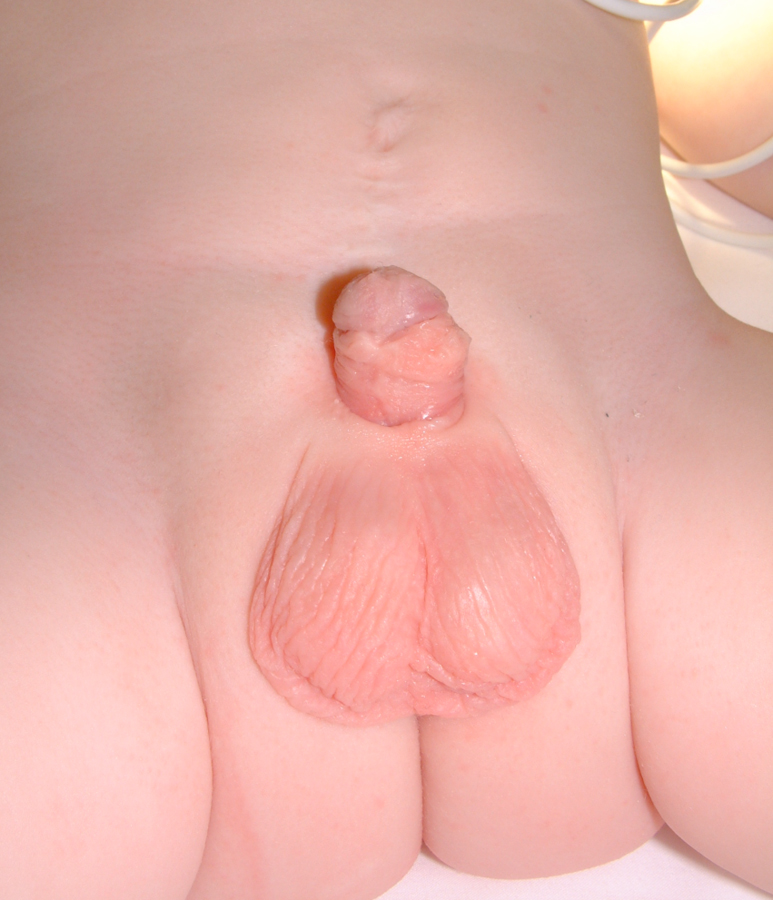
Figure 20 Postopératoire.
Fonction sexuelle chez le patient atteint d’exstrophie
Des cas ont été rapportés de patients adultes de sexe masculin atteints d’exstrophie ayant engendré ou initié une grossesse. Cela montre que la fertilité est possible chez ces patients, bien que ce ne soit pas courant. La vaste série de Shapiro portant sur 2 500 patients n’a recensé que 38 hommes ayant engendré des enfants.3 Des études de spermogrammes comparant des hommes ayant subi une réparation primaire à ceux ayant bénéficié d’une dérivation par urétérosigmoïdostomie n’ont retrouvé une numération spermatique normale que chez un sur huit dans le groupe de fermeture et chez quatre sur huit dans le groupe de dérivation. Ces différences ont été attribuées à l’éjaculation rétrograde et aux lésions iatrogènes survenues lors de la fermeture fonctionnelle de la vessie. Une autre étude a constaté qu’aucun de leurs patients reconstruits ne pouvait éjaculer normalement, ni n’avait engendré des enfants. Cinq patients n’ayant pas subi de reconstruction présentaient une éjaculation normale et deux avaient engendré des enfants. Cela conduit à la conclusion que le patient de sexe masculin présente un risque élevé d’infertilité après reconstruction. Le recours à la procréation assistée, quelle qu’en soit la modalité, s’est avéré efficace chez 13 hommes atteints d’exstrophie et a permis d’obtenir une grossesse, sans incidence d’exstrophie chez la descendance.37
Woodhouse a rapporté que la fonction sexuelle et la libido chez le patient atteint d’exstrophie sont normales.38 Plusieurs rapports montrent que la fonction érectile est préservée chez une grande majorité après reconstruction urétrale et phallique, et que l’éjaculation est souvent anormale mais généralement présente. La plupart ont rapporté des orgasmes satisfaisants et ont décrit leurs relations intimes comme sérieuses et de longue durée.39 Cependant, une étude récente utilisant une enquête anonyme sur les réseaux sociaux auprès des hommes de l’Association for the Bladder Exstrophy Communities rapporte que le Penile Perception Score et l’International Index of Erectile Function sont inférieurs aux témoins publiés. Fait intéressant, un Penile Perception Score plus élevé était corrélé à un score IIEF-15 (satisfaction sexuelle) plus élevé. Des études récentes de Rubenwolf et al démontrent que la satisfaction sexuelle des hommes et des femmes adultes après une dérivation continente semble être comparable à celle de ceux chez qui la vessie est préservée, la majorité étant en relation stable.40
Les organes génitaux externes féminins sont désormais systématiquement entièrement reconstruits au moment de la fermeture de l’exstrophie. Auparavant, cette reconstruction consistait en une réapproximation esthétique du clitoris bifide et des lèvres antérieures pour former une fourchette vulvaire, mais elle n’abordait pas l’anomalie anatomique intrinsèque de la position et de l’angle du vagin par rapport à l’abdomen et au périnée chez les patientes présentant une exstrophie. Des reconstructions complémentaires à l’adolescence, avant le début de l’activité sexuelle ou l’utilisation de tampons chez certaines patientes avec exstrophie, n’étaient pas rares. L’application de la mobilisation totale du complexe urogénital a été réalisée et a permis de corriger avec succès la position et l’angle du vagin chez les patientes atteintes d’exstrophie.18 Des rapports sexuels réussis ont été rapportés chez toutes les patientes dans une étude et une dyspareunie a été signalée chez une minorité.19 Une large série a également rapporté que les patientes atteintes d’exstrophie âgées de plus de 18 ans présentaient des désirs sexuels normaux et que beaucoup étaient sexuellement actives avec des orgasmes normaux. Certaines patientes se sentaient gênées et limitaient leur activité sexuelle en raison de l’aspect esthétique de leurs organes génitaux externes. La monsplastie constitue une partie importante de la reconstruction chez la femme, et l’utilisation de peau pilifère et de tissu adipeux pour couvrir le défaut médian est courante. Une réparation ultérieure faisant appel à des lambeaux rhomboïdes a été rapportée avec de bons résultats.41
Implications obstétricales et gynécologiques
De nombreuses femmes atteintes d’exstrophie vésicale ont donné naissance à une descendance normale (45 femmes avec 49 enfants dans un rapport).Une autre étude a porté sur 40 femmes, âgées de 19 à 36 ans, traitées pour une exstrophie vésicale lorsqu’elles étaient nourrissons, et parmi ces 40 femmes 14 grossesses ont été rapportées chez 11 femmes. Parmi ces 14 grossesses, on comptait 9 accouchements normaux, 3 fausses couches spontanées et 2 interruptions volontaires de grossesse. Un prolapsus utérin est survenu chez 7 des 11 patientes au cours de la grossesse. Il est très fréquent chez ces femmes d’observer un prolapsus du col et de l’utérus après la grossesse et l’accouchement.42 Dans ces premiers rapports, toutes les femmes avaient apparemment bénéficié auparavant de dérivations urinaires permanentes, mais des publications récentes montrent que des grossesses réussies ont été rapportées chez des femmes ayant subi des dérivations urinaires continentes. Des césariennes ont été réalisées chez des femmes avec des fermetures vésicales fonctionnelles afin de supprimer la contrainte sur le plancher pelvien et d’éviter des lésions traumatiques du mécanisme sphinctérien urinaire.42
Comme mentionné précédemment, le prolapsus des organes pelviens semble être un problème important chez les patientes atteintes d’exstrophie vésicale. Il est fréquemment observé pendant et après la grossesse ou l’accouchement, possiblement chez jusqu’à la moitié des patientes.19 Il peut survenir à un jeune âge et en l’absence d’activité sexuelle préalable ou de grossesse.19,43 Le déplacement antérieur de l’orifice vaginal et le déplacement postérieur marqué de la sangle dorsorectalis ainsi que la déficience de son compartiment antérieur ont été avancés comme explications des observations significatives de prolapsus.44 On estime que des techniques plus modernes de reconstruction du plancher pelvien, la remise en place anatomique de la vessie dans le bassin et le recours aux ostéotomies pourraient améliorer ce problème préoccupant. Des rapports antérieurs ont montré que la suspension utérine n’avait qu’un succès modeste dans la prévention des récidives de prolapsus.44 Cependant, Stein a rapporté que la fixation utérine par sacrocolpopexie a corrigé le prolapsus chez 13 femmes avec un suivi de plus de 25 ans.
Références
- Hsieh K, O’Loughlin MT, Ferrer FA. Bladder exstrophy and phenotypic gender determination on fetal magnetic resonance imaging. Urology 2005; 65 (5): 998–999. DOI: 10.1016/j.urology.2004.12.060.
- Stec AA, Pannu HK, Tadros YE, Sponseller PD, Fishman EK, Gearhart JP. Pelvic Floor Anatomy In Classic Bladder Exstrophy Using 3-dimensional Computerized Tomography: J Urol 2001; 166 (1444): 1444–1449. DOI: 10.1097/00005392-200110000-00066.
- Silver RI, Partin AW, Epstein JI, Chan DW, Carter HB, Jeffs RD, et al.. Prostate-specific antigen in men born with bladder exstrophy. Urology 1997; 49 (2): 253–256. DOI: 10.1016/s0090-4295(96)00438-4.
- Purves JT, Gearhart JP. The Bladder Exstrophy–epispadias–cloacal Exstrophy Complex. J Pediatr Urol 1999; 22 (8): 386–415. DOI: 10.1016/b978-1-4160-3204-5.00030-x.
- Schober JM, Carmichael PA, Hines M, Ransley PG. The Ultimate Challenge Of Cloacal Exstrophy. J Urol 2002; 167 (300): 300–304. DOI: 10.1097/00005392-200201000-00088.
- Lee RS, Grady R, Joyner B, Casale P, Mitchell M. Can a Complete Primary Repair Approach be Applied to Cloacal Exstrophy? J Urol 2006; 176 (6): 2643–2648. DOI: 10.1016/j.juro.2006.08.052.
- Ben-Chaim J, Peppas DS, Sponseller PD, Jeffs RD, Gearhart JP. Applications of Osteotomy in the Cloacal Exstrophy Patient. J Urol 1995; 5 (1): 865–867. DOI: 10.1097/00005392-199508000-00146.
- Silver RI, Sponseller PD, Gearhart JP. Staged Closure Of The Pelvis In Cloacal Exstrophy: First Description Of A New Approach. J Urol 1999; 161 (1): 263–266. DOI: 10.1016/s0022-5347(01)62128-1.
- Adams MC, Mitchell ME, Rink RC. Gastrocystoplasty: An Alternative Solution to the Problem of Urological Reconstruction in the Severely Compromised Patient. J Urol 1988; 140 (5 Part 2): 1152–1156. DOI: 10.1016/s0022-5347(17)41986-0.
- Hendren WH. Ileal Nipple for Continence in Cloacal Exstrophy. J Urol 1992; 148 (2 Part 1): 372–379. DOI: 10.1016/s0022-5347(17)36601-6.
- Tank ES, Lindenauer SM. Principles of management of exstrophy of the cloaca. Am J Surg 1970; 119 (1): 95–98. DOI: 10.1016/0002-9610(70)90018-8.
- Gearhart JP, Jeffs RD. Techniques to Create Urinary Continence in the Cloacal Exstrophy Patient. J Urol 1991; 146 (2 Part 2): 616–618. DOI: 10.1016/s0022-5347(17)37871-0.
- Ricketts RR, Woodard JR, Zwiren GT, Andrews HG, Broecker BH. Modern treatment of cloacal exstrophy. J Pediatr Surg 1991; 26 (4): 444–450. DOI: 10.1016/0022-3468(91)90993-4.
- Austin PF, Homsy YL, Gearhart JP, Porter K, Guidi C, Madsen K, et al.. The Prenatal Diagnosis Of Cloacal Exstrophy. J Urol 1998; 160 (1179): 1179–1181. DOI: 10.1097/00005392-199809020-00061.
- Hamada H, Takano K, Shiina H, Sakai T, Sohda S, Kubo T. New Ultrasonographic Criterion For The Prenatal Diagnosis Of Cloacal Exstrophy: Elephant Trunk-like Image. J Urol 1999; 162 (6): 2123–2124. DOI: 10.1016/s0022-5347(05)68138-4.
- Husmann DA, McLorie GA, Churchill BM. Phallic Reconstruction in Cloacae Exstrophy. J Urol 1989; 142 (2 Part 2): 563–564. DOI: 10.1016/s0022-5347(17)38816-x.
- Mathews, Perlman, Marsh, Gearhart. Gonadal morphology in cloacal exstrophy: implications in gender assignment. BJU Int 1999; 84 (1): 99–100. DOI: 10.1046/j.1464-410x.1999.00148.x.
- Reiner WG. Psychosexual development in genetic males assigned female: the cloacal exstrophy experience. Child Adolesc Psychiatr Clin N Am 2004; 13 (3): 657–674. DOI: 10.1016/j.chc.2004.02.009.
- Baker Towell DM, Towell AD. A Preliminary Investigation Into Quality of Life, Psychological Distress and Social Competence in Children With Cloacal Exstrophy. J Urol 2003; 169 (5): 1850–1853. DOI: 10.1097/01.ju.0000062480.01456.34.
- Taghizadeh A, Qteishat A, Cuckow PM. Restoring Hindgut Continuity in Cloacal Exstrophy: A Valuable Method of Optimising Bowel Length. Eur J Pediatr Surg 2009; 19 (03): 141–144. DOI: 10.1055/s-0029-1192048.
- Husmann DA, McLorie GA, Churchill BM. Closure of the Exstrophic Bladder: An Evaluation of the Factors Leading to its Success and its Importance on Urinary Continence. J Urol 1989; 142 (2 Part 2): 522–524. DOI: 10.1016/s0022-5347(17)38803-1.
- Levitt MA, Mak GZ, Falcone RA, Peña A. Cloacal exstrophy–pull-through or permanent stoma? J Pediatr Surg 2008; 43 (1): 164–170. DOI: 10.1016/j.jpedsurg.2007.09.039.
- Hurwitz RS, Manzoni GAM, Ransley PG, Stephens FD. Cloacal Exstrophy: A Report of 34 Cases. J Urol 1987; 138 (4 Part 2): 1060–1064. DOI: 10.1016/s0022-5347(17)43502-6.
- Thauvin-Robinet C, Faivre L, Cusin V, Khau Van Kien P, Callier P, Parker KL, et al.. Cloacal exstrophy in an infant with 9q34.1-qter deletion resulting from a de novo unbalanced translocation between chromosome 9q and Yq. Am J Med Genet 2004; 126a (3): 303–307. DOI: 10.1002/ajmg.a.20596.
- Rickham PP. Vesicointestinal Fissure. Anorectal Malformations in Children 1960; 35 (97): 239–249. DOI: 10.1007/978-3-540-31751-7_14.
- Mathews R, Jeffs RD, Reiner WG, Docimo SG, Gearhart JP. Cloacal Exstrophy-improving The Quality Of Life. J Urol 1998; 160 (2452): 2452–2456. DOI: 10.1097/00005392-199812020-00017.
- M K. OEIS Complex (Omphalocele, Exstrophy of Bladder, Imperforate Anus and Spine Defects). Journal of Human Anatomy 2001; 2 (1). DOI: 10.23880/jhua-16000122.
- Appignani BA, Jaramillo D, Barnes PD, Poussaint TY. Dysraphic myelodysplasias associated with urogenital and anorectal anomalies: prevalence and types seen with MR imaging. AJR Am J Roentgenol 1994; 163 (5): 1199–1203. DOI: 10.2214/ajr.163.5.7976901.
- McLaughlin KP, Rink RC, Kalsbeck JE, Keating MA, Adams MC, King SJ, et al.. Cloacal Exstrophy: The Neurological Implications. J Urol 1995; 154 (2): 782–784. DOI: 10.1016/s0022-5347(01)67162-3.
- Karrer FM, Flannery AM, Nelson MD, McLone DG, Raffensperger JG. Anorectal malformations: Evaluation of associated spinal dysraphic syndromes. J Pediatr Surg 1988; 23 (1): 45–48. DOI: 10.1016/s0022-3468(88)80538-4.
- Dick EA, Bruyn R de, Patel K, Owens CM. Spinal Ultrasound in Cloacal Exstrophy. Clin Radiol 2001; 56 (4): 289–294. DOI: 10.1053/crad.2000.0648.
- Husmann DA, Vandersteen DR, Mclorie GA, Churchill BM. Urinary Continence After Staged Bladder Reconstruction For Cloacal Exstrophy: The Effect Of Coexisting Neurological Abnormalities On Urinary Continence. J Urol 1999; 161 (5): 1598–1602. DOI: 10.1016/s0022-5347(05)68990-2.
- Schlegel PN, Gearhart JP. Neuroanatomy of the Pelvis in an Infant with Cloacal Exstrophy: A Detailed Microdissection with Histology. J Urol 1989; 141 (3 Part 1): 583–585. DOI: 10.1016/s0022-5347(17)40901-3.
- Cohen AR. The Mermaid Malformation: Cloacal Exstrophy and Occult Spinal Dysraphism. Neurosurgery 1991; 28 (6): 834–843. DOI: 10.1227/00006123-199106000-00008.
- Sponseller PD, Bisson LJ, Gearhart JP, Jeffs RD, Magid D, Fishman E. The anatomy of the pelvis in the exstrophy complex. J Bone Joint Surg Am 1995; 77 (2): 177–189. DOI: 10.2106/00004623-199502000-00003.
- Stec AAJ, Wakim A, Barbet P, McCarthy EF, Lakshmanan Y, Sponseller PD, et al.. Fetal bony pelvis in the bladder exstrophy complex: normal potential for growth? Urology 2003; 62 (2): 337–341. DOI: 10.1016/s0090-4295(03)00474-6.
- Williams AM, Solaiyappan M, Pannu HK, Bluemke D, Shechter G, Gearhart JP. 3-dimensional Magnetic Resonance Imaging Modeling Of The Pelvic Floor Musculature In Classic Bladder Exstrophy Before Pelvic Osteotomy. J Urol 2004; 172 (4 Part 2): 1702–1705. DOI: 10.1097/01.ju.0000140212.56826.4c.
- Sugar EC, Firlit CF. Management of cloacal exstrophy. Urology 1990; 32 (4): 320–322. DOI: 10.1016/0090-4295(88)90234-8.
- Greene WB, Dias LS, Lindseth RE, Torch MA. Musculoskeletal problems in association with cloacal exstrophy. J Bone Joint Surg Am 1991; 73 (4): 551–560. DOI: 10.2106/00004623-199173040-00012.
- Baird AD, Nelson CP, Gearhart JP. Modern staged repair of bladder exstrophy. J Pediatr Urol 2007; 3 (311). DOI: 10.18591/bjuik.0243.
- Purves JT, Baird AD, Gearhart JP. The modern staged repair of bladder exstrophy in the female: A contemporary series. J Pediatr Urol 2008; 4 (2): 150–153. DOI: 10.1016/j.jpurol.2007.08.003.
- Hanna MK, Williams DI. Genital Function In Males With Vesical Exstrophy And Epispadias. Br J Urol 1969; 44 (2): 169–174. DOI: 10.1111/j.1464-410x.1972.tb10062.x.
- Stein R, Stöckle M, Fisch M, Nakai H, Müller SC, Hohenfellner R. The Fate Of The Adult Exstrophy Patient. J Urol 1994; 152 (5 Part 1): 1413–1416. DOI: 10.1016/s0022-5347(17)32433-3.
- Bastuba MD, Alper MM, Oates RD. Fertility and the use of assisted reproductive techniques in the adult male exstrophy/epispadias patient. Fertil Steril 1993; 60 (4): 733–736. DOI: 10.1016/s0015-0282(16)56234-7.
- Woodhouse CRJ. Sexual function in boys born with exstrophy, myelomeningocele, and micropenis. Urology 1998; 52 (1): 3–11. DOI: 10.1016/s0090-4295(98)00121-6.
- Ben-Chaim J, Jeffs RD, Reiner WG, Gearhart JP. The Outcome of Patients with Classic Bladder Exstrophy in Adult Life. The Exstrophy–Epispadias Complex 1996; 155 (1251): 169–173. DOI: 10.1007/978-1-4757-3056-2_26.
- Kropp BP, Cheng EY. Total Urogenital Complex Mobilization In Female Patients With Exstrophy. J Urol 2000; 164 (1035): 1035–1039. DOI: 10.1097/00005392-200009020-00028.
- Woodhouse CRJ. The gynaecology of exstrophy. BJU Int 1999; 83 (S3): 34–38. DOI: 10.1046/j.1464-410x.1999.0830s3034.x.
- Mathews RI, Gan M, Gearhart JP. Urogynaecological and obstetric issues in women with the exstrophy-epispadias complex. BJU Int 2003; 91 (9): 845–849. DOI: 10.1046/j.1464-410x.2003.04244.x.
- Canalichio KL, Ahn J, Artigas P, Amies Oelschlager A-ME, Rowe C, Merguerian P, et al.. Patient-reported outcomes in adult females with bladder exstrophy: A study of long-term sexual, reproductive and urinary outcomes using social media. J Pediatr Urol 2020; 16 (5): 567.e1–567.e7. DOI: 10.1016/j.jpurol.2020.06.020.
- Canalichio KL, Ahn J, Hwang C, Amies AM, Merguerian P, Shnorhavorian M. Faculty Opinions recommendation of Long-term urological and gynecological outcomes following complete primary repair in females with bladder exstrophy. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2021; 7 (5): 08 1–608 8. DOI: 10.3410/f.740664374.793590655.
- Giron AM, Passerotti CC, Nguyen H, Cruz JASda, Srougi M. Bladder exstrophy: reconstructed female patients achieving normal pregnancy and delivering normal babies. Int Braz J Urol 2011; 37 (5): 605–610. DOI: 10.1590/s1677-55382011000500006.
- Kramer SA, Jackson IT. Bilateral Rhomboid Flaps for Reconstruction of the External Genitalia in Epispadias-Exstrophy. Plast Reconstr Surg 1986; 77 (4): 621–629. DOI: 10.1097/00006534-198604000-00019.
- Krisiloff M, Puchner PJ, Tretter W, Macfarlane MT, Lattimer JK. Pregnancy in Women with Bladder Exstrophy. J Urol 1978; 119 (4): 478–479. DOI: 10.1016/s0022-5347(17)57522-9.
- Burbige KA, Hensle TW, Chambers WJ, Leb R, Jeter KF. Pregnancy and sexual function in women with bladder exstrophy. Urology 1986; 28 (1): 12–14. DOI: 10.1016/0090-4295(86)90172-x.
- Kennedy WA, Hensle TW, Reiley EA, Fox HE, Haus T. Pregnancy after orthotopic continent urinary diversion. Int J Gynaecol Obstet 1993; 46 (1): 88–89. DOI: 10.1016/0020-7292(94)90337-9.
- Stein R, Fisch M, Bauer H, Friedberg V, Hohenfellner R. Operative Reconstruction of the External and Internal Genitalia in Female Patients with Bladder Exstrophy or Incontinent Epispadias. J Urol 1995; 154 (1002): 1002–1007. DOI: 10.1097/00005392-199509000-00026.
- Mednick L, Gargollo P, Oliva M, Grant R, Borer J. Stress and Coping of Parents of Young Children Diagnosed With Bladder Exstrophy. J Urol 2009; 181 (3): 1312–1317. DOI: 10.1016/j.juro.2008.10.051.
- Meldrum KK, Mathews RI, Nelson CP, Gearhart JP. Subspecialty training and surgical outcomes in children with failed bladder exstrophy closure. J Pediatr Urol 2005; 1 (2): 95–99. DOI: 10.1016/j.jpurol.2005.01.002.
- Nelson CP, North AC, Ward MK, Gearhart JP. Economic Impact of Failed or Delayed Primary Repair of Bladder Exstrophy: Differences in Cost of Hospitalization. J Urol 2008; 179 (2): 680–683. DOI: 10.1016/j.juro.2007.09.093.
- Nelson CP, Dunn RL, Wei JT, Gearhart JP. Surgical Repair Of Bladder Exstrophy In The Modern Era: Contemporary Practice Patterns And The Role Of Hospital Case Volume. J Urol 2005; 174 (3): 1099–1102. DOI: 10.1097/01.ju.0000169132.14799.33.
- Bethell G, Johal N, Cuckow P. Cloacal Exstrophy Repair with Primary Closure of Bladder Exstrophy: A Case Report and Review of Literature. Case Rep Pediatr 1952; 2016 (654): 1–3. DOI: 10.1155/2016/8538935.
- Cendron l., Zanotti G, Percudani R, Ramazzina I, Puggioni V, Maccacaro E, et al.. Crystal structure of allantoin racemase from Pseudomonas fluorescens AllR. Ann Chir Infant 1971; 12 (371). DOI: 10.2210/pdb5lfd/pdb.
- Jeffs RD, Charrios R, Mnay M. Primary closure of the exstrophied bladder. In: Scott R, editor. Current Controversies in Urologic Management. Philadelphia:WB Saunders; 1972. DOI: 10.1097/00006534-195701000-00025.
- Landes RR, Melnick I, Klein R. Vesical exstrophy with epispadias twenty-year follo-up. Urology 1973; 9 (1): 53–56. DOI: 10.1016/0090-4295(77)90285-0.
- Gearhart JP, Jeffs RD. State-of-the-Art Reconstructive Surgery for Bladder Exstrophy at The Johns Hopkins Hospital. Arch Pediatr Adolesc Med 1989; 143 (12): 1475. DOI: 10.1001/archpedi.1989.02150240097026.
- Grady RW, Mitchell ME. Complete Primary Repair Of Exstrophy. J Urol 1999; 162 (4): 1415–1420. DOI: 10.1016/s0022-5347(05)68327-9.
- Chan DY, Jeffs RD, Gearhart JP. Determinants of continence in the bladder exstrophy population: predictors of success? Urology 2001; 57 (4): 774–777. DOI: 10.1016/s0090-4295(00)01102-x.
- Stein R, Fisch M, Black P, Hohenfellner R. Strategies For Reconstruction After Unsuccessful Or Unsatisfactory Primary Treatment Of Patients With Bladder Exstrophy Or Incontinent Epispadias. J Urol 1999; 161 (1934): 1934–1941. DOI: 10.1097/00005392-199906000-00066.
- Grady RW, Mitchell ME. Surgical techniques for one-stage reconstruction of the exstrophy-epispadias complex. In: Wein AJ, Kavoussi LR, Novick AC, Partin AW, Peters CA, editors. Campbell-Walsh Urology. Philadelphia: Saunders; 2007.
- Husmann DA. Surgery Insight: advantages and pitfalls of surgical techniques for the correction of bladder exstrophy. Nat Clin Pract Urol 2006; 3 (2): 95–100. DOI: 10.1038/ncpuro0407.
- Kibar Y, Roth CC, Frimberger D, Kropp BP. Our initial experience with the technique of complete primary repair for bladder exstrophy. J Pediatr Urol 2009; 5 (3): 186–189. DOI: 10.1016/j.jpurol.2008.11.005.
- Mitchell ME. Bladder exstrophy repair: Complete primary repair of exstrophy. Urology 2005; 65 (1): 5–8. DOI: 10.1016/j.urology.2004.07.030.
- Gargollo PC, Borer JG, Diamond DA, Hendren WH, Rosoklija I, Grant R, et al.. Prospective Followup in Patients After Complete Primary Repair of Bladder Exstrophy. J Urol 2008; 180 (4s): 1665–1670. DOI: 10.1016/j.juro.2008.05.076.
- Shnorhavorian M, Grady RW, Anderson A. Long-Term Followup of Complete Primary Repair of Exstrophy: The Seattle Experience. Yearbook of Urology 2008; 2009 (1615): 214–215. DOI: 10.1016/s0084-4071(09)79240-1.
- Hafez AT, El-Sherbiny MT. Complete Repair Of Bladder Exstrophy: Management Of Resultant Hypospadias. J Urol 2005; 173 (3): 958–961. DOI: 10.1097/01.ju.0000147012.49955.6f.
- Gearhart JP, Baird AD. The Failed Complete Repair Of Bladder Exstrophy: Insights And Outcomes. J Urol 2005; 174 (4 Part 2): 1669–1673. DOI: 10.1097/01.ju.0000175994.35468.2f.
- Gargollo PC, Borer JG. Contemporary outcomes in bladder exstrophy. Curr Opin Urol 2007; 17 (4): 272–280. DOI: 10.1097/mou.0b013e3281ddb32f.
- Shapiro E, Jeffs RD, Gearhart JP, Lepor H. Muscarinic Cholinergic Receptors in Bladder Exstrophy: Insights Into Surgical Management. J Urol 1985; 134 (2): 308–310. DOI: 10.1016/s0022-5347(17)47139-4.
- Lee BR, Perlman EJ, Partin AW, Jeffs RD, Gearhart JP. Evaluation of Smooth Muscle and Collagen Subtypes in Normal Newborns and Those With Bladder Exstrophy. J Urol 1996; 156 (203): 2034–2036. DOI: 10.1097/00005392-199612000-00042.
- Peppas DS, Tchetgen M-B, Lee BR, Jeffs RD, Gearhart JP. A Quantitative Histological Analysis of the Bladder in Classical Bladder Exstrophy in Various Stages of Reconstruction Utilizing Color Morphometry. The Exstrophy–Epispadias Complex 1999; 1999 (41): 41–47. DOI: 10.1007/978-1-4757-3056-2_7.
- Lais A, Paolocci N, Ferro F, Bosman C, Boldrini R, Caione P. Morphometric Analysis of Smooth Muscle in the Exstrophy-Epispadias Complex. J Urol 1996; 156 (819): 819–821. DOI: 10.1097/00005392-199608001-00074.
- Orsola A, Estrada CR, Nguyen HT, Retik AB, Freeman MR, Peters CA, et al.. Growth and stretch response of human exstrophy bladder smooth muscle cells: molecular evidence of normal intrinsic function. BJU Int 2005; 95 (1): 144–148. DOI: 10.1111/j.1464-410x.2004.05267.x.
- Mathews R, Wills M, Perlman E, Gearhart JP. Neural Innervation Of The Newborn Exstrophic Bladder. J Urol 1999; 162 (506): 506–508. DOI: 10.1097/00005392-199908000-00076.
- Rösch W, Christl A, Strauss B, Schrott K-M, Neuhuber WL. Comparison of Preoperative Innervation Pattern and Postreconstructive Urodynamics in the Exstrophy-Epispadias Complex. Urol Int 1997; 59 (1): 6–15. DOI: 10.1159/000283009.
- Hipp J, Andersson K-E, Kwon TG, Kwak EK, Yoo J, Atala A. Microarray analysis of exstrophic human bladder smooth muscle. BJU Int 2008; 0 (0): 070916224627009–??? DOI: 10.1111/j.1464-410x.2007.07211.x.
- Novak TE, Lakshmanan Y, Frimberger D, Epstein JI, Gearhart JP. Polyps In The Exstrophic Bladder. A Cause For Concern? J Urol 2005; 174 (4 Part 2): 1522–1526. DOI: 10.1097/01.ju.0000179240.25781.1b.
- Toguri AG, Churchill BM, Schillinger JF, Jeffs RD. Continence in Cases of Bladder Exstrophy. J Urol 1987; 119 (4): 538–540. DOI: 10.1016/s0022-5347(17)57541-2.
- Diamond DA, Bauer SB, Dinlenc C, Hendren WH, Peters CA, Atala A, et al.. Normal Urodynamics In Patients With Bladder Exstrophy: Are They Achievable? J Urol 1999; 162 (3 Part 1): 841–845. DOI: 10.1097/00005392-199909010-00072.
- Mathews R, Gosling JA, Gearhart JP. Ultrastructure Of The Bladder In Classic Exstrophy: Correlation With Development Of Continence. J Urol 2004; 172 (4 Part 1): 1446–1449. DOI: 10.1097/01.ju.0000138248.43831.27.
- Wakim A, Barbet JP. Connections of the bladder plate and bladder neck with the bony pelvis in a fetus with classic bladder exstrophy. Urology 2002; 60 (1): 142–146. DOI: 10.1016/s0090-4295(02)01715-6.
- Gearhart JP, Mathews R. The Failed Exstrophy Closure. The Exstrophy–Epispadias Complex 1991; 18 (687): 93–96. DOI: 10.1007/978-1-4757-3056-2_15.
- Connolly JA, Peppas DS, Jeffs RD, Gearhart JP. Prevalence and Repair of Inguinal Hernias in Children with Bladder Exstrophy. J Urol 1995; 154 (1900): 1900–1901. DOI: 10.1097/00005392-199511000-00093.
- Baker LA, Gearhart JP. The staged approach to bladder exstrophy closure and the role of osteotomies. World J Urol 1998; 16 (3): 205–211. DOI: 10.1007/s003450050054.
- Silver RI, Yang A, Ben-Chaim J, Jeffs RD, Gearhart JP. Penile Length in Adulthood after Exstrophy Reconstruction. The Exstrophy–Epispadias Complex 1997; 158 (999): 117–125. DOI: 10.1007/978-1-4757-3056-2_19.
- Gearhart JP, Yang A, Leonard MP, Jeffs RD, Zerhouni EA. Prostate Size and Configuration in Adults with Bladder Exstrophy. J Urol 1993; 149 (2): 308–310. DOI: 10.1016/s0022-5347(17)36064-0.
- Berkowitz J, Carter HB, Gearhart JP. Prostate Cancer in Patients with the Bladder Exstrophy-Epispadias Complex: Insights and Outcomes. Urology 2008; 71 (6): 1064–1066. DOI: 10.1016/j.urology.2007.12.069.
- D’Hauwers KWM, Feitz WFJ, Kremer JAM. Bladder exstrophy and male fertility: pregnancies after ICSI with ejaculated or epididymal sperm. Fertil Steril 2008; 89 (2): 387–389. DOI: 10.1016/j.fertnstert.2007.03.005.
- Cadeddu JA, Benson JE, Silver RI, Lakshmanan Y, Jeffs RD, Gearhart JP. Spinal abnormalities in classic bladder exstrophy. BJU Int 1997; 79 (6): 975–978. DOI: 10.1046/j.1464-410x.1997.00190.x.
- Halachmi S, Farhat W, Konen O, Khan A, Hodapp J, Bagli DJ, et al.. Pelvic Floor Magnetic Resonance Imaging after Neonatal Single Stage Reconstruction in Male Patients With Classic Bladder Exstrophy. J Urol 2003; 170 (4 Part 2): 1505–1509. DOI: 10.1097/01.ju.0000087463.92231.b1.
- Gargollo PC, Borer JG, Retik AB, Peters CA, Diamond DA, Atala A, et al.. Magnetic Resonance Imaging Of Pelvic Musculoskeletal And Genitourinary Anatomy In Patients Before And After Complete Primary Repair Of Bladder Exstrophy. J Urol 2005; 174 (4 Part 2): 1559–1566. DOI: 10.1097/01.ju.0000175997.60933.fe.
- Ebert AK, Falkert A, Brandl R, Hirschfelder H, Koller M, RÃ\textparagraphsch WH. Pelvic-floor imaging using three-dimensional ultrasonography and magnetic resonance imaging in the long term follow-up of the bladder-exstrophy-epispadias complex. BJU Int 2010; 105 (2): 248–253. DOI: 10.1111/j.1464-410x.2009.08736.x.
- Ives E, Coffey R, Carter CO. A family study of bladder exstrophy. J Med Genet 1980; 17 (2): 139–141. DOI: 10.1136/jmg.17.2.139.
- Reutter H, Qi L, Gearhart JP, Boemers T, Ebert A-K, Rösch W, et al.. Concordance analyses of twins with bladder exstrophy–epispadias complex suggest genetic etiology. Am J Med Genet A 2007; 143a (22): 2751–2756. DOI: 10.1002/ajmg.a.31975.
- Boyadjiev SA, Dodson JL, Radford CL, Ashrafi GH, Beaty TH, Mathews RI, et al.. Clinical and molecular characterization of the bladder exstrophy-epispadias complex: analysis of 232 families. BJU Int 2004; 94 (9): 1337–1343. DOI: 10.1111/j.1464-410x.2004.05170.x.
- Wood HM, Trock BJ, Gearhart JP. In Vitro Fertilization and the Cloacal-Bladder Exstrophy-Epispadias Complex: Is there an Association? J Urol 2003; 169 (4): 1512–1515. DOI: 10.1097/01.ju.0000054984.76384.66.
- Wood HM, Babineau D, Gearhart JP. In vitro fertilization and the cloacal/bladder exstrophy–epispadias complex: A continuing association. J Pediatr Urol 2007; 3 (4): 305–310. DOI: 10.1016/j.jpurol.2006.10.007.
- Boyadjiev SA, South ST, Radford CL, Patel A, Zhang G, Hur DJ, et al.. A reciprocal translocation 46,XY,t(8;9)(p11.2;q13) in a bladder exstrophy patient disrupts CNTNAP3 and presents evidence of a pericentromeric duplication on chromosome 9. Genomics 2004; 85 (5): 622–629. DOI: 10.1016/j.ygeno.2005.01.002.
- Reutter H, Thauvin-Robinet C, Boemers TM, Rösch WH, Ludwig M. Bladder exstrophy–epispadias complex: Investigation of suppressor of variegation, enhancer of zeste and Trithorax (SET) as a candidate gene in a large cohort of patients. Scand J Urol Nephrol 2006; 40 (3): 221–224. DOI: 10.1080/00365590600621204.
- Ludwig M, Ruschenforf F, Saar K, Hubner N, Siekmann L, Boyadjiev SA, et al.. Genome-wide linkage scan for bladder exstrophy-epispadias complex. Birth Defects Res A Clin Mol Teratol. 2009; 5 (2): 74–78.
- Gearhart J, Benchaim J, Jeffs R, Sanders R. Criteria for the prenatal diagnosis of classic bladder exstrophy. Obstet Gynecol 1995; 85 (6): 961–964. DOI: 10.1016/0029-7844(95)00069-4.
- Gobbi D, Fascetti Leon F, Tregnaghi A, Gamba PG, Midrio P. Early Prenatal Diagnosis of Cloacal Exstrophy with Fetal Magnetic Resonance Imaging. Fetal Diagn Ther 2008; 24 (4): 437–439. DOI: 10.1159/000174570.
- Lattimer JK, Vernon Smith MJ. Exstrophy Closure: a Followup on 70 Cases. J Urol 1966; 95 (3): 356–359. DOI: 10.1016/s0022-5347(17)63460-8.
- Birth Defects Monitoring Systems IC for. Epidemiology of bladder exstrophy and epispadias: A communication from the international clearinghouse for birth defects monitoring systems. Teratology 1987; 36 (2): 221–227. DOI: 10.1002/tera.1420360210.
- Nelson CP, Dunn RL, Wei JT. Contemporary Epidemiology Of Bladder Exstrophy In The United States. J Urol 2005; 173 (5): 1728–1731. DOI: 10.1097/01.ju.0000154821.21521.9b.
- Ambrose SS, O’Brien DP. Surgical Embryology of the Exstrophy-Epispadias Complex. Surg Clin North Am 1974; 54 (6): 1379–1390. DOI: 10.1016/s0039-6109(16)40493-7.
- Marshall VF, Muecke C. Congenital abnormalities of the bladder. Handbuch der Urologie. New York: Springer Verlag; 1968. DOI: 10.1007/978-3-642-87399-7_4.
- Mildenberger H, Kluth D, Dziuba M. Embryology of bladder exstrophy. J Pediatr Surg 1988; 23 (2): 166–170. DOI: 10.1016/s0022-3468(88)80150-7.
- Johnson JH, Kogan SJ. The exstrophic anomalies and their surgical reconstruction. Curr Prob Surg 1974 (August):1-3. DOI: 10.1016/s0011-3840(74)80011-0.
- Rubenwolf P, Thomas C, Thüroff JW, Stein R. Sexual Function and Fertility of Women with Classic Bladder Exstrophy and Continent Urinary Diversion. J Urol 2016; 196 (1): 140–145. DOI: 10.1016/j.juro.2015.12.099.
Dernière mise à jour: 2025-09-22 07:59